扩展功能
文章信息
- 廖迪, 胡乾, 廖巧, 黄操, 刘卫平, 毕方方
- LIAO Di, HU Qian, LIAO Qiao, HUANG Cao, LIU Wei-Ping, BI Fang-Fang
- p.G38R和p.D40G突变通过改变ANXA11蛋白亚细胞定位引发肌萎缩侧索硬化症
- Mutations p.G38R and p.D40G induce amyotrophic lateral sclerosis by changing the subcellular localization of Annexin A11 protein
- 国际神经病学神经外科学杂志, 2018, 45(3): 281-286
- Journal of International Neurology and Neurosurgery, 2018, 45(3): 281-286
-
文章历史
收稿日期: 2018-02-14
修回日期: 2018-05-21
2. 中南大学医学遗传学研究中心, 湖南省长沙市 410008;
3. 托马斯杰佛逊大学病理、解剖和细胞生物化学系, 宾夕法尼亚州费城 19107
肌萎缩侧索硬化症(amyotrophic lateral sclerosis, ALS)是上、下运动神经元均受累特征性表现出进行性肌无力、肌萎缩、延髓麻痹及锥体束征的致死性神经退行性疾病。全世界ALS年发病率约为1~3 /10万人,多为散发性,约有5%~10%的患者有阳性家族史[1, 2]。ALS确切的致病机制尚未明确,目前认为遗传因素在发病中起主要作用,其可引起多种细胞功能失调,包括RNA代谢紊乱、蛋白质稳态破坏、核质运输受阻、内质网压力增大和核蛋白动力学障碍等,最终损害了运动神经元[3, 4]。
近年来,随着全基因组测序和全外显子组测序等大规模平行测序的开展,ALS相关基因的发现出现了新浪潮。2017年,Smith等[5]通过全外显子测序技术筛查了751例家族性ALS患者和180例散发性ALS患者,发现了一个新的ALS致病基因annexin A11(ANXA11)。这些患者的发病年龄在50~83岁之间,平均67岁,表现为肢体和延髓均受累,未合并额颞叶痴呆。这次研究一共发现了ANXA11的6个错义突变,分别为位于其蛋白质N端的p.G38R、p.D40G、p.G175R和p.G189E及位于C端的p.R235Q和p.R346C。本研究选取位于ANXA11蛋白N端与钙周期蛋白(S100A6)蛋白结合位点(50~62位氨基酸残基)附近的点突变p.G38R和p.D40G作为研究对象,比较这两个位点发生突变后对ANXA11蛋白亚细胞定位的影响,探索其引起ALS的发病机制。
1 材料与方法 1.1 材料人胚肾细胞系HEK293细胞由中南大学遗传实验室提供。胎牛血清、DMEM高糖培养基购自Gbico公司。脂质体Lipofectamine 2000®购自LifeTech公司。编码人ANXA11蛋白cDNA序列的质粒pANXA11-Flag购自Genscript公司。限制性核酸内切酶Nhe1、Msc1以及Quick Ligation试剂盒购自NEB公司。鼠抗GAPDH单克隆抗体和鼠抗Flag单克隆抗体购自Sigma公司。山羊抗鼠IgG-HRP购自Abcam公司。DyLight 488山羊抗鼠抗体购自Jackson ImmunoResearch Labotatories公司。
1.2 方法 1.2.1 质粒构建将质粒pANXA11-Flag用限制性核酸内切酶Nhe1和Msc1双酶切,胶回收纯化约6.8Kb的条带作为骨架。分别使用Primer1 & 2和Primer1 & 3(表 1)以质粒pANXA11-Flag为模板进行PCR扩增,PCR产物用Nhe1和Msc1双酶切,酶切产物作为插入片段用Quick Ligation连接酶分别连入骨架。室温连接10 min后转化DH5α感受态,次日挑取细菌单克隆,使用Primer4进行Sanger测序鉴定。所构建的质粒分别命名为pANXA11-G38R-Flag和pANXA11-D40G-Flag。
| 引物名称 | 序列 |
| Primer1 | 5’-GGCCGCTAGCCACCATGAGCTACCCTGGCTATC-3’ |
| Primer2 | 5’-TAGGTGGCCACGTTATCCAGCCTGATGGGGGGCATGCTGGG-3’ |
| Primer3 | 5’-TAGGTGGCCACGTTACCCAGCCCGATGGGGGGCA-3’ |
| Primer4 | 5’- CTGGCTAACTAGAGAACCCACT- 3’ |
将HEK293细胞按合适的密度接种至6孔板,培养于含10%胎牛血清的DMEM培养基中,于5%CO2,37℃条件下培养。次日用Lipofectamine 2000进行质粒转染,每孔转染3 μg质粒。转染24 h后收集细胞行Western印迹实验。
1.2.3 Western印迹实验用RIPA裂解液冰上裂解上述转染后细胞,超声处理后行BCA蛋白定量。按10 μg/孔的上样量于5%~10% SDS-PAGE胶电泳分离,电泳结束后以250 mA恒流湿法转膜至0.45 μm孔径的PVDF膜上。用5%脱脂奶粉室温封闭1 h。分别用鼠抗GAPDH单克隆抗体(1 :5000)和鼠抗Flag单克隆抗体(1 :1000)于4℃孵育过夜。用0.05% TBS-T洗PVDF膜3次,每次10 min。随后加入山羊抗鼠IgG-HRP(1 :10000)室温孵育1 h。使用上述方法洗膜。洗膜结束后进行ECL化学发光显色拍照。
1.2.4 免疫荧光将状态良好的HEK293细胞接种至铺有matrigel的爬片上,次日进行转染,24 h后进行免疫荧光检测。吸净培养基并用DPBS漂洗2次,分别用4%多聚甲醛固定及PBST透化各15 min,漂洗后用5%BSA封闭30 min。用封闭液稀释鼠抗Flag单克隆抗体(1 :300)室温孵育1 h,漂洗后再次用5%BSA封闭30 min。用封闭液稀释DyLight 488山羊抗鼠抗体(1 :600)室温避光孵育1 h,漂洗后用DAPI染核6 min。漂洗后用90%甘油封片,指甲油封边,立即在激光共聚焦显微镜下观察并拍照。图片使用Image J软件分析。
1.3 统计学分析采用SPSS 20.0进行统计分析。计量资料及计数资料均采用中位数(Q1~Q3)表示。囊泡状结构面积大小及单个细胞中囊泡个数比较采用Kruskal-Wallis H检验,两两比较采用Dunn-Bonferroni检验。囊泡核内分布率的比较采用卡方(χ2)检验。P < 0.05认为差异有统计学意义。
2 结果 2.1 质粒的构建构建编码ANXA11蛋白N端突变体p.G38R和p.D40G的真核表达载体,分别标记为pANXA11-G38R-Flag和pANXA11-D40G-Flag。见图 1。

|
| 图 1 质粒pANXA11-Flag、pANXA11-G38R-Flag和pANXA11-D40G-Flag的结构示意及Sanger测序部分序列结果图 |
将质粒pANXA11-Flag、pANXA11-G38R-Flag和pANXA11-D40G-Flag分别转染至HEK293细胞后行Western印迹检测,验证ANXA11wt、p.G38R蛋白及p.D40G蛋白在细胞中过表达。见图 2。

|
| 图 2 ANXA11wt、p.G38R和p.D40G蛋白在HEK293细胞中过表达 |
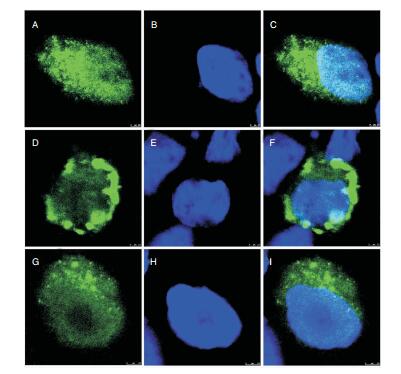
将质粒pANXA11-Flag、pANXA11-G38R-Flag和pANXA11-D40G-Flag分别转染至HEK293细胞后,通过细胞免疫荧光研究上述蛋白在细胞内的亚定位。在激光共聚焦显微镜下观察可见,ANXA11wt、p.G38R蛋白及p.D40G蛋白均可在HEK293细胞中形成点状或团块状的大量囊泡状结构,细胞核内外均可见其表达(图 3)。ANXA11wt在细胞内形成小而密的囊泡状结构,在胞质中均匀分布,并在细胞核内外分布均匀;p.G38R蛋白在细胞内形成团块状囊泡,囊泡面积较大,呈现紧贴胞膜的分布状态,细胞核内少有分布;p. D40G蛋白在细胞内也可以形成小囊泡,但较为稀疏,胞质内分布较为均匀,细胞核内囊泡数较少。
|
| 图 3 ANXA11 wt、p.G38R蛋白及p.D40G蛋白免疫荧光结果 注:A、D、G:ANXA11wt、p.G38R及p.D40G蛋白染色;B、E、H:对应细胞的DAPI染色;C、F、I:ANXA11wt、p.G38R及p.D40G蛋白染色和DAPI染色的Merge结果。A-I比例尺为2.5 μm。 |
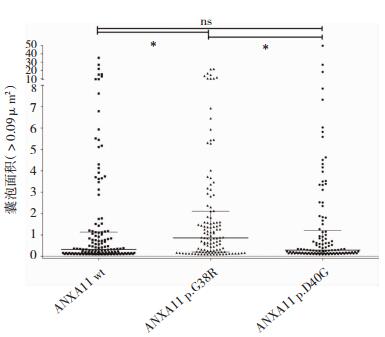
采用Image J软件进行囊泡状结构的截面积(下称囊泡面积)。我们首先收集ANXA11wt组、p.G38R组及p.D40G组囊泡面积数值,选取面积>0.09 μm2的囊泡状结构进行分析(图 4)。实验发现,ANXA11wt组囊泡面积中位数为0.3250 μm2(0.1430 μm2~1.137 μm2),p.G38R组为0.8590 μm2(0.2060 μm2~2.107 μm2),p.D40G组为0.2900 μm2(0.1520 μm2~1.212 μm2)。Kruskal-Wallis H检验发现3组囊泡面积大小存在差异。其中p.G38R组囊泡面积大于ANXA11wt蛋白组(P=0.002)和p.D40G蛋白组(P=0.006),而ANXA11wt组和p.D40G蛋白组之间的囊泡面积大小无明显差异(P=0.791)。
|
| 图 4 ANXA11 wt、p.G38R蛋白及p.D40G蛋白囊泡面积分布示意图 注:*代表差异有统计学意义,P < 0.05;ns代表差异无统计学意义。 |
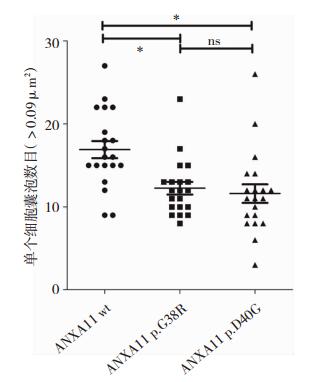
随后,我们对ANXA11 wt、p.G38R及p.D40G蛋白在单个细胞中形成的囊泡数目进行统计分析(图 5),ANXA11wt组囊泡数目中位数为16个(15~21),p.G38R组为12个(10~13),p.D40G蛋白组为11个(8~13)。Kruskal-Wallis H检验发现3组间的单个细胞中囊泡中位数存在差异(P < 0.001),ANXA11wt组的囊泡数目大于p.G38R组(P=0.002)和p.D40G组(P < 0.001),而后两者囊泡数目差异不明显(P=0.516)。
|
| 图 5 ANXA11wt、p.G38R蛋白及p.D40G蛋白在单个细胞内形成囊泡数目示意图 注:*代表差异有统计学意义,P < 0.05;ns代表差异无统计学意义。 |
本实验分析了p.G38R、p.D40G和ANXA11野生型蛋白在细胞核内的分布情况(图 6)。卡方(χ2)检验发现3种蛋白的细胞核内分布存在显著差异(P < 0.001),与ANXA11wt相比,p.G38R组(P < 0.001)和p.D40G组(P < 0.001)在细胞核内的分布比率显著减少,而p.G38R组及p.D40G组在核内的分布无明显差异(P=0.519)。

|
| 图 6 ANXA11wt、p.G38R蛋白及p.D40G蛋白囊泡细胞核内分布比率示意图;注:*代表差异有统计学意义,P < 0.05;ns代表差异无统计学意义。 |
ANXA11蛋白属于annexin A家族,该家族是一系列Ca2+依赖的磷脂结合蛋白,包括12个家族成员(annexin A1-A11, A13)[6]。annexin A蛋白拥有两个功能结构域,分别为一个位于C端的核心结构域和一个位于N端的结构域。C端的结构域位于annexin A蛋白的凸面,大部分annexin A成员的C端由四个高度相似的“annexin重复序列”组成,每个“annexin重复序列”大约有70个氨基酸残基,具有Ca2+和磷脂亲和力[7]。N端的结构域位于annexin A蛋白的凹面,是一段氨基酸组成多变且具有疏水特征的结构域。人annexin A11(ANXA11)基因位于10q22-q23,编码的ANXA11蛋白由505个氨基酸组成,具有annexin A家族中最长的N端结构域,含196个氨基酸残基,对ANXA11蛋白的细胞核定位起重要作用[8]。ANXA11蛋白N端结构域中还含有与S100A6和凋亡连接基因2蛋白(ALG-2)结合的结合位点[9, 10]。
研究表明,ANXA11可以通过其N端结构域结合ALG-2蛋白来稳定外壳蛋白复合物Ⅱ(COPII)的组分之一Sec31A蛋白,参与货物蛋白从内质网转运到高尔基体(ER-to-Golgi)的囊泡运输过程[11]。2017年Smith等[5]将HA标记的p.G38R和p.D40G突变型和野生型ANXA11过表达于小鼠的原代运动神经元中,发现这三种蛋白均在胞质中形成囊泡状结构,并通过免疫共沉淀实验证实ANXA11蛋白N端的p.G38R和p.D40G突变并不会改变其与ALG-2的结合能力,提示这两种突变可能通过其他方式影响囊泡运输。本研究中,我们使用Flag标记的p.G38R和p.D40G突变型和野生型ANXA11在HEK293中过表达,也观察到这3种蛋白都能形成类似的囊泡状结构。我们参照Smith等[5]对囊泡大小的统计分析,选取截面积大于0.09 μm2的囊泡进行统计学分析,发现在HEK293细胞中p.G38R和p.D40G突变都减少了ANXA11蛋白囊泡状结构的数目。这表明p.G38R、p.D40G突变可能会降低ANXA11蛋白参与的ER-to-Golgi运输效率,从而影响细胞在合成加工新蛋白质的效率,对细胞正常生理活动造成影响,例如能量供应、代谢废物的清除和信号分子的传导等等,这可能是p.G38R和p.D40G突变引发ALS的机制之一。
另外,本研究还观察到p.G38R蛋白可以形成相对野生型蛋白和p.D40G蛋白较大的囊泡,这让我们思考ANXA11蛋白参与形成的囊泡是什么,有何功能。有意思的是,最近Bethan等[12]在研究Stat3信号通路对溶酶体膜蛋白质组学的影响时,发现在Stat3信号上调后ANXA1、ANXA6和ANXA11蛋白在溶酶体膜上富集,这表明ANXA11可以在某些条件下参与溶酶体膜的生物合成。但是ANXA11蛋白相关囊泡状结构的性质和功能还有待进一步研究。
研究表明ANXA11蛋白N端结构域对其核内定位有着重要作用,缺乏N端结构域将影响其入核,但具体负责入核的序列尚不明确[13]。研究通过蛋白质Jpred二级结构预测发现在ANXA11蛋白N端40-44位氨基端残基及51-59位氨基端残基处分别存在一个α-螺旋,位于ANXA11蛋白N端的p.G38R和p.D40G突变会影响第一个螺旋的形成[5]。本研究发现,相比ANXA11wt、p.G38R和p.D40G突变蛋白在细胞核内的分布显著减少,提示p.G38R及p.D40G突变可能通过影响第一个α-螺旋的形成从而减少ANXA11蛋白的核定位。然而,在过表达ANXA11wt、p.G38R蛋白和p.D40G蛋白的小鼠原代神经元细胞中,并未观察到这3种蛋白在细胞核内外分布有明显差异[5]。这可能是因为细胞模型的差异,小鼠原代神经元细胞与HEK293细胞不同,为不分裂且高度分化的细胞。事实上,ANXA11蛋白的亚细胞分布也与细胞种类有关,研究发现在14日龄的大鼠胚胎迅速生长的未分化的间质细胞中,ANXA11蛋白主要集中在细胞核内,然而在18日龄胚胎中,当这些组织分化成为结缔组织时,ANXA11蛋白在细胞核和细胞质中便呈现均匀分布[14]。虽然ANXA11蛋白及其突变体在HEK293细胞核内外的差异不能代表其在神经元内的分布情况,但我们也证明了N端的p.G38R和p.D40G突变可以影响ANXA11蛋白进入细胞核的能力。
ANXA11蛋白的胞内定位与其细胞功能有着重要联系,但其在细胞核内的功能尚未明确。有研究对mRNA结合蛋白进行质谱分析发现ANXA11蛋白是候选的mRNA结合蛋白之一[15],这提示ANXA11可能参与RNA的代谢加工。综上,我们的结果表明p.G38R及p.D40G突变改变了ANXA11蛋白的亚细胞定位,提示其影响胞内囊泡运输和mRNA加工,这可能是其导致ALS发生发展的重要机制之一。
4 结论p.G38R和p.D40G突变减少了ANXA11蛋白相关囊泡状结构的数目和ANXA11蛋白在细胞核的分布,这可能是引起ALS发病的机制之一。
| [1] |
Al-Chalabi A, Hardiman O. The epidemiology of als:A conspiracy of genes, environment and time[J]. Nat Rev Neurol, 2013, 9(11): 617-628. DOI:10.1038/nrneurol.2013.203 |
| [2] |
Chen L, Zhang B, Chen R, et al. Natural history and clinical features of sporadic amyotrophic lateral sclerosis in china[J]. J Neurol Neurosurg Psychiatry, 2015, 869(10): 1075-1081. |
| [3] |
Zufiria M, Gil-Bea FJ, Fernandez-Torron R, et al. Als:A bucket of genes, environment, metabolism and unknown ingredients[J]. Prog Neurobiol, 2016, 142: 104-129. DOI:10.1016/j.pneurobio.2016.05.004 |
| [4] |
Nguyen HP, Van Broeckhoven C, van der Zee J. Als genes in the genomic era and their implications for ftd[J]. Trends Genet, 2018, 34(6): 404-423. DOI:10.1016/j.tig.2018.03.001 |
| [5] |
Smith BN, Topp SD, Fallini C, et al. Mutations in the vesicular trafficking protein annexin a11 are associated with amyotrophic lateral sclerosis[J]. Sci Transl Med, 2017, 9(388): 9157. DOI:10.1126/scitranslmed.aad9157 |
| [6] |
Gerke V, Moss SE. Annexins:From structure to function[J]. Physiol Rev, 2002, 82(2): 331-371. DOI:10.1152/physrev.00030.2001 |
| [7] |
Lecona E, Turnay J, Olmo N, et al. Structural and functional characterization of recombinant mouse annexin a1l:Influence of calcium binding[J]. Biochem J, 2003, 373(Pt 2): 437-449. |
| [8] |
Wang J, Guo C, Liu S, et al. Annexin a11 in disease[J]. Clin Chim Acta, 2014, 431: 164-168. DOI:10.1016/j.cca.2014.01.031 |
| [9] |
Satoh H, Nakano Y, Shibata H, et al. The penta-ef-hand domain of alg-2 interacts with amino-terminal domains of both annexin ⅶ and annexin xi in a ca2+-dependent manner[J]. Biochim Biophys Acta, 2002, 1600(1-2): 61-67. DOI:10.1016/S1570-9639(02)00445-4 |
| [10] |
Williams LH, McClive PJ, Van Den Bergen JA, et al. Annexin xi co-localises with calcyclin in proliferating cells of the embryonic mouse testis[J]. Develop Dynam, 2005, 234(2): 432-437. DOI:10.1002/(ISSN)1097-0177 |
| [11] |
Shibata H, Kanadome T, Sugiura H, et al. A new role for annexin a11 in the early secretory pathway via stabilizing sec31a protein at the endoplasmic reticulum exit sites (eres)[J]. J Biol Chem, 2015, 290(8): 4981-4993. DOI:10.1074/jbc.M114.592089 |
| [12] |
Lloyd-Lewis B, Krueger CC, Sargeant TJ, et al. Stat3-mediated alterations in lysosomal membrane protein composition[J]. J Biol Chem, 2018, 293(12): 4244-4261. DOI:10.1074/jbc.RA118.001777 |
| [13] |
Mizutani A, Watanabe N, Kitao T, et al. The long amino-terminal tail domain of annexin xi is necessary for its nuclear localization[J]. Arch Biochem Biophys, 1995, 318(1): 157-165. DOI:10.1006/abbi.1995.1216 |
| [14] |
Farnaes L, Ditzel HJ. Dissecting the cellular functions of annexin xi using recombinant human annexin xi-specific autoantibodies cloned by phage display[J]. J Biol Chem, 2003, 278(35): 33120-33126. DOI:10.1074/jbc.M210852200 |
| [15] |
Baltz AG, Munschauer M, Schwanhausser B, et al. The mrna-bound proteome and its global occupancy profile on protein-coding transcripts[J]. Mol Cell, 2012, 46(5): 674-690. DOI:10.1016/j.molcel.2012.05.021 |
 2018, Vol. 45
2018, Vol. 45




