扩展功能
文章信息
- 赵景茹, 董立朋, 李尧, 杨宝明, 陈景红, 霍甜甜, 李娜, 贾艳丽, 李俐涛
- ZHAO Jing-Ru, DONG Li-Peng, LI Yao, YANG Bao-Ming, CHEN Jing-Hong, Huo Tian-Tian, LI Na, JIA Yan-Li, LI Li-Tao
- 桂皮醛对脑缺血小鼠的脑保护作用及对Toll样受体6/核因子-κB信号通路的影响
- Cerebral protective effect of cinnamaldehyde and its influence on the Toll-like receptor 6/nuclear factor-kappa B signaling pathway in mice with cerebral ischemia
- 国际神经病学神经外科学杂志, 2018, 45(1): 65-69
- Journal of International Neurology and Neurosurgery, 2018, 45(1): 65-69
-
文章历史
收稿日期: 2017-06-23
修回日期: 2017-11-18
2. 河北医科大学第四医院, 河北省 石家庄市 050000
缺血性脑卒中后继发性脑损伤是患者病情加重的重要原因,其病理机制主要包括炎症反应、氧化应激和凋亡等,其中过度炎症反应是加重继发性脑损伤的主要原因之一,因此抗炎症损伤成为治疗缺血性脑卒中的重要途径之一[1-4]。Toll样受体(toll-like receptors, TLRs)介导的核因子κB(nuclear factor-kappa B, NF-κB)激活在促炎反应中发挥关键作用,并与缺血性继发性脑损伤密切相关[5, 6]。
桂皮醛(cinnamaldehyde, CA)是具有抗炎、抗氧化、抗血小板聚集、抗肿瘤和抗凋亡等多种生物学作用的中药单体。桂皮醛已被证实通过抑制TLR6信号通路从而抑制果糖介导的心脏炎症反应及纤维化,对缺血心肌发挥保护作用[7, 8]。但桂皮醛是否具有通过抗炎达到脑保护作用,仍不得而知。
本研究旨在深入探讨桂皮醛是否对局灶性脑缺血小鼠具有脑保护作用,并探讨其可能的作用机制,为桂皮醛的开发及临床应用提供依据。
1 材料与方法 1.1 试剂和仪器桂皮醛(成都艾科生物科技有限公司);兔抗TLR6、抗肿瘤坏死因子受体相关分子6(TRAF6)和抗NF-κB多克隆抗体(Bioworld公司,美国);经颅多普勒超声监测仪VMS-LDF(Moor Instruments Ltd公司,美国);多功能酶标仪(Bio-Tek公司,美国);电泳仪,电泳槽(北京六一仪器厂);PCR扩增仪(Eppendorf公司,德国)。
1.2 动物分组及给药方式实验动物采用健康雄性CD-1小鼠,体重约27~30 g,购自北京维通利华公司。随机将CD-1小鼠分为4组:大脑中动脉闭塞组(MCAO):小鼠大脑中动脉闭塞后即刻腹腔注射等量0.2% DMSO;桂皮醛低、中、高剂量组(CA25、CA50及CA75):小鼠大脑中动脉闭塞后即刻腹腔注射桂皮醛25 mg/kg、50 mg/kg及75 mg/kg。
1.3 动物模型的建立采用改良线栓法制作小鼠右侧大脑中动脉闭塞模型(MCAO)[9, 10]。手术过程中应用经颅多普勒超声监测大脑中动脉血流,当血流下降70%~80%说明模型成功。
1.4 动物模型神经功能缺损的评价各组小鼠在术后24 h采用Bederson评分法[11]测定小鼠神经功能缺失。在动物麻醉清醒后24 h进行评分并记录神经功能缺失症状,评分标准如下:0分(无神经损伤症状);1分(提尾时病灶对侧前肢不能完全伸直);2分(行走时向瘫痪侧转圈);3分(向病灶对侧跌倒);4分(不能自发行走)。
1.5 脑组织含水量测定采用干湿重法[12],去除额极后取病变侧约2 mm厚的脑组织,将脑组织放入事先称重(A)的锡纸中,立即称重(B),B-A即得湿重,然后用锡纸包裹脑组织,放入95℃烤箱内烘干24 h后取出恢复到室温,称重(C),C-A即得干重,反复称量至恒重。最终代入公式计算脑组织含水量:(脑组织湿重-脑组织干重)/湿重×100%,即(B-C)/(B-A)×100%。
1.6 脑梗死体积百分比测定脑缺血24 h后,将小鼠麻醉后断头处死并迅速取脑,切除额极,将大脑均匀切为冠状切片。脑片浸入2% TTC溶液,37 ℃孵育15 min。再置于4%多聚甲醛中固定24 h,将图像导入计算机(Image-Pro Plus 5.1软件进行图像分析)。测定脑梗死面积和脑梗死体积(红色区域为正常脑组织,苍白色区域为梗死区),水肿修正后梗死体积百分比(%):={[总梗死体积-(梗死侧半球体积-梗死对侧半球体积)]/梗死对侧半球体积}×100%[13]。
1.7 Western Blot及RT-qPCR法测定小鼠大脑皮质缺血区TLR6、TRAF6和NF-κB表达各实验组动物取皮质脑组织,置-80℃储存备用,采用Western Blot检测TLR6、TRAF6和NF-κB蛋白表达,远红外荧光扫描成像系统扫描,TLR6/GAPDH、TRAF6/GAPDH和胞核NF-κB/GAPDH比值代表相对表达水平。采用实时荧光定量PCR(RT-qPCR)检测TLR6、TRAF6及NF-κB mRNA表达量。以GAPDH作为内参基因,与对照组相比,得到目的基因表达CT值并进行数据定量分析。
1.8 统计学方法采用SPSS 13.0统计软件进行统计学分析,多组数据比较采用方差分析(one-way ANOVA),当方差齐并具有显著性差异时,进一步运用S-N-K检验两两比较,当方差不齐时,采用非参数的秩和检验。神经功能缺损评分使用chi-square(χ2)检验进行多组数据比较,并进一步用Mann-Whitney U检验两两比较,除了神经功能缺损学评分,数据均以均数±标准差(x±s)表示,检验水准取α=0.05,当P < 0.05时差异具有统计学意义。
2 结果 2.1 桂皮醛对局灶性脑缺血小鼠神经功能的影响和MCAO组比较,CA75和CA50组的神经功能缺损评分明显降低,差异有统计学意义(P < 0.05),CA25组神经功能评分与MCAO组比较无明显降低,差异无统计学意义(P>0.05)。见表 1。
| 组别 | 1分 | 2分 | 3分 | 4分 | 中位数 | 95%可信区间 |
| MCAO组 | 0 | 0 | 4 | 4 | 3.5 | 3.05~3.50 |
| CA25组 | 0 | 1 | 6 | 1 | 3.0 | 2.55~3.45 |
| CA50组 | 0 | 6 | 2 | 0 | 2.0* | 1.86~2.64 |
| CA75组 | 4 | 4 | 0 | 0 | 1.5* | 1.05~1.95 |
| 注:每组神经功能缺损评分,χ2=84.4, d. f.=16, P < 0.001;*为与MCAO组比较,P < 0.05(Mann-Whitney U检验)。 | ||||||
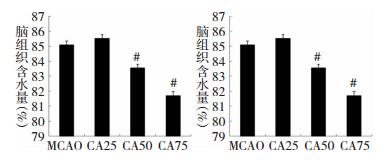
MCAO组小鼠病变侧脑组织含水量明显升高,而与MCAO组[(85.09±0.95)%]相比,CA50及CA75组24 h病变侧脑组织含水量明显降低[(83.72±0.7)3%, (81.69±0.93)%],差异具有统计学意义(P < 0.05),CA25组病变侧脑组织含水量在24 h与MCAO组比较无明显降低[(85.42±0.86)%],差异无统计学意义(P>0.05),这也和桂皮醛对神经功能的作用是相一致的(图 1)。基于桂皮醛对脑缺血小鼠神经功能及脑水肿的改善,我们推断桂皮醛中、高剂量(50 mg/kg和75 mg/kg)能够显示较好的脑保护作用,因此,接下来的研究我们主要关注桂皮醛的最低有效给药剂量50 mg/kg。
|
| 图 1 桂皮醛对脑组织含水量的影响 注:#为与MCAO组比较,P < 0.05。 |
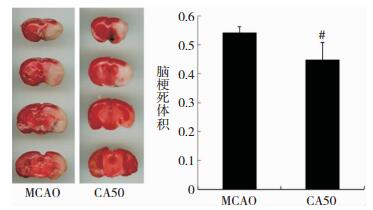
MCAO组缺血脑组织TTC染色出现大范围苍白色梗死区域。与MCAO组相比,给予桂皮醛干预后(50 mg/kg),小鼠脑梗死体积明显缩小,CA50组vs. MCAO组: 0.45 ± 0.06 vs. 0.54 ± 0.02,P<0.05,差异有统计学意义(见图 2)。
|
| 图 2 桂皮醛对脑梗死体积的影响 注:A:TTC染色示脑梗死处为苍白色;B:两组脑梗死体积柱形图;#为与MCAO组比较,P < 0.05。 |
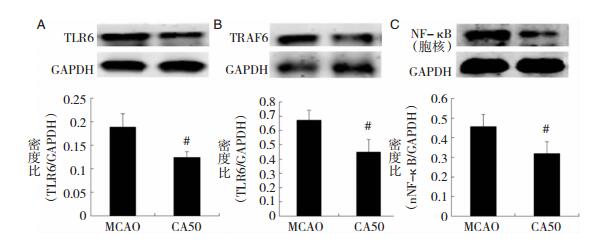
脑缺血后24 h,与MCAO组(TLR6: 0.19±0.03; TRAF6: 0.67±0.07;胞核NF-κB: 0.46±0.06)相比,CA50组TLR6、TRAF6及胞核NF-κB蛋白表达明显下降(TLR6: 0.12±0.01; TRAF6: 0.45±0.09;胞核NF-κB: 0.32±0.06),差异具有统计学意义,均P < 0.05。见图 3A-图 3C。
|
| 图 3 桂皮醛对TLR6、TRAF6及胞核NF-κB蛋白表达的影响 注:A:TLR6蛋白电泳图及与GAPDH密度比;B:TRAF6蛋白电泳图及与GAPDH密度比;C:胞核NF-κB蛋白电泳图及与GAPDH密度比;#为与MCAO组比较,P < 0.05。 |
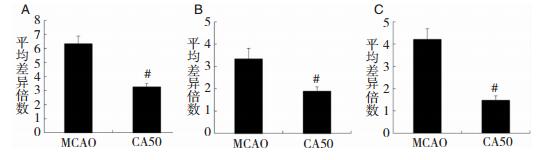
与MCAO组(TLR6: 6.32±0.07; TRAF6: 3.33±0.48; NF-κB: 4.21±0.57)相比,CA50组TLR6、TRAF6及NF-κB mRNA水平明显减低(TLR6: 3.26±0.03; TRAF6: 1.88±0.21; NF-κB: 1.47±0.33),差异有统计学意义,均P < 0.05。见图 4A-图 4C。
|
| 图 4 桂皮醛对TLR6、TRAF6及NF-κB基因表达的影响 注:A:两组TLR6 mRNA平均差异倍数;B:两组TRAF6 mRNA平均差异倍数;C:两组NF-κB mRNA平均差异倍数;#为与MCAO组比较,P < 0.05。 |
TLRs作为模式识别受体,通过激活TLRs信号通路诱导炎症介质的释放,发挥其促炎作用[14]。TLRs信号转导通路主要由两条胞内信号传导途径介导:髓样分化因子88(myeloid differentiation protein 88, MyD88)依赖型途径及MyD88非依赖型途径。细胞膜表面的TLRs胞外段被相应的配体激活后,TLRs胞内段招募胞浆内的接头蛋白MyD88,MyD88的氨基末端死亡结构域与白介素受体相关激酶(IL-1 receptor-associated kinase, IRAK)的死亡结构域相互作用,导致IRAK的磷酸化。并转而与肿瘤坏死因子受体相关分子6 (TNF receptor associated factor6, TRAF6)形成复合物。TRAF6激活活化激酶1(activated kinase 1, TAK1),TAK1进一步激活IκB激酶(IκB kinase, IKK)复合体和活化有丝分裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)。激活IKK复合体导致IkBα磷酸化降解,被解除抑制的核转录因子NF-κB转位入核,从而最终诱导炎症介质的大量表达(如TNF-α和IL-1β)。激活MAPK可以导致转录因子AP-1的活化,并诱导其他炎症介质的释放(如MMPs)[15-17]。在TLRs介导的信号转导途径中,TRAF6同时介导了MyD88依赖和非依赖信号通路,位于NF-κB和MAPKs信号通路的交叉点,且TRAF6介导的炎症信号通路与血管闭塞性疾病密切相关[18, 19]。
已有研究证实TLRs/TRAF6/NF-κB信号通路与缺血后继发性脑损伤及炎症反应密切相关[6, 20-22]。因此,TLRs/TRAF6/NF-κB炎性信号通路就成为研究缺血性脑卒中治疗的重要靶点。
在心肌缺血的动物模型中,桂皮醛通过抗炎发挥心脏保护作用[7]。桂皮醛还能够通过抑制TLR6信号通路从而抑制果糖介导的心脏炎症反应及纤维化[8]。
本研究显示桂皮醛能够通过改善神经功能评分,减轻脑组织含水量并减小脑梗死体积,进而对局灶性脑缺血小鼠发挥脑保护作用,在分子生物学试验中发现桂皮醛降低TLR6、TRAF6及NF-κB的mRNA水平,同时下调TLR6、TRAF6及胞核NF-κB蛋白的表达,因此,我们推测桂皮醛的脑保护作用可能与其抑制TLR6/TRAF6/NF-κB通路相关蛋白表达相关。当然,我们也不否认桂皮醛可能通过作用于其他完全不同的信号通路发挥其抗炎及脑保护作用,因此,仍然需要对其脑保护作用机制做出更为深入的研究。TRAF6已经被证实在脑缺血的病理生理机制中发挥作用[23, 24],而本研究也显示桂皮醛降低了脑缺血后TRAF6在脑组织的表达,这也进一步揭示TRAF6和缺血性脑损伤有着紧密联系,其可能成为独立的作用靶点在缺血性脑损伤中发挥重要作用,不过关于TRAF6和缺血性脑卒中甚至炎症相关疾病的关系,仍然需要更为深入的研究。
| [1] |
Kleinig TJ, Vink R. Suppression of inflammation in ischemic and hemorrhagic stroke:therapeutic options[J]. Curr Opinion Neurol, 2009, 22(3): 294-301. DOI:10.1097/WCO.0b013e32832b4db3 |
| [2] |
Dong L, Qiao H, Zhang X, et al. Parthenolide is neuroprotective in rat experimental stroke model:down-regulating NF-κB, phospho-p38MAPK, and caspase-1 and ameliorating BBB permeability[J]. Mediators Inflamm, 2013, 2013: 370804. |
| [3] |
丁妹, 曹志勇, 李胜利, 等. 不同炎症反应在脑梗死与短暂性脑缺血发作患者中表达及意义研究[J]. 国际神经病学神经外科学杂志, 2017, 44(3): 280-284. |
| [4] |
张秀萍, 翟凤国, 梁启超, 等. 脑缺血时半乳糖凝集素-3对大鼠脑皮质中bcl-2、BAX及caspase-3表达的影响[J]. 国际神经病学神经外科学杂志, 2017, 44(4): 375-378. |
| [5] |
Medzhitov R. Toll-like receptors and innate immunity[J]. Nat Rev, 2001, 1(2): 135-145. |
| [6] |
Zhang J, Fu B, Zhang X, et al. Neuroprotective effect of bicyclol in rat ischemic stroke:Down-regulates TLR6, TLR9, TRAF6, NF-κB, MMP-9 and up-regulates claudin-5 expression[J]. Brain Res, 2013, 1528: 80-88. DOI:10.1016/j.brainres.2013.06.032 |
| [7] |
Hwa JS, Jin YC, Lee YS, et al. 2-methoxycinnamaldehyde from Cinnamomum cassia reduces rat myocardial ischemia and reperfusion injury in vivo due to HO-1 induction[J]. J Ethnopharmacol, 2012, 139(2): 605-615. DOI:10.1016/j.jep.2011.12.001 |
| [8] |
Kang LL, Zhang DM, Ma CH, et al. Cinnamaldehyde and allopurinol reduce fructose-induced cardiac inflammation and fibrosis by attenuating CD36-mediated TLR4/6-IRAK4/1 signaling to suppress NLRP3 inflammasome activation[J]. Sci Rep, 2016, 6: 27460. DOI:10.1038/srep27460 |
| [9] |
Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91. DOI:10.1161/01.STR.20.1.84 |
| [10] |
Cheatwood JL, Emerick AJ, Schwab ME, et al. Nogo-A expression after focal ischemic stroke in the adult rat[J]. Stroke, 2008, 39(7): 2091-2098. DOI:10.1161/STROKEAHA.107.507426 |
| [11] |
Bederson JB, Pitts LH, Tsuji M, et al. Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J]. Stroke, 1986, 17(3): 472-476. DOI:10.1161/01.STR.17.3.472 |
| [12] |
Hatashita S, Hoff JT, Salamat SM. Ischemic brain edema and the osmotic gradient between blood and brain[J]. J Cereb Blood Flow Metab, 1988, 8(4): 552-559. DOI:10.1038/jcbfm.1988.96 |
| [13] |
Mizukami Y, Yoshioka K, Morimoto S, et al. A novel mechanism of JNK1 activation. Nuclear translocation and activation of JNK1 during ischemia and reperfusion[J]. J Biol Chem, 1997, 272(26): 16657-16662. DOI:10.1074/jbc.272.26.16657 |
| [14] |
Akira S. TLR signaling[J]. Curr Top Microbiol Immunol, 2006, 311: 1-16. |
| [15] |
Lin SC, Lo YC, Wu H. Helical assembly in the MyD88-IRAK4-IRAK2 complex in TLR/IL-1R signaling[J]. Nature, 2010, 465(7300): 885-890. DOI:10.1038/nature09121 |
| [16] |
Huxford T, Hoffmann A, Ghosh G. Understanding the logic of IκB:NF-κB regulation in structural terms[J]. Curr Top Microbiol Immunol, 2011, 349: 1-24. |
| [17] |
Aderem A, Ulevitch RJ. Toll like receptors in the induction of the innate immune response[J]. Nature, 2000, 406(6797): 782-787. DOI:10.1038/35021228 |
| [18] |
Miyahara T, Koyama H, Miyata T, et al. Inflammatory signaling pathway containing TRAF6 contributes to neointimal formation via diverse mechanisms[J]. Cardiovasc Res, 2004, 64(1): 154-164. DOI:10.1016/j.cardiores.2004.06.014 |
| [19] |
Liu X, Cao H, Li J, et al. Autophagy induced by DAMPs facilitates the inflammation response in lungs undergoingischemia-reperfusion injury through promoting TRAF6 ubiquitination[J]. Cell Death Differ, 2017, 24(4): 683-693. DOI:10.1038/cdd.2017.1 |
| [20] |
Fan H, Li L, Zhang X, et al. Oxymatrine downregulates TLR6, TLR2, MyD88, and NF-kappaB and protects rat brains against focal ischemia[J]. Mediators of Inflamm, 2009, 2009: 704706. |
| [21] |
Qiao H, Zhang X, Zhu C, et al. Luteolin downregulates TLR4, TLR6, NF-κB and p-p38MAPK expression, upregulates the p-ERK expression, and protects rat brains against focal ischemia[J]. Brain Res, 2012, 1448: 71-81. DOI:10.1016/j.brainres.2012.02.003 |
| [22] |
尤晓欣, 裴建. Toll样受体信号通路与缺血性中风炎症反应机制的研究进展[J]. 国际神经病学神经外科学杂志, 2014, 41(2): 138-141. |
| [23] |
Li M, Li H, Fang F, et al. Astragaloside IV attenuates cognitive impairments induced by transient cerebral ischemia and reperfusion in mice via anti-inflammatory mechanisms[J]. Neurosci Lett, 2017, 639: 114-119. DOI:10.1016/j.neulet.2016.12.046 |
| [24] |
Chen G, Ye X, Zhang J, et al. Limb Remote Ischemic Postconditioning Reduces Ischemia-Reperfusion Injury by Inhibiting NADPH Oxidase Activation and MyD88-TRAF6-P38MAP-Kinase Pathway of Neutrophils[J]. Int J Mol Sci, 2016, 17(12): pii:E1971. DOI:10.3390/ijms17121971 |
 2018, Vol. 45
2018, Vol. 45




