扩展功能
文章信息
- 张卫国, 李建民, 郭科, 胡忠波, 彭江涛, 吴淑华
- ZHANG Wei-Guo, LI Jian-Min, GUO Ke, HU Zhong-Bo, PENG Jiang-Tao, WU Shu-Hua
- 胶质瘤中LC3B与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的相关性及意义
- Correlation of LC3B with CD68+ microglia, CD4+ T lymphocytes, and CD8+ T lymphocytes in gliomas and its significance
- 国际神经病学神经外科学杂志, 2017, 44(5): 472-477
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 472-477
-
文章历史
收稿日期: 2017-05-15
修回日期: 2017-08-28
胶质瘤是颅内原发性肿瘤中发病率、病死率最高的肿瘤 。目前,手术仍是胶质瘤的主要治疗手段,即使术后配合放、化疗等辅助治疗措施,其预后仍不能得到有效改善。免疫治疗作为一种新兴的肿瘤治疗方式,因其复发率低、副作用小等优点逐渐成为最有前景的肿瘤治疗方法之一,许多恶性肿瘤患者已在免疫治疗中获益。研究发现[3-5],抗原提呈细胞、CD4+和CD8+T淋巴细胞在肿瘤免疫方面扮演了重要角色,而肿瘤免疫在胶质瘤中的研究较少。此外,新近研究[6, 7]发现,肿瘤可以通过自噬促进相关细胞因子的分泌、参与肿瘤抗原的提呈和修饰,影响肿瘤免疫。本研究拟通过检测胶质瘤组织中LC3B的表达水平及CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量,并分析其相关性,探讨胶质瘤中自噬与肿瘤细胞免疫的关系及意义。
1 材料与方法 1.1 材料 1.1.1 组织来源收集2013年01月~2016年12月滨州医学院附属医院病理科存档的具有完整临床病理资料的127例胶质瘤石蜡标本及2015年01月~2016年12月40例非功能区胶质瘤患者的新鲜手术标本,取新鲜手术标本的临近正常脑组织作为对照,并分别将新鲜胶质瘤组织和瘤旁正常组织冻存在液氮中用于蛋白质制备。根据2016年世界卫生组织(WHO)胶质瘤分类标准,由两位高年资病理医师经双盲法阅片诊断,其中高级别(Ⅲ级、Ⅳ级)胶质瘤59例,低级别(Ⅰ级、Ⅱ级)68例,年龄9~74岁,平均(47.8±9.5)岁。所有患者均为首次发现,术前未进行放、化疗且无全身免疫性疾病及其他严重的慢性疾病。研究得到滨州医学院附属医院伦理委员会批准,所有患者均已签署同意书。
1.1.2 试剂兔抗人LC3B(ab48394)抗体浓缩液购自Abcam公司,鼠单抗巨噬细胞(CD68)抗体、鼠单抗辅助/诱导T细胞(CD4)抗体、兔单抗抑制/细胞毒T细胞(CD8)抗体及通用型二抗等其他辅助试剂均购自北京中杉金桥生物技术有限公司。Western blot实验相关试剂购自碧云天公司。
1.2 方法 1.2.1 免疫组化检测石蜡标本3μm厚连续切片,免疫组化染色采用EnVision二步法,染色步骤按说明书进行。LC3B表达于胶质瘤细胞胞质,以出现棕黄色或淡黄色为阳性标志,每张切片随机选择10个高倍镜(400×)视野进行图像采集,采用Image Pro Plus 6.0图像分析软件进行半定量分析,检测所选10个视野阳性区域的积分光密度(integrated optical density,IOD)值,以其平均值的大小反映LC3B的表达量。CD68、CD4和CD8分别表达于小胶质细胞胞质、T细胞胞质,呈棕黄色或淡黄色颗粒,每张切片随机选择肿瘤内10个高倍镜(400×)视野计数阳性细胞的个数,取其平均值。
1.2.2 western blot检测冰上提取组织蛋白,BCA法测定并计算蛋白浓度,所得蛋白加入5×蛋白上样缓冲液并热变性备用。各组分别取50μg进行SDS-PAGE电泳,转膜并封闭,一抗(LC3B 1:300)及β-actin (1:1000)4℃过夜,PBST洗去一抗后二抗(羊抗兔IgG1:10000)孵育2 h,ECL曝光,分别分析吸光度值。
1.3 统计学分析计量资料均采用均数±标准差(x±s)表示,组间比较采用单因素方差分析或独立样本t检验,相关性采用Spearman相关性分析,应用SPSS 23.0统计软件进行处理,以P < 0.05为差异具有统计学意义。
2 结果 2.1 不同组织中LC3B的表达 2.1.1 免疫组织化学检测LC3B免疫组织化学染色显示,LC3B在瘤旁正常组织、低级别胶质瘤及高级别胶质瘤中呈不同程度的表达(图 1)。经单因素方差分析比较,LC3B在胶质瘤中的表达明显高于瘤旁正常组织(P < 0.05),且高级别胶质瘤明显高于低级别胶质瘤(P < 0.05)(表 1)。
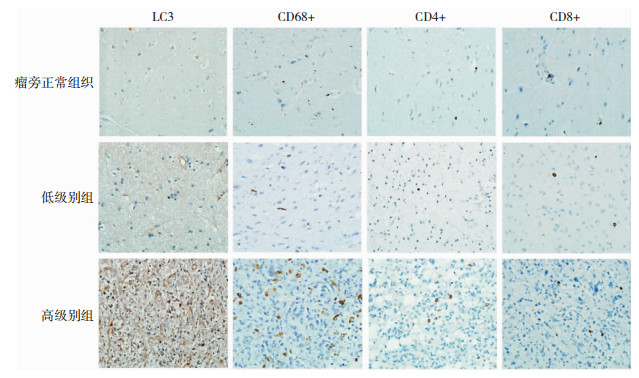
|
| 图 1 免疫组织化学染色(400×)示LC3B、CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的表达情况 |
| 组别 | n | LC3B(IOD) | CD68+ | CD4+ | CD8+ |
| 瘤旁正常组 | 40 | 1386.00±84.14 | 10.58±1.70 | 3.77±0.16 | 3.07±0.11 |
| 低级别组 | 68 | 18936.24±558.53* | 30.78±2.09* | 5.83±0.25* | 4.04±0.88* |
| 高级别组 | 59 | 36652.46±914.31*# | 49.47±3.41*# | 21.76±2.60*# | 11.72±1.67*# |
| 注:“*”不同级别胶质瘤与正常组织比较P < 0.05,“#”不同级别胶质瘤比较P < 0.05。 | |||||
blot检测瘤旁正常组织、低级别胶质瘤及高级别胶质瘤中LC3B的表达情况。应用Image Pro Plus 6.0图像分析软件对各条带进行定量分析。统计分析显示,LC3B在高级别胶质瘤中的表达与低级别相比明显升高(P < 0.05),且LC3B在低级别胶质瘤中的表达明显高于瘤旁正常组织(P < 0.05)(图 2、图 3)。
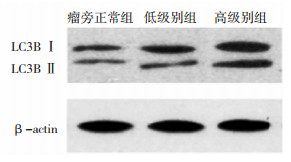
|
| 图 2 western blot示LC3B在瘤旁正常组织、低级别及高级别胶质瘤中的表达情况 |
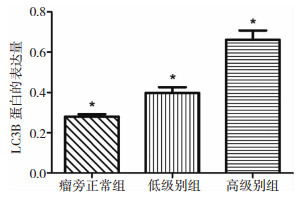
|
| 图 3 Western blot法检测不同组织中LC3B的蛋白表达量*P < 0.05 |
免疫组织化学染色显示,CD68+小胶质细胞散布于瘤旁正常脑组织及肿瘤组织内。瘤旁正常脑组织中少量CD4+和CD8+ T淋巴细胞分布于血管周围;而胶质瘤中CD4+和CD8+T淋巴细胞在肿瘤组织和血管周围均有分布(图 1)。细胞计数表明,CD68+小胶质细胞、CD4+和CD8+T淋巴细胞在高级别胶质瘤中明显高于低级别和瘤旁正常组织(P < 0.05), 且低级别胶质瘤高于瘤旁正常组织(P < 0.05)(表 1)。
2.3 不同级别胶质瘤中LC3B的表达与CD68+小胶质细胞、CD4+及CD8+T淋巴细胞数量的相关性经Spearman相关性分析显示,胶质瘤组织中LC3B的表达与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量有关。在高级别胶质瘤中,LC3B与CD68+小胶质细胞呈正相关(P=0.000,r=0.657),LC3B与CD4+T淋巴细胞呈正相关(P=0.021,r=0.608),LC3B与CD8+T淋巴细胞呈正相关(P=0.001,r=0.561);在低级别胶质瘤中,LC3B与CD68+小胶质细胞呈正相关(P=0.008,r=0.466),LC3B与CD4+T淋巴细胞呈正相关(P=0.011,r=0.599),LC3B与CD8+T淋巴细胞呈正相关(P=0.026,r=0.537)。而瘤旁正常组中LC3B与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞无明显相关(P > 0.05)(表 2)。
| 分组 | n | LC3B与CD68+ | LC3B与CD4+ | LC3B与CD8+ | |||||
| r值 | P值 | r值 | P值 | r值 | P值 | ||||
| 瘤旁正常组 | 40 | 0.194 | 0.251 | 0.239 | 0.311 | 0.221 | 0.447 | ||
| 低级别组 | 68 | 0.466 | 0.008* | 0.599 | 0.011* | 0.537 | 0.026* | ||
| 高级别组 | 59 | 0.657 | 0.000* | 0.608 | 0.021* | 0.561 | 0.001* | ||
| 注:*P < 0.05 | |||||||||
在胶质瘤组织中,LC3B的表达及CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量均与肿瘤的大小有关(P < 0.05),肿瘤直径越大其表达越高,但与患者的年龄、性别无关(P > 0.05)(表 3)。
| 临床病理参数 | n | LC3B(IOD) | p值 | CD68+ | p值 | CD4+ | p值 | CD8+ | p值 |
| 年龄 | |||||||||
| ≤50岁 | 59 | 25011.23±594.83 | 0.328 | 38.49±3.71 | 0.311 | 12.70±1.70 | 0.332 | 7.19±0.88 | 0.225 |
| > 50岁 | 68 | 29036.72±879.20 | 40.31±3.09 | 13.69±1.59 | 7.97±0.94 | ||||
| 性别 | |||||||||
| 男 | 73 | 26359.46±536.51 | 0.237 | 39.90±3.83 | 0.243 | 12.01±1.93 | 0.205 | 8.52±1.07 | 0.432 |
| 女 | 54 | 28257.76±607.57 | 38.88±3.56 | 14.87±2.00 | 6.38±1.22 | ||||
| 肿瘤大小 | |||||||||
| ≤4cm | 82 | 23805.31±531.11 | 0.006* | 36.03±3.96 | 0.032* | 10.33±1.08 | 0.021* | 5.54±0.49 | 0.016* |
| > 4cm | 45 | 33291.65±502.66 | 45.72±5.13 | 18.51±1.17 | 11.37±0.62 | ||||
| 肿瘤部位 | |||||||||
| 幕上 | 96 | 27415.34±502.66 | 0.180 | 39.16±3.52 | 0.442 | 14.35±1.76 | 0.240 | 7.99±0.74 | 0.148 |
| 幕下 | 31 | 26396.35±599.39 | 40.41±4.07 | 12.87±2.03 | 6.43±0.99 | ||||
| 注:*P < 0.05 | |||||||||
自噬是广泛存在于真核细胞中高度保守的生命现象,是通过在胞内形成双层膜结构的自噬泡来降解长寿命蛋白质和受损细胞器的过程,在维持蛋白代谢平衡、内环境稳定、结构重建、细胞生长及凋亡中发挥着重要作用[8]。自噬与肿瘤有关,且在不同的肿瘤中扮演着不同的角色。Wu等[9]研究发现,自噬相关基因LC3在结直肠癌中呈高表达,且与患者的良好预后相关。于婷等[10]在卵巢癌中却发现,LC3的表达促进了肿瘤的发生、发展。目前,自噬在胶质瘤中的作用尚无定论。本研究通过检测胶质瘤组织中自噬关键因子LC3B的表达水平,发现胶质瘤组织中的表达明显高于瘤旁正常组织,且在高级别胶质瘤中的表达高于低级别,提示胶质瘤组织中存在自噬被激活的现象。Li等[11]发现,在肿瘤发展过程中,可以通过自噬不断适应变化的肿瘤微环境,有效逃脱缺氧和营养匮乏等恶劣环境的凋亡威胁。我们推测,胶质瘤自噬的激活可能作为一种代偿方式,为胶质瘤的快速生长和旺盛代谢提供能量和稳定的肿瘤微环境。
自Thomas[12]和Burent[13]提出免疫监视学说以来,肿瘤的细胞免疫一直是肿瘤学和免疫学学者致力研究的重要内容,并取得了丰硕的研究成果。中枢神经系统由于血脑屏障的存在、缺乏淋巴引流系统和抗原提呈细胞等特点,以往被称为“免疫特免区”[14]。新近研究表明,血脑屏障对淋巴细胞的阻隔只是相对的[15],在中枢神经系统外活化的T淋巴细胞可以很容易检测位于中枢神经系统实质内的抗原[16],同时Aloisi等[17]发现,小胶质细胞激活后可表达主要组织相容性复合物(major histocompatibility complex, MHC)Ⅱ类分子发挥抗原提呈作用参与细胞免疫。因此,中枢“免疫特免区”的概念已不成立。目前在胶质瘤的相关研究中研究发现,胶质瘤患者外周血中CD4+T淋巴细胞与正常对照组相比显著降低,而CD8+T淋巴细胞则显著升高,且CD8+T淋巴细胞的数量与患者的预后关系密切[18],但CD4+T淋巴细胞和CD8+T淋巴细胞在胶质瘤组织中的相关研究尚未见报道。本实验结果表明,胶质瘤组织中存在CD68+小胶质细胞数量增多、CD4+和CD8+T淋巴细胞浸润的现象,且CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量在瘤旁正常组织、低级别胶质瘤和高级别胶质瘤中依次递增,其差异具有统计学意义。提示胶质瘤在发生发展过程中存在肿瘤细胞免疫功能的改变。
最新研究[19, 20]发现,自噬在肿瘤免疫反应中发挥着重要作用。Van den Boorn等[7]研究发现,自噬能够诱导肿瘤表面抗原的表达及释放,促使免疫细胞识别并杀伤肿瘤细胞。Wang等[21]研究表明,激活自噬能显著提高肿瘤细胞的抗原交叉提呈作用,并诱导特异性CD8+T淋巴细胞应答。本实验中,通过分析不同级别胶质瘤组织中自噬活性与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞数量的相关性,发现在高级别和低级别胶质瘤中LC3B的表达与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量均呈正相关。提示自噬水平的变化可能是影响胶质瘤细胞免疫的因素之一。一方面,自噬在降解受损细胞器和变性蛋白质的过程中可以诱导肿瘤抗原物质的产生和表达,并通过MHC-I类分子以直接提呈方式激活CD8+T淋巴细胞,或者通过抗原提呈细胞的摄取以MHC-Ⅱ类分子提呈的方式激活CD4+T淋巴细胞;另一方面,自噬可以增强肿瘤细胞内相关抗原的交叉提呈作用,诱导细胞免疫反应,但其机制尚待进一步研究。
目前,关于LC3B的表达、CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量与胶质瘤患者临床病理因素的相关性研究甚少。我们分析发现LC3B、CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的表达均与肿瘤大小有关,肿瘤直径越大其表达越高。我们认为,肿瘤直径是影响其内部血供的因素之一,直径越大血供越差,自噬活性也越高,从而促进了肿瘤抗原的表达和提呈,激活了细胞免疫反应。
总之,在胶质瘤组织中LC3B的表达及CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量均随级别的升高而增高,且LC3B的表达与CD68+小胶质细胞、CD4+和CD8+T淋巴细胞的数量均呈正相关。目前,关于胶质瘤免疫的研究甚少,本实验在胶质瘤组织中对自噬与肿瘤细胞免疫的关系进行了初步探讨,为胶质瘤的临床治疗提供了新思路和理论依据,但其机制仍待于进一步研究。
| [1] |
Malmstrom A, Gronberg BH, Marosi C, et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma:the nordic randomised, phase 3 trial[J]. Lancet oncol, 2012, 13(9): 916-926. DOI:10.1016/S1470-2045(12)70265-6 |
| [2] |
牛万祥, 周晨旭, 牛朝诗. CYP17A1和AR在脑胶质瘤中的表达及意义[J]. 国际神经病学神经外科学杂志, 2017(01): 1-4. |
| [3] |
Zinkernagel RM, Doherty PC. Immunological surveillance against altered self components by sensitised T lymphocytes in lymphocytic choriomeningitis[J]. Nature, 1974, 251(5475): 547-548. DOI:10.1038/251547a0 |
| [4] |
Coulie PG, Van den Eynde BJ, Vander Bruggen P, et al. Tumour antigens recognized by T lymphocytes:at the core of cancer immunotherapy[J]. Nat Rev Cancer, 2014, 14(2): 135-146. DOI:10.1038/nrc3670 |
| [5] |
Marcus A, Gowen BG, Thompson TW, et al. Recognition of tumors by the innate immune system and natural killer cells[J]. Adv Immunol, 2014, 122: 91-128. DOI:10.1016/B978-0-12-800267-4.00003-1 |
| [6] |
Yu P, Fu YX. Tumor-infiltrating T lymphocytes:friends or foes[J]. Lab Invest, 2006, 86(3): 231-245. DOI:10.1038/labinvest.3700389 |
| [7] |
Van den Boorn JG, Picavet DI, van Swieten PF, et al. Skin-Depigmenting Agent Monobenzone Induces Potent T-Cell Autoimmunity toward Pigmented Cells by Tyrosinase Haptenation and Melanosome Autophagy[J]. J Invest Dermatol, 2011, 131(6): 1240-1251. DOI:10.1038/jid.2011.16 |
| [8] |
Kaur J, Debnath J. Autophagy at the crossroads of catabolism and anabolism[J]. Nat Rev Mol Cell Biol, 2015, 16(8): 461-472. DOI:10.1038/nrm4024 |
| [9] |
Wu S, Sun C, Tian D, et al. Expression and clinical significances of Beclin1, LC3 and mTOR in colorectal cancer[J]. International journal of clinical and experimental pathology, 2015, 8(4): 3882-3891. |
| [10] |
于婷, 赵洪萍, 周颖, 等. 自噬相关蛋白LC3-Ⅱ在上皮性卵巢癌中的表达及临床意义[J]. 安徽医科大学学报, 2015, 50(05): 628-631. |
| [11] |
Li L, Tan J, Miao Y, et al. ROS and Autophagy:Interactions and Molecular Regulatory Mechanisms[J]. Cellular and molecular neurobiology, 2015, 35(5): 615-621. DOI:10.1007/s10571-015-0166-x |
| [12] |
Anguille S, Smitse L, Bryant C, et al. Dendritic cells as pharmacological tools for cancer immunotherapy[J]. Pharmacol Rev, 2015, 67(4): 731-753. DOI:10.1124/pr.114.009456 |
| [13] |
Burnet FM. Immunological aspects of malignant disease[J]. Lancet, 1967, 1(7501): 1171-1174. |
| [14] |
Louveau A, Smirnov I, Keyes TJ, et al. Structural and functional features of central nervous system lymphatic vessels[J]. Nature, 2015, 523(7560): 337-341. DOI:10.1038/nature14432 |
| [15] |
Carson MJ, Doose JM, Melchior B, et al. CNS immune privilege:hiding in plain sight[J]. Immunol Rev, 2006, 213: 48-65. DOI:10.1111/imr.2006.213.issue-1 |
| [16] |
Tsai CY, Chow NH, Ho TS, et al. Intracerebral injection of myelin basic protein(MBP)induces inflammation in brain and causes paraplegia in MBP-sensitized B6 mice[J]. Clin ExpImmunol, 1997, 109(1): 127-133. |
| [17] |
Aloisi F. Immune function of microglia[J]. Glia, 2001, 36(2): 165-179. DOI:10.1002/(ISSN)1098-1136 |
| [18] |
Han S, Zhang C, Li Q, et al. Tumour-infiltrating CD4(+) and CD8(+) lymphocytes as predictors of clinical outcome in glioma[J]. Br J Cancer, 2014, 110(10): 2560-2568. DOI:10.1038/bjc.2014.162 |
| [19] |
Patel S, Hurez V, Nawrocki ST, et al. Vorinostat and hydroxychloroquine improve immunity and inhibit autophagy in metastatic colorectal cancer[J]. Oncotarget, 2016, 7(37): 59087-59097. DOI:10.18632/oncotarget.v7i37 |
| [20] |
Yi Y, Zhou Z, Shu S, et al. Antigen cross-presentation:Autophagosome as the argo of shared tumor-specific antigens and DAMPs[J]. Oncoimmunology, 2012, 1(6): 976-978. DOI:10.4161/onci.20059 |
| [21] |
Wang LX, Li R, Yang G, et al. Interleukin-7-dependent expansion and persistence of Melanoma-specific T cells in lymphodepleted mice lead to tumor regression and editing[J]. Cancer Res, 2005, 65(22): 10569-10577. DOI:10.1158/0008-5472.CAN-05-2117 |
 2017, Vol. 44
2017, Vol. 44




