扩展功能
文章信息
- 赵旺淼, 葛春燕, 张万增, 李晓卫, 孙昭胜
- Zhao Wang-miao, Ge Chun-yan, Zhang Wan-zeng, Li Xiao-wei, Sun Zhao-sheng
- 利用CTA“点状征”指导中等量高血压脑出血手术方式的选择
- Selection of surgical procedures for moderate hypertensive intracerebral hemorrhage in the basal ganglia guided by CTA "spot sign"
- 国际神经病学神经外科学杂志, 2017, 44(5): 459-462
- Journal of International Neurology and Neurosurgery, 2017, 44(5): 459-462
-
文章历史
收稿日期: 2017-04-10
修回日期: 2017-08-23
近些年提出的CTA“点状征”为预测早期血肿增大提供了良好的影像学依据[1]。本文报道了我院自2012年9月至2016年9月收治的中等量(30ml~60ml)高血压基底节区脑出血166例,根据CTA“点状征”是否存在,将患者分为两类。对每种类型的脑出血再次随机分组,分别实施不同的手术方式进行干预。分析结果,对手术方式进行评估,指导高血压脑出血手术方式的选择。
1 资料与方法 1.1 临床资料入选标准:(1)符合第四届全国脑血管病学术会议修订的高血压脑出血诊断标准[2]。(2)出现症状到入院时间<6h。(3)出血部位为基底节区,出血量在30ml~60ml之间。(4)生命体征稳定。排除标准:(1)服用抗凝药物或存在凝血功能障碍。(2)患神经系统疾病并遗留神经功能障碍者。(3)严重心、肺、肝、肾等重要脏器功能障碍者。(4)外伤、动脉瘤或血管畸形破裂等原因造成的出血。(5)妊娠妇女。CTA“点状征”的诊断标准:(1)在CTA的原始图像上,血肿实质内可见“匍匐形”或“点状”高密度影,与周围血管无关。(2)至少在一个层面,可见对比剂征象直径>1.5mm。(3)造影剂密度的CT值(Hounsfield Unit, HU)至少为背景血肿密度的2倍。(4)在对应位置的非增强CT上没有高密度影[3]。经标准化、规范化后,符合入选标准的患者共有166例,其中CTA“点状征”阳性者84例,阴性者82例。对以上两类病例,每个类型随机分为开颅手术组和钻孔引流术组,两组均衡性好,具有可比性。差异无统计学意义(P>0.05)。
1.2 治疗方法入院患者首先行非增强CT扫描,确诊为脑出血并满足入选标准者行脑血管CTA扫描。由2名影像学工作人员对CTA“点状征”进行判断,患者的临床情况对其设盲,判断不一致的情况由协商解决,结果提示观察一致性良好(κ=0.841)。血肿量根据ABC/2公式计算[4]。患者入院后均给予常规药物治疗,严密观察。根据随机分组情况采取开颅手术或钻孔引流术治疗。开颅手术采取小骨窗,显微镜下彻底清除血肿,直视下严密止血,残腔留置引流管。钻孔引流术根据CT标线定位,局麻下锥颅,钻孔部位避开重要血管和功能区,将引流管置入血肿腔,在无阻力的情况下抽吸血肿,如为血凝块抽吸困难则不勉强,避免强行抽吸导致出血,引流管连接引流装置,术后2h予以尿激酶2~4万单位血肿腔内注入,促进残余血肿液化引流,每日2次,引流3~5d,残余血肿量在10ml以下拔除引流管。术后再出血诊断标准:于术后即刻,1天,3天复查头颅CT,病情有变化随时复查。参考PREDICT试验标准[1],对于开颅手术病例,残腔如有血肿,且血肿量>6ml,即诊断为术后再出血;对于钻孔引流术病例,血肿量增加>6ml或体积增加超过33%,即诊断为术后再出血。对于再出血病例,如为开颅手术组,血肿量>60ml,再次行开颅手术治疗,<60ml应用尿激酶以利引流;如为钻孔引流术组,血肿量>60ml,行开颅手术治疗,<60ml应用尿激酶以利引流。术后治疗原则相同,均包括监测神志、瞳孔、生命体征,予以脱水药、抗生素、神经营养、控制血压、维持电解质平衡、支持治疗、康复治疗等。
1.3 资料收集及统计学方法分别收集CTA“点状征”阳性及阴性脑出血病例经过不同手术方式治疗后的再出血例数、死亡例数,发病后90d的改良Rankin评分(modified Rankin Scale, mRS)及日常生活能力评分(Activities of Daily Living, ADL),评估两种手术方式。预后指标mRS>2表示患者生活依赖,ADL评分以Barthel指数(Barthel Index, BI)≥90表示患者预后良好。使用Pearson χ2检验和Fisher确切概率法进行统计分析,用SPSS 19.0作为统计软件,P<0.05认为有统计学意义。
2 结果 2.1 术后再出血情况对于CTA“点状征”阳性的患者,开颅手术组再出血病例为8例(19.0%),钻孔引流术组为17例(40.1%)。再出血率比较,差异有统计学意义(P<0.05)。对于CTA“点状征”阴性患者,开颅手术组再出血病例为7例(17.5%),钻孔引流术组为5例(11.9%)。再出血率比较,差异无统计学意义(P=0.543)。(见表 1、2)
| 开颅手术组n(%) | 钻孔引流术组n(%) | χ2值 | P值 | |
| 再出血 | ||||
| 有 | 8(19.0) | 17(40.1) | 4.613 | 0.032 |
| 无 | 34(81.0) | 25(59.9) | ||
| 死亡 | ||||
| 是 | 4(9.5) | 13(31.0) | 5.974 | 0.028 |
| 否 | 38(90.5) | 29(69.0) | ||
| mRS | ||||
| ≤2 | 11(28.9) | 7(24.1) | 0.194 | 0.660 |
| >2 | 27(71.1) | 22(75.9) | ||
| BI | ||||
| ≥90 | 8(21.1) | 5(17.2) | 0.696 | 0.153 |
| <90 | 30(78.9) | 24(82.8) |
| 开颅手术组n(%) | 钻孔引流术组n(%) | χ2值 | P值 | |
| 再出血 | ||||
| 有 | 7(17.5) | 5(11.9) | 0.513 | 0.543 |
| 无 | 33(82.5) | 37(89.1) | ||
| 死亡 | ||||
| 是 | 4(10.0) | 3(7.1) | 0.214 | 0.709 |
| 否 | 36(90.0) | 39(92.9) | ||
| mRS | ||||
| ≤2 | 11(30.6) | 13(33.3) | 0.066 | 0.797 |
| >2 | 25(69.4) | 26(66.7) | ||
| BI | ||||
| ≥90 | 10(27.8) | 9(23.1) | 0.219 | 0.640 |
| <90 | 26(72.2) | 30(76.9) |
对于CTA“点状征”阳性患者,开颅手术组死亡病例为4例(9.5%),钻孔引流术组为13例(31.0%)。死亡率比较,差异有统计学意义(P<0.05)。对于CTA“点状征”阴性患者,开颅手术组死亡病例为4例(10.0%),钻孔引流术组为3例(7.1%)。死亡率比较,差异无统计学意义(P=0.709)。(见表 1、2)
2.2.2 发病后90d mRS及BI比较对于CTA“点状征”阳性患者,mRS提示能够自理的病例,开颅手术组为11例(28.9%),钻孔引流术组为7例(24.1%),差异无统计学意义(P=0.660)。BI提示预后良好病例,开颅手术组为8例(21.1%),钻孔引流术组为5例(17.2%),差异无统计学意义(P=0.153)。对于CTA“点状征”阴性患者,mRS提示能够自理的病例,开颅手术组为11例(30.6%),钻孔引流术组为13例(33.3%),差异无统计学意义(P=0.797)。BI提示预后良好病例,开颅手术组为10例(27.8%),钻孔引流术组为9例(23.1%),差异无统计学意义(P=0.640)。(见表 1、2)
3 讨论高血压脑出血是临床上常见的危重症,有较高的致残率和死亡率。关于脑出血的治疗方式依然存在争议。大型的STICH试验并没有得出令外科医生满意的结果,它认为相对于保守治疗,早期实施外科手术并不能使患者明显获益,对于浅表的脑出血患者,手术或许有微弱的临床相关的生存优势[5, 6]。但是,手术依然是治疗脑出血的重要方法之一。STICH试验后,美国的脑出血手术量并未减少,但是住院病人的死亡率下降了,这就要求我们探讨何种病人更适合手术治疗,何种手术方式更理想[7]。初始血肿量及血肿位置是预后重要的预测因素[8],但这些因素是不可控的。CTA“点状征”是判断早期血肿增大及预后的良好指标。有良好的敏感度和特异度,而且能够预测术中的活动性出血[9]。
我们对比了最常见的两种手术方式。根据CTA“点状征”是否存在,将脑出血分为两种类型,分别予以不同的手术方式。对于“点状征”阳性患者,钻孔引流术的再出血率和死亡率高于开颅手术组。结合两种手术方式的不同,我们认为,钻孔引流术虽然创伤小,操作简单,但不能在直视下止血,CTA“点状征”阳性往往提示脑内有活动性出血,钻孔手术虽然能够清除部分血肿,但无法阻止血肿继续增大,造成再出血率增加,死亡率升高,尽管存活患者的预后未表现出明显差异。我们提供了一例钻孔引流术后再出血的典型病例(见图 1)。
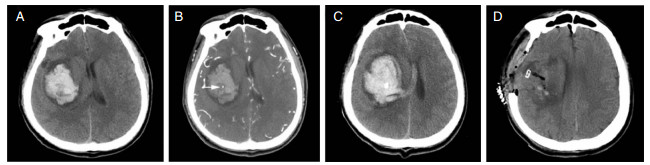
|
| 图 1 男性,51岁,症状出现后2小时入院。A.入院时非增强CT扫描提示右侧基底节区脑出血。B.进一步行CTA扫描,提示血肿内存在“点状征”(白色箭头)。C.血肿穿刺后非增强CT扫描(血肿内高密度为引流管)提示血肿增大。D.行开颅手术清除颅内血肿,术后非增强CT扫描。 |
对于CTA“点状征”阴性患者,开颅手术组的再出血率及预后指标较钻孔引流术组并未表现出差异,这有别于一些类似研究 ,国内吴国鑫等[12]研究发现,小骨窗显微手术的血肿清除率优于钻孔引流术,但术后3个月的功能评分低于钻孔引流术。党帅[13]研究认为,穿刺引流术与翼点入路经侧裂显微手术的长期神经功能无明显差别。我们认为,随着显微外科手术的普及和技术的提高,手术对于脑组织的副损伤明显减少了,清除血肿在减轻占位和机械压迫效应的同时,能够避免血肿的代谢产物对脑组织的继发损伤[14],在清除血肿方面,显微外科手术更快更彻底,所以两种手术方式没有表现出差异是可以解释的。术后再出血是影响预后的重要因素[15],所以我们选择该指标评估手术。在脑出血的治疗中,小量脑出血内科治疗往往能够获得良好的效果,而大量脑出血,无论手术与否,患者预后均不良[5],中等量脑出血的治疗能够比较理想的反映出手术治疗的效果。血肿增大主要发生在发病的前6h,病情恶化亦常出现在发病初期,“点状征”的检出频率随着发病时间延长而下降[16],所以我们选择了超急性期患者作为研究对象,该研究对象仅能代表脑出血的一个亚组,对于不同发病时间窗、不同部位及血肿量的脑出血仍需进一步分类研究。
综上所述,利用CTA“点状征”对中等量脑出血进行分类。“点状征”阳性患者更适宜开颅手术治疗,能够降低再出血率及死亡率。对于“点状征”阴性患者,两种手术方式没有明显差异,考虑到钻孔引流术创伤小,麻醉简单,费用少,更适宜推广。CTA“点状征”可以作为急性期脑出血分类的一个良好指标,为脑出血手术治疗方式的选择提供参考。
| [1] |
Demchuk AM, Dowlatshahi D, Rodriguez Luna D, et al. Prediction of haematoma growth and outcome in patients with intracerebral haemorrhage using the CT-angiography spot sign(PREDICT):a prospective observational study[J]. Lancet Neurol, 2012, 11(4): 307-314. DOI:10.1016/S1474-4422(12)70038-8 |
| [2] |
中华神经外科学会. 脑血管疾病分类及诊断[J]. 中华神经外科杂志, 1997, 13(1): 2-3. |
| [3] |
Thompson AL, Kosior JC, Gladstone DJ, et al. Defining the CT angiography "spot sign" in primary intracerebral hemorrhage[J]. Can J Neurol Sci, 2009, 36(4): 456-461. DOI:10.1017/S0317167100007782 |
| [4] |
Kothari RU, Brott T, Broderick JP, et al. The ABCs of measuring intracerebral hemorrhage volumes[J]. Stroke, 1996, 27(8): 1304-1305. DOI:10.1161/01.STR.27.8.1304 |
| [5] |
Mendelow AD, Gregson BA, Femandes HM, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral haematomas in the International Surgical Trial in Intracerebral Haemorrhage (STICH):a randomised trial[J]. Lancet, 2005, 365(9457): 387-397. DOI:10.1016/S0140-6736(05)70233-6 |
| [6] |
Mendelow AD, Gregson BA, Rowan EN, et al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial lobar intracerebral haematomas (STICH Ⅱ):a randomised trial[J]. Lancet, 2013, 382(9890): 397-408. DOI:10.1016/S0140-6736(13)60986-1 |
| [7] |
Adeoye O, Ringer A, Hornung R, et al. Trends in surgical management and mortality of intracerebral hemorrhage in the United States before and after the STICH trial[J]. Neurocrit Care, 2010, 13(1): 82-86. DOI:10.1007/s12028-010-9351-4 |
| [8] |
Broderick JP, Brott TG, Duldner JE, et al. Volume of intracerebral hemorrhage. A powerful and easy-to-use predictor of 30-day mortality[J]. Stroke, 1993, 24(7): 987-993. DOI:10.1161/01.STR.24.7.987 |
| [9] |
Brouwers HB, Raffeld MR, van Nieuwenhuizen KM, et al. CT angiography spot sign in intracerebral hemorrhage predicts active bleeding during surgery[J]. Neurology, 2014, 83(10): 883-889. DOI:10.1212/WNL.0000000000000747 |
| [10] |
Zhou H, Zhang Y, Liu L, et al. A prospective controlled study:minimally invasive stereotactic puncture therapy versus conventional craniotomy in the treatment of acute intracerebral hemorrhage[J]. BMC Neurol, 2011, 11: 76. DOI:10.1186/1471-2377-11-76 |
| [11] |
Sun H, Liu H, Li D, et al. An effective treatment for cerebral hemorrhage:minimally invasive craniopuncture combined with urokinase infusion therapy[J]. Neurol Res, 2010, 32(4): 371-377. DOI:10.1179/016164110X12670144526147 |
| [12] |
吴国鑫, 何明颖, 陈汉民. 应用DTI评估钻孔引流和小骨窗两种术式治疗中等量基底节区脑出血的预后情况[J]. 国际神经病学神经外科学杂志, 2016, 43(5): 399-402. |
| [13] |
党帅. 比较三种不同手术方式对基底节脑出血患者长期神经功能及颅内感染的影响[J]. 国际神经病学神经外科学杂志, 2016, 43(6): 526-530. |
| [14] |
Miller CM, Vespa PM, McArthur DL, et al. Frameless stereotactic aspiration and thrombolysis of deep intracerebral hemorrhage is associated with reduced levels of extracellular cerebral glutamate and unchanged lactate pyruvate ratios[J]. Neurocrit Care, 2007, 6(1): 22-29. DOI:10.1385/NCC:6:1 |
| [15] |
Wang WZ, Jiang B, Liu HM, et al. Minimally invasive craniopuncture therapy vs. conservative treatment for spontaneous intracerebral hemorrhage:results from a randomized clinical trial in China[J]. Int J Stroke, 2009, 4(1): 11-16. DOI:10.1111/j.1747-4949.2009.00239.x |
| [16] |
Dowlatshahi D, Brouwers HB, Demchuk AM, et al. Predicting intracerebral hemorrhage growth with the spot sign:the effect of onset-to-scan time[J]. Stroke, 2016, 47(3): 695-700. |
 2017, Vol. 44
2017, Vol. 44



