扩展功能
文章信息
- 张秀萍, 翟凤国, 梁启超, 刘佳维
- ZHANG Xiu-Ping, ZHAI Feng-Guo, LIANG Qi-Chao, LIU Jia-Wei
- 脑缺血时半乳糖凝集素-3对大鼠脑皮质中bcl-2、BAX及caspase-3表达的影响
- Effect of galectin-3 on expression of B-cell lymphoma-2, Bcl-2-asociated X protein, and cysteine aspartic acid-specific protease 3 in rat cerebral cortex during cerebral ischemia
- 国际神经病学神经外科学杂志, 2017, 44(4): 375-378
- Journal of International Neurology and Neurosurgery, 2017, 44(4): 375-378
-
文章历史
收稿日期: 2016-12-19
修回日期: 2017-07-01
半乳糖凝集素-3(galectin-3, Gal-3) 广泛分布于正常组织和疾病组织中,参与多种生理和病理过程,包括细胞生长和分化、免疫调节、细胞黏附、炎症反应、肿瘤侵袭、转移以及细胞凋亡等[1]。大量研究证实,Gal-3蛋白直接参与调节细胞凋亡,其具有促进细胞凋亡及抗细胞凋亡双重作用,但其在脑缺血/再灌注缺血/再灌注组(ischemia /reperfusion, I/R)损伤中的作用机制尚未见报道。同时,有研究表明,Gal-3缺乏可抑制B淋巴细胞瘤-2(B-cell lymphoma-2, bcl-2) 的表达,促进线粒体凋亡通路主要成员Bcl-2相关X蛋白(Bcl-2 associated X protein, BAX)及含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteine aspastic acid-specific protease 3, caspase-3) 的表达变化。
基于以上原因,通过脑缺血/再灌注损伤大鼠模型,确定Gal-3是否可以通过调控bcl-2、BAX及caspase-3的表达,参与脑缺血的病理过程,从而为脑缺血的发病及治疗机制提供一定的实验依据。
1 材料和方法 1.1 实验动物、分组及给药SPF级雄性SD大鼠18只,体重270~320 g,购自北京维通利华实验动物技术有限公司。大鼠随机分为3组,即假手术组(sham),假手术5 min后经侧脑室注射等容量生理盐水;缺血/再灌注组(I/R),脑缺血5 min后经侧脑室注射等容量生理盐水;Gal-3 RNA干扰组(siRNA),脑缺血5 min后经侧脑室注射Gal-3 siRNA 10 μg[2]。
1.2 主要试剂及仪器生物素标记的蛋白分子量标准(KangChen, KC-410);HRP标记的二级抗体;Trizol试剂(Invitrogen,美国);组织总蛋白提取试剂盒(KangChen, KC-415);BCA蛋白质定量试剂盒(KangChen, KC-430);KCTM化学发光试剂盒(KangChen, KC-420);逆转录试剂盒(Invitrogen);sybergreen I试剂盒(Invitrogen);PCR仪(BIO-RAD);real-time PCR仪(Applied biosystem);NanoDrop ND-1000紫外分光光度计。
1.3 大鼠大脑中动脉阻塞模型制备采用线栓法[3]制备大鼠大脑中动脉阻塞(middle cerebral artery occlusion, MCAO)模型,以10%水合氯醛(350 mg/kg)对大鼠进行麻醉,仰卧位固定,颈部正中切开皮肤,暴露并分离右侧的颈总、颈内及颈外动脉。于颈内、颈外动脉的分叉处以动脉夹夹闭,将颈外动脉近心端及远心端结扎,中间剪断。将尼龙线栓由颈外动脉的游离端插入到颈内动脉,深度大约为(18.5±0.5) mm,直至产生阻力感,使线头端通过大脑中动脉起始处,结扎颈内动脉用以固定尼龙线并防止出血,将切口逐层缝合,线残端留1 cm长于皮外。1.5 h后,将尼龙线拔出并进行再灌注至24 h,期间大鼠肛温保持37℃。假手术组大鼠不阻塞大脑中动脉,其他步骤同I/R组。
1.4 real-time PCR检测Gal-3、bcl-2、bax和caspase-3 mRNA表达取各组大鼠脑皮质组织,按Trizol试剂盒说明书提取总RNA。使用NanoDrop® ND-1000测定RNA A260/A280的比值范围在1.8~2.1之间。按逆转录试剂盒说明书合成cDNA,具体引物序列如下:
bcl-2(F:5’TGGGATGCCTTTGTGGAAC3’;R:5’CATATTTGTTTGGGGCAGGTC3’);
caspase-3(F:5’GAGCTGGACTGCGGTATTGAG3’;R: 5’ACACGGGATCTGTTTCTTTGC3’);
Gal-3(F:5’AGCCCAACGCAAACAGTATC3’;R:5’GGCTTCAACCAGGACCTGTA3’);
BAX(F:5’TTTTTGCTACAGGGTTTCATCCAGG3’;R: 5’CCATATTGCTGTCCAGTTCATCTCC3’);
GAPDH(F:5’GGAAAGCTGTGGCGTGAT3’;R:5’AAGGTGGAAGAATGGGAGTT3’);
Gal-3 siRNA[4](F:5’-GCAAUACAAAGCUGGAUAA dTdT-3’;R:5’-PUUAUCCAGCUUUGUAUUGCdTdT-3’)。
将dNTP 2.5 μl、10×PCR缓冲液2.5 μl、MgCl2溶液1.5 μ l、Taq聚合酶1U、2× Sybergreen、Gal-3、bcl-2、caspase-3、bax或GAPDH上下游引物各1 μl及cDNA模板1 μl,加无RNA酶水补足25 μl,轻弹管底将溶液混合。按50℃ 2 min,95℃ 10 min,95℃ 15 s,60℃ 1min,95℃ 15 s(40个循环);95℃ 15 s,60℃ 1 min反应条件进行real-time PCR反应。
1.5 Western blot检测Gal-3、bcl-2、BAX和caspase-3蛋白表达按蛋白提取试剂盒说明书提取各组大脑皮质蛋白(组织称重,切小块,加入预冷的含抑制剂的蛋白质抽提试剂,匀浆器匀浆,14, 000 xg预冷离心15 min),BCA蛋白质定量试剂盒进行定量,SDS-PAGE电泳,转膜,脱脂奶粉封闭1 h,将封闭过的膜加一级抗体4℃过夜,TBST洗3次,每次5 min。分别加兔抗鼠Gal-3多克隆抗体、兔抗鼠bcl-2多克隆抗体、兔抗鼠caspase-3多克隆抗体和兔抗鼠bax多克隆抗体(稀释度为1 :3000),4℃摇床过夜,加入HRP标记的羊抗兔二级抗体,室温摇床孵育2 h,充分漂洗,按照KCTM化学发光试剂盒说明曝光。β-actin做内参重复以上步骤。ImageJ分析软件分析特异条带灰度值。
1.6 统计学分析数据采用均数±标准差(x±s)表示,采用SPSS 17.0及Graphpad 5.0统计软件,组间比较用t检验进行分析。real-time PCR结果用2-△△CT(即表达升高或降低的倍数)表示。P < 0.05表示差异具有统计学意义。
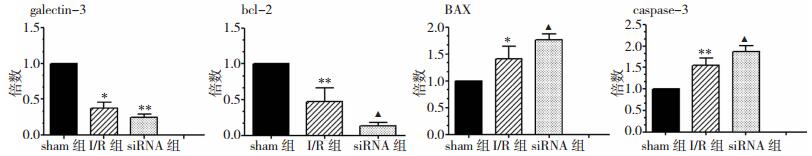
2 结果 2.1 脑缺血/再灌注损伤时Gal-3对bcl-2、BAX和caspase-3 mRNA表达的影响与sham组比较,I/R组Gal-3和bcl-2 mRNA表达均下调(P < 0.05);BAX及caspase-3 mRNA表达均上调(P < 0.05)。与I/R组比较,siRNA组Gal-3及bcl-2 mRNA表达均下调(P < 0.05);BAX及caspase-3 mRNA表达均上调(P < 0.05)。见表 1、图 1。
| 组别 | 例数(n) | Gal-3 | bcl-2 | BAX | caspase-3 |
| sham组 | 6 | 1.00±0.01 | 1.00±0.02 | 1.00±0.03 | 1.00±0.01 |
| I/R组 | 6 | 0.38±0.08* | 0.47±0.19** | 1.41±0.24* | 1.55±0.17** |
| siRNA组 | 6 | 0.24±0.05▲▲ | 0.14±0.04▲ | 1.76±0.12▲ | 1.88±0.13▲ |
| 注:*为与sham组比较,P < 0.05;**为与sham组比较,P < 0.01;▲为与I/R组比较,P < 0.05;▲▲为与I/R组比较,P < 0.01。 | |||||
|
| 图 1 脑缺血时Gal-3对bcl-2、bax和caspase-3 mRNA表达的影响 |
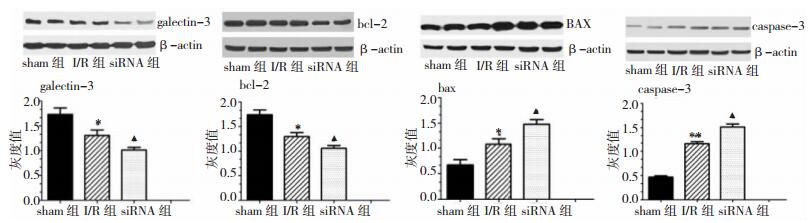
与sham比较,I/R组Gal-3及bcl-2蛋白表达均下调(P < 0.05);BAX及caspase-3蛋白表达均上调(P < 0.05)。与I/R组比较,siRNA组Gal-3及bcl-2蛋白表达下调(P < 0.05);而BAX及caspase-3蛋白表达上调(P < 0.05)。见表 2、图 2。
| 组别 | Gal-3 | bcl-2 | BAX | caspase-3 |
| sham组 | 1.732±0.262 | 1.743±0.192 | 0.672±0.208 | 0.468±0.053 |
| I/R组 | 1.310±0.215* | 1.299±0.160* | 1.076±0.246* | 1.155±0.083** |
| siRNA组 | 1.014±0.109▲ | 1.058±0.111▲ | 1.480±0.184▲ | 1.515±0.124▲ |
| 注:*为与sham组比较,P < 0.05;**为与sham组比较,P < 0.01;▲为与I/R组比较,P < 0.05。 | ||||
|
| 图 2 脑缺血时Gal-3对bcl-2、BAX和caspase-3蛋白表达的影响 |
我国最新的全国公民死亡原因调查结果显示,脑缺血已成为我国公民致死、致残最主要的疾病之一[5]。我国现存脑血管病患者700余万人,其中约有80%~85%的脑血管病患者为脑缺血[6]。
脑缺血发病机制非常复杂,目前研究认为,与脑缺血发生发展相关的病理机制包括:能量耗竭、兴奋性毒性、钙超载、氧化应激、炎症和细胞凋亡等。脑缺血再灌注损伤会产生大量活性氧,引发一系列的事件,包括细胞凋亡及坏死[7]。而细胞凋亡是脑缺血的一个突出特点,在延迟梗死中起着重要的病理作用[8]。
大量研究证实,Gal-3蛋白直接参与调节细胞凋亡。其具有促进细胞凋亡及抗细胞凋亡双重作用。Huang等[9]发现人脑垂体腺瘤组织中Gal-3及Bcl-2的mRNA及蛋白表达均明显升高,认为Gal-3可能通过与Bcl-2协同产生抗凋亡作用。Fukumori等[10]采用人前列腺癌LNCaP细胞系,转染Gal-3,之后发现,用抗癌药物处理后,Gal-3间接抑制细胞色素c的释放和caspase-3的激活;表明Gal-3可能抑制抗癌药物诱导的细胞凋亡。Yang等[11]通过人白血病T细胞转染Gal-3后发现,Gal-3可能通过bcl-2相关细胞死亡抑制通路成为抑制细胞凋亡的调节子。Okamura等[12]发现慢性阻塞性肾小管慢性损伤细胞内Gal-3可抑制半胱氨酸天冬氨酸蛋白酶(caspase)的活力、抑制肾小管上皮细胞的凋亡,从而可通过抑制细胞凋亡而保护肾小管慢性损伤。以上研究均表明,Gal-3具有一定的抑制细胞凋亡的作用。而本研究发现,大鼠I/R后,脑皮质中Gal-3及bcl-2 mRNA及蛋白表达下调;BAX及caspase-3 mRNA及蛋白表达上调;而Gal-3 RNA干扰后,Gal-3及bcl-2 mRNA及蛋白表达下调更显著,BAX及caspase-3 mRNA及蛋白表达上调更显著。表明Gal-3可能通过上调bcl-2、下调caspase-3及BAX mRNA及蛋白的表达,参与脑缺血/再灌注损伤的病理过程。
| [1] |
林芳, 任阳, 冯琳, 等. 2型糖尿病患者基质金属蛋白酶-12基因多态性与缺血性卒中的相关性研究[J]. 国际神经病学神经外科学杂志, 2017, 44(1): 44-48. |
| [2] |
韩江全, 卢俊江, 向灿辉, 等. MicroRNA-155对糖尿病大鼠脑缺血损伤血管再生的调控[J]. 中国病理生理杂志, 2015, 31(2): 354-358. |
| [3] |
Calloni RL, Winkler BC, Ricci G, et al. Transient middle cerebral artery occlusion in rats as an experimental model of brain ischemia[J]. Acta Cir Bras, 2010, 25(5): 428-433. DOI:10.1590/S0102-86502010000500008 |
| [4] |
魏杨辉. Galectin-3siRNA和pIRES-IL-24-TRAIL的构建及其对乳腺癌细胞增殖和凋亡的影响[D]. 南方医科大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-90023-1014101027.htm
|
| [5] |
Nagakannan P, Shivasharan BD, Thippeswamy BS, et al. Protective effect of hydroalcoholic extract of Mimusops elengi Linn. flowers against middle cerebral artery occlusion induced brain injury in rats[J]. J Ethnopharmacol, 2012, 140(2): 247-254. DOI:10.1016/j.jep.2012.01.012 |
| [6] |
王虹虹, 曾红. 缺血性脑血管病概述[J]. 中国临床医生, 2011, 39(6): 7-10. |
| [7] |
Ozaki M, Deshpande SS, Angkeow P, et al. Inhibition of the Rac1 GTPase protects against nonlethal ischemia/reperfusion-induced necrosis and apoptosis in vivo[J]. FASEB J, 2000, 14(3): 418-429. |
| [8] |
Cheng CY, Lin JG, Su NY, et al. Electroacupuncture-like stimulation at Baihui and Dazhui acupoints exerts neuroprotective effects through activation of the brain-derived neurotrophic factor-mediated MEK1/2/ERK1/2/p90RSK/bad signaling pathway in mild transient focal cerebral ischemia in rats[J]. BMC Complement Altern Med, 2014, 14: 92. DOI:10.1186/1472-6882-14-92 |
| [9] |
Huang CX, Hou YH, Liu YS. Expression of galectin-3 correlates with apoptosis in pituitary adenoma cells[J]. Neurosci Bull, 2008, 24(1): 34-38. DOI:10.1007/s12264-008-1029-y |
| [10] |
Fukumori T, Oka N, Takenaka Y, et al. Galectin-3 Regulates Mitochondrial Stability and Antiapoptotic Function in Response to Anticancer Drug in Prostate Cancer[J]. Cancer Res, 2006, 66(6): 3114-3119. DOI:10.1158/0008-5472.CAN-05-3750 |
| [11] |
Yang RY, Hsu DK, Liu FT. Expression of galectin-3 modulates T-cell growth and apoptosis[J]. Proc Nat Acad Sci, 1996, 93(13): 6737-6742. DOI:10.1073/pnas.93.13.6737 |
| [12] |
Okamura DM, Pasichnyk K, Lopez-Guisa JM, et al. Galectin-3 preserves renal tubules and modulates extracellular matrix remodeling in progressive fibrosis[J]. Am J Physiol Renal Physiol, 2011, 300(1): F245-F253. DOI:10.1152/ajprenal.00326.2010 |
 2017, Vol. 44
2017, Vol. 44




