扩展功能
文章信息
- 李巷, 韩金玲, 康慧聪
- Li Xiang, Han Jin-Ling, Kang Hui-Cong
- 腺苷A2A受体拮抗剂对大鼠氯化锂-毛果芸香碱所致癫痫模型的影响
- Effect of adenosine A2A receptor antagonist on a rat model of lithium-pilocarpine epilepsy
- 国际神经病学神经外科学杂志, 2017, 44(3): 285-288
- Journal of International Neurology and Neurosurgery, 2017, 44(3): 285-288
-
文章历史
收稿日期: 2017-02-23
修回日期: 2017-04-25
2. 华中科技大学附属同济医院神经内科, 湖北省武汉市 430032
癫痫发病的危险因素有多种。其发病机制比较复杂,有研究表明,炎性损伤参与了癫痫持续状态的发生[1]。以往有研究表明,腺苷A1受体可通过激活后抑制谷氨酸的表达发挥抗癫痫作用[2, 3]。但当癫痫频繁发作,腺苷浓度降低,A1受体结合能力减弱,致使腺苷的抗癫痫作用减弱。现已有研究表明,腺苷A2A受体的结合能力高于A1受体,且作用与A1的作用相反,可通过阻断A2A受体发挥脑保护作用[4.5]。但阻断A2A受体是否能够在癫痫持续状态(SE)模型中也发挥脑保护作用鲜有报道。本研究成功复制氯化锂-毛果芸香碱SE模型,旨在探讨腺苷A2A受体阻断剂SCH58261对SE的作用及具体机制。
1 材料与方法 1.1 实验动物及分组SPF级雄性Wistar大鼠,体重200~300 g,温度18~25℃,自由饮食水,适应性喂养1周后进行实验。大鼠随机分为对照组、模型组及A2A受体阻断剂组。
1.2 药品与试剂兔抗JNK多克隆抗体、兔抗p-JNK多克隆抗体、兔抗p-p38单克隆抗体、小鼠抗p38单克隆抗体、小鼠抗p-Erk1/2单克隆抗体和兔抗Erk1/2单克隆抗体均购自美国Cell Signal公司;SCH58261购自英国Tocris Cookson公司;其他化学试剂为国产分析纯。
1.3 SE模型建立除对照组外,其余大鼠均给予腹腔注射氯化锂3 mmol/kg,18~24 h后腹腔注射毛果芸香碱50 mg/kg·40~60 min模型点燃后,参照改良后Racine分级法进行癫痫强度的评价,若达到5级发作视为点燃成功,发作持续15 min后给予阿托品,40 min后给予地西泮及6%水合氯醛交替腹腔注射直至发作控制[10]。A2A受体阻断剂组在氯化锂-毛果芸香碱注射前15 min予腹腔给药(SCH58261 0.05 mg/kg),对照组给予同等剂量生理盐水。所有实验动物在点燃成功持续发作后40 min予地西泮及水合氯醛终止发作,对照组在同时间点给予上述药物。并于发作终止后24 h留取标本。
1.4 海马神经元Nissl染色三组实验动物在24 h后采用取-70℃冰箱中预冷异戊烷灌注取脑,-20℃冰箱保存备用。采用Nissl染色液进行染色、脱水、透明及封片等后期处理。采用BI-2000型图像分析系统进行神经元的观察,在光学显微镜(×400) 视野下观察各组海马组织Nissl染色阳性神经元的损伤情况,随机选择3个视野进行阳性神经元的计数,取平均值。
1.5 Western blot检测冰上剥离海马,提取总蛋白,测定蛋白浓度后,SDS-PAGE凝胶电泳,转膜,封闭后,加一抗、二抗孵育,DAB显色,扫描胶片,使用美国Gene Genius公司凝胶成像分析系统分析JNK、p-JNK、P38、p-P38、ERK和p-ERK光密度值,计算p-JNK/JNK、p-P38 /P38和p-ERK /ERK比值。
1.6 统计学分析数据分析采用SPSS 15.0软件,计量数据以均数±标准差(x±s)来表示。各组间差异分析采用单因素方差分析。P < 0.05代表差异有统计学意义。
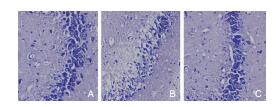
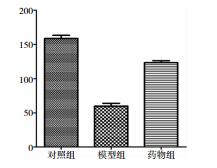
2 结果 2.1 Nissl染色结果尼氏染色的结果显示,对照组染色最为清晰,可见Nissl小体大而数量多,呈蓝紫色;模型组染色最模糊,Nissl小体的数量减少,甚至消失;A2A受体阻断剂组介于二者中间。光镜下进行神经元计数,结果显示,对照组、模型组及A2A受体阻断剂组双侧海马CA3区正常形态神经元计数分别为158.6±8.4、59.8±7.4和123.4±5.0,模型组神经元计数显著低于对照组,差异具有统计学意义(P < 0.05),A2A受体阻断剂组神经元计数显著高于模型组,差异具有统计学意义(P < 0.05)。说明阻断剂明显改善了海马区神经损伤情况,药物对癫痫持续状态下海马神经元损伤有抑制作用。见图 1、图 2。
|
| 图 1 尼氏染色双侧海马CA3区神经元结果 注:A:对照组;B:模型组;C:A2A受体阻断剂组。 |
|
| 图 2 神经元细胞染色正常计数柱形图 |
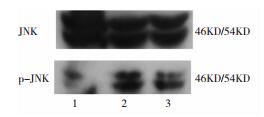
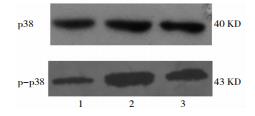
Western blot分析显示,三组中JNK、P38和ERK表达差异无统计学意义。对照组中p-JNK、p-P38和p-ERK表达量较少,模型组中p-JNK、p-P38和p-ERK表达量明显增多,A2A受体阻断剂组中p-JNK和p-P38表达量较模型组少,p-ERK表达量与模型组无明显差异。
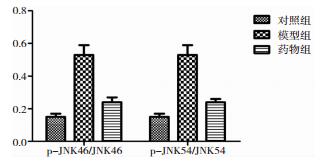
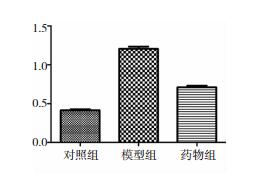
相对光密度值分析示,p-JNK46/JNK46在对照组、模型组、A2A受体阻断剂组中分别为0.15±0.02、0.53±0.06和0.24±0.03,组间差异有统计学意义(P < 0.05);p-JNK54/JNK54在三组中分别为0.15±0.02、0.53±0.06和0.24±0.02,组间差异有统计学意义(P < 0.05)。p-P38/P38在对照组、模型组和A2A受体阻断剂组中分别为0.41±0.03、1.20±0.06和0.71±0.04,组间差异有统计学意义(P < 0.05)。p-ERK42/ERK42在对照组、模型组和A2A受体阻断剂组中分别为0.11±0.03、1.04±0.09和1.05±0.05;p-ERK44/ERK44在对照组、模型组和A2A受体阻断剂组中分别为0.12±0.03、1.03±0.05和1.04±0.05;模型组和A2A受体阻断剂组明显高于对照组(P < 0.05),但两组之间表达无差异。见图 3~图 8。
|
| 图 3 p-JNK/JNK Western blot结果 注:1:对照组;2:模型组;3:A2A受体阻断剂组 |
|
| 图 4 p-JNK/JNK相对光密度分析柱状图 |
|
| 图 5 p-P38/P38 Western blot结果 注:1:对照组;2:模型组;3:A2A受体阻断剂组 |
|
| 图 6 p-P38/P38相对光密度分析柱状图 |

|
| 图 7 p-ERK/ERK Western blot结果 注:1:对照组;2:模型组;3:A2A受体阻断剂组 |

|
| 图 8 p-ERK/ERK相对光密度分析柱状图 |
腺苷在信号转导中作为G蛋白偶联受体发挥作用,与Gs偶联,有抑制腺苷酸环化酶(AC),降低cAMP水平的作用,参与神经元兴奋等重要生命活动[6]。在神经退行性疾病中,腺苷A2A受体的拮抗剂表现出减轻损害的作用[7]。腺苷A2A受体的亲和力较强,此受体被阻断或是受到损伤时,能够减轻脑部的损伤情况,改善神经功能[8, 9]。腺苷A2A受体主要分布在基底节区,近年来研究发现A2A受体在与癫痫相关的新皮质和边缘系统也有分布。在病理条件下,A2A受体表达会有变化。研究证实,在帕金森病患者体内,A2A受体的表达上调,而且分布也有变化[10]。反复发作的癫痫模型中,A2A受体的表达也明显上调,说明A2A受体在相关疾病(如癫痫和帕金森病)中有更大的研究价值。
本课题组前期研究已经显示,在氯化锂-毛果芸香碱SE模型中,A1受体表达及结合力降低,而A2A表达及结合力增加,两方面导致癫痫发作不易控制,脑神经元损伤严重[11]。本实验即在此基础上,推测A2A受体水平升高会加重癫痫持续状态,造成脑部损伤,如果阻断A2A受体可能抑制癫痫发作以及对海马神经元损伤起保护作用。前期研究证实,在杏仁核点燃癫痫模型中,SCH58261发挥作用的有效浓度在0.005 mg/kg到0.5 mg/kg之间(腹腔注射),本实验参照以往实验[12],选取有效浓度0.05 mg/kg进行干预。本实验选用点燃后的大鼠,并且A2A受体的结合能力增强,密度也增加,以增加A2A受体阻断剂与受体结合概率,充分表达抑制性。
本研究结果显示,与对照组相比,氯化锂-毛果芸香碱SE模型中双侧海马CA3区神经元缺失明显,细胞数量明显少于A2A受体阻断剂组和对照组,说明A2A受体阻断剂组的腺苷A2A受体阻断剂SCH58261可以减少神经元损伤,证实腺苷A2A受体阻断剂SCH58261可以减轻SE模型中海马神经元损伤。丝裂原活化蛋白激酶系统(MAPKs)是体内重要的信号转导系统,参与了细胞的生长、分化、死亡等多种过程,实验中,我们也检测了JNK、p38、ERK及其磷酸化蛋白的表达情况[13, 14]。Western blot检测SE模型中双侧海马p-JNK、p-P38和p-ERK表达明显增多,药物组中p-JNK和p-P38的表达较模型组在一定程度上减少,说明药物能够抑制p-JNK及p-P38表达,进一步抑制了相应的下游信号通路,参与SE模型中神经元保护作用。
本研究发现A2A受体阻断剂有改善癫痫持续状态,减轻神经损伤,但A2A受体阻断剂的有效浓度尚需要进一步研究,有研究表示这类阻断剂有一定的不良反应,A2A受体发挥作用可能存在其他的通路,例如之前已有研究表明,癫痫的发作与谷氨酸的释放有关,与其相关的信号通路和蛋白质表达值得进一步的探讨。
综上所述,SCH58261(0.05 mg/kg,腹腔注射)对大鼠氯化锂-毛果芸香碱SE模型有一定的脑保护作用。其作用机制可能是通过抑制p-JNK及p-P38信号通路实现。
| [1] |
杨博文, 陈欣, 孙皓, 等. 癫痫发病危险因素的meta分析[J]. 中国循证医学杂志, 2014, 14(1): 94-100. DOI:10.7507/1672-2531.20140016 |
| [2] |
谢井伟, 王新军, 梁博, 等. CPEB-4蛋白在癫痫致痫灶中的表达及临床意义[J]. 实用医学杂志, 2013, 29(9): 1445-1448. |
| [3] |
张笋, 王维平, 冯连元. 腺苷与腺苷激酶在癫痫中的作用[J]. 国际神经病学神经外科学杂志, 2008, 35(3): 267-271. |
| [4] |
Avsar E, Empson RM. Adenosine acting via A1 receptors, controls the transition to status epilepticus-like behaviour in an in vitro model of epilepsy[J]. Neuropharmacology, 2004, 47(3): 427-437. DOI:10.1016/j.neuropharm.2004.04.015 |
| [5] |
El Yaboubi M, Ledent C, Parmentier M, et al. Adenosine A2A receptor deficient mice are partially resistant to limbic seizures[J]. Naunyn Schmiedebergs Arch Pharmacol, 2009, 380(3): 223-232. DOI:10.1007/s00210-009-0426-8 |
| [6] |
黄瑛, 马颖钰, 张璞, 等. 蛋氨酸对化疗药物引起内耳损伤的保护作用[J]. 河北医科大学学报, 2012, 33(8): 904-907. |
| [7] |
王任烨, 狄枫, 徐英, 等. 腺苷及其受体在神经系统中的生物学作用[J]. 国外医学药学分册, 2006, 33(4): 279-282. |
| [8] |
Yu L, Haverty PM, Mariani J, et al. Genetic and pharmacological inactivation of adenosine A2A receptor reveals an Egr-2-mediated transcriptional regulatory network in the mouse striatum[J]. Physiol Genomics, 2005, 23(1): 89-102. DOI:10.1152/physiolgenomics.00068.2005 |
| [9] |
王皓香, 范文辉. 腺苷受体A1与A2A相互作用对缺血性脑损伤的影响[D]. 第三军医大学, 2012. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y2163860
|
| [10] |
张丹, 张建军, 刘耕陶. 治疗帕金森病新药:腺苷A_(2A)受体拮抗剂[J]. 中国药理学通报, 2006, 22(8): 897-900. |
| [11] |
康慧聪, 刘晓艳, 胡琦, 等. 氯化锂-毛果芸香碱点燃癫(癎)大鼠模型中腺苷激酶表达的动态改变[J]. 中国临床神经科学, 2009, 17(3): 225-230. |
| [12] |
Xiang LI, KANG H, LIU X, et al. Effect of Adenosine A2A Receptor Antagonist ZM241385 on Amygdala-kindled Seizures and Progression of Amygdala Kindling[J]. J Huazhong Univ Sci Technolog Med Sci, 2012, 32(2): 257-264. DOI:10.1007/s11596-012-0046-2 |
| [13] |
Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases[J]. Science, 2002, 298(5600): 1911-1912. DOI:10.1126/science.1072682 |
| [14] |
Harrison JC, Zyla TR, Bardes ES, et al. Stress-specific activation mechanisms for the "cell integrity" MAPK pathway[J]. J Biol Chem, 2004, 279(4): 2616-2622. DOI:10.1074/jbc.M306110200 |
 2017, Vol. 44
2017, Vol. 44




