扩展功能
文章信息
- 苏旭明, 张学新, 刘海英
- Hedgehog信号通路在神经胶质细胞瘤中的相关研究进展
- 国际神经病学神经外科学杂志, 2015, 42(6): 564-567
- Disease Surveillance, 2015, 42(6): 564-567
-
文章历史
- 收稿日期: 2015-10-09
- 修回日期: 2015-12-18
神经胶质细胞瘤(胶质瘤)是中枢神经系统最常见的原发性恶性肿瘤,其治疗主要以手术为中心,辅以放疗、化疗、生物免疫治疗等多种措施的综合治疗方案。但由于胶质瘤细胞具有生长迅速、无边界浸润、易复发等特点,因此其治疗预后并不满意[1]。Hedgehog信号通路是一高度保守的细胞信号传导通路,自发现至今已被证实在肿瘤的发生、发展和体内平衡中起重要作用,尤其参与胚胎和中枢神经系统的发育[2]。目前研究表明:诸多肿瘤中都包含激活的Hedgehog信号通路,该通路的活化可能是肿瘤干细胞发生恶性转化的关键步骤,且促进肿瘤的增殖、迁移和侵袭等[3]。而失活的Hedgehog信号通路导致胶质瘤的干细胞能力减弱。这就为我们研究胶质瘤的发病机制及诊断治疗提供了新的思路。本文就Hedgehog通路在胶质瘤中的相关研究进展进行综述。
1 Hedgehog信号转导通路概述Hedgehog(HH)基因是首先在黑腹果蝇身上发现的,从非脊椎动物到脊椎动物进化保守,可编码一种高度保守的分泌型糖蛋白。目前在哺乳动物中至少已发现三种HH同源基因:Shh、Ihh和Dhh。其中Shh表达最为广泛,对哺乳动物的乳腺、前列腺、肺、毛发和神经系统等多器官的发育起重要作用,并且与肿瘤发生存在着关系。研究表明Shh信号通路的组成为:Shh信号蛋白、Ptch和Smo跨膜蛋白及通路下游的核转录因子Gli、类运动蛋白、丝氨酸/苏氨酸蛋白激酶、Fu抑制剂、蛋白激酶A等。
1.1 Shh信号蛋白Shh信号蛋白是一种活性分泌型糖蛋白,具有自我催化加工能力。Shh基因有三个外显子,外显子2主要编码Shh-N端信号肽,其为活性信号肽,与胆固醇共价连接,导向分泌整个HH蛋白。外显子3主要编码Shh-C端信号肽,其无明显信号活性,但可促进自身蛋白酶解作用,已有体外研究证实,Shh-C端在从内质网转移到蛋白媒体后被迅速降解[4]。Shh蛋白只有通过上述翻译后的修饰过程才能获得完全功能。
1.2 跨膜蛋白Ptch和SmoPtch是一种12次跨膜蛋白受体。Smo是一种7次跨膜蛋白受体,属于G蛋白偶联受体超家族的一员。在人类体内发现存在两种Ptch同源基因:Ptch1和Ptch2,其中Ptch1基因的表达受HH信号调控。Ptch蛋白位于细胞膜表面,具有两种功能,一是与Shh蛋白结合,二是抑制Smo蛋白。目前在人体内发现只存在一种Smo同源基因,其对信号通路具有激活作用,一旦Shh蛋白与Ptch1结合,Ptch1对Smo的抑制作用就被解除,Smo将信号向胞内传递,导致下游的Gli全长修饰为转录激活因子,进入胞核内激活靶基因的转录。(过程见图 1所示)
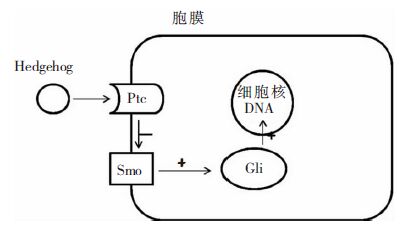
|
| 图 1 Hedgehog信号通路转运示意图 注:Ptch及Smo位于胞膜,Ptch对Smo起抑制作用,而Smo对下游起激活作用。当Hh与Ptch结合后Ptch对Smo的抑制作用解除,Smo将信号向胞内传递,导致胞内Gli全长修饰为转录激活因子,再进入细胞核内激活靶基因的转录。 |
Gli蛋白是一种锌指蛋白,人类存在三种同源基因:Gli1、Gli2和Gli3,分别编码:Gli1蛋白、Gli2蛋白和Gli3蛋白[5]。Gli1蛋白因证实与胶质瘤形成有关而首先被命名,其在相关性肿瘤的发生、发展中起着必不可少的作用,也是Shh信号的最终响应者和功能执行者。在人类,Gli2或Gli3通过直接连接到与Gli连接位点同源的序列来激活Gli1启动子。当Shh缺如时,Smo蛋白处于失活状态,Gli2和Gli3被磷酸化,从而失活,抑制下游靶基因转录;一旦Shh结合Ptch1,Smo处于活化状态,使Gli2和Gli3保持全长型,并进入核内促进相关基因表达,启动下游靶基因的转录[6]。研究发现:由于Gli1基因本身受通路调节,Gli1蛋白表达可直接反映通路的活性状态;多数情况下,Gli1蛋白起激活作用,Gli3起抑制作用,而Gli2在不同细胞及不同时期可能起激活或抑制作用[7]。
2 Shh信号通路与胶质瘤目前研究表明,可能与胶质瘤增殖有关的信号通路有:酪氨酸激酶受体家族信号转导通路;丝氨酸/苏氨酸激酶受体信号转导通路;Notch信号通路;细胞内Ras/Raf/MEK/MAPK信号转导通路及最近备受关注的Shh信号通路等。由于胶质瘤的高度异质性,目前很难确定哪条信号通路更为重要[8]。近期的研究发现,Notch、HH和骨形态发生蛋白(bone morphogenic protein,BMP)途径参与了对胶质瘤中CD133+GSCs的调控。其中,Shh途径抑制剂能够抑制成神经管细胞瘤的生长,减少恶性胶质瘤中的干细胞样肿瘤细胞,增加肿瘤对放射的敏感性。
同时大量研究证实,Shh通路参与一些胶质瘤和髓母细胞瘤以及相应的模型系统的存活和维持。HH信号通路可通过血管内皮细胞来调控GSCs,从而改变胶质瘤的增殖、迁徙能力[9]。Rao等[10]在小鼠小脑内注射带有Shh和c-myc的反转录病毒诱发髓母细胞瘤(这些小鼠的转基因表达局限于NSCs中)。有研究通过阻断胶质瘤细胞系Shh通路限制了胶质瘤细胞的迁移和扩散,说明Shh通路在胶质瘤的发展和复发中起了重要作用。Ptch基因及其等位基因作为一种肿瘤抑制基因,其突变是髓母细胞瘤发生的关键。有实验发现Ptch1半合性缺失的小鼠在出生后25周大约有19%发展成小脑髓母细胞瘤样肿瘤。Ptch1的杂合性缺失及突变和人髓母细胞瘤的关系也被广泛证实,Zurawel等[11]在37例髓母细胞瘤中发现有3例Ptch1突变。他们用半定量RT-PCR和原位杂交技术证实Ptch1、Smo、Gli在髓母细胞瘤中均有表达,而在周围正常组织并不表达。Gli蛋白在神经胶质瘤的发生发展中也起重要作用。有研究证明,Gli蛋白在人胶质瘤细胞系中的表达水平高出正常对照50倍左右。相关研究报道了胶质瘤患者Hh通路的持续活化,提示该通路调控肿瘤干细胞的自我更新,对胶质瘤的持续生存和生长必不可少,该通路的抑制则可以导致体内外肿瘤生长的停滞。因此,Hh通路在胶质瘤的增殖、侵袭中起着不可或缺的作用[12, 13],可作为胶质瘤治疗的新靶点。
3 Shh信号通路与其它肿瘤的相关研究及进展目前已有研究表明,HH信号通路涉及到肿瘤细胞的生长、凋亡、转移及新生血管等多个方面。该信号通路的异常激活对多种人类肿瘤的发生、发展及其恶性生物学特性的维持起重要作用,这些发现使人类对肿瘤发病机制的研究进入到一个新的阶段。HH通路在多种肿瘤细胞如基底细胞癌、前列腺癌、胰腺癌、食管癌、胃癌和结肠癌等中均有表达上调。其作用模式无论是Ptch或Smo的基因突变、功能缺失,还是肿瘤细胞及微环境的改变,都会引起Hh信号通路的异常激活,导致细胞特异性的组织增生,进而参与肿瘤的发生和发展。
4 Shh信号通路及其抑制物的相关研究和进展当前,针对Shh信号通路产生抗肿瘤作用的小分子化合物的研究正引起广泛关注。其中环巴胺(cyclopamine)或是作用位点与环巴胺相同的拮抗剂,引起了人们的关注。cyclopamine是第一个被发现的Shh信号通路的特异性抑制剂,其最早从藜芦属植物中提取获得。直到20世纪90年代,才发现了这种化合物具有抑制Shh信号通路的作用,并且这种效应在体内和体外实验中都已得到了验证。cyclopamine的主要作用机制是通过与Smo的结合,从而改变转录因子Gli和Ptch的转录,防止肿瘤介导基因的表达,最终抑制Shh信号通路。Hirotsu等人[14]的研究表明,cyclopamine可减少小鼠体内肿瘤细胞的生长,但其副作用使小鼠经历了体重减轻和脱水,并最终导致死亡。此外,cyclopamine化学性质不稳定、溶解性差。因此Warzecha等人指出,由于严重的副作用及有限的疗效使环巴胺不适合在临床广泛应用[15]。
其它Smo抑制剂,目前已经上市的GDC-0449,其是第一个被美国食品和药物管理局(FDA)批准的治疗不能被手术切除或接受放疗的局限性进展性基底细胞癌的药物[16]。GDC-0449具有芳基联吡啶芳胺的结构,其中吡啶上的N原子作为H原子受体的结构,是GDC-0449产生作用所必需的。GDC-0449较cyclopamine具有更好的水和酸稳定性,目前其还被用于复发性难治的髓母细胞瘤、卵巢癌、复发性或转移性胰腺癌、晚期胃癌等癌症[17];Cyclopamine的半合成类似物IPI-269609有着更好的酸稳定性和水溶性,在此基础上进一步改造,通过体内、体外的生物活性评价和药代分析,得到了更优化的化合物IPI-926,对转移性的髓母细胞瘤鼠模型研究表明,IPI-926能够很好地延长它的生命,目前有望进一步临床试验[18];LDE225是近期研究的Smo拮抗物,能够阻断G1细胞周期和促进肿瘤细胞凋亡。维生素D3能以高亲和力结合Smo上的cyclopamine结合位点,被发现能抑制Smo活性和其下游Shh信号通路中Gli的活性,从而抑制细胞生长,这种能力甚至比激活维生素D3的受体更明显。Solinas等[19]研究发现一系列双环乙内酰脲是一个新的SMO抑制剂,通过对其结构改造修饰得到了可以进一步研究的化合物MK-5710,临床前的研究显示它具有很好的药动学性质。
伊曲康唑是三氮唑类亲脂性的广谱抗真菌药物,通过抑制真菌的固醇生物合成而起作用,其主要的机制同样是有效地抑制了Shh信号通路。对其作用机制研究中发现,伊曲康唑虽然同样作用于Shh信号通路中重要的因子Smo,但其机制与cyclopamine或其它已知的Smo抑制剂作用不同,其主要是通过阻止由HH配体刺激引起的Smo堆积而发挥作用的。研究还发现,伊曲康唑与cyclopamine结合于不同的Smo位点,故而提示,伊曲康唑可能与cyclopamine等小分子化合物共同作用于Smo,并且有协同作用。约翰霍普金斯大学研究发现伊曲康唑具有Shh信号通道抑制剂的作用,目前正在进行经过治疗的非鳞状非小细胞肺癌的II期临床试验。
转录因子Gli也是Hh信号通路的关键介质,它们的异常激活可能导致肿瘤的增殖和转移,因此其被认为是新的治疗靶点。三氧化二砷(ATO)是FDA批准的用于治疗急性早幼粒细胞性白血病患者的药物,其能直接结合Gli并抑制其转录活性,阻止Gli基因的内源性表达。试验表明在裸鼠身上接种肿瘤内皮143B细胞,ATO可以显著降低每日治疗量和提高患者生存受益,并且经ATO治疗后肿瘤细胞中凋亡细胞数量也显著增多。
Gli激活物抑制剂(GANT)可阻止Gli的转录介导。目前已发现两个GANT,分别是GANT-61和GANT-58。目前研究表明,GANT-61可以修饰Gli基因并防止他与DNA启动子结合,抑制肿瘤细胞增殖和细胞集落形成。
5 前景与展望近年来,Shh信号通路在肿瘤细胞,尤其是对神经胶质细胞瘤的起源、增殖、发展、转归中的重要作用不断被揭示。但其对胶质瘤生物学特性的影响仍存在许多问题。例如是否存在其它机制调控胶质瘤细胞发生发展;Shh信号通路与其它肿瘤信号通路是否联合交叉作用于胶质细胞,其作用机制如何;Shh分泌蛋白能否在脑脊液中检出并作为胶质瘤特异性肿瘤标志物来指导临床分期及预后判断,Shh通路特异性抑制剂能否用于胶质瘤的治疗并改善患者预后等。这些问题都有待于我们继续研究。
对于胶质瘤的临床治疗,通过分子生物学手段研究Shh信号通路在不同级别、不同病理类型胶质瘤中的表达和活化状态,可以进一步明确Shh通路在胶质瘤形成和生长中的作用,为我们提供新的治疗靶点,为将来通过分子生物学手段抑制肿瘤增殖和生长,甚至阻断肿瘤细胞起源提供理论依据。
| [1] | Siebzehnrubl FA,Reynolds BA,Vescovi A,et al.The Origins of Glioma:E Pluribus Glia,2011,59:1135-1147. |
| [2] | Marini KD,Payne BJ,Watkins DN, et al. Mechanisms of Hedgehog signalling in cancer.Growth Factors,2011,29:221-234. |
| [3] | Takezaki T,Hide T,Takanaga H, et al.Essential role of the Hedgehog signaling pathway in human glioma-initiating cells.Cancer Sci, 2011,102(7):1306-1312. |
| [4] | Chen X,Tukachinsky H, Huang CH,et al.Processing and turnover of the Hedgehog protein in the endoplasmic reticulum.J Cell Biol,2011,192(5):825-838. |
| [5] | Javelaud D,Pierrat MJ,Mauviel A.Crosstalk between TGF-β and hedgehog signaling in cancer.FEBS Lett,2012,586(14):2016-2025. |
| [6] | Omenetti A,Chois,Michelotti G,et al.Hedgehog signaling in the liver,J Hepatol,2011,54(2):366-373. |
| [7] | 潘登,李艳.Hedgehog-Gli信号通路与肿瘤.现代肿瘤医学,2011,19(3):591-595. |
| [8] | 景芳邈,滕菲菲,张孟业.Shh信号通路在神经胶质瘤发生发展中的作用.第二军医大学学报,2012,5(33):554-554. |
| [9] | Yan GN,Lv YF,Yang L,et al.Glioma stem cells enhance endothelial cell migration and proliferation via the Hedgehog pathway.Oncol Lett,2013,6:1524-1530. |
| [10] | Rao G, Pedone CA, Coffin CM, et al. c-Myc enhances sonic hedgehog-induced medulloblastoma formation from nestin-expressing neurd progenitors in mice. Neoplasia, 2003, 5:198-204. |
| [11] | Zurawel RH, Allen C, Chiappa S, et al. Analysis of PTCH/SMO/SHH pathway genes in medulloblastoma. Genes Chromosomes Cancer, 2000, 27:44-45. |
| [12] | Takezaki T,Hide T,Takanaga H,et al.Essential role of the Hedgehog signaling pathway in human glioma-initiating cells.Cancer Sci,2011,102(7):1306-1312. |
| [13] | 朴星银,蒋传路,胶质瘤相关Hedgehog信号通路的研究进展.中国微侵袭神经外科杂志,2012,17(11):526-528. |
| [14] | Hirotsu M, Setoguchi T, Sasaki H, et al. Smoothened as a new therapeutic target for human osteosarcoma Mol.Cancer,2010,9:5. |
| [15] | Warzecha J,Dinges D,Kaszap B,et al.Effect of the Hedgehog-inhibitor cyclopamine on mice with osteosarcoma pulmonary metastases.Int J Mol Med,2012,3:423-427. |
| [16] | Lyons TG,O'Kane GM,Kelly CM,Efficacy and safety of vismodegib:A new therapeutic agents in the treatment of basal cell carcinoma.Expert Opin.Drug Saf,2014,13:1125-1132. |
| [17] | Chang AL,Atwood SX,Tartardm,et al.Surgical excision after neoadjuvant therapy with vismodegib for a locally advanced basal cell carcinoma and resistant basal carcinomas in Gorlin syndrome,JAMA Dermatol,2013,149(5):2168-6084. |
| [18] | Tang JY,Marghoob AA.Emerging treatments and signaling pathway inhibitors.Semin Cutan Med Surg,2011,30(45):514-518. |
| [19] | Solinasa,Faureh,Roudauth,et al.Acylthiourea,acylurea,and acylguanidine derivatives with potent Hedgehog inhibiting activity.J Med Chem,2012,55(4):1559-1571. |
 2015, Vol. 42
2015, Vol. 42

 ,
,