扩展功能
文章信息
- 李政, 徐运
- 帕金森病病因及发病机制的进展研究
- 国际神经病学神经外科学杂志, 2014, 41(4): 345-348
- Disease Surveillance, 2014, 41(4): 345-348
-
文章历史
- 收稿日期:2014-04-01
- 修回日期:2014-07-28
2. 南京大学医学院附属鼓楼医院神经科, 江苏省南京市 210008
帕金森病(Parkinson’s disease,PD)又称为特发性帕金森病(idiopathic Parkinson’s disease),由英国医师James Parkinson在1817年首次描述并在1892年由Charcot命名,是一种老年人最常见的锥体外系变性疾病,主要病变发生在黑质及纹状体通路。临床多表现为静止性震颤、肌强直、运动迟缓和姿势步态异常。国内外对本病的研究已有190多年历史,已经找到越来越多的相关致病基因及可能病因,但这些基因突变及病因如何引起神经系统临床症状的机制仍尚未有统一定论。临床上亦缺乏针对其病因及发病机制的治疗措施。因此进一步了解病因及发病机制将会为临床治疗提供更广阔的前景。 1 帕金森病的可能病因 1.1 年龄因素
对于许多疾病来说老年化都是一个主要的危险因素。研究证明,无论是发达国家中,还是发展中国家,疾病与年龄的相关性不断增长[1]。调查发现,在50~59岁人群中,每十万人中有17.4人患病,在70~79岁人群中每十万人中就有93.1人患病,终身发展的风险在1.5%[2]。随着年龄的增长,帕金森病(PD)患者颅内的多巴胺(DA)能神经元数目随之减少。研究发现年龄每增长10年,DA能神经元丢失率可达5%~10%,但具体机制仍不明了[3]。除此之外,随着年龄的增长防御机制随之老化,而氧化应激损伤增强。Starke-Reed发现在80岁左右的人群中,体内50%左右的蛋白都存在不同程度的氧化应激损伤。氧化应激产生活性氧,导致DNA损伤、蛋白质崩解,酶及脂质物质破坏,从而引起神经细胞的凋亡[4]。在动物研究中,Mansour等发现老年鼠体内的星形胶质细胞存在着一个年龄相关性的突触损伤机制。在星形胶质细胞衰老的同时,神经保护作用减弱。另外,小胶质细胞也随着年龄的增长而导致染色体端粒不断缩短,最终使得细胞裂解[1]。但目前多认为年龄增长只是PD的一个诱发因素,因为正常的神经系统老化并不能直接引起PD样的运动障碍,所以年龄介导的神经元衰老机制仍需进一步研究。 1.2 遗传因素
大量研究使得我们目前已对许多导致帕金森综合征或是帕金森叠加综合征的基因有了一定的了解[3],包括PD的重要危险因素GBA、MAPT、EIF4G1;导致迟发型常染色体遗传型PD的VPS35(空泡蛋白分型35)和与伴有黑质纹状体-苍白球神经退变及路易小体形成的常染色体遗传型PD相关的ATP13A2、MAPT、EIF4G1等[5]。PD不同的遗传形式及症状也与特殊的基因突变具有相关性。但其中具体的生化途径仍不清楚,目前认为与相关的基因突变引起氧化应激损伤、谷氨酸兴奋性毒性、线粒体功能障碍、神经炎症和细胞凋亡等导致神经细胞损害有关。了解PD相关的基因不仅为进一步明确发病机制提供机遇,也为寻找有效的药物作用靶点提供机会。 2 帕金森病的发病机制 2.1 氧化应激损伤
大量动物实验证明氧化应激在PD中起着重要作用。人类大脑组织内含有大量的磷脂和多链不饱和脂肪酸(PUFAs),这些组织都易受活性氧自由基损伤。氧化损伤后,细胞内蛋白质和脂质双分子层结构发生改变[6],从而影响正常的生理过程及细胞结构学,最终导致细胞功能障碍和损害。在体研究也发现氧化应激损伤在PD发病机制中占主要作用。尸检发现,PD患者黑质内的氧化标志物明显升高,提示黑质中的细胞处于氧化应激状态。线粒体产生过量活性氧,导致溶酶体结构改变,引起脂质过氧化,蛋白质三级结构改变,DNA损伤,DA能神经元的受损[7]。研究者发现25%~30%的PD患者都存在复合物I不同程度的缺失。复合物I是线粒体内氧化链中的重要组成部分,缺失会引起神经元内活性氧产生增多。他们认为这是由于氧化应激引起的,最终导致黑质功能降低。 2.2 兴奋性神经毒性
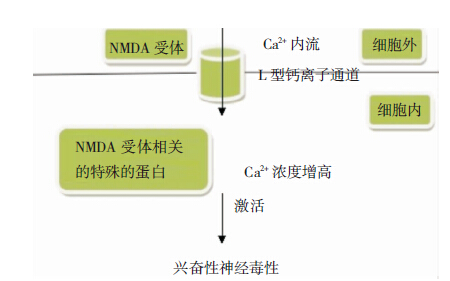
谷氨酸作为哺乳动物中枢神经系统最重要的兴奋性神经递质,在各种神经系统疾病中均起到重要作用。过度的谷氨酸能活化引起神经兴奋性毒性和氧化应激。谷氨酸活化N-甲基-D-天冬氨酸(NMDA)受体,使得突触后膜去极化,钙离子内流,改变细胞内生理环境,最终引起DA能神经元损伤[8]。但是为什么在神经退行性疾病中,这种兴奋性神经毒性作用更明显呢?目前主流的研究认为这与特殊类型的钙离子通道相关:NMDA过度兴奋就会促使大量Ca2+通过L-型钙离子通道流入神经元。而通过L-型钙离子通道进入细胞的钙离子增多,会使NMDA受体相关的特殊蛋白与钙离子依赖的神经毒性通路相耦合,引起细胞死亡(图 1)[9]。
2.3 同型半胱氨酸人体内同型半胱氨酸(Hcy)只能由S腺苷蛋氨酸转化而成。S腺苷蛋氨酸在甲基转移酶作用下分解为S腺苷Hcy和甲基,进一步脱去腺苷形成Hcy。而Hcy又可以在蛋氨酸合成酶及维生素B12的催化作用下接受外来甲基生成蛋氨酸。所以临床多通过补充维生素B12来降低体内Hcy[10]。但目前已证明仅通过补充叶酸、VB12并不能预防或治疗神经退行性疾病。Sanchez-Guajardo等[7]发现Hcy的增加会使得神经元对毒素的敏感性增高,但具体机制不明。Benson发现PD患者中高同型半胱氨酸血症的发生率较正常人增高。同时他们发现Hcy的升高主要与左旋多巴的甲基化分解代谢过程相关。左旋多巴被甲基化形成3-O-甲基多巴,而这个过程中的甲基是由S腺苷蛋氨酸提供,S腺苷蛋氨酸在提供甲基的同时生成S腺苷Hcy,之后分解产生Hcy。这个生化反应过程就是目前治疗PD的最主要药理学过程[11]。流行病学研究也发现大量未使用左旋多巴的病人也存在高同型半胱氨酸血症。所以Hcy与PD的具体关系仍没有定论。但共识认为将患者体内Hcy的代谢作用等维持在一个动态平衡,是预防和治疗PD的有效方法。 2.4 免疫炎性机制 2.4.1 炎症反应
中枢神经系统炎症反应主要是通过激活吞噬细胞和胶质细胞,分泌免疫调节因子介导神经元损伤来完成的。目前认为暴露于毒素、病原体等促炎物质是导致PD的主要因素之一[12]。胶质细胞的活化和级联性地炎症反应会引起神经元变性。早在20年前研究者们就通过尸检发现,PD患者颅内存在大量活化的人类白细胞抗原(HLA)-DR阳性的小胶质细胞[13]。Dariusz也通过一个60例的样本研究发现,PD患者体内的炎症相关促炎及抗炎细胞因子的水平较正常人均明显增高,证实炎症反应可能对于PD发病的分子机制起着重要作用[14]。为PD病理生理学机制提供了重要的研究方向。 2.4.2 神经免疫反应
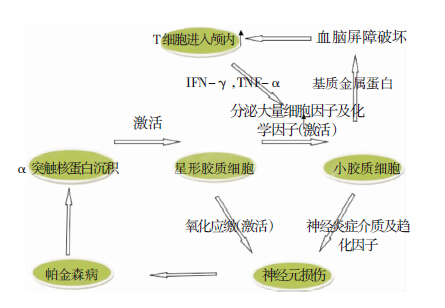
免疫反应在神经退行性疾病中的作用近年来也逐渐受到关注。PD中的免疫反应是由沉积的α突触核蛋白激活星形胶质细胞来启动的,分泌的大量细胞因子、化学因子激活小胶质细胞,活化的小胶质细胞会进一步释放大量神经炎症介质、趋化因子,最终使得神经元损伤;同时活化的星形胶质细胞激活氧化应激作用最终导致神经元死亡;而活化的小胶质细胞产生基质金属蛋白(MMP),调节血脑屏障的通透性,使得大量外周T细胞通过血脑屏障被募集至中枢神经系统内,T细胞分泌的IFN-γ,TNF-α等生长因子进一步激活小胶质细胞(图 2)。同时,外界刺激会激活颅内的补体系统,产生补体3a和4a,刺激机体产生膜攻击蛋白(MAP)从而直接造成神经损害[15]。
|
| 图 2 免疫炎症在帕金森病中的作用机制。 |
线粒体能量代谢障碍导致ATP产生减少,使得细胞结构破坏、功能下降。神经元细胞对于缺氧损伤较其他组织更加敏感,因此线粒体功能障碍对于中枢神经系统的损伤更加显著,大量研究表明线粒体功能障碍可导致DA能神经元损害[16]。正常情况下,线粒体存在持续的分裂和融合行为,最终形成不同形态、大小、数目及内容物的线粒体,他们的功能也随之改变[17]。而在病理情况下,氧化损害发生累积并引起线粒体正常形态改变,形成存在呼吸损害和转移障碍的球形线粒体[18]。PINK1和Parkin是存在于PD中的分裂蛋白,他们被募集到存在功能障碍的线粒体中,标记线粒体并抑制其向轴突移动,最终被巨噬细胞吞噬[19]。1989年Schapira等[20]首次发现复合物I在PD患者颅内存在部分缺失。进一步研究发现PD黑质中线粒体复合物Ⅰ活性下降30%~40%。复合体Ⅰ是呼吸链中的主要组成成分。这种缺陷会阻断氧化磷酸化系统,使ATP生成减少,自由基产生增加,细胞凋亡的敏感性增加。ATP生产减少会影响脑组织的能量供给,导致DA能神经元死亡。根据这个研究结果,目前许多研究者利用MPTP和鱼藤酮这两种线粒体呼吸链复合物Ⅰ抑制剂,均能够形成高度选择性的损伤中脑DA能神经元的PD模型。所以在PD病理生理学的进一步研究中线粒体的功能障碍及其结构改变仍是重要的目标。 2.6 细胞凋亡与自噬作用
PD的主要病理改变是中脑黑质致密部的DA能神经元进行性的变性丢失。凋亡和自噬都是细胞内的基本生理过程,在维护机体平衡的过程中起着十分重要的作用。细胞凋亡过程中存在两种特殊物质:DRP1促进线粒体细胞色素C释放,OPA1抑制细胞色素C释放。当他们之间的平衡被打破时,大量凋亡因子细胞色素C被释放激活细胞死亡过程[18]。细胞凋亡激活后,形态上发生改变,经历阿米巴样改变,细胞膜出泡,细胞骨架崩塌,细胞质凝结,核固缩,染色体凝集或破碎,细胞膜折叠形成凋亡小体,然后迅速被巨噬细胞或邻近细胞吞噬,最终引起细胞死亡。内在或外在的刺激因子通过活化配体激活神经元细胞的凋亡过程。凋亡信号被传递到线粒体,引起细胞色素C的释放。细胞色素C与APAF-1绑定后激活caspase-9和caspase-3,引起蛋白质水解并最终导致神经元细胞凋亡[21]。正常生理作用下,有丝分裂后期细胞如神经元细胞,都是高度凋亡抵抗的细胞,而在病理情况下其自我凋亡异常发生。因此,最近许多研究者都强调异常凋亡途径在神经退行性疾病中的重要性[22]。除了凋亡系统,自噬系统也起到重要作用。自噬过程包括双层膜结构形成、延伸、囊泡成熟,然后囊泡被运至溶酶体内被降解,进而引起细胞死亡。各种外来刺激均会抑制mTOR,mTOR是自噬系统中最关键的调节器,它能够直接磷酸化ULK1-mAtg13复合物并抑制ULK1酶的活化,这是诱导自噬系统活化的重要途径。ULK1-mAtg13复合物活化会促使吞噬泡的膜结构形成。吞噬泡外膜在Atg12和LC3复合体的作用下发生延伸作用。然后在活化的LC3复合体的作用下形成自噬小体。最后自噬小体与内涵体及溶酶体相融合,最终形成自吞噬体,完成降解作用。最终导致神经元的死亡[22]。
综上所述,PD的病因及发病机制十分复杂,且仍有待近一步研究。由于PD的临床特点,患者多需要密切的照料,所以PD患者不仅自身深受病痛折磨,也会给家人和社会带来巨大的压力。虽然目前国际上在外科、组织移植及基因治疗等研究方面均已取得了显著的进展,但临床上仍多以对症的口服药物治疗为主。找到针对病因及发病机制的有效治疗方案是目前急需解决的问题。
| [1] | Chinta SJ, Lieu CA, Demaria M, et al. Environmental stress, ageing and glial cell senescence: a novel mechanistic link to Parkinson's disease? J Intern Med, 2013, 273(5): 429-436. |
| [2] | Lees AJ, Hardy J, Revesz T. Parkinson's disease. Lancet, 2009, 373(9680): 2055-2066. |
| [3] | Pan PY, Yue Z. Genetic causes of Parkinson's disease and their links to autophagy regulation. Parkinsonism Relat Disord, 2014, 20(Suppl 1): 154-157. |
| [4] | Zuo L, Motherwell MS. The impact of reactive oxygen species and genetic mitochondrial mutations in Parkinson's disease. Gene, 2013, 532(1): 18-23. |
| [5] | Trinh J, Farrer M. Advances in the genetics of Parkinson disease. Nat Rev Neurol, 2013, 9(8): 445-454. |
| [6] | Zhou C, Huang Y, Przedborski S. Oxidative stress in Parkinson's disease: a mechanism of pathogenic and therapeutic significance. Ann N Y Acad Sci, 2008, 1147: 93-104. |
| [7] | Sanchez-Guajardo V, Barnum CJ, Tansey MG, et al. Neuroimmunological processes in Parkinson's disease and their relation to alpha-synuclein: microglia as the referee between neuronal processes and peripheral immunity. ASN Neuro, 2013, 5(2): 113-139. |
| [8] | Oster S, Radad K, Scheller D, et al. Rotigotine protects against glutamate toxicity in primary dopaminergic cell culture. Eur J Pharmacol, 2014, 724(C): 31-42. |
| [9] | Keelan J, Vergun O, Duchen MR. Excitotoxic mitochondrial depolarisation requires both calcium and nitric oxide in rat hippocampal neurons. J Physiol, 1999, 520(Pt 3): 797-813. |
| [10] | Stead LM, Jacobs RL, Brosnan ME, et al. Methylation demand and homocysteine metabolism. Adv Enzyme Regul, 2004, 44: 321-333. |
| [11] | Zoccolella S, Lamberti P, Armenise E, et al. Plasma homocysteine levels in Parkinson's disease: role of antiparkinsonian medications. Parkinsonism Relat Disord, 2005, 11(2): 131-133. |
| [12] | Walsh S, Finn DP, Dowd E. Timecourse of nigrostriatal neurodegeneration and neuroinflammation in the 6-hydroxydopamine-induced axonal and terminal lesion models of Parkinson's disease in the rat. Neuroscience, 2011, 175: 251-261. |
| [13] | Tansey MG, McCoy MK, Frank-Cannon TC. Neuroinflammatory mechanisms in Parkinson's disease: potential environmental triggers, pathways, and targets for early therapeutic intervention. Exp Neurol, 2007, 208(1): 1-25. |
| [14] | Koziorowski D, Tomasiuk R, Szlufik S, et al. Inflammatory cytokines and NT-proCNP in Parkinson's disease patients. Cytokine, 2012, 60(3): 762-766. |
| [15] | More SV, Kumar H, Kim IS, et al. Cellular and molecular mediators of neuroinflammation in the pathogenesis of Parkinson's disease. Mediators Inflamm, 2013, 2013: 952375. |
| [16] | Nunnari J, Suomalainen A. Mitochondria: in sickness and in health. Cell, 2012,148(6): 1145-1159. |
| [17] | Westermann B. Bioenergetic role of mitochondrial fusion and fission. Biochim Biophys Acta, 2012, 1817(10): 1833-1838. |
| [18] | Itoh K, Nakamura K, Iijima M, et al. Mitochondrial dynamics in neurodegeneration. Trends Cell Biol, 2013, 23(2): 64-71. |
| [19] | Yu W, Sun Y, Guo S, et al. The PINK1/Parkin pathway regulates mitochondrial dynamics and function in mammalian hippocampal and dopaminergic neurons. Hum Mol Genet, 2011, 20(16): 3227-3240. |
| [20] | Schapira AH, Cooper JM, Dexter D, et al. Mitochondrial complex I deficiency in Parkinson's disease. Lancet, 1989, 1(8649): 1269. |
| [21] | Adams JM, Cory S. Apoptosomes: engines for caspase activation. Curr Opin Cell Biol, 2002, 14(6): 715-720. |
| [22] | Ghavami S, Shojaei S, Yeganeh B, et al. Autophagy and apoptosis dysfunction in neurodegenerative disorders. Prog Neurobiol, 2013, 112: 24-49. |
 2014, Vol. 41
2014, Vol. 41