患者女性,19岁,主诉无明显诱因出现右侧大腿疼痛1月。口服药物对症治疗(具体不详),间断缓解。专科体格检查(我院):右大腿中下段内侧压痛、肿胀明显,右下肢肌力感觉无异常,余无特殊。否认既往病史。实验室检查(我院):碱性磷酸酶水平为156 U/L(正常参考值:35~100 U/L),其余未见明显异常。当地医院行X射线检查:右股骨骨质破坏。MRI检查(外院):右股骨中下段骨质破坏伴软组织肿物,考虑恶性。行PET/CT检查前10 d我院曾行“右股骨占位切检”。
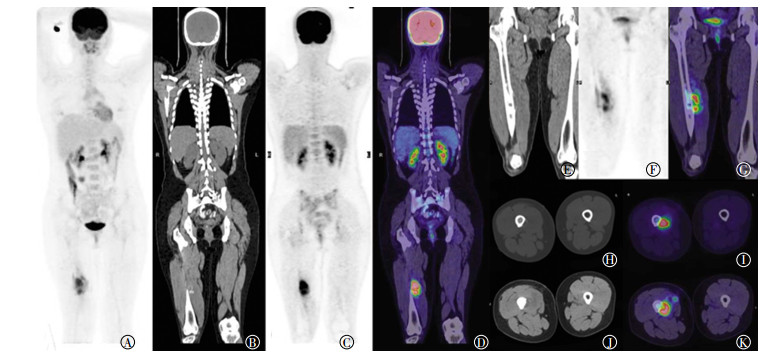
2 PET/CT影像学表现由图 1可见:右股骨中段局限骨质破坏,髓腔密度增高,内侧伴软组织肿物,内见肿瘤骨,PET显示异常放射性浓聚,SUVmax=12.4。
|
图 1 骨肉瘤患者(女性,19岁)18F-FDG PET/CT图 Figure 1 18F-FDG PET/CT images of osteosarcoma (female, 19 years old) 图中, A:全身MIP图; B、C、D:右大腿病灶冠状位CT图、PET图、PET/CT融合图; E、F、G:右大腿病灶切检术后骨及邻近软组织病灶冠状位CT图、PET图、PET/CT融合图; H、I:(骨窗)右大腿病灶横轴位CT图、PET/CT融合图; J、K:右大腿病灶横轴位CT图、PET/CT融合图。FDG:氟脱氧葡萄糖; PET:正电子发射断层显像术; CT:计算机体层摄影术; MIP:最大密度投影。 |
患者男性,25岁,主诉无意中发现左大腿肿物伴乏力、间断高热1月余,间歇性跛行2周。期间曾于当地医院对症按摩治疗,自觉肿物大小无明显变化。患者入院前1个半月曾于外院确诊IgA(免疫球蛋白A)肾病,规律治疗后自述恢复尚可。专科体格检查:左大腿可触及10 cm×8 cm×7 cm大小软组织肿物,质硬,边界欠清,凸出皮肤表面,局部皮温较对侧偏高,局部皮色正常,未见红肿及破溃,无局部压痛、叩击痛。实验室检查(我院):肝肾功能多项指标异常升高。丙氨酸氨基转移酶水平为116 U/L(9~50 U/L),碱性磷酸酶水平为188 U/L(45~125 U/L),乳酸脱氢酶水平为821 U/L(0~248 U/L),α羟基丁酸脱氢酶水平为495 U/L(90~180 U/L)U/L。肿瘤标志物未查。当地医院MRI:左大腿实性肿物,可疑恶性。
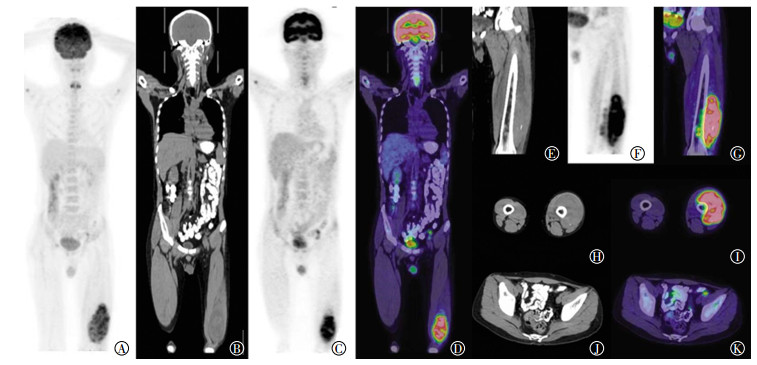
2 PET/CT影像学表现由图 2可见:(1)左股骨中下段骨质破坏,髓腔密度不均,周围伴软组织肿物包绕,PET显示异常放射性浓聚,SUVmax=13.1,浓聚范围约9.9 cm×7.1 cm×15.2 cm;(2)左侧髂脉区结节,边界不清,PET显示异常放射性浓聚,SUVmax=5.3,大小约1.2 cm×0.6 cm。
|
图 2 尤文肉瘤患者(男性,25岁)18F-FDG PET/CT图 Figure 2 18F-FDG PET/CT imaging of Ewing sarcoma (male, 25 years old) 图中, A:全身MIP图; B、C、D:左大腿软组织病灶冠状位CT图、PET图、PET/CT融合图; E、F、G:左大腿病灶骨及邻近软组织病灶冠状位CT图、PET图、PET/CT融合图; H、I:左大腿病灶骨及邻近软组织病灶横轴位CT图、PET/CT融合图; J、K:左髂脉区淋巴结横轴位CT图、PET/CT融合图。FDG:氟脱氧葡萄糖; PET:正电子发射断层显像术; CT:计算机体层摄影术; MIP:最大密度投影。 |
病例一:右股骨中段骨肉瘤可能性大。
病例二:左侧股骨中下段骨质破坏及周围软组织肿物,考虑为恶性肿瘤,伴左髂脉区可疑淋巴结转移,建议活检。
【病理诊断】病例一:(右股骨)骨肉瘤,请结合临床及影像学检查。
病例二:(左大腿)结合免疫组化为尤文肉瘤。免疫组化:Vim(+)、Fli-1(+)、CD99(+)、Bcl-2(B细胞淋巴瘤2)(+)、CDK4(+)、MDM2(双微体2)(+)、S-100(散在弱+)、Syn(突触素)(灶性弱+)、Ki-67(70%+)、LCA(白细胞共同抗原)(-)、CK广(广谱细胞角蛋白)(-)、CD56(-)、NSE(神经特异性烯醇化酶)(-)、CD34(-)、Desmin(-)、Myogenin(-)、Myo-D1(-)。
【讨论辨析】骨肿瘤病变临床上可分为原发性骨肿瘤、继发性骨肿瘤和瘤样病变。原发性骨肿瘤是指骨基本组织(骨、软组织和纤维组织)发生的肿瘤和骨附属组织(血管、神经、脂肪和骨髓)发生的肿瘤,还有特殊组织来源的肿瘤(如脊索瘤)以及组织来源未定的肿瘤(如骨巨细胞瘤)。继发性骨肿瘤是指恶性肿瘤的骨转移和良性骨病变的恶变。瘤样病变是指临床、病理和影像学表现与骨肿瘤相似却并非真性骨肿瘤的一类病变,其同时又具有骨肿瘤的某些特征(如复发、恶变等),如骨纤维异常增殖症和畸形性骨炎等。
骨肿瘤与瘤样病变的整体人群发病率虽然不高[1-2],但由于其临床表现、病理和影像学表现复杂多样,临床诊断也是颇具难度。其中,影像学检查在诊断中占重要地位,它可以显示肿瘤的准确部位、大小、邻近骨和软组织的变化及侵犯范围,对多数病例能做出良恶性、原发或转移的诊断,对于临床确定治疗方案及判断预后有非常重要的意义。对骨肿瘤影像学诊断的要求是:①判断骨病变是否为肿瘤;②如果是肿瘤,判断良恶性,是原发还是转移性肿瘤;③肿瘤的侵犯范围;④推断肿瘤的组织学类型。其中重点在于判断肿瘤良恶性,因为恶性骨肿瘤的致残率和致死率较高,对患者的生存质量影响很大。在观察图像时可以从发病部位、病变数目、局部骨质变化、骨膜增生、生长速度、是否侵及邻近组织器官及周围软组织变化等方面予以关注。
由于不同疾病的影像学表现异质性不明显,对骨肿瘤的诊断需将发病年龄、疾病史、临床表现、实验室检查、影像学检查及病理检查等相结合以进一步提高诊断的准确性。鉴于骨肿瘤疾病种类繁多,笔者只选取了临床工作中相对多见且易误诊的骨肉瘤和尤文肉瘤2个病种来分析讨论。
骨肉瘤,亦称成骨肉瘤,是最常见的原发骨恶性肿瘤,在儿童和青少年中最常见[3]。骨肉瘤多见于男性,男女患病比例为(1.5~1.7): 1,该病好发于儿童和年轻成年人,年龄为10~30岁,发病部位可发生于任何骨,好发于长骨,以股骨远端和胫骨近端最多见。该病病理分型多样,包括髓内型骨肉瘤、毛细血管扩张型骨肉瘤、骨旁骨肉瘤、骨膜骨肉瘤及其他多种骨肉瘤亚型等,其中,以髓内型最多见。临床上疼痛、局部肿胀和运动障碍为骨肉瘤的三大主要症状,其恶性程度高,疾病进展快,易早期发生血行转移,如肺转移[4]。实验室检查多见碱性磷酸酶水平升高,这是成骨活性增加的直接反映。影像学表现主要包括:①骨质破坏,多始于干骺端,可随骨破坏区域扩大而融合成大片骨缺损,硬化性、溶骨性骨破坏甚至二者混合均可出现;②肿瘤骨,是骨肉瘤的本质表现,为骨破坏区和软组织肿块内的骨成分,可以表现为云絮状、斑块状或针状;③软组织肿块,肿瘤侵犯骨外时出现;④骨膜反应,为骨肉瘤的重要征象却非特异征象,形态多样,如葱皮样、放射状、针状、单层状或Codman三角等[5]。在CT上骨质破坏表现为局部骨小梁消失,皮质变薄伴虫噬样溶骨性骨质破坏;肿瘤骨中高密度瘤骨(又称象牙骨)与正常骨皮质密度相当或更高,呈片状或颗粒状,低密度瘤骨密度低于正常骨皮质,呈磨玻璃样、絮状、斑片状、针状等;软组织肿块多围绕病骨,密度不均,边缘不规整,内伴瘤骨或钙化;骨膜反应为骨皮质外环形或半环形高密度骨膜新生骨影,当被肿瘤破坏时残存的环形或半环形高密度影与骨皮质之间形成Codman三角。软组织肿物整体常表现为软组织肿块偏于病骨一侧或包绕病骨生长,可侵犯周围正常肌肉、神经、血管等,内常伴坏死囊性区,软组织内瘤骨明显易见,肿瘤髓腔侵犯时密度增高也能较清楚显示,还可发现肺转移病灶。多数恶性肿瘤细胞代谢活跃,对葡萄糖供能需求旺盛;FDG作为葡萄糖类似物也可以被肿瘤细胞摄取。基于肿瘤细胞这一代谢特点而进行的18F-FDG PET/CT显像,图像上显示肿瘤呈高摄取状态。在骨肉瘤中,骨破坏区主要表现为FDG不均匀高摄取,伴溶骨区者常伴放射性稀疏区;肿瘤骨中高密度瘤骨的FDG摄取明显低于低密度瘤骨,软组织肿块多呈明显FDG高摄取,出血坏死区表现为FDG低摄取或缺损;骨膜反应常表现为与周围肿瘤组织延续的FDG高摄取[6]。总体来说,高密度瘤骨的FDG摄取明显低于骨肉瘤溶骨破坏、低密度瘤骨及软组织肿块。区域淋巴结、肺转移灶等常呈FDG明显高摄取状态。
尤文肉瘤(Ewing sarcoma)也称尤文氏肉瘤、骨内皮细胞瘤、神经上皮样瘤等。1921年由Ewing首先提出,尤文肉瘤发病率排在骨肉瘤、软骨肉瘤后,为儿童及青少年第二常见的恶性骨肿瘤,其组织来源不明确,有研究者认为是小圆细胞肿瘤,也有认为是神经外胚瘤的一种[7-8]。尤文肉瘤好发年龄为5~20岁,30岁以后极少发病,男女患病比例相当。发病部位为任何含红骨髓的骨,20岁以下好发于管状骨,如四肢长骨骨干和干骺端,通常不侵及骨骺;20岁以上好发于扁骨,如骨盆骨、肩胛骨、肋骨等。极少数为骨外尤文肉瘤。全身症状常似骨感染:发热、WBC增高、血沉高等,局部症状以疼痛、肿胀为主,易早期发生骨骼、肺及其他脏器转移。影像学检查无特征性表现,病理基础为起自髓腔的肿瘤浸润髓腔,沿哈弗氏系统生长,侵犯、穿透骨皮质致骨膜掀起,形成巨大软组织肿物,尤文肉瘤细胞无成骨性,不会形成明显瘤软骨和瘤骨,可出现因肿瘤刺激瘤内或骨膜的成骨细胞反应性骨质增生、硬化,形态多样,病变区可呈弥漫性骨质疏松样,斑点状、虫噬样、穿凿样溶骨性改变;周围骨皮质呈花边样缺损亦或地图样溶骨性病变破坏,因此根据骨破坏与增生的比例,尤文肉瘤可分为溶骨型、硬化型和混合型[9];此外,肿瘤早期即可穿破骨皮质形成巨大不均质软组织肿块,与骨破坏不成比例,常于骨干周围呈碟形压迹,其内可伴有针状肿瘤骨;可出现葱皮样、针状、日光放射样骨膜反应和Codman三角。在18F-FDG PET/CT图像上,溶骨性骨破坏常呈不均匀FDG摄取增高,亦可表现为低摄取[10],呈与放射性稀疏区并存状态;软组织肿块、骨膜反应及肿瘤骨表现与上述骨肉瘤类似。
病例一为19岁女性患者,以右侧大腿疼痛局部症状为主,无发热等伴随症状。18F-FDG PET/CT显示右股骨中段局限骨质破坏,髓腔密度增高,伴一侧软组织肿物,内见肿瘤骨,总体呈FDG异常增高摄取。患者无明显发热、WBC增高等明显感染史,影像学表现上无窦道、软组织破溃,故先不考虑化脓性骨髓炎这一青少年常见疾病,而作出恶性肿瘤的诊断并不困难。该例患者因为局灶性病变、无明显原发恶性肿瘤病灶,故暂时不考虑转移的可能,而进一步诊断为原发骨恶性肿瘤。更进一步分析病灶形态,右股骨干髓腔内边界不清的骨质破坏区,穿破骨皮质生长,伴软组织肿物形成,内见瘤骨,有骨膜反应。除了位置不是典型的干骺端外,影像学表现更贴近骨肉瘤,结合碱性磷酸酶水平升高,尽管患者检查前已经行切检但病理结果未出,我们仍给出了骨肉瘤可能性大的诊断。在给出诊断前,我们也曾考虑到骨纤维肉瘤可能,但它常见于年龄较大(25~45岁)者,且好发于骨干,骨质增生、骨膜反应少见,无肿瘤骨形成。另外因该例患者发病年龄、部位符合,也曾考虑到尤文肉瘤可能,但鉴于患者无全身症状、瘤骨较大、Codman三角明显而暂不作为首要诊断。需要指出的是,该例患者病变部位为股骨中段,尽管病灶下界接近远端,与我们认知的好发于股骨远端并不十分吻合,在诊断时我们把这一参考因素降级,没有严苛要求。最终患者的切检病理结果确诊为骨肉瘤。
病例二为25岁男性患者,因左大腿肿物伴间断高热1月余就诊,1个半月前确诊IgA肾病且规律治疗。18F-FDG PET/CT显示左股骨远端骨质破坏,髓腔密度不均,周围伴巨大软组织肿物包绕,呈FDG异常高摄取。该例患者有高热病史,首先要与骨髓炎相鉴别,急性骨髓炎病史短(多以周记),而该例患者虽有IgA肾病但发热病史月余,时间较长,故不首先考虑骨髓炎;该例患者影像学表现上无窦道形成、软组织破溃,故化脓性骨髓炎亦不作为首要诊断。朗格汉斯细胞增生症多发生于扁平骨,以溶骨性骨质破坏表现为主,与该例患者表现不符合,暂不作出该主要诊断。同时,由IgA肾病我们想起了肾性骨病,肾性骨病一般由慢性肾功能衰竭时钙、磷及维生素D代谢障碍引起,病程较长,症状上以骨痛、骨折、骨变形为主,与该例患者表现不符合,亦不列为主要诊断。排除良性疾病可能性后,由于18F-FDG PET/CT未发现明显原发恶性肿瘤病灶,我们暂不考虑转移瘤的可能,而作出了原发骨恶性肿瘤的诊断,建议结合病理结果。患者碱性磷酸酶、乳酸脱氢酶水平升高,结合年龄、发病部位,加之图像上软组织肿块内的肿瘤骨,我们可能首先考虑骨肉瘤,但因骨破坏较轻微,破坏程度与软组织肿块不成比例,与骨肉瘤又不尽相符。如果是尤文肉瘤的话,患者的年龄略大,发病部位、发热病史符合,骨破坏轻而不均质软组织肿块巨大、碟形压迹、肿块内伴肿瘤骨符合,18F-FDG PET/CT影像上髓腔密度不均伴多发软组织结节,但髓腔起源性致骨破坏区不明显,未见明显溶骨性改变。原发骨恶性淋巴瘤基本可以排除,因为骨淋巴瘤以溶骨性破坏为主,而且该例患者伴有左髂脉区淋巴结转移。后患者行穿刺病理检查,结果示:小细胞恶性肿瘤。为了进一步确诊又行左股骨瘤段骨截除病理检查,结果示:(左大腿)结合免疫组化结果,考虑为尤文肉瘤。该例患者单纯依靠影像学检查作出尤文肉瘤的诊断还是有难度的。
笔者选取的这两个病例,患者年龄相近、发病位置均位于股骨,实验室检查都有碱性磷酸酶水平升高,影像学表现都有骨质破坏、髓腔密度增高,伴软组织肿块、瘤骨,18F-FDG PET/CT显像呈FDG异常高摄取。PET/CT的优势在检测骨转移方面具有比骨扫描更高的灵敏度和准确性,对淋巴结及肺转移灶的检测特别有效[11-12],但仍不能给出明确诊断,二者鉴别起来颇具难度。不同的是病例二有高热病史,图像上骨破坏与软组织肿物不成比例、软组织肿物巨大、碟形压迹,更符合尤文肉瘤的诊断;病例一无明显全身症状,以局部症状为主,骨质破坏、骨膜反应及瘤骨相对明显,在诊断上更贴近骨肉瘤。
综上,影像学检查对少数征象典型的骨肿瘤易确诊,对于大多数影像学缺乏特征性表现的病例则很难诊断,加之临床表现的不特异性,有的病例甚至单独依靠病理结果也难以给出确定性的诊断。因此,对于骨肿瘤病变的诊断需要将影像、临床、病理三者紧密结合才有利于提高诊断的准确性,更好地为临床提供指导。
【专家点评】本文中选取的两例病例均较好,具有代表性,临床上原发性骨肿瘤中骨肉瘤与尤文氏肉瘤有时确实难以鉴别,常常等到病理结果出来还未能得出正确结论。文章讨论部分鉴别诊断内容丰富,但遗憾的是仅仅围绕传统的X射线检查进行鉴别诊断,这与本文题目稍有偏题,为凸显18F-FDG PET/CT的优点,应紧扣18F-FDG PET/CT这一主题,围绕病例深入分析,逻辑缜密,得出结论。如18F-FDG PET/CT实现了对原发性骨肿瘤解剖结构改变和代谢变化的优势互补,PET高代谢除恶性肿瘤外还有哪些病变会导致SUV明显增高,通过18F-FDG在不同疾病中的特点,结合病史、实验室检查、CT检查等进行鉴别诊断;另外,18F-FDG PET/CT一次检查就能发现全身代谢情况,在疾病诊断、鉴别诊断、临床分期及预后判断中具有非常重要的价值。
点评专家 陈志军主任医师,硕士生导师,江西省肿瘤医院核医学科主任。中华医学会核医学专委会肿瘤学组委员、治疗学组放射性粒子工作委员会副主委;中国抗癌协会肿瘤核医学专委会常委,肿瘤标志物专委会、肿瘤微创专委会、肿瘤科普专委会委员;国家卫生健康委员会规划信息司甲类大型医疗设备咨询专家;中国核学会核医学分会理事;江西核学会常务理事、核医学专委会副主委;江西省抗癌协会放射性粒子微创治疗专委会、肿瘤核医学专委会主委;江西省卫生系统学术技术带头人。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 江伟负责论文的撰写与修订;付蔷、尹国涛负责病例与文献的收集;于筱舟、朱湘负责论文的审核与校对;徐文贵负责方案的提出与设计、论文的审阅。
| [1] |
王连唐, 刘子君.
5444例原发性恶性骨肿瘤组织病理学统计分析[J]. 中国肿瘤临床, 2007, 34(8): 457–461.
DOI:10.3969/j.issn.1000-8179.2007.08.011 Wang LT, Liu ZJ. Histopathological Survey and Analysis of 5444 Cases with Malignant Primary Bone Tumor[J]. Chin J Clin Oncol, 2007, 34(8): 457–461. DOI:10.3969/j.issn.1000-8179.2007.08.011 |
| [2] | Biermann JS, Adkins D, Benjamin R, et al. Bone cancer[J]. J Natl Compr Canc Netw, 2007, 5(4): 420–437. DOI:10.6004/jnccn.2007.0037 |
| [3] | Ottaviani G, Jaffe N. The epidemiology of osteosarcoma[J]. Cancer Treat Res, 2009, 152: 3–13. DOI:10.1007/978-1-4419-0284-9_1 |
| [4] | Isakoff MS, Bielack SS, Meltzer P, et al. Osteosarcoma:Current Treatment and a Collaborative Pathway to Success[J]. J Clin Oncol, 2015, 33(27): 3029–3035. DOI:10.1200/JCO.2014.59.4895 |
| [5] | Henk CB, Grampp S, Wiesbauer P, et al. Das Ewing-Sarkom Bildgebende Diagnostik[J]. Der Radiologe, 1998, 38(6): 509–522. DOI:10.1007/s001170050386 |
| [6] | Palmerini E, Colangeli M, Nanni C, et al. The role of FDG PET/CT in patients treated with neoadjuvant chemotherapy for localized bone sarcomas[J]. Eur J Nucl Med Mol Imaging, 2017, 44(2): 215–223. DOI:10.1007/s00259-016-3509-z |
| [7] | Kim SK, Park YK. Ewing sarcoma:a chronicle of molecular pathogenesis[J]. Hum Pathol, 2016, 55: 91–100. DOI:10.1016/j.humpath.2016.05.008 |
| [8] | Ozaki T. Diagnosis and treatment of Ewing sarcoma of the bone:a review article[J]. J Orthop Sci, 2015, 20(2): 250–263. DOI:10.1007/s00776-014-0687-z |
| [9] | Iwamoto Y. Diagnosis and treatment of Ewing's sarcoma[J]. Jpn J Clin Oncol, 2007, 37(2): 79–89. DOI:10.1093/jjco/hyl142 |
| [10] | Györke T, Zajic T, Lange A, et al. Impact of FDG PET for staging of Ewing sarcomas and primitive neuroectodermal tumours[J]. Nucl Med Commun, 2006, 27(1): 17–24. DOI:10.1097/01.mnm.0000186608.12895.69 |
| [11] | Byun BH, Kong CB, Lim I, et al. Comparison of 18F-FDG PET/CT and 99mTc-MDP bone scintigraphy for detection of bone metastasis in osteosarcoma[J]. Skeletal Radiol, 2013, 42(12): 1673–1681. DOI:10.1007/s00256-013-1714-4 |
| [12] | Hurley C, McCarville MB, Shulkin BL, et al. Comparison of 18F-FDG-PET-CT and Bone Scintigraphy for Evaluation of Osseous Metastases in Newly Diagnosed and Recurrent Osteosarcoma[J]. Pediatr Blood Cancer, 2016, 63(8): 1381–1386. DOI:10.1002/pbc.26014 |
 2018, Vol. 42
2018, Vol. 42


