2. 100853 北京, 解放军总医院核医学科
2. Department of Nuclear Medicine, the PLA General Hospital, Beijing 100853, China
脂肪酸是心肌能量的主要来源,其摄取与血流量和浓度成正比[1]。脂肪酸从血液中清除的半衰期少于2 min,并以50%~60%的第一次提取分数浓缩在心肌细胞中。在心肌缺血或损伤时脂肪酸摄取和氧化量减少,因此脂肪酸摄取量的改变被认为是缺血和心肌损伤的敏感标志。
14(R, S)-[18F]氟-6-硫杂十七烷酸(14(R, S)-[18F]fluoro-6-thia-heptadecanoic acid,18F-FTHA)是脂肪酸代谢的长链脂肪酸底物,是一种假的长链脂肪酸,被组织吸收进入线粒体或掺入复合脂质,心肌中18F-FTHA摄取的累积量和摄取速率反映了长链脂肪酸的β-氧化速率[2]。18F-FTHA近年来被用于研究人类脂肪酸代谢,确定骨骼肌和心肌脂肪酸摄取率。在线粒体中,18F-FTHA经历了β-氧化的初始步骤[3],之后因硫杂原子的存在使得进一步的β-氧化被阻断,并被心肌组织捕获。这一特性使18F-FTHA在心肌细胞内富集,为PET显像提供了最佳信号。本研究着力实现18F-FTHA的自动化合成,并对其物理、化学和生物学性能进行鉴定。通过正常昆明小鼠体内的生物学分布实验确定其在心肌中的特异性摄取。
1 材料与方法 1.1 仪器与试剂Minitrace型回旋加速器、Tracerlab FX-FN型多功能合成器:美国通用电气公司;LC-20AT型高效液相色谱仪:日本岛津公司;Simplicity型超纯水机:美国Millipore公司。
甲醇、乙醇:德国Merck公司;二甲亚砜、氢氧化钠:美国Sigma-Aldrich公司;乙腈:加拿大Premptar公司;苄基-14-(R, S)-对甲苯磺酰基-6-硫代十七烷酸脂、氨基聚醚(K2.2.2):德国ABX公司;Light QMA柱、SPE C18柱:美国Waters公司;18O-H2O水:美国Cambridge公司;超纯水为自行制备。
1.2 实验动物昆明小鼠40只,体质量18~20 g,4~6周龄,清洁级,雌雄兼用,由内蒙古大学动物实验室提供。实验动物许可证号:SCXK(蒙)2016-0001。
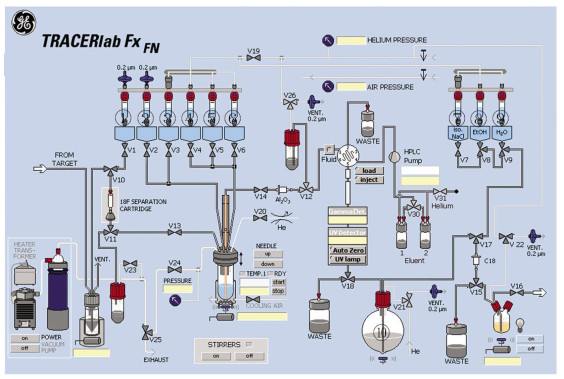
1.3 方法 1.3.1 合成前的准备18F-FTHA的合成是在GE Tracerlab FX-FN自动化合成器上完成,合成管路连接示意图见图 1。瓶①~瓶⑩中分别加入不同溶液,瓶①:3 mg K2CO3溶于0.5 mL超纯水的溶液;瓶②:15 mg K2.2.2溶于1.0 mL高纯乙腈的溶液;瓶③:10 mg苄基-14-(R, S)-对甲苯磺酰基-6-硫代十七烷酸脂溶于1.0 mL高纯乙腈的溶液;瓶④:1.0 mL 0.2 mol/L的NaOH溶液;瓶⑤:1.2 mL 0.2 mol/L的HCl溶液;瓶⑥:2.0 mL 80%甲醇溶液;瓶⑦和瓶⑧:各为15 mL超纯水;瓶⑨:1.0 mL乙醇;瓶⑩:60 mL超纯水。QMA柱依次用10 mL 0.5 mol/L的NaHCO3溶液和超纯水淋洗并吹干,安装在V10和V11阀之间。C18柱依次用10 mL乙醇和超纯水淋洗并吹干,安装在V15和V17阀之间。
|
图 1 Tracerlab FX-FN自动化合成器的操作界面图 Figure 1 Operation interface of GE Tracerlab FX-FN automated synthesizer |
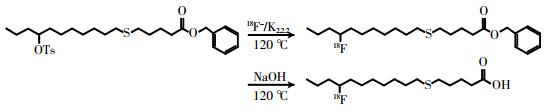
由Minitrace型回旋加速器经18O(p, n)18F核反应制备的18F-,传输到Tracerlab FX-FN的18F-离子收集瓶后负压转移到QMA柱子上,经瓶①溶液洗脱到反应管,再加入瓶②溶液,加热干燥(过程为65 ℃加热65 s、120 ℃加热90 s),同时抽真空。之后降温到60 ℃加入瓶③溶液(120 ℃ 2atm反应6 min);降温到90 ℃加入瓶④溶液水解5 min,加入瓶⑤溶液中和,降温到40 ℃加入瓶⑥溶液混匀,注入半制备型高效液相色谱仪(制备柱:NM VP 250 mm×16 mm、流动相:CH3OH : H2O=80 : 20)进行纯化,收集产品至瓶⑩,与60 mL超纯水混合。将此含有产品的低浓度甲醇溶液以氦气压过C18柱,富集产品18F-FTHA;富集产品的C18柱以瓶⑦和瓶⑧的超纯水洗涤2次去甲醇,最后由瓶⑨的乙醇从C18柱洗脱到产品收集瓶与9 mL生理盐水混合。18F-FTHA的合成路线图见图 2。
|
图 2 14(R, S)-[18F]氟-6-硫杂十七烷酸(18F-FTHA)的合成路线图 Figure 2 Synthesis procedure of 14(R, S)-[18F]fluoro-6-thia-heptadecanoic acid |
观察18F-FTHA物理性状,测定放射性活度、比活度、半衰期和放射性核纯度。比活度应不小于37 GBq/mmol,用时间衰变法测定18F半衰期应为109.8 min,放射性核纯度应大于98%。
1.3.3.2 化学鉴定用带有放射性检测器的分析型高效液相色谱仪鉴别所合成的产物,并测定其化学纯度、放射化学纯度和室温稳定性。高效液相色谱仪分析条件为分析柱:Shim-peck VP-ODS 250 mm×4.6 mm柱,紫外检测波长为254 nm,放射性检测器:Bioscan Flow Count。流动相:CH3OH : H2O : CH3COOH=80 : 19.6 : 0.4,流速:1 mL/min。18F-FTHA的鉴定采用标准品(FTHA)与产品(18F-FTHA)共同进样方法。pH值以精密pH试纸测定,室温放置1、2、3、6 h后分别测定其放射化学纯度的稳定性。
1.3.3.3 生物学鉴定异常毒性实验采用昆明小鼠20只,每只尾静脉注射37 MBq(0.5 mL)18F-FTHA,连续48 h观察小鼠有无不良反应和死亡现象。无菌检查以18F-FTHA注射液常规细菌培养72 h后观察有无细菌生长,细菌内毒素检查以鲎试剂浊度法检测。
1.3.4 18F-FTHA在正常小鼠体内的生物学分布昆明小鼠20只(采用随机数字表法分为4组,每组5只)经尾静脉分别注射18F-FTHA显像剂7.4 MBq(体积<0.2 mL)。注射后15、30、60、90 min时各处死1组小鼠,分别取心脏、肝脏、脾、肺、肾脏、肌肉和骨等主要器官和血液,称重并用γ计数仪测定其放射性计数,计算每克组织百分注射剂量率(%ID/g)。公式:每克组织百分注射剂量率=每克组织放射性计数/注射的总放射性计数×100%,测得数据按时间推算法进行衰减校正。
1.3.5 统计学分析采用SPSS 15.0软件对数据进行统计学分析。符合正态分布的计量数据以x+s表示,组间数据比较采用配对t检验。P<0.05表示差异有统计学意义。
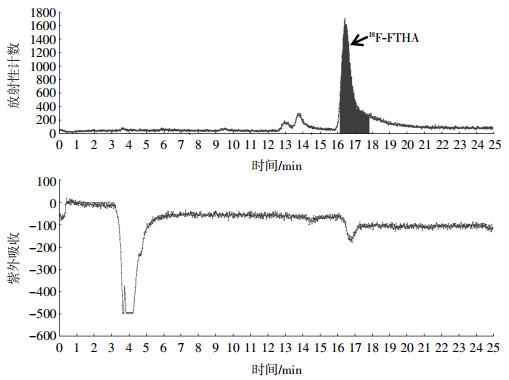
2 结果 2.1 18F-FTHA的自动化合成在Tracerlab Fx-FN自动化合成器上完成了18F-FTHA的自动化合成,总合成时间约为50 min,其中前30 min为反应过程、后20 min为半制备型高效液相色谱仪分离过程。如图 3所示,收集16.2~17.8 min的放射性组分为18F-FTHA,未经衰减校正的放射化学产率为(10.0±1.7)%。
|
图 3 14(R, S)-[18F]氟-6-硫杂十七烷酸(18F-FTHA)的半制备型高效液相色谱仪纯化图 Figure 3 Semi-preparative high performance liquid chromatography purification of 14(R, S)-[18F] fluoro-6-thia-heptadecanoic acid |
18F-FTHA注射液为含10%乙醇的无色澄清透明溶液,pH值为6~7,比活度为65 GBq/mmol,18F半衰期为(109.8±5.0)min,放射性核纯度≥99%。
2.2.2 化学鉴定分析测定结果显示,18F-FTHA的放射化学纯度>98%(图 4)。18F-FTHA在分析性高效液相色谱仪上的保留时间为16.8 min。18F-FTHA室温放置1、2、3、6 h后的放射化学纯度均>95%。证明其辐射自分解量极微,室温环境中较为稳定。

|
图 4 14(R, S)-[18F]氟-6-硫杂十七烷酸(18F-FTHA)的分析型高效液相色谱仪鉴别图 Figure 4 Identification of 14(R, S)-[18F]fluoro-6-thia-heptadecanoic acid by analytical high performance liquid chromatography |
小鼠尾部注射18F-FTHA后观察48 h,小鼠活动正常,无任何不良反应及死亡现象发生。18F-FTHA注射液常规培养细菌72 h,未见细菌生长。内毒素检测为阴性,内毒素含量小于1 EU/mL。
2.3 18F-FTHA在正常小鼠体内的生物学分布18F-FTHA在正常小鼠体内不同时间点的生物学分布结果见表 1。由表 1可知,18F-FTHA显像剂在血液中清除快,心肌摄取高,非靶器官摄取较低。在注射显像剂后的各个时间点心肌摄取均高于肺部摄取,60 min时心肌/肺的摄取比值为6/1(t=0.27,P=0.01),90 min时心肌/肺的摄取比值为10/1(t=2.21,P=0.03),差异有统计学意义。肝脏摄取呈先高后低的趋势,在15 min和30 min时肝脏摄取均高于心肌,而60 min和90 min时心肌摄取均高于肝脏,而且有较高的心肌与肝脏放射性摄取比值,60 min时心肌/肝脏的摄取比值为3/1(t=0.75,P=0.02),90 min时心肌/肝脏的摄取比值为4/1(t=1.15,P=0.03),差异有统计学意义。
| 表1 14(R, S)-[18F]氟-6-硫杂十七烷酸(18F-FTHA)在昆明小鼠体内的生物学分布(x+s,n=5) Table 1 The biodistribution of 18F-FTHA in Kunming mice |
心肌代谢显像技术集中在3个关键领域:葡萄糖代谢、脂肪酸代谢和氧化代谢。在这些领域已经研发了多种分子探针,并且取得了相当大的成功,特别是用于存活心肌的检测[4]。
游离脂肪酸是高能量化合物,是生物体组织的主要能量来源[5]。生物体组织中的游离脂肪酸是以甘油酯的形式储存于所有器官中。当生物体组织需要提供能量时,游离的脂肪酸以甘油三酯的形式从脂肪组织和肝脏快速移入体循环以满足生物体的能量需求[6]。
心肌通过长链脂肪酸的β-氧化获得大量的三磷酸腺苷(ATPs)以维持其代谢[7]。葡萄糖、乳酸、酮和氨基酸是可用于心肌能量代谢的其他底物,与其他器官相反,心肌具有在缺血等紧急情况下切换能量源的固有能力,以维持稳定状态。在缺氧的状态下,心肌转变成厌氧模式,因为与β-氧化相比糖酵解需要更少的氧气,导致葡萄糖的使用量增加[8]。这种心肌选择代谢能量底物的灵活性取决于底物可用性、底物的链长、氧供应、刺激、组织血管、激素效应和心脏负荷等因素。心肌组织的选择性摄取脂肪酸最佳的链长为12~20个碳原子[9]。
本研究实现了由17个碳原子构成碳链的18F-FTHA的自动化合成,碳链长度能满足心肌组织的选择性摄取脂肪酸最佳的链长为12~20个碳原子的要求[9]。18F-FTHA在GE Tracerlab FX-FN合成器上的放射化学产率为(10.0±1.7)%,与国产合成器相比,产率相当[10]。18F-FTHA的放射化学纯度较高,且体外稳定性较好,室温放置6 h时放射化学纯度仍>95%。物理、化学、生物学性能符合要求,能满足临床需要。小鼠体内生物学分布研究结果表明含有17个碳原子链的18F-FTHA有很高的心肌摄取,在注射后60 min达到峰值。从小鼠体内生物学分布数据分析推测18F-FTHA的PET/CT显像时间窗应在注射显像剂之后60 min。但是本研究没有进行显像实验,例如以大鼠心肌缺血模型的脂肪酸代谢显像验证显像剂的显像效果。另外半制备型高效液相色谱仪分离过程中用到的有毒溶剂甲醇在最终产品中的含量未能测定,用于人体之前应进行相关检测,把甲醇含量控制在可接受范围内。
18F-FTHA在血浆和身体组织中的不同脂质库之间的生物学分布和分配一直没有很好的表征,并且没有关于18F-FTHA在脑、脂肪组织和胰腺等主要的代谢调节器官中的代谢过程的研究数据。现有的离体信息大多局限于心脏、骨骼肌和肝脏,并且主要来源于小动物[11],但从啮齿动物到人类的外推需要非常小心。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 何玉林、张晓军负责现场实验、论文的撰写;李剑波、张国建负责数据统计分析;张锦明、王雪梅负责方法的建立、论文的审阅。
| [1] | Giedd KN, Bergmann SR. Fatty acid imaging of the heart[J]. Curr Cardiol Rep, 2011, 13(2): 121–131. DOI:10.1007/s11886-010-0163-0 |
| [2] | Mather KJ, Hutchins GD, Perry K, et al. Assessment of myocardial metabolic flexibility and work efficiency in human type 2 diabetes using 16-[18F]fluoro-4-thiapalmitate, a novel PET fatty acid tracer[J/OL]. Am J Physiol Endocrinol Metab, 2016, 310(6): E452-460[2018-07-03]. https://www.ncbi.nlm.nih.gov/pubmed/26732686. DOI: 10.1152/ajpendo.00437.2015. |
| [3] | Guiducci L, Grnroos T, Jrvisalo MJ, et al. Biodistribution of the fatty acid analogue 18F-FTHA:plasma and tissue partitioning between lipid pools during fasting and hyperinsulinemia[J]. J Nucl Med, 2007, 48(3): 455–462. |
| [4] | Yoshinaga K, Tamaki N. Imaging myocardial metabolism[J]. Curr Opin Biotechnol, 2007, 18(1): 52–59. DOI:10.1007/978-3-319-61401-4_11 |
| [5] | Mittendorfer B, Liem O, Patterson BW, et al. What does the measurement of whole-body fatty acid rate of appearance in plasma by using a fatty acid tracer really mean?[J]. Diabetes, 2003, 52(7): 1641–1648. DOI:10.2337/diabetes.52.7.1641 |
| [6] | Tuunanen H, Ukkonen H, Knuuti J. Myocardial fatty acid metabolism and cardiac performance in heart failure[J]. Curr Cardiol Rep, 2008, 10(2): 142–148. DOI:10.1007/s11886-008-0024-2 |
| [7] | McArdle B, Dowsley TF, Cocker MS, et al. Cardiac PET:metabolic and functional imaging of the myocardium[J]. Semin Nucl Med, 2013, 43(6): 434–448. DOI:10.1053/j.semnuclmed.2013.06.001 |
| [8] | Korvald C, Elvenes OP, Myrmel T. Myocardial substrate metabolism influences left ventricular energetics in vivo[J/OL]. Am J Physiol Heart Circ Physiol, 2000, 278(4): H1345-1351[2018-07-03]. https://www.ncbi.nlm.nih.gov/pubmed/?term=Myocardial+substrate+meta.bolism+influences+left+ventricular+energetics+in+vivo. DOI: 10.1152/ajpheart.2000.278.4.H1345. |
| [9] | Knuuti J, Tuunanen H. Metabolic imaging in myocardial ischemia and heart failure[J]. Q J Nucl Med Mol Imaging, 2010, 54(2): 168–176. |
| [10] |
张晓军, 刘健, 孙志军, 等.
多功能模块合成新肌显像剂18F-FTHA及Micro-PET显像[J]. 同位素, 2013, 26(4): 222–227.
DOI:10.7538/tws.2013.26.04.0222 Zhang XJ, Liu J, Sun ZJ, et al. Labeling and Imaging Study of Fatty Acid Analogue 18F-FHTA on Domestic Synthesis Module[J]. Isotopes, 2013, 26(4): 222–227. DOI:10.7538/tws.2013.26.04.0222 |
| [11] | DeGrado TR, Wang S, Holden JE, et al. Synthesis and preliminary evaluation of 18F-labeled 4-thia palmitate as a PET tracer of myocardial fatty acid oxidation[J]. Nucl Med Biol, 2000, 27(3): 221–231. |
 2018, Vol. 42
2018, Vol. 42


