CT是目前临床上应用最广泛的影像学检查方法,具有时间分辨率高、密度分辨率高的特点,CT对比剂以提高病变组织与周围组织的X射线衰减系数差别而应用于临床。目前临床应用最广泛的碘对比剂为小分子对比剂,但其很快就会通过肾脏排泄,血池时间短,使得CT检查技术作为分子影像学工具一直难有较大发展。近年来随着纳米医学的发展,各种高原子序数纳米材料尤其是金纳米材料的合成与开发为CT分子影像提供了新的契机,金纳米棒表面修饰后无毒性、生物相容性好、体内循环时间长,且其表面易于修饰不同的基团,可进行靶向成像,使其成为性能优异的分子影像学载体[1-2]。本研究意在探讨聚乙二醇(polyethylene glycol,PEG)修饰后的金纳米棒制成的新型CT对比剂进行体外CT成像,并对新型对化剂的CT成像参数进行优化及图像质量控制。
1 材料与方法 1.1 材料与设备十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)购自国药集团上海化学试剂有限公司;氯金酸、硼氢化钠、硝酸银、抗坏血酸购自美国Sigma-Aldrich公司;PEG购自西安瑞禧生物科技有限公司。碘对比剂采用非离子型对比剂优维显(碘浓度370 mgI/mL),购自拜耳医药保健有限公司中国广州分公司(生产批号:241A)。
采用美国Philips heathcare公司的256层螺旋Brilliance iCT机,自制样本扫描架。UV-2450型紫外-可见光分光光度计由日本岛津公司生产。tecnai G 2F型高分辨透射电子显微镜由荷兰飞利浦公司生产。
1.2 金纳米棒的合成及修饰采用金种子和生长液的方法制备金纳米棒。将5 mL 0.2 mol/L的CTAB溶液加入到5 mL 0.0005 mol/L的氯金酸溶液中,于28℃中水浴中搅拌摇匀后缓慢加入冰冷的0.6 mL 0.01 mol/L的硼氢化钠溶液,得到金种子液,待用。将25 mL的CTAB溶液(0.2 mol/L)加入至750 μL的硝酸银溶液(0.004 mol/L)与25 mL的氯金酸溶液(0.001 mol/L)的混合液中,于28 ℃水浴中搅拌摇匀后缓慢加入350 μL的抗坏血酸(0.08 mol/L),得到生长液。最后将60 μL的金种子液加入到50 mL的生长液中混合,震荡摇匀经生长2 h,即得到了金纳米棒(纳米金颗粒)原液。原液经过离心2次(离心半径为6.5 cm,10 000 r/min),每次10 min,纯化弃上清后去除表面活性剂,收集浓缩的金纳米棒,在去离子水中重悬,继续震荡2 h,得到纯化的金纳米棒。纯化的金纳米棒与含巯基的聚乙二醇(PEG-SH)及邻二硫吡啶基-聚乙二醇-琥珀酰亚胺戊酸酯(OPSS-PEG-SVA)室温下共孵育1 h,孵育后进行离心(离心半径为6.5 cm,10000转/min)15 min,获得PEG化的金纳米棒。
1.3 金纳米棒的粒径及理化特征测量使用紫外可见分光光度计检测金光吸收谱。用透射电子显微镜观察金纳米棒形态。制备金纳米棒的透射电子显微镜样品:用离心机在10 000 r/min(离心半径为6.5 cm)下反复离心(约30 min)去除多余的表面活性剂CTAB,用移液枪将浓缩的金纳米棒溶液滴加到铜网表面,放置于室温下自然干燥。样品放入样品盒,进行电子显微镜扫描。透射电子显微镜图像在加速电压为200 kV、放大倍数为80 000倍的条件下获得。
1.4 体外CT扫描、CT值测定及图像质量评价将离心纯化的金纳米棒配成梯度悬液,分别为0、0.2、0.4、0.6、0.8、1.0、2.0 mg/mL的8个浓度梯度,并以相同的浓度梯度对临床用CT对比剂进行稀释,将装载上述浓度梯度的金纳米棒溶液与碘对比剂稀释溶液样本扫描架置于扫描床上进行CT扫描。通过改变扫描条件对各样品进行CT成像:通过测量CT值及图像质量评估探讨合适的CT扫描条件。CT扫描设置如下:①分别在空气与水中扫描。②分别在不同管电压(80、100、120、140 kV)条件下扫描。③管电压为80 kV时,分别在不同毫安秒(50、100、200、300、400 mAs)条件下扫描。④将不同浓度的金纳米棒与碘对比剂放置在80 kV、300 mAs条件下进行CT扫描。参数:层厚为0.8 mm,转速为0.75 s每周,矩阵大小为512×512,显示视野为200 mm×200 mm。对样品扫描3次,所测CT值和SD值取平均值代表各样品的CT值和噪声值,信噪比=(CT对比剂-CT水)/SD水。
1.5 统计学分析采用SPSS19.0软件对不同浓度的金纳米棒与碘对比剂的CT值进行统计学分析。不同浓度金纳米棒与碘对比剂对CT值的影响采用pearson相关性分析,P < 0.05表示差异有统计学意义。
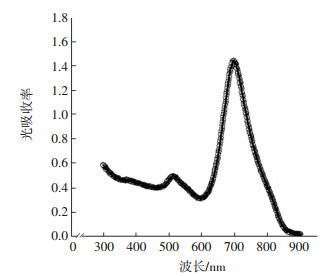
2 结果 2.1 金纳米棒的形貌特性、粒径大小、吸收光谱特征合成的金纳米棒为棒状结构,其粒径均匀,分散性好,长径为50~60 nm,短径为20~30 nm(图 1),粒径比为2.0~2.5。金纳米棒的光吸收曲线上其紫外吸收峰有两个峰值,位置分别在520 nm和690 nm左右(图 2)。

|
图 1 金纳米棒在透射电子显微镜下的形貌特征(×80 000) Figure 1 Transmission electron microscope morphology of gold nanorods |
|
图 2 金纳米棒的光吸收曲线 Figure 2 Optical absorption curves of gold nanorods |
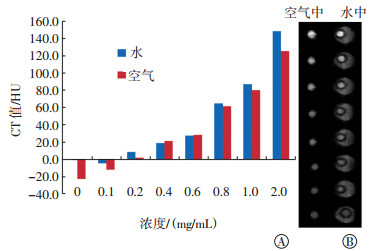
检测不同浓度金纳米棒在空气中与在水中扫描的CT差异。如图 3中A所示,相同浓度对比剂下,在空气中扫描的CT值较水中扫描的CT值偏低;将水作为参考样本,在水中扫描得到的CT值最为接近真实值,在空气中扫描得到的CT值较水中扫描的CT值偏低。金纳米棒在空气中和水中行CT扫描获得的灰度图像见图 3中B,在水中扫描获得的图像可视效果更好,也能得到更准确的测量数据。
|
图 3 不同浓度金纳米棒在空气和水中的CT值测量结果(A)和CT扫描灰度图像(B) Figure 3 CT values of different concentrations of gold nanorods in the air and in the water bath(A) and gray scale map of CT scanning images(B) |
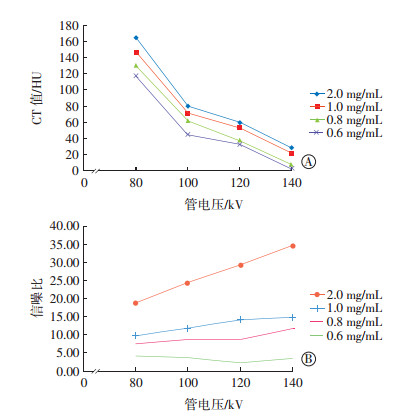
不同浓度金纳米棒在不同管电压条件下的CT值差异与信噪比差异见图 4。管电压越低,金纳米棒溶液的CT值越高(图 4中A)。不同管电压条件下,当金纳米棒溶液浓度为2.0 mg/mL时,信噪比差异明显;当浓度xy1.0 mg/mL时,信噪比差异不明显(图 4中B)。
|
图 4 不同浓度金纳米棒在不同管电压条件下的CT值差异(A)和信噪比差异(B) Figure 4 CT value difference(A) and signal-to-noise ratio difference (B) of different concentration gold nanorods under different tube voltage conditions |
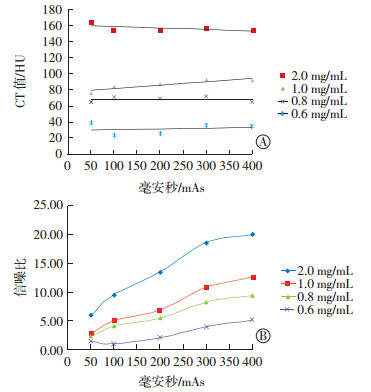
不同浓度金纳米棒在不同毫安秒条件下的CT值差异与信噪比差异见图 5。毫安秒的高低并不影响金纳米棒溶液的CT值测量(图 5中A);随着毫安秒的增高,图像的信噪比也得到了提高,但当毫安秒>300 mAs时,图像的信噪比增加不明显(图 5中B)。
|
图 5 不同浓度金纳米棒在不同毫安秒条件下的CT值差异(A)和信噪比差异(B) Figure 5 CT value difference(A) and signal-to-noise ratio difference (B) of different concentration gold nanorods under different tube current conditions |
将不同浓度的金纳米棒溶液与碘对比剂放置在80 kV、300 mAs条件下进行CT扫描,比较不同浓度金纳米棒溶液与碘对比剂的CT值差异并进行灰度图显示。如图 6中A所示,随着浓度的增加,金纳米棒与碘对比剂的CT值也升高,并存在高度的正相关关系(r=0.990、0.994,均P < 0.05),随着浓度的升高,两种溶液的CT值差异越来越大。不同浓度金钠米棒和碘对比剂在水中行CT扫描获得的灰度的图像见图 6中B,在相同浓度条件下,金钠米棒较碘对化剂有更高的对比度。
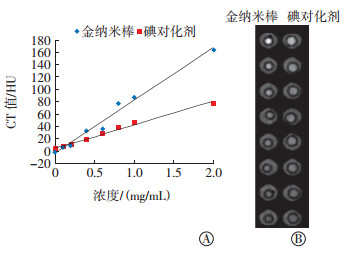
|
图 6 不同浓度金纳米棒与碘对比剂溶液在80 kV、300 mAs条件下的CT值差异(A)和灰度图显示(B) Figure 6 CT value difference (A) and gray scale map of different concentration nanoscale gold nanorods and iodinated contrast agent under 80 kV and 300 mAs conditions (B) |
CT是目前临床上应用最广泛的影像学检查方法,其成像迅速,有平扫和增强扫描两种模式。平扫有时会因为病变组织与周围正常组织间衰减系数差别小而难以识别,而增强扫描是通过引入CT对比剂增加病变组织与周围组织间的衰减系数差别,差别越大,得到的图像越清晰,病变越容易被识别,从而提高诊断的准确率。本研究对金纳米棒与碘对比剂进行不同扫描参数成像,金纳米棒与碘对比剂均对X射线有衰减作用,均能提高病变组织与周围组织的衰减系数差别,且金纳米棒对X线的衰减较碘对比剂对X线的衰减更多,是一种理想的新型CT对比剂。
CT对比剂的选择条件是衰减系数高,而决定物质衰减系数的因素有物质的密度、原子序数和每千克物质所含的电子数(电子密度)。目前临床上常用的对比剂为小分子化合物碘对比剂(碘密度为4.94 g/cm3,原子序数为53),但其表面不易于修饰,血池和体内时间循环短,很快就经肾脏代谢排泄,使CT检查技术的应用一直严重滞后于MRI及核医学等其他影像学检查技术。近年来随着纳米医学的发展,各种高原子序数纳米材料[3]尤其是金纳米材料的合成与开发为CT分子影像学提供了新的契机,金作为一种高密度、高原子序数(金密度为19.3 g/cm3,原子序数为79)的金属材料无疑可以提供更优质的图像。金纳米材料因其形状不同有金纳米球、金纳米棒及金纳米壳等。金纳米棒因合成容易、粒径比可控的优点而被广泛使用。金纳米棒表面经过修饰后无毒性、生物相容性好、体内循环时间长,且表面易于修饰不同的基团进行靶向成像,利于金纳米棒的光热作用,还可以进行肿瘤的精准光热治疗[4-5],金纳米棒是一种性能优异的分子影像学载体。
目前合成金纳米棒的方法主要有模板法、电化学方法、光化学方法和晶种生长方法等[6]。其中晶种生长法作为制备金纳米棒的方法使用最广,且可以根据不同的投料比来控制合成粒径的大小。
3.2 体外成像扫描的图像质量控制及精确测量在同一个CT探测器、同一扫描层面内有两种以上不同密度而又重叠的物质时,CT仪会采集到多种密度物质的数据,此时,输出的信号为各数据的平均值,所得的CT值不能反映其中任何一种物质,这种现象称为部分容积效应[7]。将金纳米棒悬液与碘对比剂放置在空气和水中进行CT扫描,以水样本为参照物,放置在水中扫描得到的结果更为准确。其主要原因是水的CT值为0 HU,而空气的CT值为-1000 HU,在X线束穿透对比剂的时候,会产生线束硬化现象,相当于降低了物质的吸收密度,放置在空气中比放置在水中扫描对物质的影响更大,所以水浴模式对金纳米颗粒体外成像的测量更为准确。
图像的质量需要X线束的辐射剂量做支持,而辐射剂量的高低主要取决于管电压与毫安秒。采用不同的扫描参数会对图像质量有不同程度地影响[8]。本研究采用不同管电压与不同毫安秒对不同浓度金纳米棒悬液与碘对比剂进行了体外成像,结果表明,管电压对金纳米颗粒与碘对比剂CT值的影响比较明显,在80 kV条件下,金纳米颗粒与碘对比剂的CT值均为最高。毫安秒对金纳米棒悬液与碘对比剂的CT值基本无影响,但随着毫安秒的增加,图像噪声得到降低,图像质量与毫安秒呈正相关。在80 kV管电压的条件下,300 mAs可保证图像整体质量。在80 kV、300 mAs扫描条件下,同样浓度的金纳米棒较碘对比剂衰减系数高,在0.4 mg/mL及以上浓度时可以达到肉眼可辨别的差异。在对比剂浓度为0.1~2.0 mg/mL时,分析金纳米棒溶液与碘对比剂的浓度与CT值间的相关性,可以得知金纳米棒溶液浓度对CT值的影响与碘对比剂浓度对CT值影响相同,都存在高度的正相关关系。
对比剂能够应用在CT成像中,依赖的是X射线与物质的相互作用。在医用X射线能量领域内,光电效应是X射线与物质发生的主要作用,而光电效应发生的概率与物质的原子序数立方呈正比关系[9]。在本研究中,碘的原子序数为53,而金的原子序数为79,因此,金纳米棒较碘对比剂对X射线有着更强的衰减作用,CT值更高。在管电压对图像质量的影响方面,有研究表明,金的吸收阈值(80.7 keV)较碘的吸收阈值(33.2 keV)更高,在医用X线能量领域内,X线束中的平均光子能量更接近金的吸收阈值[10]。采用低管电压技术能增强光电效应,减少康普顿散射,提高金纳米棒对X线束的衰减作用,得到比碘对比剂更高的CT值[11]。这意味着在相同浓度对比剂的情况下,金纳米颗粒可提高靶血管或组织与周围组织的对比度,为低浓度对比剂提供了更多可能。
综上所述,本研究所制备的PEG化的金纳米颗粒是一种新型的CT对比剂,具有比现有CT碘对比剂更优秀的显影特征,iCT机在优选的扫描参数条件下可获得优良的显影图像,未来可在其表面连接功能化基团实现CT分子成像。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 尹伟负责现场实验及数据的获取与分析和论文的撰写;刘日负责现场实验及数据的获取与分析;王敏杰负责方法建立和论文审阅;弓静负责现场实验及数据的获取与分析、方法建立和论文审阅。
| [1] |
郭妍妍, 刘雅娟, 王琳, 等.
功能化高分子脂质体包裹的纳米金颗粒作为新型CT造影剂的初步研究[J]. 中国生化药物杂志, 2017, 37(4): 5–8.
DOI:10.3969/j.issn.1005-1678.2017.04.002 Guo YY, Liu YJ, Wang L, et al. Preliminary research on functional polymer liposome-entrapped gold nanoparticles as CT contrast agents[J]. Chin J Biological Pharms, 2017, 37(4): 5–8. DOI:10.3969/j.issn.1005-1678.2017.04.002 |
| [2] | Rajkumar S, Prabaharan M. Theranostics Based on Iron Oxide and Gold Nanoparticles for Imaging-Guided Photothermal and Photodynamic Therapy of Cancer[J]. Curr Top Med Chem, 2017, 17(16): 1858–1871. DOI:10.2174/1568026617666161122120537 |
| [3] | Liu Y, Ai K, Lu L. Nanoparticulate X-ray computed tomography contrast agents:from design validation to in vivo applications[J]. Acc Chem Res, 2012, 45(10): 1817–1827. DOI:10.1021/ar300150c |
| [4] | Lin W, Zhang X, Qian L, et al. Doxorubicin-Loaded Unimolecular Micelle-Stabilized Gold Nanoparticles as a Theranostic Nanoplatform for Tumor-Targeted Chemotherapy and Computed Tomography Imaging[J]. Biomacromolecules, 2017, 18(12): 3869–3880. DOI:10.1021/acs.biomac.7b00810 |
| [5] | Sasidharan S, Bahadur D, Srivastava R. Albumin stabilized gold nanostars:A biocompatible nanoplatform for SERS, CT imaging and photothermal therapy of cancer[J]. Rsc Advances, 2016, 6(87): 84025–84034. DOI:10.1039/C6RA11405A |
| [6] |
翟宏菊, 戴晓威, 曹爽, 等.
金纳米粒子的合成、性质及其应用新进展[J]. 吉林师范大学学报(自然科学版), 2017, 38(2): 13–16.
DOI:10.16862/j.cnki.issn1674-3873.2017.02.003 Zhai HJ, Dai XW, Cao S. New Progress of Synthesis, Properties and Applications of Gold Nanoparticles[J]. J Jilin Normal Univ (Natural Science Edition), 2017, 38(2): 13–16. DOI:10.16862/j.cnki.issn1674-3873.2017.02.003 |
| [7] |
余建明.
实用医学影像技术[M]. 人民卫生出版社, 2015: 501.
Yu JM. Practical medical imaging technology[M]. People's health press, 2015: 501. |
| [8] | Beik J, Jafariyan M, Montazerabadi A, et al. The benefits of folic acid-modified gold nanoparticles in CT-based molecular imaging: radiation dose reduction and image contrast enhancement[J/OL]. Artif Cells Nanomed Biotechnol, 2017: 1-9[2018-01-05]. https://www.ncbi.nlm.nih.gov/pubmed/29233015. DOI:10.1080/21691401. 2017. 1408019. |
| [9] | Seibert JA, Boone JM. X-ray imaging physics for nuclear medicine technologists. Part 2:X-ray interactions and image formatio[J]. J Nucl Med Technol, 2005, 33(1): 3–18. |
| [10] | Kang S, Eom J, Kim B, et al. Evaluation of gold K-edge imaging using spectral computed tomography with a photon-counting detector:A Monte Carlo simulation study[J]. Optik-Inter J Light Electron Optics, 2017, 140: 253–260. DOI:10.1016/j.ijleo.2017.04.062 |
| [11] |
李锋坦, 李东, 张云亭.
管电压对CT值测量、辐射剂量及图像质量影响的模型研究[J]. 中华放射学杂志, 2013, 47(5): 458–461.
DOI:10.3760/cma.j.issn.1005-1201.2013.05.016 Li FT, Li D, Zhang YT. Influence of tube voltage on CT attenuation, radiation dose, and image quality:phantom study[J]. Chin J Radiol, 2013, 47(5): 458–461. DOI:10.3760/cma.j.issn.1005-1201.2013.05.016 |
 2018, Vol. 42
2018, Vol. 42


