2. 233030, 蚌埠医学院核医学教研室
2. Department of Nuclear Medicine, Bengbu Medical College, Bengbu 233030, China
脂质体是上世纪60年代英国科学家Bangham在电镜下首先发现的[1]。由于脂质体小囊能够包裹药物,并且具有良好的生物亲和性、靶向性等[2-3],因此在医药领域内被广泛应用。提高放射性核素标记的配体与靶细胞受体特异性的结合率并延长滞留时间等是受体显像领域亟待解决的问题。近年来一些学者在这方面做了很多探索,赵新明等[4]在分析脂质体与非脂质体介导的99Tcm-表皮生长因子受体(EGFR)mRNA反义肽核酸(PNA)在体外人卵巢癌SKOV3细胞中摄取率的差别时发现,脂质体可以明显提高细胞对其的摄取率,同时也提高了对表皮生长因子受体高表达肿瘤的显像效果。Yin等[5]和刘开春[6]的实验结果表明,脂质体造影剂能够明显延长显影时间,并且稳定性较好。
99Tcm-MIBI最初是作为心肌显像剂应用于临床,近年来还用于一些肿瘤显像,比如乳腺癌等恶性肿瘤的显像[7-8]。99Tcm-MIBI在影像学中可作为诊断试剂载体或者显影剂[9],如Rodriguez-Evora等[10]用99Tcm标记脂质体作为载体用于前哨淋巴结显像。由此,我们考虑将99Tcm-MIBI制备成脂质体的形式,以提高其在体内某些肿瘤显像中的靶向性。本试验采用乙醇注入-超声法,以99Tcm-MIBI、大豆卵磷脂和胆固醇为基本原料,以脂质体粒径及包封率为衡量指标,对99Tcm-MIBI脂质体的制备进行初步探究。
1 材料与方法 1.1 试剂与仪器大豆卵磷脂、胆固醇由美国SIGMA公司提供;MIBI由北京大学师宏药物研制中心提供;99Mo-99Tcm发生器为原子高科股份有限公司产品;其他试剂均为国产分析纯。
电子天平(BS224S型):塞多利斯科学仪器(北京)有限公司;磁力搅拌器(SH2-2型):上海梅颖浦仪器仪表制造公司;JY92-Ⅱ超声细胞粉碎机:宁波新芝生物科技股份有限公司;透射电子显微镜(JEM-2010):日本电子光学公司;放射免疫γ计数仪(DMF-96型):合肥众城机电技术开发有限责任公司;离心机(Eppendorf AG 22331):德国Hamburg公司。
1.2 试验方法 1.2.1 99Tcm-MIBI脂质体的制备99Tcm-MIBI脂质体的制备步骤:(1)淋洗游离99TcmO4-,按照使用说明标记MIBI,制备得到99Tcm-MIBI,测定99Tcm-MIBI的放化纯度大于98%,备用;(2)将一定比例的大豆卵磷脂和胆固醇溶于无水乙醇;(3)将质量浓度分别为0.005、0.010、0.015 mg/mL的99Tcm-MIBI缓慢加入上述(2)溶液中并混匀;(4)取PBS溶液注入烧杯中,并放在磁力搅拌器上匀速、恒温搅拌;(5)在搅拌状态下将(3)中混合物缓慢滴入盛有PBS溶液的烧杯中制成99Tcm-MIBI脂质体悬液,并旋转蒸发除去乙醇;(6)取99Tcm-MIBI脂质体悬液用超声处理后过0.22 μm滤膜,放入4℃冰箱内贮存备用。
1.2.2 99Tcm-MIBI脂质体粒径大小和包封率的测定取适量相同体积的99Tcm-MIBI脂质体悬液4份分别加入离心管中,每2份一组,一组用来实验测量(测量组),另一组作为对照组。测量组99Tcm-MIBI脂质体于4℃下离心30 min(12 000× g)后弃上清,PBS重悬沉淀,洗涤3次。分别测量测量组沉淀和对照组的放射性活度。
| $ 包封率 = \frac{离心后脂质体的放射性活度}{对照组的放射性活度} \times 100\% $ |
用蒸馏水稀释制备好的99Tcm-MIBI脂质体悬液至较低浓度,滴在铜网上放置至成膜且均匀,多余液体自然挥发干燥,用电子显微镜在电压为200 kV条件下,放大不同倍数观察99Tcm-MIBI脂质体的粒径大小及形态变化。
1.2.3 超声时间的优化取适量相同体积的99Tcm-MIBI脂质体悬液分别装在5个小烧杯内,经探头式超声仪分别进行1、3、5、7、9 min(超声强度为200 W,超声10 s,间隔5 s)处理,分别取部分悬液测定包封率,其余保存在4℃冰箱中。
1.2.4 大豆卵磷脂与胆固醇质量比的优化按大豆卵磷脂与胆固醇质量比分别为3 : 1、4 : 1、5 : 1、6 : 1制备99Tcm-MIBI脂质体(方法同1.2.1),经探头式超声仪进行5 min(超声强度为200 W,超声10 s,间隔5 s)处理,分别取部分悬液测定包封率,其余保存在4℃冰箱中。
1.2.5 99Tcm-MIBI脂质体稳定性实验把同一批99Tcm-MIBI脂质体保存在4℃冰箱中,分别在制备后第1、30、90天时在电镜下观察99Tcm-MIBI脂质体的粒径大小及形状变化。
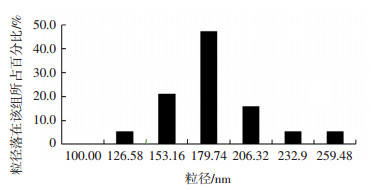
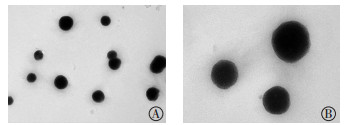
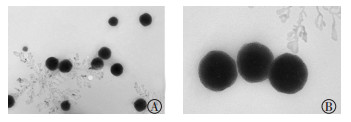
2 结果 2.1 99Tcm-MIBI脂质体的粒径大小和包封率由表 1可知,随着99Tcm-MIBI质量浓度的增加,粒径大小随之增大。99Tcm-MIBI质量浓度为0.010 mg/mL时,大部分脂质体粒径分布在100~200 nm(图 1),脂质体包封率最高(8.5±1.3)%,且比其他两组高(表 1)。同时由电镜图 2~4可见,99Tcm-MIBI质量浓度为0.005 mg/mL时的脂质体纳米粒子形状欠规则,表面凸凹不平;99Tcm-MIBI质量浓度为0.010 mg/mL和0.015 mg/mL时的脂质体粒径形状较为规则,呈完整圆球形或椭圆形。
| 表1 不同质量浓度的99Tcm-MIBI脂质体的粒径大小和包封率(x ± s) Table 1 Particle size and encapsulation efficiency of different concentrations of 99Tcm-MIBI liposomes(x ± s) |
|
图 1 质量浓度为0.010 mg/mL的99Tcm-MIBI脂质体粒径的大小及分布 Figure 1 The size and distribution of 99Tcm-MIBI liposome at the concentration of 0.010 mg/mL 图中,MIBI:甲氧基异丁基异腈。 |

|
图 2 质量浓度为0.005 mg/mL的99Tcm-MIBI脂质体粒子在4 ℃冰箱中保存1 d后的电镜图 Figure 2 Electron microscopy of 99Tcm-MIBI liposomal particles at the concentration of 0.005 mg/mL, storaged in refrigerator at 4℃ for 1 d 脂质体粒子形状欠规则,表面凸凹不平。A:放大倍数为20 000;B:放大倍数为50 000。MIBI:甲氧基异丁基异腈。 |
|
图 3 质量浓度为0.010 mg/mL的99Tcm-MIBI脂质体粒子在4℃冰箱中保存1 d后的电镜图 Figure 3 Electron microscopy of 99Tcm-MIBI liposomal particles at the concentration of 0.010 mg/mL, storaged in refrigerator at 4℃ for 1 d 图中,脂质体粒子形状较为规则、均匀,呈完整球形或椭圆形。A:放大倍数为20 000;B:放大倍数为50 000。MIBI:甲氧基异丁基异腈。 |
|
图 4 质量浓度为0.015 mg/mL的99Tcm-MIBI脂质体粒子在4℃冰箱中保存1 d后的电镜图 Figure 4 Electron microscopy of 99Tcm-MIBI liposomal particles at the concentration of 0.015 mg/mL, storaged in refrigerator at 4℃ for 1 d 图中,脂质体粒子形状较为规则、均匀,呈完整球形或椭圆形。A:放大倍数为20 000:B:放大倍数为50 000。MIBI:甲氧基异丁基异腈。 |
当超声时间分别为1、3、5、7、9 min时,包封率分别为(5.6±0.6)%、(6.9±1.2)%、(8.4±2.7)%、(7.1±0.9)%、(3.4±1.2)%。当超声时间为5 min时, 脂质体的包封率最高;当超声时间为9 min时,包封率迅速降低。所以选择测定的最佳超声时间为5 min。
2.3 大豆卵磷脂与胆固醇的质量比对包封率的影响当大豆卵磷脂与胆固醇的质量比分别为3 : 1、4 : 1、5 : 1、6 : 1时,包封率分别为(6.7±2.6)%、(8.5±1.7)%、(7.1±1.9)%、(6.2±1.1)%。当大豆卵磷脂与胆固醇的质量比为4 : 1时,脂质体的包封率最高,所以选择4 : 1为最佳。
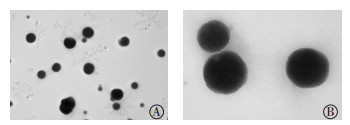
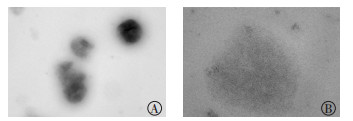
2.4 99Tcm-MIBI脂质体稳定性实验制备好在4℃冰箱内保存的99Tcm-MIBI脂质体粒子,在第1天后粒径较小,形状较为规则、均匀,呈完整球形或椭圆形(图 3);30 d后粒径大小及形状未见明显改变(图 5);90 d后脂质体崩解,形状欠佳,显影模糊,仅隐约可见轮廓(图 6)。
|
图 5 质量浓度为0.010 mg/mL的99Tcm-MIBI脂质体粒子在4℃冰箱中保存30 d后的电镜图 Figure 5 Electron microscopy of 99Tcm-MIBI liposomal particles at the concentration of 0.010 mg/mL, storaged in refrigerator at 4℃ for 30 d 图中,脂质体粒子形状较为规则、均匀,呈完整球形或椭圆形。A:放大倍数为15 000;B:放大倍数为50 000。MIBI:甲氧基异丁基异腈。 |
|
图 6 质量浓度为0.010 mg/mL的99Tcm-MIBI脂质体粒子在4℃冰箱中保存90 d后的电镜图 Figure 6 Electron microscopy of 99Tcm-MIBI liposomal particles at the concentration of 0.010 mg/mL, storaged in refrigerator at 4℃ for 90 d 图中,脂质体崩解,形状欠佳,显影模糊,仅隐约可见轮廓。A:放大倍数为15 000;B:放大倍数为50 000。MIBI:甲氧基异丁基异腈。 |
利用放射性核素标记药物制备脂质体,在医药领域已有很多研究及应用报道。本研究主要讨论以乙醇注入-超声法制备99Tcm-MIBI脂质体,并重点选择了超声时间、大豆卵磷脂与胆固醇质量比及稳定性3个主要因素对自制的99Tcm-MIBI脂质体进行分析。
有研究结果表明,当脂质体粒径小于10 nm时易被机体清除,而大于200 nm时易被肝脾等器官吸收,故脂质体直径大小应该在10~200 nm[11]。本研究制备的99Tcm-MIBI脂质体,当质量浓度分别为0.005、0.010 mg/mL时,粒径大小均符合上述结果;当质量浓度为0.015 mg/mL时,粒径大于200 nm。当99Tcm-MIBI质量浓度为0.010 mg/mL时,大部分脂质体粒径分布在100~200 nm,且包封率最高。
据文献报道,脂质体制备时行超声处理,能够降低脂质体的粒径大小,提高脂质体的均匀性[12]。本研究采用探头超声(将超声探头插入脂质体悬液中),输出的部分能量传递到脂质体悬液中,从而提高反应体系的温度,故超声时应把盛放脂质体悬液的烧杯放入冰水中。超声处理时间的长短对脂质体的包封率有非常大的影响。超声时间太短, 99Tcm-MIBI脂质体包封率较低,并且脂质体粒径均匀性欠佳,随着超声时间的延长,包封率增高,但当超声时间达到9 min时,则包封率迅速下降,并且有部分白色物质(胆固醇)析出,分析原因可能是因为超声时间过长破坏了脂质体的稳定性。本研究结果显示,99Tcm-MIBI脂质体在超声功率为200 W时,最佳超声时间为5 min(其中工作10 s,间隔5 s)。
制备99Tcm-MIBI脂质体时采用大豆卵磷脂和胆固醇这两种类脂。胆固醇具有双亲性,它能提高脂质体的稳定性,同时还能与磷脂良好融合,改变磷脂在脂质双层中的排列次序及流动性,从而使所载药物更易通过薄膜进入细胞。因此提高胆固醇的比例有助于提升包封率;但是当胆固醇达到一定比例时,脂质体形成就会变得困难,并且脂质体的稳定性较差(易被超声破坏)。因此,本研究制备99Tcm-MIBI脂质体的大豆卵磷脂与胆固醇的最佳质量比为4 : 1。
脂质体中磷脂、胆固醇的种类繁多,并且比例也不尽相同,因此需要制备的脂质体性状及包封率差异很大。Belhaj-Tayeb等[13]利用游离99Tcm标记MIBI所得的包封率与本研究的包封率值相似(都小于10%);袁超等[14]以聚乙二醇-聚乳酸聚乙醇酸共聚物(PEG-PLGA)制备雄激素受体三螺旋形成寡核苷酸(TFO-NPs)的脂质体时,所得包封率为72.3%;Lee等[15]和赵颖等[16]利用放射性核素标记脂质体获得了较高的包封率(大于90%)。所以只有结合脂质体的性状及包封率等多种因素来共同确定制备方案[16]。本研究的不足之处:包封率较低;本方法所得脂质体中的乙醇不能完全去除。我们只是初步制备了99Tcm-MIBI脂质体并对其特征进行简要分析,在以后还将对其在体内的稳定性、细胞实验及在荷瘤鼠体内的显像做进一步研究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李辉、孙俊杰、李卫鹏、訾刚负责现场实验、论文的撰写等;袁超负责方法的建立、论文的审阅。
| [1] | Wilkins DJ, Ottewill RH, Bangham AD. On the flocculation of sheep leucocytes:I. Electrophoretic studies[J]. J Theor Biol, 1962, 2(2): 165–175. DOI:10.1016/0022-5193(62)90045-0 |
| [2] | Landesman-Milo D, Ramishetti S, Peer D. Nanomedicine as an emerging platform for metastatic lung cancer therapy[J]. Cancer Metastasis Rev, 2015, 34(2): 291–301. DOI:10.1007/s10555-015-9554-4 |
| [3] | Alam MI, Paget T, Elkordy AA. Formulation and advantages of furazolidone in liposomal drug delivery systems[J]. Eur J Pharm Sci, 2016, 84: 139–145. DOI:10.1016/j.ejps.2016.01.017 |
| [4] |
赵新明, 韩静雅, 贾立镯, 等.
脂质体介导99Tcm-EGFR mRNA反义肽核酸在荷SKOV3卵巢癌裸鼠体内的分布及显像[J]. 中华核医学与分子影像杂志, 2014, 34(5): 379–384.
DOI:10.3760/cma.j.issn.2095-2848.2014.05.010 Zhao XM, Han JY, Jia LZ, et al. Imaging and biodistribution of lipofectamine-mediated 99Tcm labeled EGFR mRNA antisense peptide nucleic acid in SKOV3 tumor-bearing nude mice[J]. Chin J Nucl Med Mol Imaging, 2014, 34(5): 379–384. DOI:10.3760/cma.j.issn.2095-2848.2014.05.010 |
| [5] | Yin T, Wang P, Zheng R, et al. Nanobubbles for enhanced ultrasound imaging of tumors[J]. Int J Nanomedicine, 2012, 7: 895–904. DOI:10.2147/IJN.S28830 |
| [6] |
刘开春.
脂质体纳泡超声造影剂的制备及体外超声显像效果观察[J]. 医学影像学杂志, 2017, 27(7): 1375–1378.
Liu KC. Preparation of gas-coated liposomesand evaluation of its enhancement effect for ultrasound imaging in vitro[J]. J Med Imaging, 2017, 27(7): 1375–1378. |
| [7] | Homma T, Manabe O, Ichinokawa K, et al. Breast cancer detected as an incidental finding on 99Tcm-MIBI scintigraphy[J/OL]. Acta Radiol Open, 2017, 6 (7): 2058460117715665[2018-01-31]. https: //www.ncbi.nlm.nih.gov/pmc/articles/PMC5533265. DOI: 10.1177/2058460117715665. |
| [8] |
李建勋, 齐德林, 盛权根, 等.
99mTc-MIBI显像对乳腺肿块鉴别诊断的价值[J]. 临床军医杂志, 2002, 30(5): 39–41.
DOI:10.3969/j.issn.1671-3826.2002.05.016 Li JX, Qi DL, Sheng QG, et al. 99mTc-MIBI Scintigraphy in the Evaluation of the Breast Cancer Diagnosis[J]. Clin J Med Off, 2002, 30(5): 39–41. DOI:10.3969/j.issn.1671-3826.2002.05.016 |
| [9] | Gudlur S, Sandén C, Matou ková P, et al. Liposomes as nanoreactors for the photochemical synthesis of gold nanoparticles[J]. J Colloid Interface Sci, 2015, 456: 206–209. DOI:10.1016/j.jcis.2015.06.033 |
| [10] | Rodriguez-Evora M, Reyes R, Alvarez-Lorenzo C, et al. Bone regeneration induced by an in situ gel-forming poloxamine, bone morphogenetic protein-2 system[J]. J Biomed Nanotechnol, 2014, 10(6): 959–969. DOI:10.1166/jbn.2014.1801 |
| [11] |
邓启盼.
纳米脂质体应用于肿瘤研究的进展[J]. 国际病理科学与临床杂志, 2010, 30(6): 489–494.
DOI:10.3969/j.issn.1673-2588.2010.06.008 Deng QP. Progress in the applications of nanoliposomes in cancer research[J]. J Int Pathol Clin Med, 2010, 30(6): 489–494. DOI:10.3969/j.issn.1673-2588.2010.06.008 |
| [12] |
涂宗财, 马达, 王辉, 等.
薄膜-探头式超声法和注乙醇-DHPM法制备的鱼油脂质体的理化性质研究[J]. 食品工业科技, 2015, 36(14): 127–130.
DOI:10.13386/j.issn1002-0306.2015.14.017 Tu ZC, Ma D, Wang H, et al. Physicochemical properties of fish oil nanoliposomes made by thin-film rehydration-ultrasonic and ethanol injection-DHPM[J]. Sci Technol Food Ind, 2015, 36(14): 127–130. DOI:10.13386/j.issn1002-0306.2015.14.017 |
| [13] | Belhaj-Tayeb H, Briane D, Vergote J, et al. In vitro and in vivo study of 99Tcm-MIBI encapsulated in PEG-liposomes:a promising radiotracer for tumour imaging[J]. Eur J Nucl Med Mol Imaging, 2003, 30(4): 502–509. DOI:10.1007/s00259-002-1038-4 |
| [14] |
袁超, 张勇, 焦举, 等.
载雄激素受体三螺旋形成寡核苷酸PEG-PLGA纳米粒子的制备与应用[J]. 中山大学学报(医学科学版), 2008, 29(5): 602–605.
DOI:10.3321/j.issn:1672-3554.2008.05.022 Yuan C, Zhang Y, Jiao J, et al. Preparation and Primary Application of Androgen Receptor Triplex-forming Oligonucleotides Loaded PEG-PLGA Nanoparticles[J]. J Sun Yat-Sen Univ (Med Sci), 2008, 29(5): 602–605. DOI:10.3321/j.issn:1672-3554.2008.05.022 |
| [15] | Lee JH, Shao S, Cheng KT, et al. 99mTc-Labeled Porphyrin-Lipid Nanovesicles[J]. J Liposome Res, 2015, 25(2): 101–106. DOI:10.3109/08982104.2014.932379 |
| [16] |
赵颖, 张琳, 王澈.
抗肿瘤脂质体的制备及其靶向性研究进展[J]. 中国生化药物杂志, 2017, 37(1): 311–314.
DOI:10.3969/j.issn.1005-1678.2017.01.093 Zhao Y, Zhang L, Wang C. Advances in studies of anti-cancer liposomes with its preparation and targeting[J]. Chin J Biochem Pharm, 2017, 37(1): 311–314. DOI:10.3969/j.issn.1005-1678.2017.01.093 |
 2018, Vol. 42
2018, Vol. 42


