2. 610500, 成都医学院临床医学院
2. School of Clinical Medicine, Chengdu Medical College, Chengdu 610500, China
放射治疗(简称放疗)是恶性肿瘤重要的治疗手段,卵巢对放射线高度敏感,较低的剂量即可能导致卵巢早衰[1-2]。如何消除或减轻放疗对卵巢功能损伤的研究具有重要临床意义。相关研究及我们前期研究结果已证明,在放化疗前给予促性腺激素释放激素激动剂(gonadotropin releasing hormone agonist, GnRH-a)能够减少其对卵巢功能的损害[3-4]。但由于GnRH-a存在“点火效应”,因此在GnRH-a应用后约2周才可以进行放化疗,否则会使卵巢受到更严重的损害,这一缺点易导致治疗时机的延误,造成不良结果[5-6]。促性腺激素释放激素拮抗剂(gonadotropin releasing hormone antagonist,GnRH-ant)是促性腺激素释放激素(gonadotropin releasing hormone,GnRH)类似物家族中的拮抗剂,相比激动剂,它可快速抑制性腺轴和卵巢,且无明显“点火效应”[7]。但对于其能否对放疗中的卵巢起保护作用,目前国内外相关研究甚少。本研究拟采用大鼠盆腔照射模型,通过在放疗前应用GnRH-ant抑制卵巢功能,观察其对放疗所致卵巢功能损伤的保护作用,并对其防护作用机制展开研究。
1 材料与方法 1.1 实验动物及动情周期的判断雌性无特定病原级Wistar大鼠50只,鼠龄8~10周,体质量220~250 g,购自四川大学华西实验动物中心,饲养于无特定病原级动物房,人为控制光照周期(12 h明、12 h暗),控制室内温度在(25±1)℃,相对湿度保持在55%~65%,大鼠随意采食全价鼠饲料及清洁水。为了保证实验中大鼠处于同步动情周期,避免不同动情周期对实验结果的干扰,本实验采用阴道分泌物涂片法判断大鼠所处动情周期。具体操作方案:每日早晨7点刮取大鼠阴道分泌物,显微镜下观察分泌物特点,根据分泌物形态特点判断大鼠所处动情周期,每次实验均选用有正常动情周期且处于同步动情周期的大鼠。
1.2 主要试剂GnRH-ant注射用醋酸西曲瑞克(Cetrorelix,思则凯)购自瑞士雪兰诺大药厂。GnRH-a醋酸戈舍瑞林注射液(Goserelin,诺雷得)购自阿斯利康药业(中国)有限公司。大鼠黄体生成素(luteinizing hormone, LH)酶联免疫分析试剂盒购自上海科兴商贸有限公司。大鼠卵泡刺激素(follice-stimulating hormone,FSH)分析试剂盒(ELISA Kit)购自上海生工生物工程股份有限公司。大鼠雌二醇(estradiol,E2)分析试剂盒(ELISA Kit)购自上海晨易生物科技有限公司。大鼠抗缪勒管激素(anti-mullerian hormone,AMH)分析试剂盒(ELISA Kit)购自武汉伊莱瑞特生物科技股份有限公司。
1.3 大鼠的分组与给药取同步动情周期的雌性Wistar大鼠10只,采用随机数字表法将其分为GnRH-a组与GnRH-ant组,分别于大鼠动情期给予以下处理,GnRH-a组:醋酸戈舍瑞林注射液皮下注射0.25 mg(1次);GnRH-ant组:醋酸西曲瑞克5 μg溶于0.5 mL生理盐水皮下注射,每日1次,连续10 d。从第1天给药后大鼠每日经尾静脉采血,采用酶联免疫吸附法连续测定两组大鼠血清LH(15 d)和E2(16 d)的水平变化。
取同步动情周期的雌性Wistar大鼠40只,采用随机数字表法将大鼠分为对照组、GnRH-ant组、放疗组和GnRH-ant+放疗组。于动情期分别给予以下处理,对照组:皮下注射0.9%生理盐水0.5 mL;GnRH-ant组:醋酸西曲瑞克5 μg溶于0.5 mL生理盐水皮下注射(每日1次,连续10 d);放疗组:6 cm × 6 cm小野盆腔60Co照射200 cGy,1次;GnRH-ant+放疗组:醋酸西曲瑞克5 μg溶于0.5 mL生理盐水皮下注射,每日1次,连续注射4 d后行6 cm × 6 cm小野盆腔60Co照射200 cGy(1次),继续给药(连续6 d),共10 d。停药15 d后取血,检测血清FSH、E2和AMH的水平。采用颈椎脱臼法处死大鼠,解剖切取各组大鼠双侧卵巢,称取卵巢湿重。为了解GnRH-ant对卵巢抗辐射保护功能的主要作用阶段及具体作用机制,在实验终点时,将各组大鼠卵巢分别进行石蜡包埋处理,石蜡切片行苏木精-伊红染色法染色,分类计数卵巢内各级卵泡总数,评价卵巢功能的保护情况。
1.4 大鼠盆腔照射方法与技术因大鼠体型较小,无法行单独照射卵巢,故采用盆腔正方形射野进行卵巢所在区域照射。具体操作方法:腹腔注射7%水合氯醛1.5 mL,待大鼠麻醉后,取仰卧位,大鼠专用固定体架拉伸捆绑固定四肢,暴露大鼠腹部及盆腔;采用中国核动力研究所60Co远距离GWXG-80型治疗机,机架角0°,单前野垂直照射。为了确保组内放射治疗处理的一致性,需要在1个照射野内1次性对1只(共10只)小鼠并排同时进行照射,故将源皮距(SSD)80 cm修改为100 cm,并相应对百分深度剂量及其他放疗剂量相关参数进行了重新计算与测量,保证了小鼠受照剂量的准确性。射野上界为肋缘下,下界为肛门口,左右界开放,射野面积6 cm × 6 cm,处方深度根据既往解剖所得大鼠卵巢平均深度数据1 cm,处方剂量给予200 cGy,1次。
1.5 统计学分析使用SPSS 25.0统计软件对数据进行统计学分析。计量结果均采用均数±标准差(x ± s)表示,数据符合正态分布且方差齐,采用两组间比较独立样本t检验,多组间比较通过单因素方差分析并采用最小显著性差异法(LSD)。P<0.05表示差异有统计学意义。
2 结果 2.1 GnRH-a与GnRH-ant对卵巢功能抑制的对比由图 1可见,GnRH-a组在给药后LH水平先表现为一过性升高,6 d左右达最高峰[(37.70±7.50)IU/L],在第11天左右达到最大抑制状态[(0.37±1.12)IU/L];GnRH-ant组在给药后血清LH水平迅速下降,4 d左右即可达到最大抑制状态[(0.46±1.37)IU/L],停药后5 d(1个动情周期)左右,LH即可恢复治疗前水平[(15.20±4.26)IU/L],上述两组的血清LH水平变化有明显不同。
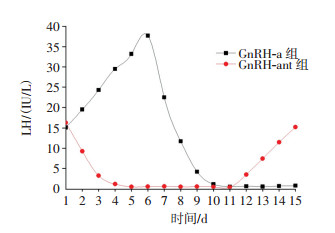
|
图 1 GnRH-a组与GnRH-ant组给药后大鼠血清LH水平的变化 Figure 1 Dynamic change of serum luteinizing hormone(LH) of the rats after administration of gonadotropin releasing hormone agonist(GnRH-a) and gonadotropin releasing hormone antagonist (GnRH-ant) group 图中,LH:黄体生成素;GnRH-a:促性腺激素释放激素激动剂;GnRH-ant:促性腺激素释放激素拮抗剂。 |
血清E2水平的变化滞后于LH的变化。由图 2可见,GnRH-ant组血清E2水平在5 d左右达最大抑制状态[(0.40±0.52)pg/mL],停药后5 d(1个动情周期)E2水平恢复到治疗前水平[(46.80±6.71)pg/mL];GnRH-a组在给药后E2的水平表现为一过性升高,7 d左右达最大值[(146.00±23.70)pg/mL],12 d左右达到最大抑制状态[(0.60±0.73)pg/mL]。GnRH-a组和GnRH-ant组的E2水平变化与LH的变化趋势相同。
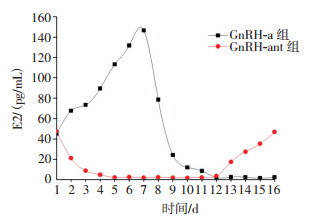
|
图 2 GnRH-a组与GnRH-ant组给药后大鼠血清E2水平的变化 Figure 2 Dynamic change of serum estradiol(E2) of the rats after administration of gonadotropin releasing hormone agonist(GnRH-a) and gonadotropin releasing hormone antagonist (GnRH-ant) group 图中,E2:雌二醇;GnRH-a:促性腺激素释放激素激动剂;GnRH-ant:促性腺激素释放激素拮抗剂。 |
经数据分析结果显示,注射醋酸西曲瑞克后大鼠卵巢功能迅速受到抑制,4 d前后即可达到最大抑制水平。因此,将大鼠卵巢照射时间确定在GnRH-ant组给药后第4天,并在照射后继续连续给药6 d。
2.2.2 各组大鼠卵巢外观及平均湿重的比较解剖各组大鼠,肉眼可见放疗组大鼠卵巢明显萎缩,表面呈暗红色且布满微小出血点,质地较硬;GnRH-ant+放疗组卵巢表面呈淡粉红色且无明显皱缩,质地柔软。称取各组大鼠双侧卵巢湿重,对照组[(64.3±13.5)mg]、GnRH-ant组[(59.7±11.2)mg]和GnRH-ant+放疗组[(58.3±9.1)mg]比较,差异均无统计学意义(t=-0.31~-1.16,均P>0.05);GnRH-ant+放疗组与放疗组[(37.8±7.1)mg]比较,卵巢湿重较高且差异有统计学意义(t=5.61,P=0.000);GnRH-ant组与对照组比较,在卵巢外观、形态、质地等方面无明显差异,GnRH-ant组卵巢湿重略小于对照组,但差异无统计学意义(t= 0.829,P=0.418)。
2.2.3 各组大鼠血清FSH、E2和AMH水平的变化在GnRH-ant组停药后第15天,测量各组大鼠血清FSH、E2和AMH水平,结果见表 1。放疗组在照射后卵巢功能受损,与对照组比较,血清E2的水平降低、FSH水平呈反馈性升高;GnRH-ant+放疗组的激素水平较对照组也表现为卵巢功能受损,即E2的水平降低和FSH的升高,但与放疗组相比,其E2水平较高、FSH水平较低,且差异均有统计学意义(t=8.64、7.75,均P=0.000)。除了E2及FSH这两个易受月经周期影响的指标外,在目前认为反映卵巢储备功能较稳定的指标AMH的测定中,GnRH-ant+放疗组与放疗组比较,AMH水平显著较高且差异有统计学意义(t=6.81,P=0.000)。
| 表1 醋酸西曲瑞克治疗后4组大鼠血清FSH、E2和AMH的水平(x ± s) Table 1 Levels of serum estradiol(E2), follice-stimulating hormone(FSH) and auti-mullerian hormone(AMH) in 4 groups after cetrorelix acetate treatment(x ± s) |
通过统计分析,我们发现GnRH-ant+放疗组与放疗组相比,生长卵泡和成熟卵泡的数量差异均无统计学意义(t=0.67~0.88,P>0.05);原始、初级卵泡的数量较高,且差异有统计学意义(t=4.42,P=0.000)。具体数据见表 2。
| 表2 4组大鼠各型卵泡的计数比较(x ± s) Table 2 Comparison of various types of follicular counts in rats of 4 groups (x ± s) |
放疗是诸多盆腔恶性肿瘤必要的治疗手段,放疗不但能根治肿瘤还能有效预防手术后复发,特别是对于女性患者的宫颈癌、内膜癌、直肠癌等。生殖性腺是对射线超敏的器官。如何在肿瘤放疗的同时减轻对卵巢功能的影响是亟待解决的问题[8]。
既往的研究曾发现青春期前的女性卵巢对外源性有害刺激较不敏感。这一特点提示科学家可人为制造这一状态,以期达到保护放化疗患者卵巢功能的目的[9]。而其主要使用的手段就是GnRH类似物,基于对垂体GnRH受体的不同作用,GnRH类似物包括GnRH-a和GnRH-ant。我们之前的研究结果表明,在放疗前应用GnRH-a诱导卵巢休眠,能减轻对卵巢功能的损伤,但是由于“点火效应”的存在,需要在使用GnRH-a约2周后方可开始放疗,这将会延误肿瘤治疗的时机[3]。在既往的研究中,研究者观察到了GnRH类似物中的拮抗剂可以快速、可逆地抑制促性腺激素的分泌,因此该药物多被用于辅助生殖医学[10]。在本研究中,我们对比了GnRH-ant和GnRH-a对大鼠卵巢相关激素的作用,结果发现,GnRH-ant对大鼠卵巢功能的抑制比GnRH-a更为迅速有效,4 d左右即可达到最大抑制状态,且没有GnRH-a给药后的短暂FSH与E2水平的升高,即所谓的“点火效应”,这一优点在临床中具有重要意义。这意味着,只要在放疗前通过简短的GnRH-ant预处理,就可以开始肿瘤的放化疗,而传统所使用的GnRH兴奋剂,如戈舍瑞林或亮丙瑞林等,则需在给药后近两周才能进行放疗,如果不按此时间进行将导致更为严重的卵巢功能损伤,因为应用GnRH-a后产生的点火效应将使照射后的卵巢变得更为敏感[11]。
在本研究中,我们观察到放疗组在放疗后卵巢湿重的显著减轻和间质纤维化,卵巢表面布满微小出血点;而在GnRH-ant+放疗组,这一情况明显好转,放疗后其E2水平显著高于放疗组,而FSH水平显著较低,提示其卵巢功能得到了较大程度的保护。目前公认、能较好地反映卵巢储备功能的是AMH水平,GnRH-ant+放疗组的AMH水平显著高于放疗组。以上提示放疗前通过GnRH-ant预处理可以对卵巢功能起到保护作用。卵巢功能的有效行使,虽然受FSH、LH和E2等相关激素的调控,但卵巢内现存卵泡数量才是卵巢储备功能的根本指标,尤其是今后具备向成熟卵泡发育的原始及初级卵泡数量。在卵巢分类计数中,GnRH-ant组的原始、初级卵泡数高于对照组,这说明GnRH-ant能够阻滞卵泡的发育。放疗组的卵巢呈现出明显的间质纤维化且卵巢中散布大量的早期闭锁卵泡,而在GnRH-ant+放疗组,保留了大量的原始、初级卵泡。这是卵巢在放疗损伤后恢复功能的物质基础。此外,由组织血液灌注情况决定的氧合水平也是决定放疗敏感性的一个重要因素,通常血供丰富的组织对放疗更为敏感[12]。我们观察到放疗组的卵巢表面呈暗红色,且较多的散在出血灶,表明曾有过一个血流大量灌注的过程,而GnRH-ant+放疗组的卵巢表面呈淡红色,有血流过度灌注的痕迹,我们推测GnRH-ant有可能通过调节LH水平,减少卵巢血供,进而降低其放射敏感性。
综上所述,本研究结果表明GnRH-ant能够较GnRH-a更快地对卵巢功能进行抑制,且无GnRH-a所致的“点火效应”。GnRH-ant能够通过将卵泡阻滞在对射线相对不敏感的原始、初级卵泡阶段,降低放射线对卵巢功能的损伤。但对这一过程中所涉及的分子生物学过程及其调控作用的关键时间节点,还有待进一步研究揭示。另外本研究也存在一些不足之处,由于大鼠动情周期与女性存在一定差别,本研究结论能否应用于人体,还有待进一步临床研究证实。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 谭燕负责实验方法的建立、实验的实施、数据的获取与分析;孙春堂负责研究命题的设计、体外数据的初步收集与分析、论文的撰写与审阅;颜高姝、范子煊、刁鹏、彭倩负责实验的实施、数据的分析;罗兴波负责实验动物的购买、饲养及动物模型的处理;王卫东负责方法学的指导、论文的审阅。
| [1] | Adriaens I, Smitz J, Jacquet P. The current knowledge on radiosensitivity of ovarian follicle development stages[J]. Hum Reprod Update, 2009, 15(3): 359–377. DOI:10.1093/humupd/dmn063 |
| [2] | Said RS, El-Demerdash E, Nada AS, et al. Resveratrol inhibits inflammatory signaling implicated in ionizing radiation-induced premature ovarian failure through antagonistic crosstalk between silencing information regulator 1 (SIRT1) and poly (ADP-ribose) polymerase 1 (PARP-1)[J]. Biochem Pharmacol, 2016, 103: 140–150. DOI:10.1016/j.bcp.2016.01.019 |
| [3] |
谭燕, 颜高姝, 刁鹏, 等.
促性腺激素释放激素激动剂对辐射所致大鼠卵巢功能损伤的防护作用研究[J]. 国际放射医学核医学杂志, 2017, 41(5): 314–320.
DOI:10.3760/cma.j.issn.1673-4114.2017.05.002 Tan Y, Yan GS, Diao P, et al. Protective effect of gonadotropin-releasing hormone agonist on ovarian functional impairment caused by radiation in rats[J]. Int J Radiat Med Nucl Med, 2017, 41(5): 314–320. DOI:10.3760/cma.j.issn.1673-4114.2017.05.002 |
| [4] | Del MastroL. Temporary ovarian suppression with goserelin and ovarian function protection in patients with breast cancer undergoing chemotherapy[J]. J Clin Oncol, 2011, 29(24): 3339–3340. DOI:10.1200/JCO.2011.36.9942 |
| [5] | Guenther V, Alkatout I, Junkers W, et al. Fertility Preservation in Female Patients with Breast Cancer-a Current Dverview[J]. Geburtshife FrauenheilkD, 2017, 77(10): 1088–1094. DOI:10.1055/s-0043-119543 |
| [6] | Moore HC, Unger JM, Phillips KA, et al. Goserelin for ovarian protection during breast-cancer adjuvant chemotherapy[J]. N Engl J Med, 2015, 372(10): 923–932. DOI:10.1056/NEJMoa1413204 |
| [7] | Baines E. GnRH antagonist protects ovarian function[J]. Lancet Oncol, 2007, 8(8): 675. |
| [8] | Lobo RA. Potential options for preservation of fertility in women[J]. N Engl J Med, 2005, 353(1): 64–73. DOI:10.1056/NEJMra043475 |
| [9] | Rodriguez-Wallberg K, Turan V, Munster P, et al. Can ovarian suppression with gonadotropin-releasing hormone analogs (GnRHa) preserve fertility in cancer patients?[J]. Ann Oncol, 2016, 27(2): 357. DOI:10.1093/annonc/mdv554 |
| [10] | Lambalk CB, Banga FR, Huirne JA, et al. GnRH antagonist versus long agonist protocols in IVF:a systematic review and meta-analysis accounting for patient type[J]. Hum Reprod Update, 2017, 23(5): 560–579. DOI:10.1093/humupd/dmx017 |
| [11] | Demeestere I, Brice P, Peccatori FA, et al. Gonadotropin-releasing hormone agonist for the prevention of chemotherapy-induced ovarian failure in patients with lymphoma:1-year follow-up of a prospective randomized trial[J]. J ClinOncol, 2013, 31(7): 903–909. DOI:10.1200/JCO.2012.42.8185 |
| [12] | Song G, Chen Y, Liang C, et al. Catalase-Loaded TaOxNanoshells as Bio-Nanoreactors Combining High-Z Element and Enzyme Delivery for Enhancing Radiotherapy[J]. Adv Mater, 2016, 28(33): 7143–7148. DOI:10.1002/adma.201602111 |
 2018, Vol. 42
2018, Vol. 42


