2. 510655 广州, 中山大学附属第六医院核医学科;
3. 510080 广州, 中山大学附属第一医院核医学科;
4. 510080 广州, 中山大学附属第一医院放疗科
2. Department of Nuclear Medicine, The Sixth Affiliated Hospital, Sun Yat-sen University, Guangzhou 510655, China;
3. Department of Nuclear Medicine, The First Affiliated Hospital, Sun Yat-sen University, Guangzhou 510080, China;
4. Department of Radiation Oncology, The First Affiliated Hospital, SunYat-sen University, Guangzhou 510080, China
近几十年来,原发性肝癌的全球发病率逐渐上升,早期发现和诊断对其治疗及预后至关重要。与大多数恶性肿瘤相比,肝癌的诊断可以完全依据影像学表现。然而,推荐用于病灶成像的增强CT或MRI的灵敏度较低,分别为76%和61%[1]。18F-FDG PET可为肝脏手术、移植和姑息治疗提供有价值的预后信息,但在肝细胞癌的诊断中作用有限[2-3]。乙酸盐和胆碱能显像剂对18F-FDG显像具有重要的互补作用[4]。虽然11C-乙酸盐的摄取机制尚不清楚,但最新研究发现大多数前列腺肿瘤脂肪酸合成代谢活跃,推测这是由于肿瘤中11C-乙酸盐摄取增加,即以乙酸盐为底物合成短链脂肪酸[5]。11C-乙酸盐在肝癌成像方面显示出很好的前景,但是11C的半衰期(20.4 min)短,限制了它的广泛应用。为此,开发了18F-氟乙酸(18F-fluoroacetic acid, 18F-FAC)作为11C-乙酸盐的替代物。18F-FAC的缺点在于其被骨骼大量吸收,放射性示踪剂的脱氟特性限制了它的使用[6-7]。因此,需要开发或寻找新的PET示踪剂以克服现有的缺点或补充现有的示踪剂。因此,我们制备了18F-氟丙酸(18F-fluoropropionic acid, 18F-FPA),探讨18F-FPA在人肝癌SK-Hep 1细胞中的摄取情况和在荷肝癌肿瘤模型中的显像效果,并对其摄取机制进行了初步探索。
1 材料与方法 1.1 试剂与仪器人肝癌SK-Hep 1细胞系来自中国科学院细胞库(上海),无特定病原体级雄性Bclb/c裸鼠,4~6周龄,体质量20~25 g,购自广州中山大学医学院实验动物中心。4,7,13,16,21,24-六氧-1,10-二氮双环[8.8.8]二十六烷(K222)购自法国ABX公司;乙腈和二甲基亚砜(DMSO)购自美国Aldrich公司;甲基-2-溴丙酸乙酯购自阿拉丁试剂(上海)有限公司;奥利司他(Orilistat)购自美国Sigma-Alrich公司;5-十四烷氧基-2-呋喃甲酸(5-Tetradecyloxy-2-furoic acid, TOFA)购自美国Cayman Chemical公司;其余试剂均为国产分析纯或化学纯。Sep Pak QMA、C18 plus柱购自美国Waters公司;micro PET/CT显像仪购自德国Bruker公司,由中山大学中山医学院实验平台提供。
1.2 细胞培养和动物模型的建立人肝癌SK-Hep 1细胞培养基使用DMEM,采用含10%胎牛血清,于37℃、5% CO2的细胞培养箱中培养。培养基每周例行更换3次,选择处于指数增长的肿瘤细胞用于实验。所有实验均在中山大学动物实验中心批准的方案下进行,常规消毒后每只Bclb/c裸鼠腋窝皮下注射5×106个/mL肿瘤细胞100 μL,其中含细胞培养悬液50 μL、基质胶50 μL。荷人肝癌SK-Hep 1小鼠在无特定病原体级环境中培养,食物充足。每周测量2次体质量和肿瘤体积。待肿瘤体积长到500~1000 mm3时进行实验。
1.3 18F-FPA的合成18F-FPA的合成是基于文献[8]和既往的合成方法。回旋加速器通过180(p,n)18F核反应生产得到18F离子,18F离子通过QMA柱俘获后用K222溶液淋洗到反应瓶中;利用氮气在116 ℃加热条件下除去溶剂;将甲基-2-溴丙酸乙酯加入含有[18F]KF/K222的反应瓶中,在密闭的反应管内加热至100 ℃并持续15 min。冷却后,用8 mL水将中间体挂在HLB柱子上。用2 mol/L的NaOH通过HLB固相萃取小柱,室温下水解5 min。用1 mL灭菌水通过HLB-Al2O3-SCX柱将产品洗至产品瓶中,调节pH值至中性或弱酸性,用生理盐水配成溶液通过0.22 μm无菌滤膜后使用。使用高效液相色谱测定18F-FPA的放射性化学纯度。
1.4 体外实验 1.4.1 细胞结合实验将人肝癌SK-Hep 1细胞悬液于实验前一天铺于24孔板中(1×107个/孔),将细胞培养基倒掉,用PBS清洗细胞2次,加入18F-FPA(约2 mL,0.074 MBq/孔),于37℃、5%CO2细胞培养箱分别孵育5、30、60、90和120 min后,用PBS冲洗细胞2次,再加入1 mol/L的NaOH 500 μL,裂解20 min,收集细胞裂解液,用γ计数仪测细胞放射性活度。结果以平均值±标准差表示,每次实验重复4次。
| $ 细胞摄取率 = \frac{细胞摄取剂量}{注入总剂量} \times 100\% $ |
将人肝癌SK-Hep 1细胞悬液接种于24孔板,于37℃、5%CO2培养箱中孵育1 d,将细胞培养基倒掉,用PBS清洗2次,然后将细胞悬液分为对照组和实验组,对照组加入200 μL PBS;实验组共分为5组,分别加入不同浓度梯度(25、50、100、200、400 μmol/L)的抑制剂奥利司他或TOFA 200 μL,孵育30 min后加入18F-FPA(约2 mL,0.074 MBq/孔),孵育60 min后用PBS冲洗细胞2次,用1 mol/L NaOH 500 μL,裂解20 min,收集细胞裂解液,用γ计数仪测细胞放射性活度。结果以平均值±标准差表示,每次实验重复4次。实验组得出的数据与对照组相比,观察在不同浓度的抑制剂条件下细胞对18F-FPA的摄取抑制情况。
1.5 荷人肝癌SK-Hep 1小鼠micro PET/CT显像将荷人肝癌SK-Hep 1小鼠禁食4 h,小鼠在注射放射性示踪剂前用2%戊巴比妥钠(40 mg/kg)麻醉,并在整个研究过程中保持麻醉状态,然后经尾静脉给予100~120 μL 18F-FPA溶液,约3.70~4.44 MBq。给药60 min后行全身microPET/CT显像。先行15 min的静态PET扫描,然后用CT扫描对病变部位进行校正和定位。同一只荷人肝癌SK-Hep 1小鼠,完成18F-FPA显像后放置24 h,在与18F-FPA同样的注射剂量、扫描条件下给小鼠尾静脉注射18F-FDG进行显像。使用Albira PET系统和PMOD 3.7版软件进行图像重建,由2名核医学科医师在肿瘤和肌肉组织上绘制ROI,获得肿瘤及组织器官的每克组织百分注射剂量率(ID%/g值),并对所获得的数据进行分析。
1.6 肿瘤组织苏木精-伊红法染色PET/CT显像完成后,处死荷人肝癌SK-Hep 1小鼠,分离肿瘤组织,用冷的PBS溶液冲洗细胞3次,部分肿瘤组织用4%甲醛溶液浸泡,然后用石蜡切片,每片厚5 μm,脱蜡、水化,苏木精染色5 min后伊红染色2 min,在光学显微镜下观察肿瘤细胞形态。
1.7 统计学分析应用SPSS18.0软件进行统计学分析。所有数据均用平均数±标准差(x±s)表示,计数数据符合正态分布且方差齐,18F-FPA和18F-FDG在肿瘤中的放射性摄取率的比较采用t检验。P<0.05表示差异有统计学意义。
2 结果 2.1 18F-FPA合成结果18F-FPA的合成在40 min内完成,经高效液相色谱分析测定,产物的放射性化学纯度>95%,比活度>37 GBq/μmol,合成最终产率为(45±2)%。
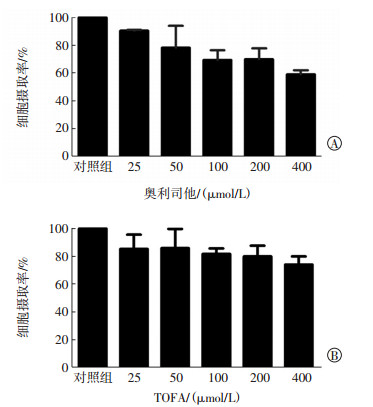
2.2 体外细胞实验结果18F-FPA在人肝癌SK-Hep 1细胞中的摄取率从5 min的(1.3±0.4)%上升到120 min的(4.6±0.2)%,30~60 min放射性摄取增加速度最快(图 1)。不同浓度梯度抑制剂奥利司他和TOFA分别对人肝癌SK-Hep 1细胞摄取抑制的实验结果见图 2。由图 2可见,随着抑制剂浓度的增高,人肝癌SK-Hep 1细胞的放射性摄取率表现出逐渐降低的趋势。与对照组比较,当抑制剂奥利司他和TOFA的浓度分别为400 μmol/L时,人肝癌SK-Hep 1细胞对18F-FPA的摄取率分别下降了(40.3±4.0)%和(26.0±6.0)%。

|
图 1 不同时间点人肝癌SK-Hep 1细胞对18F-氟丙酸的摄取率 Figure 1 The cellular uptake rate of 18F-fluoropropionic acid by human hepatocellular carcinoma SK-Hep 1 cells at different time points |
|
图 2 不同浓度抑制剂奥利司他和TOFA对18F-FPA在人肝癌SK-Hep 1细胞中的摄取抑制作用 Figure 2 Different concentrations of Orilistat and TOFA presented a inbibitive effect on of 18F-fluoropropionic acid in SK-Hep 1 cells 图中,A:SK-Hep 1细胞中不同浓度脂肪酸合成酶抑制剂奥利司他对18F-FPA的摄取抑制;B:SK-Hep 1细胞中不同浓度乙酰辅酶A合成酶抑制剂TOFA对18F-FPA的摄取抑制。FPA:氟丙酸;TOFA:5-十四烷氧基-2-呋喃甲酸。 |
荷人肝癌SK-Hep 1小鼠注射18F-FPA后行microPET/CT显像结果见图 3。由图 3可见,静脉注射18F-FPA 60 min后,microPET/CT显像显示在荷人肝癌SK-Hep 1小鼠中表现出快速且准确的肿瘤定位,相应的肿瘤摄取值为(8.15±0.13)%ID/g,肿瘤/肝放射性比值为1.63±0.26。18F-FDG PET/CT显像中,肿瘤摄取值为(3.25±0.50)%ID/g,肿瘤/肝放射性比值为1.09±0.21。18F-FPA的肿瘤/肝放射性比值高于18F-FDG,差异有统计学意义(t=4.055,P=0.047)。

|
图 3 18F-FDG和18F-FPA在荷人肝癌SK-Hep 1小鼠中的micro PET/CT显像图 Figure 3 micro PET/CT imaging of 18F-FDG and 18F-fluoropropionic acid in human hepatocellular carcinoma SK-Hep 1 mice 图中,红色箭头指向肿瘤部位;FDG:氟脱氧葡萄糖;FPA:氟丙酸;Min:最小;Max:最大;%ID/g:每克组织百分注射剂量率。 |
人肝癌SK-Hep 1细胞肿瘤组织病理图见图 4。图中可见大量异性细胞,证明成功建立了肿瘤动物模型。

|
图 4 人肝癌SK-Hep 1细胞肿瘤组织病理图(苏木精-伊红染色,×200) Figure 4 Histopathology of SK-Hep 1 tumor tissue(HE, ×200) |
物质代谢异常是恶性肿瘤的重要标志,除了已知的糖酵解外,恶性肿瘤会有脂质代谢紊乱的表现[9-10]。放射性核素标记的小分子,如葡萄糖、乙酸酯、FAC已被广泛用于各种肿瘤的检测,包括肝癌、前列腺癌和乳腺癌等[11-13]。18F-FDG PET可为肝脏手术、移植和姑息治疗提供有价值的预后信息,但其在肝癌诊断中的作用有限[16]。11C-乙酸酯和11C-胆碱PET对肝细胞肝癌的诊断有较高的灵敏度,在18F-FDG PET/CT中联合11C-乙酸酯和11C-胆碱显像可提高诊断原发性肝癌的整体灵敏度,但也存在一些缺点和局限性。本研究对短烷基羧酸18F-FPA进行了实验研究,结果表明,18F-FPA合成简便,产率高,是一种非常有前景的肿瘤PET显像剂。本研究结果与以往研究结果相符合[15-18]。
丙酸钠、钾和钙盐通常被广泛用于食品添加剂。代谢研究表明,丙酸可作为脂肪酸、糖原、氨基酸等合成的前体。有研究结果显示,丙酸可取代乙酸,成为心脏和肿瘤细胞首选的能量基质[18]。丙酸首先由线粒体丙酰基-辅酶A合成酶催化转变为丙酰基辅酶A,这是脂肪酸代谢的第一个共同步骤[19]。在本研究的抑制细胞实验中,我们推断18F-FPA可能有类似于18F-FAC的代谢机制,参与脂肪酸代谢。奥利司他和TOFA分别抑制脂肪酸合成酶、乙酰辅酶A羧化酶[20-22]。奥利司他可以特异性地抑制脂肪酸合成酶,它对不同的肿瘤细胞的增殖有潜在的抑制作用,并可抑制肿瘤的生长[23-25]。TOFA对肝细胞、大鼠肝脏或雄性大鼠肝脏的脂肪酸合成有抑制作用,降低内源性脂肪酸从而对细胞膜磷脂组分产生影响。已有研究证明,TOFA对肺癌、结肠癌和前列腺癌细胞均有细胞毒性[26-27]。在本研究中,脂肪酸合成关键酶抑制剂能够不同程度地抑制18F-FPA在人肝癌SK-Hep 1细胞中的摄取,证明18F-FPA的摄取参与脂肪酸代谢途径。
本研究中,18F-FPA的体外细胞摄取及荷人肝癌SK-Hep 1小鼠PET/CT显像结果表明,18F-FPA在人肝癌SK-Hep 1细胞中具有较高地摄取,且可清晰地显示肿瘤。与传统显像剂18F-FDG相比,18F-FPA具有更好的显像效果,是一种具有前景的肿瘤PET/CT显像剂。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 赵竞负责现场试验、数据的获取与分析、论文的撰写;张占文、马慧负责现场试验、数据的分析;聂大红、蒋宁一负责论文的审阅;刘生、唐刚华负责命题的提出、方法的建立、论文的审阅。
| [1] | Sun H, Song T. Hepatocellular carcinoma:Advances in diagnostic imaging[J]. Drug Discov Ther, 2015, 9(5): 310–318. DOI:10.5582/ddt.2015.01058 |
| [2] | Haug AR. Imaging of primary liver tumors with positron-emission tomography[J]. Q J Nucl Med Mol Imaging, 2017, 61(3): 292–300. DOI:10.1053/j.sult.2012.11.006 |
| [3] | Sun DW, An L, Wei F, et al. Prognostic significance of parameters from pretreatment 18F-FDG PET in hepatocellular carcinoma:a meta-analysis[J]. Abdom Radiol (NY), 2016, 41(1): 33–41. DOI:10.1007/s00261-015-0603-9 |
| [4] | Deford-Watts L M, Mintz A, Kridel S J. The potential of 11C-acetate PET for monitoring the Fatty acid synthesis pathway in Tumors[J]. Curr Pharm Biotechnol, 2013, 14(3): 300–312. DOI:10.2174/1389201011314030006 |
| [5] | Grassi I, Nanni C, Allegri V, et al. The clinical use of PET with 11C-acetate[J]. Am J Nucl Med Mol Imaging, 2012, 2(1): 33–47. |
| [6] | Schiepers C, Huang SC, Dahlbom M. Dynamic PET/CT with 11C-acetate in prostate cancer[J]. J Nucl Med, 2013, 54(2): 326. DOI:10.2967/jnumed.112.112532 |
| [7] | Ponde DE, Dence CS, Oyama N, et al. 18F-fluoroacetate:a potential acetate analog for prostate tumor imaging-in vivo evaluation of 18F-fluoroacetate versus 11C-acetate[J]. J Nucl Med, 2007, 48(3): 420–428. |
| [8] | Wang H, Tang G, Hu K, et al. Comparison of three 18F-labeled carboxylic acids with 18F-FDG of the differentiation tumor from inflammation in model mice[J]. BMC Med Imaging, 2016, 16: 2. DOI:10.1186/s12880-016-0110-7 |
| [9] | Menendez JA, Lupu R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis[J]. Nat Rev Cancer, 2007, 7(10): 763–777. DOI:10.1038/nrc2222 |
| [10] | Calvisi DF, Wang C, Ho C, et al. Increased lipogenesis, induced by AKT-mTORC1-RPS6 signaling, promotes development of human hepatocellular carcinoma[J]. Gastroenterology, 2011, 140(3): 1071–1083. DOI:10.1053/j.gastro.2010.12.006 |
| [11] | Brogsitter C, Zophel K, Kotzerke J. 18F-Choline, 11C-choline and 11C-acetate PET/CT:comparative analysis for imaging prostate cancer patients[J]. Eur J Nucl Med Mol Imaging, 2013, 40(Suppl 1): S18–27. DOI:10.1007/s00259-013-2358-2 |
| [12] | Yamamoto Y, Nishiyama Y, Kameyama R, et al. Detection of hepatocellular carcinoma using 11C-choline PET:comparison with 18F-FDG PET[J]. J Nucl Med, 2008, 49(8): 1245–1248. DOI:10.2967/jnumed.108.052639 |
| [13] | Yoshii Y, Furukawa T, Oyama N, et al. Fatty acid synthase is a key target in multiple essential tumor functions of prostate cancer: uptake of radiolabeled acetate as a predictor of the targeted therapy outcome[J/OL]. Plos one, 2013, 8 (5): e64570[2018-05-22]. https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0064570. DOI:10.1371/journal.pone.0064570. |
| [14] | Kornberg A, Küpper B, Thrum K, et al. Increased 18F-FDG Uptake of hepatocellular carcinoma on positron emission tomography independently predicts tumor recurrence in liver transplant patients[J]. Transplantat Proc, 2009, 41(6): 2561–2563. DOI:10.1016/j.transproceed.2009.06.115 |
| [15] | Dang YH, Cai J, Li X, et al. Imaging Potential and Biodistribution in vivo of 2-[18F]Fluoropropionic Acid in Breast Cancer-bearing Mice[J]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao, 2015, 37(3): 320–324. DOI:10.3881/j.issn.1000-503X.2015.03.014 |
| [16] | Pillarsetty N, Punzalan B, Larson SM. 2-18F-Fluoropropionic Acid as a PET Imaging Agent for Prostate Cancer[J]. J Nucl Med, 2009, 50(10): 1709–1714. DOI:10.2967/jnumed.109.064212 |
| [17] |
张占文, 胡平, 唐刚华.
肿瘤短链脂肪酸代谢PET显像剂研究进展[J]. 国际放射医学核医学杂志, 2017, 41(6): 430–436.
DOI:10.3760/cma.j.issn.1673-4114.2017.06.009 Zhang ZW, Hu P, Tang GH. Progress on short-chain fatty acid tumor molecular probes for PET imaging[J]. Int J Radiat Med Nucl Med, 2017, 41(6): 430–436. DOI:10.3760/cma.j.issn.1673-4114.2017.06.009 |
| [18] | Wehrle JP, Ng CE, McGovern KA, et al. Metabolism of alternative substrates and the bioenergetic status of EMT6 tumor cell spheroids[J]. NMR Biomed, 2000, 13(6): 349–360. DOI:10.1002/ijc.23835 |
| [19] | Ricks CA, Cook RM. Regulation of volatile fatty acid uptake by mitochondrial acyl CoA synthetases of bovine liver[J]. J Dairy Sci, 1981, 64(12): 2324–2335. DOI:10.3168/jds.S0022-0302(81)82854-8 |
| [20] | Carvalho MA, Zecchin KG, Seguin F, et al. Fatty acid synthase inhibition with Orlistat promotes apoptosis and reduces cell growth and lymph node metastasis in a mouse melanoma model[J]. Int J Cancer, 2008, 123(11): 2557–2565. DOI:10.1002/IJC.23835 |
| [21] | Wysham WZ, Roque DR, Han J, et al. Effects of Fatty Acid Synthase Inhibition by Orlistat on Proliferation of Endometrial Cancer Cell Lines[J]. Target Oncol, 2016, 11(6): 763–769. DOI:10.1007/s11523-016-0442-9 |
| [22] | Ricks CA, Cook RM. Regulation of volatile fatty acid uptake by mitochondrial acyl CoA synthetases of bovine liver[J]. J Dairy Sci, 1981, 64(12): 2324–2335. DOI:10.3168/jds.S0022-0302(81)82854-8 |
| [23] | Wysham WZ, Roque DR, Han J, et al. Effects of Fatty Acid Synthase Inhibition by Orlistat on Proliferation of Endometrial Cancer Cell Lines[J]. Target Oncol, 2016, 11(6): 763–769. DOI:10.1007/s11523-016-0442-9 |
| [24] | Xiao X, Liu H, Li X. Orlistat treatment induces apoptosis and arrests cell cycle in HSC-3 oral cancer cells[J]. Microb Pathog, 2017, 112: 15–19. DOI:10.1016/j.micpath.2017.09.001 |
| [25] | Sokolowska E, Presler M, Goyke E, et al. Orlistat Reduces Proliferation and Enhances Apoptosis in Human Pancreatic Cancer Cells (PANC-1)[J]. Anticancer Res, 2017, 37(11): 6321–6327. DOI:10.21873/anticanres.12083 |
| [26] | Li S, Qiu L, Wu B, et al. TOFA suppresses ovarian cancer cell growth in vitro and in vivo[J]. Mol Med Rep, 2013, 8(2): 373–378. DOI:10.3892/mmr.2013.1505 |
| [27] | Guseva NV, Rokhlin OW, Glover RA, et al. TOFA (5-tetradecyl-oxy-2-furoic acid) reduces fatty acid synthesis, inhibits expression of AR, neuropilin-1 and Mcl-1 and kills prostate cancer cells independent of p53 status[J]. Cancer Biol Ther, 2011, 12(1): 80–85. DOI:10.4161/cbt.12.1.15721 |
 2018, Vol. 42
2018, Vol. 42


