2. 350014 福州, 福建省肿瘤医院, 福建医科大学附属肿瘤医院放疗科
2. Department of Radiation Oncology, Fujian Cancer Hospital, Fujian Medical University Cancer Hospital, Fuzhou 350014, China
原发性中枢神经系统肿瘤中最常见的是脑胶质瘤,当前治疗的主要方式为手术、放疗及放化疗的联合治疗[1]。复发性脑胶质瘤患者的预后极差,以复发性胶质母细胞瘤为例,平均生存期为14.5个月[2]。18F-FDG PET/CT在预测复发脑胶质瘤患者预后中具有一定的价值[3]。但是,18F-FDG在正常脑组织中有较高本底,18F-FDG显像很难准确勾画肿瘤的边界和浸润范围,一些炎性病变会导致18F-FDG非特异性的摄取,限制了其在脑肿瘤中的应用。18F-脱氧胸腺嘧啶核苷(fluorothymidine, FLT)主要用来评估恶性肿瘤的增殖活性,且正常脑组织对18F-FLT的摄取非常低,因此18F-FLT是一种理想的脑肿瘤显像剂。本研究旨在分析18F-FLT PET/CT显像中的肿瘤增殖体积(proliferation volume,PV),18F-FLT、18F-FDG PET/CT显像中肿瘤的SUVmax与正常脑组织的平均标准化摄取值(average standardized uptake value, SUVmean)的比值(用“T/N”表示)及其他相关临床因素对复发脑胶质瘤患者的预后价值。
1 资料与方法 1.1 一般资料回顾性分析2012年1月至2016年1月在本院行18F-FDG与18F-FLT PET/CT显像的脑胶质瘤患者资料,所有确诊为首次复发且符合以下条件的患者被纳入本研究:①病理结果为脑胶质瘤;②复发由病理结果证实,或多次MRI检查结合其他临床资料证实;③ Karnofsky(卡氏,KPS,百分法)评分≥60分。排除标准:如果治疗相关的良性病变(包括手术后瘢痕、纤维增生、放射性水肿反应、放射性脑坏死等)不能排除,则该患者将被排除。
确诊为复发的脑胶质瘤患者有20例,其中男性13例、女性7例,年龄为12~73岁,平均年龄(45.65±15.50)岁。患者检查之后根据临床情况接受不同的治疗,对所有的患者进行随访(无失访)直至其死亡。总生存时间(OS)定义为从18F-FDG PET/CT扫描到患者死亡的时间。
1.2 显像方法由日本住友重工公司的HM-10回旋加速器生产的18F,经日本住友重工公司的F300E自动合成模块合成的18F-FDG和18F-FLT,放化纯度均>95%。患者禁食6 h以上,血糖控制在10.0 mmol/L以下,按患者体重静脉注射18F-FDG 4.44 MBq/kg,在暗室平卧60 min,排尿后行PET/CT脑显像。显像仪器为荷兰Philips公司生产的GEMINI TF Ⅱ PET/CT仪。显像条件:三维PET扫描,采集一个床位(6 min/床位),矩阵为128×128;CT扫描为视野(FOV)250 mm、电压140 kV、电流250 mA、螺距0.75、单圈旋转时间0.8 s。隔日行18F-FLT显像,患者无需禁食,其余显像条件同18F-FDG PET/CT显像。
1.3 图像分析图像重建采用滤波反投影法。PET/CT融合图像、PET图像和CT图像都通过软件进行帧对帧对比分析。18F-FDG与18F-FLT浓聚灶均由2位5年以上PET/CT诊断经验的核医学科医师目测确认,如有争议则组织科室讨论确定。手动勾画ROI,由计算机自动生成肿瘤的SUVmax,同时在对侧未受累的正常脑组织区域勾画直径为1.0 cm的圆形ROI作为正常对照组织,如果因为肿瘤的位置导致在对侧大脑半球无法勾画正常脑组织,则在18F-FDG或18F-FLT摄取最高的层面上选取完整的脑组织进行勾画,并计算T/N。在复发病灶的浓聚区域范围内以40% SUVmax为阈值,软件自动计算出PV。在18F-FLT PET/CT图像上测量复发肿瘤的T/NFLT、最大直径、PV;在18F-FDG PET/CT图像上测量复发肿瘤的T/NFDG。所有数据由同一位核医学医师测量和记录。
1.4 统计学分析应用IBM SPSS 20.0软件进行统计学分析。通过受试者工作特征曲线(receiver operating characteristic curve,ROC)分析PV、肿瘤最大直径、T/NFDG、T/NFLT预测肿瘤复发(患者为长生存期)的最佳阈值,并评价预测效能。采用Kaplan-Meier分析法进行生存分析,组间比较采用log-rank检验。采用比例风险回归模型(proportional hazards model,Cox模型)对PV、最大直径、T/NFDG、T/NFLT及其他相关临床因素与预后关系进行单因素和多因素分析。P < 0.05表示差异有统计学意义。
2 结果 2.1 病理、PET/CT及随访的结果首次手术病理结果为世界卫生组织(world health organization,WHO)Ⅱ级的有7例,其中星型细胞瘤6例、室管膜瘤1例;首次手术病理结果为WHO Ⅲ、Ⅳ级的有13例,其中Ⅲ级3例(均为间变性少突胶质细胞瘤)、Ⅳ级10例(均为胶质母细胞瘤)。18F-FDG PET/CT图像上测量的T/NFDG为0.404~3.882(1.720±0.950)。18F-FLT PET/CT图像上测量的T/NFLT为2.40~24.00(9.00±4.60),肿瘤最大直径为1.10~5.80(2.87±1.10)cm,PV为1.35~33.67(13.30±7.48)cm3。随访截至2016年12月,20例患者全部死亡。患者的中位生存期为7个月,>7个月界定为长生存期,≤7个月界定为短生存期。其他一般资料见表 1。
| 表1 20例复发脑胶质瘤患者的一般特征 Table 1 Characteristics of 20 patients with recurrent gliomas |
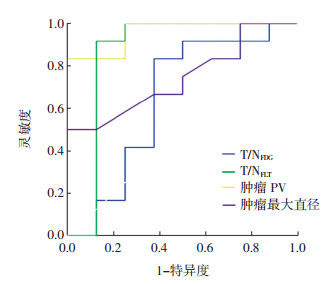
不同因素预测复发脑胶质瘤患者为长生存期的ROC曲线见图 1。PV的最佳阈值为12.565 cm3,对应的灵敏度为83.300%、特异度为100%,ROC曲线下面积(area under roc curve,AUC)为0.958(95%CI:0.879~1.000);T/NFLT的最佳阈值为7.752,对应的灵敏度为91.700%、特异度为87.500%、AUC为0.865(95%CI:0.636~1.000);最大直径的最佳阈值为2.800 cm,对应的灵敏度为58.300%、特异度为75.000%、AUC为0.745(95%CI:0.529~0.961);T/NFDG的最佳阈值为1.192,对应的灵敏度为83.300%、特异度为62.500%、AUC为0.646(95%CI:0.365~0.926)。
|
图 1 不同因素预测复发脑胶质瘤患者为长生存期的ROC曲线 Figure 1 Receiver operating characteristic curve of the factors that indicated long survival time 图中,T/N:肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值;FLT:脱氧胸腺嘧啶核苷;FDG:氟脱氧葡萄糖;PV:增殖体积;ROC:受试者工作特征曲线。 |
不同PV(< 12.565 cm3与≥12.565 cm3)、T/NFLT(< 7.752与≥7.752)、最大直径(< 2.800 cm与≥2.800 cm)、T/NFDG(< 1.192与≥1.192)、首次手术病理结果(Ⅱ级与Ⅲ、Ⅵ)间的生存结果差异均有统计学意义(χ2=12.587、12.219、4.285、5.955、6.787,均P < 0.05);不同年龄(< 52岁与≥52岁)与性别组间的生存结果差异均无统计学意义(χ2=1.064、0.611,均P>0.05)。
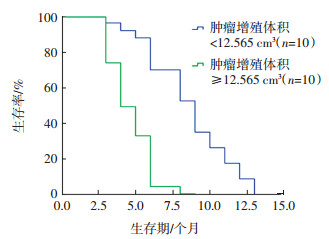
2.4 Cox模型单因素分析及多因素分析结果Cox模型单因素分析结果提示,PV、T/NFLT、T/NFDG、首次手术病理结果与20例复发脑胶质瘤的生存期相关,最大直径、患者的年龄、性别对20例复发脑胶质瘤的生存期没有影响(表 2)。应用Cox模型对全部20例复发脑胶质瘤的PV、T/NFLT、T/NFDG、首次病理等预后相关因子进行多因素分析,结果显示PV是本组20例复发脑胶质瘤患者预后的独立影响因素,危险比为0.208(95%CI:0.076~0.953,P=0.012),生存曲线分析也显示PV < 12.565 cm3的10例患者生存时间明显高于PV≥12.565 cm3的10例患者(图 2);而T/NFLT、T/NFDG和首次病理结果均不能作为独立预后因素,危险比分别为4.947(95%CI:0.727~33.644)、1.837(95% CI:0.576~5.853)和2.335(95%CI:0.558~9.764),P值分别为0.102、0.304和0.245(均>0.05)。
| 表2 影响20例复发脑胶质瘤患者预后的Cox模型单因素分析 Table 2 Cox single-factor analyses of twenty patients with recurrent glioma |
|
图 2 20例复发脑胶质瘤患者Cox模型多因素分析生存曲线 Figure 2 Cox multi-factor analyses survivorship curve of twenty patients with recurrent glioma |
有研究结果显示,18F-FLT PET/CT显像中的T/NFLT与脑胶质瘤预后显著相关[4-5]。也有研究结果提示,高级别胶质瘤的T/NFLT明显高于低级别胶质瘤的T/NFLT[6]。这证明T/NFLT是一个反映胶质瘤患者肿瘤细胞增殖的可靠参数。本研究结果中,仅Cox模型单因素分析结果提示T/NFLT和复发脑胶质瘤患者的预后显著相关,而多因素分析结果提示T/NFLT不是独立预后因素。在脑胶质瘤的治疗中,尤其是综合治疗后复发的脑胶质瘤存在异质性,T/NFLT只能反映某一截面肿瘤的增殖水平,而不是肿瘤整体的增殖水平。这可能是T/NFLT不能作为复发脑胶质瘤患者独立预后因素的原因。
PV代表了肿瘤中具有较高增殖活性的部分,同时包含了增殖因素和解剖体积因素。因此可以推测,PV是一个可靠的代表患者肿瘤负荷的生物标志。国外的研究结果显示,18F-FLT PET对复发恶性脑胶质瘤患者生存的预测有较高的价值[7-8]。Idema等[9]研究结果表明,18F-FLT PET/CT显像得出的肿瘤PV是原发性恶性脑胶质瘤患者独立的预后因素,其预测能力强于其他已知的临床因素。本研究结果也显示,PV < 12.565 cm3的10例患者生存时间明显高于PV≥12.565 cm3的10例患者。因此提示PV大的复发恶性脑胶质瘤与PV小的复发恶性脑胶质瘤相比,可能需要更积极的治疗和更密切的随访。
18F-FDG PET/CT显像中的代谢功能参数,在预测肺癌、食管癌、宫颈癌、淋巴瘤等肿瘤的预后中有较高的价值[10-13]。也有研究结果显示,18F-FDG PET能够预测高级别复发脑胶质瘤的预后[14]。本研究结果也提示,T/NFDG < 1.192患者的生存期显著高于T/NFDG≥1.192的患者。由于正常脑皮质对18F-FDG的高摄取,使得18F-FDG PET很难准确勾画肿瘤的边界和浸润范围,难以准确计算肿瘤的代谢体积,而且一些炎性病变尤其是肉芽肿性病变导致FDG非肿瘤性的摄取增加,也导致肿瘤的代谢体积很难真正体现肿瘤的代谢活性,这些方面都限制了18F-FDG PET在脑胶质瘤中的应用。
病理分级通常被认为是恶性胶质瘤的一个重要预后因素。而我们的研究中,原发肿瘤的病理分级在Cox模型单因素分析中与预后相关,但是在多因素分析中不是一个独立预后因素。因为复发脑胶质瘤患者的一般情况相对较差,得到所有患者复发时的病理诊断结果几乎不可能,因此我们采用第一次获得的病理结果进行分级,这有可能低估了一部分患者复发时的病理分级。因为部分WHO低级别的胶质瘤,复发时会转化成WHO更高级别的胶质瘤。
我们的研究存在一定的不足:①研究纳入的病例相对较少,降低了研究结果的说服力;②入组患者在PET/CT扫描后接受了不同的治疗,而且恶性胶质瘤复发后的治疗方式很难统一,我们没有调整PET/CT扫描后治疗方式对生存期的影响;③为了避免不同复发次数对生存期的影响,本研究仅纳入了初次复发的脑胶质瘤患者,但是在实际临床工作中,相当一部分的脑胶质瘤患者都会有多次复发。18F-FLT PET/CT显像得出的PV在多次复发的脑胶质瘤患者预后中的价值仍需进一步研究。
综上所述,18F-FLT PET/CT显像是一种无创的影像学技术,可以在体外监测复发恶性脑胶质瘤的增殖活性,并计算恶性复发脑胶质瘤的肿瘤PV。18F-FLT PET/CT显像得出的肿瘤PV是复发恶性脑胶质瘤的独立预后因素。临床医师可以通过18F-FLT PET/CT显像来预测复发恶性脑胶质瘤的生存期,指导个体化治疗决策的制定,对于肿瘤PV大的患者,给予更积极的治疗和更密切的随访以提高患者的生存期。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘道佳负责命题的提出、设计和论文的撰写;吴君心负责数据的提供、论文的修改;唐明灯负责论文的审阅;林端瑜负责图像处理与数据分析;张杰平、李生栩负责资料的收集;蔡志华负责图像的采集;吕清湖负责资料的收集。
| [1] |
刘道佳, 唐明灯, 林端瑜, 等.
18F-FDG与18F-FLT PET/CT诊断脑胶质瘤综合治疗后复发的对比研究[J]. 中华核医学与分子影像杂志, 2017, 37(4): 198–201.
DOI:10.3760/cma.j.issn.2095-2848.2017.04.002 Liu DJ, Tang MD, Lin DY, et al. Comparison on the diagnostic values of 18F-FDG and 18F-FLT PET/CT in patients with suspicious recurrence of glioma after multimodal treatment[J]. Chin J Nucl Med Mol Imaging, 2017, 37(4): 198–201. DOI:10.3760/cma.j.issn.2095-2848.2017.04.002 |
| [2] | Kamiya-Matsuoka C, Gilbert MR. Treating recurrent glioblastoma:an update[J]. CNS Oncol, 2015, 4(2): 91–104. DOI:10.2217/cns.14.55 |
| [3] | Santra A, Kumar R, Sharma P, et al. F-18 FDG PET-CT for predicting survival in patients with recurrent glioma:a prospective study[J]. Neuroradiology, 2011, 53(12): 1017–1024. DOI:10.1007/s00234-011-0898-3 |
| [4] | Thiele F, Ehmer J, Piroth MD, et al. The quantification of dynamic FET PET imaging and correlation with the clinical outcome in patients with glioblastoma[J]. Phys Med Biol, 2009, 54(18): 5525–5539. DOI:10.1088/0031-9155/54/18/012 |
| [5] | Karunanithi S, Sharma P, Kumar A, et al. Can 18F-FDOPA PET/CT predict survival in patients with suspected recurrent glioma? A prospective study[J]. Eur J Radiol, 2014, 83(1): 219–225. DOI:10.1016/j.ejrad.2013.09.004 |
| [6] | Yamamoto Y, Ono Y, Aga F, et al. Correlation of 18F-FLT uptake with tumor grade and Ki-67 immunohistochemistry in patients with newly diagnosed and recurrent gliomas[J]. J Nucl Med, 2012, 53(12): 1911–1915. DOI:10.2967/jnumed.112.104729 |
| [7] | Schwarzenberg J, Czernin J, Cloughesy TF, et al. 3'-deoxy-3'-18F-fluorothymidine PET and MRI for early survival predictions in patients with recurrent malignant glioma treated with bevacizumab[J]. J Nucl Med, 2012, 53(1): 29–36. DOI:10.2967/jnumed.111.092387 |
| [8] | Schiepers C, Dahlbom M, Chen W, et al. Kinetics of 3'-deoxy-3'-18F-fluorothymidine during treatment monitoring of recurrent high-grade glioma[J]. J Nucl Med, 2010, 51(5): 720–727. DOI:10.2967/jnumed.109068361 |
| [9] | Idema AJ, Hoffmann AL, Boogaarts HD, et al. 3'-Deoxy-3'-18F-fluorothymidine PET-derived proliferative volume predicts overall survival in high-grade glioma patients[J]. J Nucl Med, 2012, 53(12): 1904–1910. DOI:10.2967/jnumed.112.105544 |
| [10] |
董烨, 吴湖炳, 王全师, 等.
18F-FDG PET/CT多次显像在监测和预测非小细胞肺癌术后复发和转移中的价值[J]. 中华核医学与分子影像学杂志, 2014, 34(2): 81–85.
DOI:10.3760/cma.j.issn.2095-2848.2014.02.001 Dong Y, Wu HB, Wang QS, et al. Prediction of postoperative recurrence and metastasis with 18F-FDG PET/CT in patients with non-small cell lung cancer[J]. Chin J Nucl Med Mol Imaging, 2014, 34(2): 81–85. DOI:10.3760/cma.j.issn.2095-2848.2014.02.001 |
| [11] |
谢彦婷, 郑容.
18F-FDG PET/CT在食管癌放疗中的应用[J]. 国际放射医学核医学杂志, 2013, 37(1): 42–46.
DOI:10.3760/cma.j.issn.1673-4114.2013.01.012 Xie YT, Zheng R. The application of 18F-FDG PET/CT in the radiotherapy of esophageal cancer[J]. Int J Radiat Med Nucl Med, 2013, 37(1): 42–46. DOI:10.3760/cma.j.issn.1673-4114.2013.01.012 |
| [12] |
陈丹丹, 吴湖炳, 王全师, 等.
18F-FDG PET/CT在复发宫颈癌疗效评价及预后预测中的价值[J]. 中华核医学与分子影像学杂志, 2015, 35(3): 168–172.
DOI:10.3760/cma.j.issn.2095-2848.2015.03.003 Chen DD, Wu HB, Wang QS, et al. Value of 18F-FDG PET/CT in the evaluation of treatment response and prognosis for patients with recurrent uterine cervical cancer[J]. Chin J Nucl Med Mol Imaging, 2015, 35(3): 168–172. DOI:10.3760/cma.j.issn.2095-2848.2015.03.003 |
| [13] |
戴云秀, 杨光杰, 王振光, 等.
18F-FDG PET/CT基线SUVmax在滤泡性淋巴瘤侵袭性、分期评价中的价值及其与中期疗效的相关性研究[J]. 国际放射医学核医学杂志, 2018, 42(2): 104–110.
DOI:10.3760/cma.j.issn.1673-4114.2018.02.002 Dai YX, Yang GJ, Wang ZG, et al. Evaluation of invasiveness, staging, and correlation with interim therapeutic response based on baseline 18F-FDG PET/CT SUVmax in patients with follicular lymphoma[J]. Int J Radiat Med Nucl Med, 2018, 42(2): 104–110. DOI:10.3760/cma.j.issn.1673-4114.2018.02.002 |
| [14] | Colavolpe C, Chinot O, Metellus P, et al. FDG-PET predicts survival in recurrent high-grade gliomas treated with bevacizumab and irinotecan[J]. Neuro Oncol, 2012, 14(5): 649–657. DOI:10.1093/neuonc/nos012 |
 2018, Vol. 42
2018, Vol. 42


