男患儿,12岁,半年内胸痛间断发作4次,抗炎治疗后好转。就诊20 d前发热37.4~38.5℃,抗炎治疗效果不明显。实验室检查结果:神经元特异性烯醇化酶为(neuron-specific enolase,NSE)23.59 μg/L(0~15.2 μg/L),甲胎蛋白(-),β-人绒毛膜促性腺激素(-);红细胞计数为4.15×1012/L[(4.0~4.5)×1012/L],血红蛋白为103 g/L(120~140 g/L),白细胞计数为9.24×109/L[(8.00~10.00)×109/L],中性粒细胞绝对值为5.69×109/L[(1.80~6.30)×109/L],淋巴细胞绝对值为2.52×109/L[(1.10~3.20)×109/L],单核细胞绝对值为0.94×109/L([0.10~0.60)×109/L],C-反应蛋白为31.8 mg/L(0~8.0 mg/L),乳酸脱氢酶为466 U/L(0~248 U/L),β2微球蛋白(-)。外院CT示纵隔占位。现发热、头晕、胸闷、乏力。
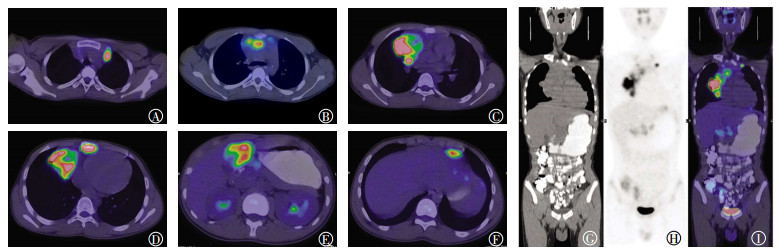
2 PET/CT影像学表现由图 1可见,前纵隔见不规则肿块,以右侧为著,CT值为38 HU,内见多发钙化,边界欠清,大小约7.3 cm×6.0 cm×12.3 cm,PET图像显示异常放射性浓聚,SUVmax=18.2。左侧最上纵隔及内乳区、腔静脉前、右心膈角、心包前、左前肋膈角多发结节,CT值为26 HU,边界欠清,PET图像显示异常放射性浓聚,SUVmax=6.6,大者最大层面约1.8 cm×1.7 cm。肝多发低密度灶,CT值为40 HU,边界欠清,PET显示异常放射性浓聚,SUVmax=13.1,大者最大层面约4.8 cm×3.7 cm。胸骨骨质破坏,周围见软组织肿块,最大层面约3.6 cm×2.2 cm,PET显示异常放射性浓聚,SUVmax=15.6。
|
图 1 B3型胸腺瘤患儿(男性,12岁)18F-FDG PET/CT图图中,A~F:病灶位置轴位PET/CT融合图,依次为内乳区淋巴结、前纵隔原发灶及心包前淋巴结、前纵隔原发灶及腔静脉前淋巴结、前纵隔原发灶及胸骨转移灶、左前肋膈角淋巴结、肝左叶转移灶;G:全身CT图;H:全身PET图;I:全身PET/CT融合图。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术。 Figure 1 18F-FDG PET/CT images of type B3 thymoma (male 12 years old) |
男患儿,15岁,运动后胸痛1年,咳嗽20余天,近期加重,一般上午轻,午后至夜间较重,伴低热,约37.4 ℃,未服药可自行好转。实验室检查结果:NSE为359.1 μg/L(0~15.2 μg/L),甲胎蛋白(-),β-人绒毛膜促性腺激素(-);红细胞计数为6.36×1012/L[(4.30~5.80)×1012/L],血红蛋白为160 g/L(135~175 g/L),白细胞计数为5.34×109/L[(3.50~9.50)×109/L],中性粒细胞绝对值为3.67×109/L[(1.80~6.30)×109/L],淋巴细胞绝对值为0.96×109/L[(1.10~3.20)×109/L],单核细胞绝对值为0.51×109/L[(0.10~0.60)×109/L],C-反应蛋白15.3 mg/L(0~8.0 mg/L),乳酸脱氢酶816 U/L(0~248 U/L),β2微球蛋白(-)。现咳嗽、盗汗、消瘦,无肿瘤家族史。
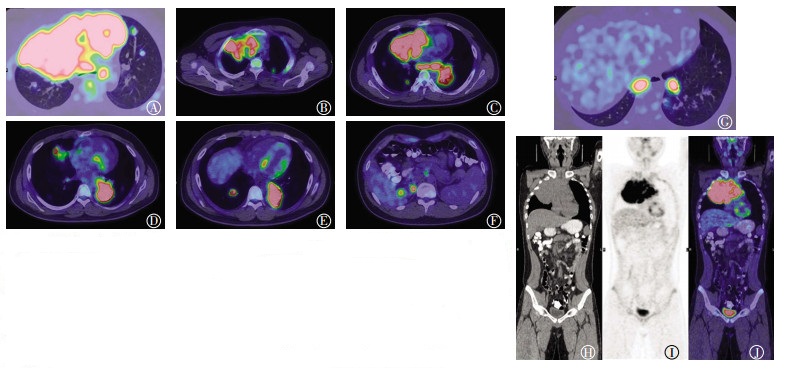
2 PET/CT影像学表现由图 2可见,右肺上叶前段可见巨大软组织肿物,累及前纵隔并突入纵隔血管间隙,上腔静脉及心右缘受包绕,CT值为38 HU,内见散在钙化,PET图像显示肿物呈弥漫放射性浓聚,SUVmax=14.5,较大横断面约16.4 cm×9.8 cm,邻近胸膜受累,肿物与胸膜可见条带状水样密度影。左肺下叶背段椎旁软组织肿物,CT值为38 HU,可见分叶,边缘毛糙,包绕邻近左肺门,PET图像显示异常放射性浓聚,SUVmax=9.5,较大横断面约5.2 cm×4.8 cm,周围伴磨玻璃密度影。双肺多发大小不等结节及肿块,CT值为32 HU,边缘尚光滑,PET图像显示异常放射性浓聚,SUVmax=11.3,大者约3.0 cm×2.4 cm。上纵隔血管间隙、纵隔内气管周围、主动脉弓旁、主肺窗、隆突下、奇食窝及左肺门多发结节及肿块,CT值为30 HU,边界不清,相互融合,PET图像显示异常放射性浓聚,SUVmax=9.1,大者约5.5 cm×2.3 cm,邻近气管及左右主支气管受压、变形,气道尚通畅。双肾上极结节,CT值为43 HU,边界不清,PET图像显示异常放射性浓聚,SUVmax=7.6,大者约2.0 cm×1.5 cm。
|
图 2 弥漫大B细胞淋巴瘤患儿(男性,15岁)18F-FDG PET/CT图图中,A~G:病灶位置轴位PET/CT融合图,依次为右肺上叶原发灶、左肺下叶椎旁转移灶及双肺转移灶、右肾上极转移灶、纵隔多发转移淋巴结;H:全身CT图;I:全身PET图;J:全身PET/CT融合图。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术。 Figure 2 18F-FDG PET/CT images of diffuse large B cell lymphoma (male 15 years old) |
病例一:前纵隔恶性病变(1恶性淋巴瘤、2恶性胸腺瘤、3神经内分泌肿瘤),淋巴结转移、肝转移、骨转移。
病例二:右肺上叶前段巨大软组织肿物,考虑为恶性(1肺来源神经内分泌肿瘤、2淋巴瘤);纵隔肺门淋巴结转移双肺转移双肾转移。
【病理诊断】病例一:B3型胸腺瘤(纵隔)伴大片坏死,间质含铁血黄素沉积及组织细胞反应,符合化疗后改变,侵犯周围肺组织,肿物周围见淋巴结1枚,可见癌转移(1/1),送检肺门淋巴结1枚,可见癌转移(1/1),送检纵隔淋巴结7枚、右无名静脉旁淋巴结1枚、膈神经淋巴结1枚均未见癌转移。
免疫组化:CK-pan(上皮+),P63(上皮+),CD117(上皮+),CD5(部分肿瘤细胞+),TDT(-),CD1a(淋巴细胞+),CD3(淋巴细胞+),CD20(淋巴细胞+),Ki-67(80%+),CD99(淋巴细胞+)。
转移性上皮样恶性肿瘤(肝左叶+部分Ⅴ段),结合病史及免疫组化结果符合转移性B3型胸腺瘤,切缘(-)。
免疫组化:Hepatocyte(-),GPC-3(-),CK7(-),CK19(散在+),P63(散在+),CD117(+),CD5(T淋巴细胞+),Ki-67(80%+),TDT(-),CD20(B淋巴细胞+),CD3(T淋巴细胞+),CD1a(-),CK5/6(-)。
病例二:弥漫大B细胞淋巴瘤(右前纵隔针吸穿刺),考虑纵隔原发。
免疫组化:CD3(-),CD20(+),CD30(-),SALL-4(-),CD117(-),Bcl-6(-),CD5(-),c-Myc(<5%+),CD21(部分+),CD23(+),CD10(-),Bcl-2(+),Mum-1(+)。
【讨论辨析】前纵隔肿瘤约占纵隔肿瘤的45%,其中大部分是起源于胸腺或淋巴组织的肿瘤[1]。
淋巴瘤是继白血病、神经系统肿瘤后儿童中最常见的肿瘤。淋巴瘤原发于淋巴结或结外淋巴组织,几乎可侵及全身所有脏器,它是常见的前纵隔肿瘤之一,分为霍奇金淋巴瘤(Hodgkins disease,HD)和非霍奇金淋巴瘤(non-Hodgkinlymphoma,NHL)两大类。约70%的HD患者早期表现为胸内淋巴结增大,95%的HD患者可见上纵隔淋巴结受侵犯,此外,可有胸腺(约40%)、肺实质(10%)、胸膜(10%)受累[2]。NHL肺实质和胸膜受累比例与HD相似;结外脏器较HD更易受累,常见于扁桃体、胃肠道等。
纵隔生殖细胞起源的肿瘤包括畸胎瘤、精原细胞瘤、绒毛膜上皮癌和内胚窦瘤或卵黄囊瘤,90%以上为畸胎瘤,除了成熟的畸胎瘤外,其他类型的生殖细胞瘤均为恶性肿瘤[3]。
大多数畸胎瘤见于胸腺内或在胸腺附近,少数可起自于后纵隔。畸胎瘤可以是囊性、囊实性或实性肿块。囊性肿块边界清楚,囊肿中有时可以显示脂-液平面。在CT检查中,纵隔肿块内发现钙化和脂肪成分时,可以作出良性畸胎瘤的特异性诊断。未成熟的畸胎瘤为实性肿块,其少有钙化、脂肪,增强强化不均匀,与其他生殖细胞瘤较难鉴别。
卵黄囊瘤或内胚窦细胞瘤一般为高度恶性病变,单纯根据PET/CT图像结果对恶性生殖细胞性肿瘤作出特异性诊断有一定困难。不过大多数精原细胞瘤表现为均质的软组织密度肿块,需密切结合实验室检查进行进一步定性,如甲胎蛋白升高提示内胚窦瘤,而绒毛膜促性腺激素升高时要考虑绒毛膜上皮癌。
胸腺瘤又称胸腺上皮瘤,它是含有不同比例的胸腺上皮细胞和淋巴细胞的实质性肿块。胸腺瘤世界卫生组织分型为A、AB、B1~3及C型(表 1)[4]。
| 表1 胸腺瘤不同分类方法的对应关系 Table 1 Correspondence of different classification methods of thymoma |
胸腺瘤CT表现:大小形状变化较大,可为凸出于胸腺边缘的圆形、类圆形的局灶性软组织肿块,也可为大的分叶状肿块,占据整个胸腺。肿瘤具有轻度均匀的强化,也可因出血、坏死而形成低密度区。有10%~15%的胸腺瘤为侵袭性的,侵袭性胸腺瘤的诊断基础是肿瘤扩展超过包膜范围并侵入邻近结构[5]。CT表现为除了胸腺区较大的肿块以外,还可见到肿块侵犯或包绕邻近纵隔结构,伴有肺转移或胸膜、心包膜种植。出现胸膜、心包膜增厚和(或)胸腔、心包积液等胸膜、心包膜浸润性征象时,常有利于作出恶性胸腺瘤的诊断[6]。
中纵隔肿瘤主要为胚胎性前肠畸形,如支气管源性囊肿和一些淋巴瘤侵入中纵隔。
后纵隔肿块占儿童纵隔肿块的35%左右[7]。最常见的为神经源性肿瘤,占50%~90%,其中约80%为起源于椎旁交感神经链的神经节细胞,包括神经母细胞瘤、神经节母细胞瘤、神经节细胞瘤;其余的有起源于周围神经的肿瘤,如神经鞘膜瘤、神经纤维瘤;少见的有起源于副神经节的肿瘤,如嗜铬细胞瘤[8]。
病例一因胸痛反复发作、发热就诊,抗炎治疗后效果不明显。实验室检查仅发现C-反应蛋白、乳酸脱氢酶升高。PET/CT影像学表现给我们的第一印象是恶性淋巴瘤,淋巴瘤是最常见的儿童前纵隔肿瘤之一[9],纵隔淋巴结、胸腺、肺实质及结外器官均有受累。发热及乳酸脱氢酶升高也是淋巴瘤的典型症状。但患儿肝脏仅为局部受累,且脾脏没有增大及弥漫性高代谢,这又与淋巴瘤的特征性表现相悖。由于患儿主要病灶位于前纵隔部位,且有明确的多部位转移,并不能排除恶性胸腺瘤的诊断。虽然各年龄段均可发生胸腺瘤,但绝大多数是在50~60岁,儿童胸腺瘤非常少见。有文献报道,重症肌无力是胸腺瘤最常见的临床表现,发生率为30%~50%[10-11]。本例患儿并未出现明显重症肌无力症状。由于患儿肿瘤标志物中仅NSE稍升高,诊断中也考虑到神经内分泌肿瘤的可能性。综上分析,我们考虑恶性淋巴瘤的可能性大,恶性胸腺瘤及神经内分泌肿瘤不能除外,建议结合淋巴结活检结果进行诊断。后对患儿行超声引导下穿刺活检,病理结果示:前纵隔肿物穿刺组织为恶性肿瘤,呈上皮样形态及表型,核增殖指数较高,结合免疫组化考虑为B3型胸腺瘤。在多周期化疗后,对患儿行纵隔肿物切除及肝左叶扩大切除,术后病理结果示:B3型胸腺瘤(纵隔)伴大片坏死,转移性上皮样恶性肿瘤(肝左叶+部分Ⅴ段),结合病史及免疫组化结果符合转移性B3型胸腺瘤。
病例二因活动后胸痛,近期咳嗽加重伴低热就诊。PET/CT影像学表现给我们的第一印象是右肺恶性病变伴纵隔淋巴结、双肺、双肾转移。儿童肺部原发性恶性肿瘤极为罕见,但实验室检测提示NSE明显升高,其余肿瘤标志物均为阴性,且主要病灶位于纵隔旁及胸椎旁,首先考虑儿童神经源性肿瘤或神经内分泌肿瘤的可能。患儿有长期午后低热和乳酸脱氢酶升高的临床表现,虽然血常规和β2微球蛋白没有明显异常,但也要考虑到淋巴瘤的可能。淋巴瘤的影像表现个体差异较大,本例患儿虽然没有典型的肝脾肿大伴高代谢及全身多发淋巴结肿大,但除纵隔淋巴结转移外,双肺及双肾的转移并不能将淋巴瘤的诊断完全排除。虽然纵隔是儿童生殖细胞性肿瘤的好发部位,但本例患儿甲胎蛋白及β-人绒毛膜促性腺激素均为阴性,基本可以排除内胚窦瘤及绒毛膜上皮癌等恶性生殖细胞性肿瘤的诊断。后患儿在诊治中经右前纵隔针吸穿刺病理诊断为弥漫大B细胞淋巴瘤,并考虑纵隔原发。经多周期化疗后,患儿病情稳定并部分缓解(图 3),也证实了淋巴瘤的最终诊断。回顾最初诊断,诊断方向受NSE明显升高的影响较大,单纯依靠PET/CT的影像学表现不能给出准确诊断,还需要其他辅助检查结果的支持。

|
图 3 弥漫大B细胞淋巴瘤患儿(男性,15岁)MIP图图中,A:化疗前PET/CT全身MIP图B:化疗3个月后PET/CT全身MIP图C:化疗后10个月PET-CT全身MIP图。MIP:最大密度投影。 Figure 3 Maximum intensity projection image of diffuse large B cell lymphoma (male 15 years old) |
同病异影、异病同影,还是摆在影像诊断医师面前的棘手问题,需要我们综合各方面的诊断依据,在考虑常见病多发病的同时,也不轻易排除少见病症的诊断,以期给出更为准确的影像诊断结果。
【专家点评】纵隔肿瘤是儿童最常见的肿瘤发病部位之一,其病理来源多样,可以起源于胸腺细胞、生殖细胞或淋巴细胞。尽管不同来源的纵隔肿瘤恶性程度、治疗方式及预后状况有很大差异,但它们的影像学特征具有很大的相似性,同形异病这一特点在纵隔肿瘤中具有很明显的代表性。由于纵隔肿瘤缺乏典型的影像学特征,单纯依靠影像学特点去诊断很容易造成误诊。
该研究选取了2例缺乏影像特异性的儿童纵隔占位性病变,通过分析不同病理来源的肿物的发病部位及影像学特点,并结合临床检验资料,抽丝剥茧地对病变进行了深入的分析并抓住了主要病变特点,诊断思路非常清晰,从而得到合理的影像学结论。尽管研究者对这2例病例进行了准确清晰地分析并得到了合理的结论,但我们也要承认PET/CT在纵隔肿物的诊断中并不具备一锤定音的价值,临床必需依靠病理才能确诊并治疗。
我们需要清醒地认识到18F-FDG-PET/CT对纵隔肿瘤最重要的价值不是诊断,而是病灶表现出来的侵犯范围、分期以及18F-FDG摄取水平的高低所反映的生物学特征,这是临床治疗及后续疗效评价的基础。病例一展示了PET/CT在胸腺瘤诊断及分期方面的价值;病例二很好地展示了18F-FDG PET/CT在淋巴瘤应用方面的价值,淋巴瘤也是目前PET/CT应用最好的肿瘤,治疗前诊断分期,治疗早期预测患者的预后,治疗结束评价疗效及判断患者是否适合干细胞移植。PET/CT所反映的生物学信息为临床精准诊断、精准分期及精准疗效评价提供了客观的依据。
点评专家 樊卫教授,广州中山大学肿瘤医院核医学科主任。中国抗癌协会肿瘤核医学专业委员会侯任主任委员,中华医学会核医学分会肿瘤学组副组长,中华医学会核医学分会委员,广东省医学会核医学分会侯任主任委员。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘晓园负责论文的撰写与修订;朱磊负责论文的审核、校对;杨钊、刘建井负责病例与文献的收集;徐文贵负责方案的提出与设计、论文的审阅。
| [1] | Davis RD, Oldham HN, Sabiston DC. Primary cysts and neoplasms of the mediastinum:recent changes in clinical presentation, methods of diagnosis, management, and results[J]. Ann Thorac Surg, 1987, 44(3): 229–237. DOI:10.1016/S0003-4975(10)62059-0 |
| [2] | McCarten KM, Metzger ML, Drachtman RA, et al. Significance of pleural effusion at diagnosis in pediatric Hodgkin lymphoma: a report from Children's Oncology Group protocol AHOD0031[J/OL]. Pediatr Radiol, 2018[2018-07-05]. https://www.ncbi.nlm.nih.gov/pubmed/?term=30014200. DOI: 10.1007/s00247-018-4197-6. [published online ahead of print]. |
| [3] | Schneider DT, Calaminus G, Koch S, et al. Epidemiologic Analysis of 1, 442 Children and Adolescents Registered in the German Germ Cell Tumor Protocols[J]. Pediatr Blood Cancer, 2004, 42(2): 169–175. DOI:10.1002/pbc.10321 |
| [4] | Alexander Marx, John K. The 2015 WHO Classification of Tumors of the Thymus:Continuity and Changes[J]. J Thorac Oncol, 2015, 10(10): 1383–1395. DOI:10.1097/JTO.0000000000000654 |
| [5] | Tomaszek S, Wigle DA, Keshavjee S, et al. Thymomas:review of current clinical practice[J]. Ann Thorac Surg, 2009, 87(6): 1973–1980. DOI:10.1016/j.athoracsur.2008.12.095 |
| [6] | Scagliori E, Evangelista L, Panunzio A, et al. Conflicting or complementary role of computed tomography(CT) and positron emission tomography (PET)/CT in the assessment of thymic cancer and thymoma:our experience and literature review[J]. Thorac Cancer, 2015, 6(4): 433–442. DOI:10.1111/1759-7714.12197 |
| [7] | Thacker PG, Mahani MG, Heider A, et al. Imaging Evaluation of Mediastinal Masses in Children and Adults:Practical Diagnostic Approach Based on A New Classification System[J]. J Thorac Imaging, 2015, 30(4): 247–267. DOI:10.1097/RTI.0000000000000161 |
| [8] | Pavlus JD, Carter BW, Tolley MD, et al. Imaging of Thoracic Neurogenic Tumors[J]. AJR Am J Roentgenol, 2016, 207(3): 552–561. DOI:10.2214/AJR.16.16018 |
| [9] | Tansel T, Onursal E, Dayloǧlu E, et al. Childhood mediastinal masses in infants and children[J]. Turk J Pediatr, 2006, 48(1): 8–12. |
| [10] | Marx A, Porubsky S, Belharazem D, et al. Thymoma related myasthenia gravis in humans and potential animal models[J]. Exp Neurol, 2015, 270: 55–65. DOI:10.1016/j.expneurol.2015.02.010 |
| [11] | Scorsetti M, Leo F, Trama A, et al. Thymoma and thymic carcinomas[J]. Crit Rev Oncol Hematol, 2016, 99: 332–350. DOI:10.1016/j.critrevonc.2016.01.012 |
 2018, Vol. 42
2018, Vol. 42


