小细胞神经内分泌癌,又称小细胞癌,绝大部分发生在肺内。肺外小细胞癌几乎可发生于肺外的各个组织器官,约占所有小细胞癌的2%~9%,常见于胃肠道、泌尿生殖系统、头颈部、乳腺等部位[1-3]。小细胞癌发生的部位不同,其流行病学、生物学行为、临床影像特征具有明显差异[4]。女性生殖道小细胞癌最常见的发生部位为宫颈,其次为卵巢、输卵管、子宫内膜、阴道和外阴[1]。宫颈小细胞癌的发病机制尚存在争议,有研究结果显示,其发生与高危型人乳头瘤病毒(16/18)感染相关[5]。与其他宫颈恶性肿瘤相比,宫颈小细胞癌更易发生宫旁侵犯和淋巴结转移[1]。宫颈小细胞癌较为罕见,缺乏特征性影像学表现,文献报道其18F-FDG PET/CT显像多呈异常高代谢[6-9]。
1 患者资料患者女性,63岁,因“头痛7 d”入院。既往体健,无传染病史和肿瘤病史。入院后行体格检查,右颅顶部触及一质硬包块,无发红、无瘙痒;其余无明显异常。肿瘤标志物未检测。血尿常规及血生化均无明显异常。
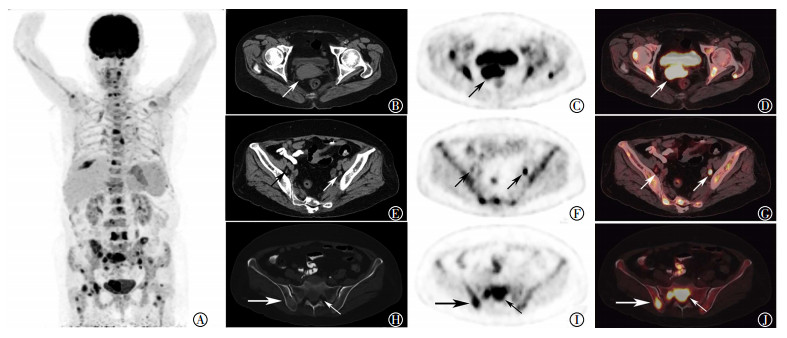
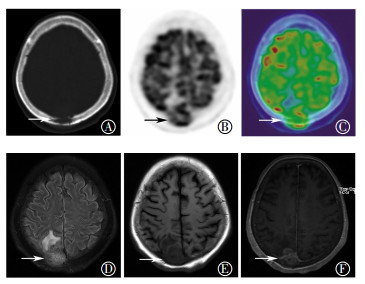
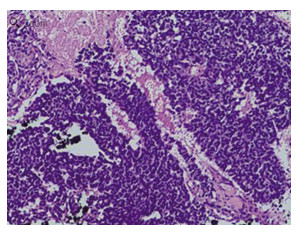
本院颅脑CT平扫示右顶叶高密度结节影,周围伴低密度水肿带,邻近颅骨骨质破坏,考虑颅内肿瘤性病变。进一步行颅脑MRI,平扫示右顶叶稍长T1、T2信号结节,大小约3.0 cm×2.6 cm,以宽基底附于邻近脑膜,并穿过邻近颅骨内外板,邻近脑实质向内推移伴水肿带;增强MRI扫描示病灶明显强化,考虑侵袭性脑膜瘤累及颅顶骨可能性大。为进一步排除转移瘤的可能性,行18F-FDG PET/CT(德国Siemens mCT-s64)全身检查。该患者在检查前签署了知情同意书。患者空腹(血糖:5.4 mmol/L),静脉注射显像剂18F-FDG(南京江原安迪科武汉分公司,放射性活度:240.5 MBq),平静休息1 h后行PET/CT全身断层显像,显像范围为颅顶至大腿根部,2 min/床位,共6个床位,图像行衰减校正及迭代法重建,以多层面、多幅显示。PET/CT影像表现:①子宫颈明显增厚伴软组织团块,边界欠清晰,病灶大小约4.3 cm×2.7 cm,代谢异常增高,SUVmax为20.0(图 1中B~D);②盆腔内双侧髂外血管旁见淋巴结,大小分别为11 mm×9 mm(左,SUVmax为10.4)和7 mm×4 mm(右,SUVmax为2.7)(图 1中E~G);③全身多处骨骼(胸骨、双侧锁骨、双肩胛骨、肱骨、多发肋骨、颈胸腰椎多发椎体及附件、骨盆组成骨及股骨)见多发溶骨性骨质破坏,部分伴软组织团块形成,代谢异常增高,SUVmax为5.2~20.6(图 1中H~J为骨盆组成骨的骨转移图像);④颅顶骨见骨质破坏,伴颅内团块及低密度水肿带,代谢异常增高,SUVmax为16.4(图 2)。综合诊断为:子宫颈恶性肿瘤性病变伴盆腔淋巴结及多发骨骼转移,建议结合宫颈活检。宫颈活检病理结果(图 3):子宫颈神经内分泌癌(小细胞癌)。免疫组化检测:神经细胞黏连分子CD56(+)、嗜铬颗粒蛋白A(+)、细胞角蛋白CK5/6(-)、增殖细胞核抗原Ki-67阳性率约90%、P16(+)、P63(+)、突触素(+)、甲状腺转录因子1(+)。
|
图 1 患者女性,63岁,宫颈小细胞神经内分泌癌18F-FDG PET/CT显像图图中,A:全身MIP图;B~D:宫颈病灶轴位CT、PET及PET/CT融合图像,CT平扫示宫颈明显增厚伴软组织团块,PET显像示病灶代谢异常增高,SUVmax为20.0(箭头示病灶);E~G:双侧盆腔淋巴结轴位CT、PET及PET/CT融合图像,CT平扫示双侧髂外血管旁淋巴结,大小分别为11 mm×9 mm(左)、7 mm×4 mm(右),PET显像示代谢异常增高,SUVmax为10.4(左)和2.7(右)(箭头示病灶);H~J:骨盆组成骨的骨转移轴位CT、PET及PET/CT融合图像,CT平扫骨窗示骶骨及右髂骨见骨质破坏,PET示代谢异常增高,SUVmax为16.4(箭头示病灶)。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;MIP:最大密度投影;SUVmax:最大标准化摄取值。 |
|
图 2 患者女性,63岁,宫颈小细胞神经内分泌癌颅骨转移18F-FDG PET/CT及MRI图像图中,A~C:右颅顶部病灶轴位CT、PET及PET/CT融合图像,CT平扫骨窗示颅顶骨骨质破坏,PET示代谢异常增高,SUVmax为16.4(箭头示病灶);D~F:右颅顶部病灶MRI图像,D为T2-Flair序列,E为T1-Flair序列,右顶叶见稍长T2、T1信号结节影,周围脑实质内见长T2信号水肿带,病灶侵及邻近颅骨,F为MRI增强扫描,示病灶呈明显强化(箭头示病灶)。FDG:氟脱氧葡萄糖;PET:正电子发射断层显像术;CT:计算机体层摄影术;MRI:磁共振成像;SUVmax:最大标准化摄取值;Flair序列:液体衰减反转恢复序列。 |
|
图 3 患者女性,63岁,宫颈小细胞神经内分泌癌病理图(苏木精-伊红染色,放大倍数为20×10)图中,宫颈组织中见瘤细胞呈圆形或短梭形非典型细胞,部分成巢状或片状排列,细胞体积较小,胞质少而不明显,细胞核呈椒盐状蓝染,核仁染色不明显,内可见局灶坏死。 |
宫颈小细胞癌是宫颈恶性肿瘤中罕见的病理类型,约占所有宫颈恶性肿瘤的1%,其年平均发病率为0.06/10万[10]。宫颈小细胞癌临床表现缺乏特异性,常见症状包括异常阴道流血、流液、盆腔疼痛或压迫症状。但因病变一般不侵犯宫颈表面上皮而是以间质浸润性生长为主,常规巴氏涂片或液基薄层细胞学检查的灵敏度和特异度较低,所以该病早期不易被发现。宫颈小细胞癌的侵袭性较强,具有早期转移且进展较快的特点,其复发率高、预后较差[11-12]。
宫颈小细胞癌的影像学表现缺乏特异性,CT平扫可表现为等密度或稍低密度肿块,18F-FDG PET/CT显像多呈异常高摄取。Chen等[6]报道了25例宫颈小细胞癌患者,原发灶中位SUVmax为10.2(0~33.0)。Lin等[7]报道了5例宫颈-阴道神经内分泌肿瘤,其中1例为宫颈小细胞癌,其SUVmax为5.62。本例患者宫颈病灶CT表现为边界不清的等密度团块,18F-FDG摄取水平异常增高,SUVmax为20.0;病灶虽未侵及邻近的膀胱及直肠组织,但已有淋巴结及多发骨转移;盆腔内转移淋巴结较小,但其18F-FDG摄取异常增高。本例患者以颅内病变为首发表现,通过行18F-FDG PET/CT全身检查发现原发肿瘤位于宫颈,同时发现盆腔淋巴结转移及多处骨质破坏,综合考虑诊断为宫颈恶性肿瘤伴多发转移,通过病理学检查证实为小细胞癌,提示该患者分期较晚,预后不良。
宫颈小细胞癌在临床中较为少见,目前,关于18F-FDG PET/CT在该病中应用价值的研究较少,仅1篇前瞻性研究[6],其余3篇均为病例报道[7-9]。Chen等[6]的研究表明,18F-FDG PET/CT可使部分宫颈小细胞癌患者的分期下调或上调,分期下调可避免患者接受过度治疗;他们发现接受规范治疗的肿瘤早期患者(Ⅰ/ⅡB)生存期较长;他们还发现,尽管PET/CT可以探测更多的远处淋巴结转移或骨转移,但晚期患者的长期生存率并未因此得到改善;研究结果显示,所有患者的中位无失败生存期为17.4个月,中位肿瘤特异性生存期为32.5个月。由于该病的特殊性以及患者数量较少的原因,18F-FDG PET/CT在预测该病预后方面的价值仍需进一步的大样本研究。
总之,18F-FDG PET/CT对宫颈小细胞癌的原发灶、淋巴结转移、骨转移及其他较隐匿部位转移病灶的探测灵敏度较高,在该病的临床管理中具有较好的应用价值。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李崇佼负责病史收集、数据分析、论文撰写、修改及校正;田月丽、沈美娟负责病史收集、数据获取及分析;幸奠奎负责数据及图片处理;文兵、何勇负责研究命题的提出、设计、论文修改及最终版本修订。
| [1] | Joyce EA, Kavanagh J, Sheehy N, et al. Imaging features of extrapulmonary small cell carcinoma[J]. Clin Radiol, 2013, 68(9): 953–961. DOI:10.1016/j.crad.2013.04.006 |
| [2] |
朱文丰, 代海洋, 黎昕, 等.
直肠神经内分泌肿瘤的CT诊断[J]. 国际放射医学核医学杂志, 2015, 39(3): 220–223.
DOI:10.3760/cma.j.issn.1673-4114.2015.03.007 Zhu WF, Dai HY, Li X, et al. Diagnosis of rectal neuroendocrine tumor using CT[J]. Int J Radiat Med Nucl Med, 2015, 39(3): 220–223. DOI:10.3760/cma.j.issn.1673-4114.2015.03.007 |
| [3] |
龙再颖, 赵燕霞, 孙达.
乳腺神经内分泌癌99Tcm-MIBI显像表现一例[J]. 国际放射医学核医学杂志, 2016, 40(4): 318–320.
DOI:10.3760/cma.j.issn.1673-4114.2016.04.016 Long ZY, Zhao YX, Sun D. A case of neuroendocrine carcinoma of the breast:99Tcm-MIBI imaging[J]. Int J Radiat Med Nucl Med, 2016, 40(4): 318–320. DOI:10.3760/cma.j.issn.1673-4114.2016.04.016 |
| [4] | Dasari A, Mehta K, Byers LA, et al. Comparative study of lung and extrapulmonary poorly differentiated neuroendocrine carcinomas:a seer database analysis of 162, 983 cases[J]. Cancer, 2018, 124(4): 807–815. DOI:10.1002/cncr.31124 |
| [5] |
刘兰芳, 朱笕青.
宫颈小细胞癌的研究进展[J]. 中华肿瘤防治杂志, 2008, 15(19): 1511–1514.
DOI:10.3969/j.issn.1673-5269.2008.19.022 Liu LF, Zhu JQ. Study of small cell carcinoma of cervix[J]. Chin J Cancer Prev Treat, 2008, 15(19): 1511–1514. DOI:10.3969/j.issn.1673-5269.2008.19.022 |
| [6] | Chen MY, Chou HH, Liu FY, et al. 18F-FDG PET in small-cell cervical cancer:a prospective study with long-term follow-up[J]. Eur J Nucl Med Mol Imaging, 2016, 43(4): 663–674. DOI:10.1007/s00259-015-3229-9 |
| [7] | Lin Y, Lin WY, Liang JA, et al. Opportunities for 2-[18F] fluoro-2-deoxy-D-glucose PET/CT in cervical-vaginal neuroendocrine carcinoma:case series and literature review[J]. Korean J Radiol, 2012, 13(6): 760–770. DOI:10.3348/kjr.2012.13.6.760 |
| [8] | Hsieh TC, Wu YC, Sun SS, et al. Rare breast and adrenal gland metastases from small-cell neuroendocrine carcinoma of uterine cervix[J]. Clin Nucl Med, 2012, 37(3): 280–283. DOI:10.1097/RLU.0b013e31823ea6c4 |
| [9] | Nguyen VX, Nguyen BD, Lam-Himlin DM. Positron emission tomography/computed tomography imaging of adrenocorticotropic hormone-producing small-cell neuroendocrine carcinoma of the cervix[J]. Int J Gynaecol Obstet, 2017, 137(2): 197–198. DOI:10.1002/ijgo.12104 |
| [10] | Chen J, Macdonald OK, Gaffney DK. Incidence, mortality, and prognostic factors of small cell carcinoma of the cervix[J]. Obstet Gynecol, 2008, 111(6): 1394–1402. DOI:10.1097/AOG.0b013e318173570b |
| [11] | Delaloge S, Pautier P, Kerbrat P, et al. Neuroendocrine small cell carcinoma of the uterine cervix:what disease? What treatment? Report of ten cases and a review of the literature[J]. Clin Oncol (R Coll Radiol), 2000, 12(6): 357–362. DOI:10.1053/clon.2000.9194 |
| [12] | Weed JC, Graff AT, Shoup B, et al. Small cell undifferentiated (neuroendocrine) carcinoma of the uterine cervix[J]. J Am Coll Surg, 2003, 197(1): 44–51. DOI:10.1016/S1072-7515(03)00120-0 |
 2018, Vol. 42
2018, Vol. 42


