放疗被广泛应用于肺癌的临床治疗,但肺癌细胞对射线的敏感性不同,在放疗过程中会发生辐射抵抗,因此比较不同肺癌细胞的辐射抗性,探究提高肺癌细胞辐射敏感性的方法具有重要意义。
非小细胞肺癌(non-small-cell lung cancer,NSCLC)是发病率最高、研究最多的肺癌。过去20多年,虽然研究人员深入了解了NSCLC的分子基础和基因基础,但肺癌患者总的生存率并没有明显提高。肺癌细胞产生放化疗抵抗是临床治疗效果差的重要原因,肺癌细胞抗性产生的机制亟待探究。放疗和一些化疗药物都可以通过升高细胞内活性氧(ROS)的水平造成DNA损伤,从而导致肺癌细胞死亡或抑制其增殖、转移。然而,肺癌细胞内抗氧化系统的相关基因突变和蛋白丰度的变化会导致其产生放化疗抵抗[1-2]。
核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)作为一种核转录因子可以与抗氧化作用元件(ARE)结合调节一系列抗氧化基因的表达,如HO-1(heme oxygenase-1,血红素加氧酶-1)、NQO1(NAD(P)H:quinone oxidoreductase 1,还原型辅酶/醌氧化还原酶1)、GSTs(glutathione S-transferase,谷胱甘肽S-转移酶)[3-5],也可以调节药物的解毒作用和药物泵出[6]。Nrf2在人体各组织器官中广泛表达,它的含量主要受到Keap1的调节[7]。正常情况下,Nrf2在胞质中可与Keap1结合发生泛素化,并被转运到蛋白酶体降解,氧化应激可使二者解聚,游离Nrf2可以稳定存在并转位入细胞核发挥转录因子的作用[5, 8]。肺癌细胞中Nrf2常过表达,且Nrf2过表达的肺癌患者较Nrf2正常表达的患者预后差[9]。研究人员对NSCLC的辐射抗性机制做了大量研究工作,但Nrf2蛋白与NSCLC辐射敏感性的相关报道很少。由于不同类型肺癌肿瘤由不同类型细胞组成,因此临床上对放疗敏感性的表现不同,探究不同肺癌细胞的辐射敏感性差异以及导致这种差异的原因,有助于临床医师针对不同患者制定更精准的治疗方案。A549属于鳞状NSCLC细胞,来源于外植体肺肿瘤,H460属于鳞状大细胞肺癌细胞,来源于胸膜积液,两者在耐药性和辐射抗性等方面存在较大差异,但具体机制还不明确。笔者通过对肺癌A549和H460两个细胞系的辐射敏感性进行比较,并对比两者的Nrf2蛋白含量,探讨Nrf2蛋白水平差异对两种细胞系辐射敏感性的影响。
1 材料与方法 1.1 试剂和仪器RPMI 1640培养基购于美国HyClone公司;胎牛血清购于美国Gibco公司;二喹啉甲酸(BCA)、MTT、吉姆萨染液均购于中国Sigma公司;anti-Nrf2抗体购于英国abcam公司;RIPA细胞裂解液购于北京索莱宝科技有限公司;anti-β-Tubulin抗体购于北京康为世纪生物科技有限公司;山羊抗小鼠(兔)免疫球蛋白二抗(辣根过氧化物酶标记)购于北京中杉金桥生物技术有限公司。照射仪器为加拿大Atomic Energy of Canada Co. Ltd 137Cs γ射线源。细胞培养箱为力康(Heal Force)生物科技公司HF90/HF240二氧化碳培养箱。Powerpac基础电泳仪和ChemiDoc MP化学发光成像系统购于美国伯乐(BIO-Rad)公司。
1.2 细胞系及细胞培养肺癌细胞A549和H460购于中国医学科学院基础医学研究所。H460细胞接受小剂量(2 Gy)照射后继续培养筛选得到一种辐射抗性较强的H460细胞,将其命名为H460R。A549、H460和H460R细胞都在直径10 cm培养皿中培养,用含有10%胎牛血清的RPMI 1640培养液于37℃、5% CO2培养箱中常规培养、传代,取对数生长期细胞进行实验。
1.3 细胞照射照射剂量率为1.02 Gy/min。取对数生长期细胞接种在培养皿或培养板中,待细胞贴壁后更换RPMI 1640(加10%胎牛血清)新鲜培养基并用封口膜封住培养皿或培养板口,将其置于射线源下,完全暴露照射(肺癌A549和H460细胞克隆形成实验照射剂量分别为2、4、6 Gy;肺癌H460和H460R细胞克隆形成实验照射剂量分别为1、2、4、6 Gy)。细胞照射后放回培养箱继续培养。
1.4 细胞克隆形成实验将细胞接种在60 mm培养皿中,每皿接种细胞400个,各照射组均设置3个平行皿。待细胞贴壁后分别用137Cs γ射线进行照射,继续培养2 h后更换新鲜培养基。每2 d更换1次培养基,约2周后使用吉姆萨染液染色计数,统计≥50个细胞的克隆数量。
1.5 单细胞凝胶电泳实验(彗星实验)肺癌A549和H460细胞经4 Gy 137Cs γ射线照射后2 h收集细胞,用PBS冲洗2次,使用PBS重悬调节细胞悬液密度至4×105个/mL~5×105个/mL。彗星实验板每孔铺0.75%正常熔点琼脂糖凝胶约500 μL,待凝胶凝结后,将30 μL细胞悬液与70 μL 0.75%低熔点琼脂糖凝胶混匀滴于上层铺平,将彗星实验板完全浸没在细胞裂解液中,4℃下裂解2.5 h。将彗星实验板移入装有Tris-硼酸缓冲液的电泳槽中进行DNA解旋20 min,30 V电压电泳20 min,电泳结束后使用中和缓冲液中和20 min。彗星实验板用PBS冲洗后经溴化乙啶染色,在荧光显微镜下观察拍照。使用CASP 6.0软件分析图像。casp_1.2.3b1彗星分析软件分析olive尾距值和尾部DNA含量。
1.6 细胞蛋白提取和蛋白质印迹实验收集肺癌A549、H460和H460R细胞,使用RIPA组织/细胞裂解液在4℃下裂解20~30 min,4℃下12 000×g离心15 min,吸取上层液体即为蛋白溶液,使用二喹啉甲酸对提取的蛋白进行定量。在10%聚丙烯酰胺凝胶中每孔上样40 μg蛋白进行电泳,将蛋白转印至聚偏氟乙烯膜上,用5%脱脂奶粉TBST(Tris-Hcl缓冲液+Tween20)缓冲液在室温下封闭1 h,anti-β-Tubulin抗体4℃孵育过夜,山羊抗小鼠(兔)免疫球蛋白二抗孵育2 h。使用增强化学发光试剂后,将聚偏氟乙烯膜放入化学发光凝胶成像系统中曝光成像。
1.7 统计学方法采用SPSS 17.0软件进行统计学分析。定量资料符合正态分布,方差齐,采用独立样本t检验进行比较。P<0.05表示差异有统计学意义。
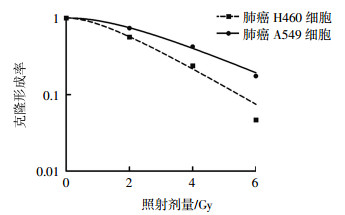
2 结果 2.1 照射后肺癌A549和H460细胞的生存情况经2、4、6 Gy 137Cs γ射线照射后,A549细胞的克隆形成率分别为(73.78±14.69)%、(42.26±3.19)%、(17.50±2.18)%;H460细胞的克隆形成率分别为(56.38±6.28)%、(23.82±8.25)%、(4.66±0.87)%。不同照射剂量的A549细胞克隆形成率高于H460细胞且差异均有统计学意义(t=7.99,P=0.015;t=6.75,P=0.019;t=12.03,P=0.005),这表明肺癌A549细胞比H460细胞的辐射抗性强(图 1)。
|
图 1 137Cs γ射线照射对肺癌A549细胞和H460细胞的克隆形成率的影响 Figure 1 Clone forming rate of the A549 and H460 lung cancer cells after irradiated by 137Cs γ ray |
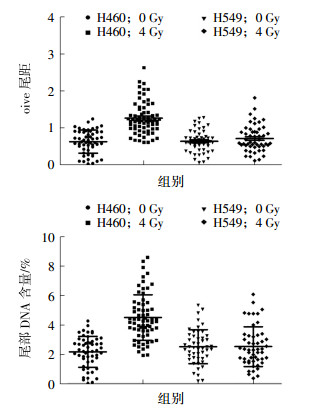
肺癌A549细胞和H460细胞经4 Gy 137Cs γ射线照射后2 h DNA的损伤修复结果见图 2,H460细胞的olive尾距值为1.27±0.05,A549细胞的olive尾距值为0.68±0.04。H460细胞的尾部DNA含量为(4.51±0.19)%,A549细胞的尾部DNA含量为(2.12±0.14)%。H460细胞的olive尾距值(t=8.69,P=0.04)和尾部DNA含量(t=10.30,P=0.023)均高于A549细胞,且差异均有统计学意义。H460细胞中存在明显的DNA损伤,而A549细胞中的DNA损伤基本无法通过彗星实验检测出来。这说明A549细胞的DNA损伤修复能力比H460细胞强。
|
图 2 4 Gy 137Cs γ射线照射后2 h肺癌A549和H460细胞DNA的损伤情况图中,A:单细胞凝胶电泳彗星olive尾距值比较;B:单细胞凝胶电泳彗星尾部DNA含量比较。DNA:脱氧核糖核酸。 Figure 2 DNA damage of the A549 and H460 lung cancer cells after 2 h irradiated by 4 Gy 137Cs γ ray |
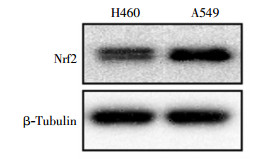
蛋白质印迹实验结果显示,肺癌A549细胞比H460细胞的Nrf2蛋白含量高(图 3)。经4 Gy 137Cs γ射线照射后2 h提取蛋白,结果发现A549和H460细胞中Nrf2蛋白含量都会升高,但A549细胞内Nrf2蛋白含量仍明显高于H460细胞(图 4)。
|
图 3 肺癌A549细胞和H460细胞中Nrf2蛋白的表达图中,Nrf2:核因子E2相关因子2。 Figure 3 Nrf2 protein level in A549 and H460 lung cancer cells |

|
图 4 4 Gy 137Cs γ射线照射后2 h肺癌A549细胞和H460细胞中Nrf2蛋白的表达图中,Nrf2:核因子E2相关因子2。 Figure 4 Nrf2 protein level in A549 and H460 lung cancer cells after 2 h irradiated by 4 Gy 137Cs γ ray |
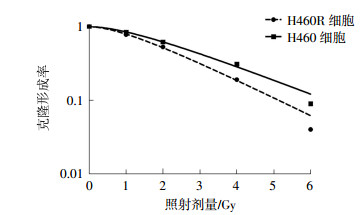
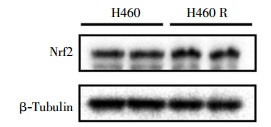
经1、2、4、6 Gy 137Cs γ射线照射后,H460R细胞的克隆形成率为(84.15±13.20)%、(62.27±9.25)%、(31.13±2.55)%、(9.34±1.07)%,与H460细胞的克隆形成率进行比较,两者经4、6 Gy 137Cs γ射线照射后克隆形成率的差异有统计学意义(t=9.24、10.33,均P<0.05),肺癌H460R细胞的辐射抗性明显强于H460细胞(图 5)。通过蛋白质印迹实验比较两种细胞内的Nrf2蛋白含量,结果发现肺癌H460R细胞中Nrf2蛋白含量高于H460细胞(图 6)。
|
图 5 137Cs γ射线照射对肺癌H460细胞和H460R细胞克隆形成率的影响 Figure 5 Clone forming rate of the H460 and H460R cells after irradiated by 137Cs γ ray |
|
图 6 肺癌H460细胞和H460R细胞中Nrf2蛋白的表达图中,Nrf2:核因子E2相关因子2。 Figure 6 Nrf2 protein level in H460 and H460R cells |
放疗是一种有效的、被广泛应用的癌症治疗手段,其治疗原理是电离辐射可以直接或间接造成DNA损伤,进而诱发癌细胞的死亡。电离辐射可以造成直接DNA损伤,细胞内的水被电离产生的活性氧、自由基造成间接的DNA损伤。然而,一些癌细胞由于细胞周期调节基因的突变、DNA损伤修复基因的突变或氧化还原平衡调节基因的突变等产生了辐射抗性[10-11]。保持细胞内低水平活性氧是肿瘤细胞产生辐射抗性的重要原因,已有文献报道抗氧化酶系统过度活化导致肿瘤细胞产生辐射抗性,抑制抗氧化系统的突变可以增强肿瘤细胞的辐射敏感性[12]。
Nrf2是一系列抗氧化基因的转录调节器,有研究发现,通过调节Nrf2可以提高白血病和甲状腺癌的化疗效果[13]。在NSCLC中有8%~11%存在Nrf2/Keap1信号通路的突变,Nrf2过表达可以促进肿瘤的增殖,导致肿瘤细胞的放化疗抵抗,抑制Nrf2过表达可以增强这些细胞的放化疗敏感性[2, 9]。不同的肺癌细胞对γ射线表现出不同的辐射抗性。我们猜想,不同癌细胞的辐射抗性或许与它们的Nrf2蛋白含量有关,即细胞系中Nrf2蛋白的含量越高其辐射抗性越强。通过克隆形成实验和彗星实验,我们比较了A549细胞和H460细胞对γ射线的敏感性,通过蛋白质印迹实验比较了二者Nrf2蛋白的含量以及照射后Nrf2含量的变化。结果证实,Nrf2蛋白含量高的A549细胞对γ射线的辐射抗性强于Nrf2蛋白含量低的H460细胞。使用单细胞凝胶电泳检测细胞DNA损伤的过程中,较大(6 Gy)和较小剂量(2 Gy)照射都不能很好地区分两种细胞DNA损伤的差别,4 Gy照射后2 h比较两种细胞的olive尾距值和尾部DNA含量,可以明显看出H460细胞比A549细胞的DNA损伤严重。在受到照射后,两种细胞的Nrf2蛋白含量都有增加,但A549细胞的Nrf2蛋白含量仍明显高于H460细胞,证明在受到γ射线照射后,Nrf2蛋白含量较高的A549细胞表现出更强的细胞保护作用。由此可见,较高水平的Nrf2蛋白含量可能是A549细胞比H460细胞辐射抗性更强的一种原因。小剂量照射筛选出的H460R细胞比H460细胞辐射抗性强,并且Nrf2蛋白含量较高,表明Nrf2是影响H460细胞辐射敏感性的重要因素。
探寻肿瘤细胞辐射敏感性的标志物有助于我们提高肿瘤放疗的疗效和进行肿瘤个体化精准治疗。近年来的研究发现,Nrf2会影响肺癌的发生、发展及临床治疗[14-15],所以详细阐明Nrf2与肺癌细胞生物活性的关系具有重要意义。我们的实验结果证明Nrf2可能是A549和H460两种细胞具有不同辐射敏感性的原因,所以Nrf2有望成为一种评价不同细胞辐射敏感性的标志物。我们只比较了两种细胞,要想确定Nrf2可以作为一种辐射敏感性评价标志物还应比较更多细胞。另外,影响细胞辐射敏感性的原因还有很多,在研究Nrf2与细胞辐射敏感性的过程中还要综合考虑其他影响因素。在临床放疗治疗癌症的过程中,针对肿瘤细胞Nrf2过表达的患者,我们可以研发合适的Nrf2抑制剂来增强肿瘤细胞的辐射敏感性,达到更好的临床治疗效果。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 孙晓辉负责研究命题的设计、研究过程的实施、数据的获取分析、论文的起草撰写等;孔阳阳、路倩颖负责实验实施和数据分析;徐畅、王彦、杜丽清、纪凯华、何宁宁、王芹提供方法学指导和论文审阅;刘强负责研究命题的提出、论文的最终审阅。
| [1] | Lee S, Lim MJ, Kim MH, et al. An effective strategy for increasing the radiosensitivity of human lung cancer cells by blocking Nrf2-dependent antioxidant responses[J]. Free Radic Biol Med, 2012, 53(4): 807–816. DOI:10.1016/j.freeradbiomed.2012.05.038 |
| [2] | Singh A, Bodas M, Wakabayashi N, et al. Gain of Nrf2 function in non-small-cell lung cancer cells confers radioresistance[J]. Antioxid Redox Signal, 2010, 13(11): 1627–1637. DOI:10.1089/ars.2010.3219 |
| [3] | Loboda A, Damulewicz M, Pyza E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases:an evolutionarily conserved mechanism[J]. Cell Mol Life Sci, 2016, 73(17): 3221–3247. DOI:10.1007/s00018-016-2223-0 |
| [4] | Gorrini C, Harris IS, Mak TW. Modulation of oxidative stress as an anticancer strategy[J]. Nat Rev Drug Discov, 2013, 12(12): 931–947. DOI:10.1038/nrd4002 |
| [5] | Zucker SN, Fink EE, Bagati A, et al. Nrf2 amplifies oxidative stress via induction of Klf9[J]. Mol Cell, 2014, 53(6): 916–928. DOI:10.1016/j.molcel.2014.01.033 |
| [6] | Taguchi K, Motohashi H, Yamamoto M. Molecular mechanisms of the Keap1-Nrf2 pathway in stress response and cancer evolution[J]. Genes Cells, 2011, 16(2): 123–140. DOI:10.1111/j.1365-2443.2010.01473.x |
| [7] | Lu MC, Ji JA, Jiang ZY, et al. The Keap1-Nrf2-ARE Pathway As a Potential Preventive and Therapeutic Target:An Update[J]. Med Res Rev, 2016, 36(5): 924–963. DOI:10.1002/med.21396 |
| [8] | Kobayashi A, Kang MI, Watai Y, et al. Oxidative and electrophilic stresses activate Nrf2 through inhibition of ubiquitination activity of Keap1[J]. Mol Cell Biol, 2006, 26(1): 221–229. DOI:10.1128/MCB.26.1.221-229.2006 |
| [9] | Shibata T, Ohta T, Tong KI, et al. Cancer related mutations in NRF2 impair its recognition by Keap1-Cul3 E3 ligase and promote malignancy[J]. Proc Natl Acad Sci USA, 2008, 105(36): 13568–13573. DOI:10.1073/pnas.0806268105 |
| [10] |
刘佳, 高刚, 朴春南, 等.
调节肿瘤放射敏感性的miRNAs研究进展[J]. 国际放射医学核医学杂志, 2016, 40(2): 159–164.
DOI:10.3760/cma.j.issn.1673-4114.2016.02.015 Liu J, Gao G, Piao CN, et al. Progress of microRNAs in regulating tumor radiation sensitivity[J]. Int J Radiat Med Nucl Med, 2016, 40(2): 159–164. DOI:10.3760/cma.j.issn.1673-4114.2016.02.015 |
| [11] | Zhou S, Ye W, Shao Q, et al. Nrf2 is a potential therapeutic target in radioresistance in human cancer[J]. Crit Rev Oncol Hematol, 2013, 88(3): 706–715. DOI:10.1016/j.critrevonc.2013.09.001 |
| [12] | Moss RW. Do antioxidants interfere with radiation therapy for cancer?[J]. Integr Cancer Ther, 2007, 6(3): 281–292. DOI:10.1177/1534735407305655 |
| [13] |
张海燕, 孟欣, 都镇先, 等.
siNrf2对万珂诱导甲状腺癌细胞凋亡影响及其机制的探讨[J]. 中华肿瘤防治杂志, 2012, 19(3): 180–183, 196.
Zhang HY, Meng X, Du ZX, et al. Effects of siNrf2 on apoptosis of thyroid cancer cells induced by bortezomib and its meohanism[J]. Chin J Cancer Prev Treat, 2012, 19(3): 180–183, 196. |
| [14] |
冯稳, 张冰, 于庆凯.
核因子E2相关因子2在肺腺癌中的表达及临床意义[J]. 中国现代医学杂志, 2016, 26(4): 29–32.
DOI:10.3969/j.issn.1005-8982.2016.04.006 Feng W, Zhang B, Yu QK. Expression and clinical significance of Nrf2 in pulmonary adenocarcinoma[J]. Chin J Mod Med, 2016, 26(4): 29–32. DOI:10.3969/j.issn.1005-8982.2016.04.006 |
| [15] |
莫享阳, 乔洪源, 欧阳学农, 等.
Keap1/Nrf2/ARE信号通路介导非小细胞肺癌耐药机制的研究进展[J]. 现代肿瘤医学, 2015, 23(9): 1322–1324.
DOI:10.3969/j.issn.1672-4992.2015.09.45 Mo XY, Qiao HY, Ouyang XN, et al. Research progress on Keap1/Nrf2/ARE signaling pathways mediating the drug resistance mechanisms in non-small cell lung cancer[J]. J Mod Oncol, 2015, 23(9): 1322–1324. DOI:10.3969/j.issn.1672-4992.2015.09.45 |
 2018, Vol. 42
2018, Vol. 42


