PET/MR作为多模态影像设备,优势之一是用PET技术定量分析放射性药物在活体组织内的代谢过程。然而对PET图像定量分析准确性影响较为严重的一个因素是所探测的γ光子在穿透人体时会被组织吸收而衰减,因此确定组织的衰减系数从而对γ光子的衰减进行校正成为PET显像中的关键技术之一[1]。在PET/CT显像中,是利用CT扫描直接获取人体组织的衰减系数图(μ map),然后将低能级宽能谱的X线(40~140 kV)衰减系数转换成高能级单一能量的511 keV γ光子的衰减系数[2]。然而在PET/MR显像中,MRI信号与组织对γ光子的衰减强度无关,因此无法直接用于PET的衰减校正[3]。
目前在PET/MR显像中,基于MRI的衰减校正方法有图集法和分割法。后者通过MRI信号强度把人体分割成不同的组织类型,然后分配其已知的衰减系数。这种分割法最大的挑战是难以得到骨骼的MRI信号,因为其T2弛豫时间非常短,很难在MRI图像上区分骨骼与空气,而二者又是衰减作用差异最大的。超短回波时间(ultrashort echo time,UTE)序列可以获得短T2的组织信号,如骨、肌腱和韧带,可以区分头部的颅骨、脑实质和空气,已用于PET/MR脑部显像的衰减校正[4-5]。
本研究的主要目的是基于UTE序列和CT的μ map对PET/MR采集的PET数据衰减校正,评价不同μ map得到的PET图像和定量比较两者μ map的差别,旨在了解PET/MR是否能够提供准确的定量诊断信息。
1 资料与方法 1.1 研究对象选取10名因肿瘤筛查而来我科接受PET/CT检查的受检者资料(男性4名,女性6名,年龄25~65岁),所有受检者脑部临床诊断及PET/MR检查均正常。10名受检者在自愿前提下,在脑PET/CT扫描后立即进行脑PET/MR扫描。本研究方案除增加检查时间外不增加受检者其他负担,所有受检者在接受PET/CT及PET/MR检查之前均签署了知情同意书。
1.2 数据采集 1.2.1 PET/CT采集使用德国西门子Biograph64 PET/CT系统(syngo6.5 2012A)进行临床常规脑图像采集。CT的毫安秒为110 mAs,管电压为120 kV,旋转时间是0.5 s,层厚3 mm。CT图像将进一步用于随后PET/MR显像中的PET衰减校正。
1.2.2 PET/MR采集使用德国西门子Biograph mMR PET/MR系统(VB18P)进行临床常规脑部采集。PET持续8 min的三维发射扫描,同时MRI进行UTE、T1、T2序列的扫描。其中和本研究有关的UTE序列的扫描参数:重复时间为11.94 ms,回波时间1为0.07 ms,回波时间2为2.46 ms,扫描视野为300 mm×300 mm,脉冲翻转角为10°,层厚为1.56 mm。
1.3 图像重建 1.3.1 UTE_μ map重建对UTE图像进行分割处理[5],并对分割的骨、脑实质和空气区域分别用其相应的线性衰减系数重新赋值:骨为0.1510/cm、脑实质为0.1000/cm、空气为0/cm,从而获得UTE_μ map。
1.3.2 CT_μ map重建以UTE_μ map为基准,使用美国MathWorks公司MATLAB 7.1软件和英国Friston等[6]开发的统计参数图(statistical parametric mapping,SPM)8对PET/CT系统扫描的CT图像进行空间配准与图像重切。配准结果通过分析左侧脑室最前缘、右侧动眼神经起始端和第二颈椎最上缘3个解剖标志点的吻合情况判断空间配准精度。配准后的CT图像经过计算转换成511 keV γ光子的衰减系数图(CT_μ map)[7]。相对于UTE_μ map,只有骨、脑实质和空气3种成分组成的衰减系数图,CT_μ map值是连续变化的,更接近于真值,是理想的金标准。
1.3.3 PETUTE重建使用PET/MR的RetroRecon软件重建PET图像:导入PET原始数据,选UTE_μ map用作衰减校正,重建方法为迭代,使用3次迭代和21个子集,图像矩阵为344 mm×344 mm,放大倍数为2.5,4 mm半高宽的高斯滤波,加散射校正。
1.3.4 PETCT重建使用PET/MR的RetroRecon软件重建PET图像:导入PET原始数据,选择CT_μ map用作衰减校正,其他条件同上。
1.4 图像处理及统计学分析 1.4.1 衰减系数图的比较及统计学分析使用德国西门子MMWP工作站TrueD软件融合UTE_μ map和CT_μ map,视觉比较两者差别;另外,还可以用Matlab7.1软件基于阈值法对μ map体素进行分割[8-9],使用配对t检验比较UTE_μ map和CT_μ map在颅脑骨、脑实质及空气的差异。
1.4.2 PET图像的比较及统计学分析PETUTE和PETCT原始DICOM格式数据经MRIcro 1.40软件处理,转化为SPM可分析数据格式。在Mtalab 7.1平台上用SPM8对图像进行预处理和统计学分析。图像预处理包括图像的标准化和平滑处理等;统计学分析包括参数设置/参数估计及对无效假设进行检验,并进行统计推断。在一定显著性水平(P<0.05)下进行成组资料t检验,获得平均差异图。
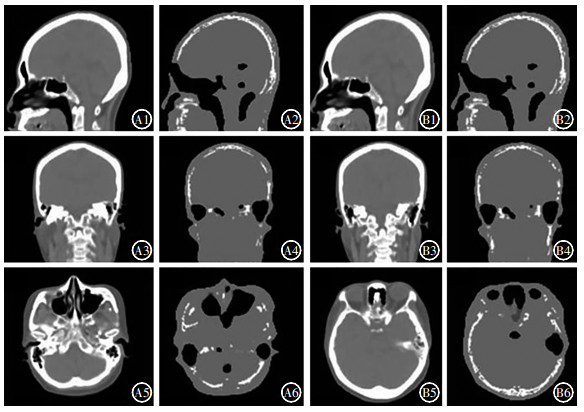
2 结果 2.1 衰减系数图的差异基于视觉评估未见CT_μ map与UTE_μ map有位置偏差,解剖标志点的位置偏差为(1.0±0.6)mm。基于阈值分割法计算出10名受检者UTE_μ map和CT_μ map在颅脑骨(t=-23.45,P < 0.05)和空气(t=5.29,P < 0.05)中的差异有统计学意义,差别分别为-64.8%±8.7%、74.8%±44.7%;在脑实质中的差异无统计学意义(t= -1.24,P>0.05),差别为-1.5%±3.9%。UTE_μ map低估的颅脑骨主要位置在枕骨、颞骨、蝶骨及筛骨。另外在鼻窦和外耳道这种组织与空气交界处,UTE_μ map显示含气空腔范围明显过多(图 1)。
|
图 1 UTE_μ map与CT_μ map区别 Figure 1 The difference between UTE_μ map and CT_μ map 受检者男性, 46岁。图中, UTE:超短回波时间; UTE_μ map (A2、A4、A6、B2、B4、B6)相比CT_μ map (A1、A3、A5、B1、B3、B5)明显低估颅脑骨和脑室分布, 且脑颅骨分布和位置也有差别, 主要表现在枕骨、颞骨、蝶骨及筛骨, 另外在鼻窦和外耳道组织与空气交界处, UTE_μ map显示空腔范围明显过多。UTE:超短回波时间; CT:计算机体层摄影术。 |
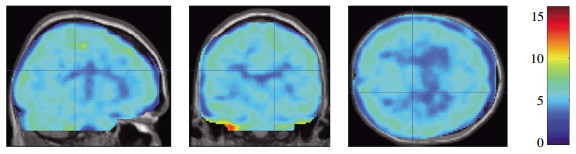
按照P<0.05阈值水平和在一定的体素阈值(k=100体素)下,将PETUTE代谢低估区域投射到三维立体图形,PETUTE组大脑代谢相对于PETCT组在脑组织距离颅骨和含气空腔越近区域代谢低估越严重(图 2)。
|
图 2 PETUTE与PETCT统计参数图分析结果 Figure 2 Statistical parametric mapping analysis of PETUTE and PETCT 图中, A:矢状位图; B:冠状位图; C:横断位图; PETUTE图像相对PETCT图像在脑组织距离颅骨和含气空腔越近区域代谢低估越严重。右侧色状条蓝色值为0表示两者代谢一致; 数值越大, 颜色越偏红色, 表示PETUTE代谢被低估越严重。PET:正电子发射断层显像术; UTE:超短回波时间; CT:计算机体层摄影术。 |
PET/MR在临床应用的最大挑战之一就是PET衰减校正问题,而脑部PET/MR的衰减校正方法的研究也持续受到学者们的关注[6-7, 10-13]。与其他研究目的一样,本研究旨在了解西门子Biograph mMR PET/MR(VB18P)UTE衰减校正方法对临床诊断的影响。
本研究发现在脑部PET/MR检查中,UTE序列可以较好地分割脑实质,但对于骨和含气空腔分割并不理想,主要因为UTE_μ map低估了对γ光子衰减最多的骨组织含量和高估了含气空腔的范围,同时,越接近骨的组织内γ光子被骨衰减的越多,所以越靠近骨和含气空腔的区域代谢低估越严重。
Dickson等[14]通过基于MRI和CT的衰减校正方法对25例患者PET神经系统的对照研究结果发现,MRI的衰减校正方法影响PET定量分析的准确性,与本研究结果一致。但Dickson等是对13例患者在PET/CT检查完成后立刻进行PET/MR检查,另外12例在PET/MR检查后立刻行PET/CT检查,其中可能存在不同设备、放射性核素的衰变以及神经系统的生理活动对代谢的影响,导致结果的不确定性。而我们对CT图像的配准处理用于UTE序列,并对同一PET数据进行衰减校正,完全避免了上述因素对PET代谢的影响。
根据研究结果,我们认为,目前PET/MR在神经系统疾病的临床应用中对PET代谢行定量分析时,需要结合μ map及MR常规序列初步判断定量分析区域是否有严重低估骨组织含量和高估含气空腔的范围。只有排除这些影响,PET图像才能提供相对可靠的定量分析结果。所以未来研究新的衰减校正方法和参数优化是提高PET结果准确性的重要方法。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘家金负责方法建立、现场试验、论文撰写;毕晓、党浩丹负责现场试验、论文撰写;富丽萍负责方法建立;尹大一、陈英茂、徐白萱负责论文审阅。
| [1] | Roy S, Wang WT, Carass A, et al. PET attenuation correction using synthetic CT from ultrashort echo-time MR imaging[J]. J Nucl Med, 2014, 55(12): 2071–2077. DOI:10.2967/jnumed.114.143958 |
| [2] | Zaidi H, Montandon ML, Alavi A. Advances in Attenuation Correction Techniques in PET[J]. PET Clin, 2007, 2(2): 191–217. DOI:10.1016/j.cpet.2007.12.002 |
| [3] | Martinez-Möller A, Souvatzoglou M, Delso G, et al. Tissue classification as a potential approach for attenuation correction in whole-body PET/MRI:evaluation with PET/CT data[J]. J Nucl Med, 2009, 50(4): 520–526. DOI:10.2967/jnumed.108.054726 |
| [4] | Schreibmann E, Nye JA, Schuster DM, et al. MR-based attenuation correction for hybrid PET-MR brain imaging systems using deformable image registration[J]. Med Phys, 2010, 37(5): 2101–2109. DOI:10.1118/1.3377774 |
| [5] | Keereman V, Fierens Y, Broux T, et al. MRI-based attenuation correction for PET/MRI using ultrashort echo time sequences[J]. J Nucl Med, 2010, 51(5): 812–818. DOI:10.2967/jnumed.109.065425 |
| [6] | Friston K. Introduction Experimental design and Statistical Parametric Mapping[J]. Human Brain Function, 2010, 4(6): 350–355. |
| [7] | Aasheim LB, Karlberg A, Goa PE, et al. PET/MR brain imaging:evaluation of clinical UTE-based attenuation correction[J]. Eur J Nucl Med Mol Imaging, 2015, 42(9): 1439–1446. DOI:10.1007/s00259-015-3060-3 |
| [8] | Chan TF, Vese LA. Active Contour Without Edges[J]. IEEE Trans Image Process, 2001, 10(2): 266–277. |
| [9] | Otsu N. A Threshold Selection Method from Gray-Level Histograms[J]. IEEE Trans syst man cybern, 1979, 9(1): 62–66. DOI:10.1109/TSMC.1979.4310076 |
| [10] | Delso G, Carl M, Wiesinger F, et al. Anatomic evaluation of 3-dimensional ultrashort-echo-time bone maps for PET/MR attenuation correction[J]. J Nucl Med, 2015, 55(5): 780–785. DOI:10.2967/jnumed.113.130880 |
| [11] | Delso G, Carl M, Wiesinger F, et al. Anatomic evaluation of 3-dimensional ultrashort-echo-time bone maps for PET/MR attenuation correction[J]. J Nucl Med, 2014, 55(5): 780–785. DOI:10.2967/jnumed.113.130880 |
| [12] | Delso G, Wiesinger F, Sacolick LI, et al. Clinical evaluation of zero-echo-time MR imaging for the segmentation of the skull[J]. J Nucl Med, 2015, 56(3): 417–422. DOI:10.2967/jnumed.114.149997 |
| [13] | Jena A, Taneja S, Goel R, et al. Reliability of semiquantitative 18F-FDG PET parameters derived from simultaneous brain PET/MRI:a feasibility study[J]. Eur J Radiol, 2014, 83(7): 1269–1274. DOI:10.1016/j.ejrad.2014.04.008 |
| [14] | Dickson JC, O'Meara C, Barnes A. A comparison of CT-and MR-based attenuation correction in neurological PET[J]. Eur J Nucl Med Mol Imaging, 2014, 41(6): 1176–1189. DOI:10.1007/s00259-013-2652-z |
 2018, Vol. 42
2018, Vol. 42


