2. 150081, 哈尔滨医科大学附属肿瘤医院PET/CT中心
2. PET/CT Center, Harbin Medical University Cancer Hospital, Harbin 150081, China(Tian MH, Liang BY
子宫内膜癌是发生于子宫内膜的上皮性恶性肿瘤,多见于围绝经期及绝经后的女性,我国每年子宫内膜癌的新发病例数约5万,死亡病例数约为1.8万[1],呈逐年上升趋势。文献报道,晚期子宫内膜癌的复发和死亡的风险很高,Ⅳ期子宫内膜癌的5年生存率仅为5%~15%[2]。为了提高子宫内膜癌患者治疗的有效性,临床医师需要判别患者的风险类别,以便制定最佳的治疗方案。
目前,18F-FDG PET/CT已被广泛应用于各种恶性肿瘤的分期及疗效监测,其半定量参数SUVmax是预测多种恶性肿瘤的侵袭性和预后的有效指标。有研究显示SUVmax和子宫内膜癌组织学预后因素之间存在相关性[3-9],但SUVmax仅代表肿瘤内某一点的代谢活动,不能反映整个肿瘤体积的代谢,因此引入了肿瘤代谢体积(metabolic tumor volume, MTV)和总糖酵解(total lesion glycolysis, TLG),这两个参数比SUVmax能更精确地反映肿瘤的生物学行为、预后和治疗后的反应[10]。有关MTV和TLG在子宫内膜癌术前评估价值的研究报道较少[11-16],因此本研究旨在分析18F-FDG PET/CT代谢参数对子宫内膜癌患者术前风险评估的有效性。
1 资料与方法 1.1 临床资料收集2008年8月至2017年1月于哈尔滨医科大学附属肿瘤医院手术前行PET/CT全身检查的44例子宫内膜癌患者,年龄38~76岁,平均年龄(54.89±7.61)岁;绝经前患者9例,绝经后患者35例。临床症状为不规则的阴道流血或阴道排液。所有患者于PET/CT检查后2周行手术治疗,术前均未行任何治疗,临床及影像资料完整,均经手术病理证实,排除了接受新辅助化疗或术前放疗的3例患者。检查前所有患者均签署了知情同意书。患者临床病理特征见表 1。
| 表1 44例子宫内膜癌患者的临床病理特征(例) Table 1 Clinic opathological features of endometrial 44 carcinoma patients |
根据肿瘤的侵袭性及临床病理特点,将患者分为高风险组(21例)和低风险组(23例)。低风险组患者包括:国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)分期为Ⅰ期,病理类型为子宫内膜样腺癌,组织学分级1级或2级,且肌层浸润深度<1/2,需同时满足以上条件。高风险组患者包括:非子宫内膜样腺癌,组织学分级为3级,且肌层浸润深度≥1/2[16]。
1.3 PET/CT检查方法采用美国GE公司生产的Discovery Elite PET/CT仪,显像剂18F-FDG由美国GE公司的Minitrace回旋加速器和化学合成系统自动合成,放化纯度>98%。患者禁食6 h以上,血糖控制在正常范围之内(6 mmol/L以下),按体质量静脉注射18F-FDG(5.55~7.40 MBq/kg),待患者平静休息60 min后,行全身PET/CT扫描。先采集CT图像,CT扫描参数:管电流140 mA,管电压120 kV,层厚3.75 mm,扫描时间0.5 s;采用二维模式采集PET图像:采集6~7个床位,每个床位采集2.5 min,矩阵为128×128。利用CT透射扫描数据对PET图像进行衰减校正,把校正后的PET图像与CT图像进行融合,分别得到矢状位、横断位及冠状位的融合图像。将数据传至Xeleris工作站进行图像融合。
1.4 图像分析由3名具有10年工作经验的PET/CT副主任医师进行综合分析,并将所有数据传至GE AW4.6工作站,用PET VCAR软件进行数据后处理,在图像上最大截面处测量出SUVmax,以SUVmax的40%为阈值,自动勾画出ROI,并在矢状位、横断位及冠状位3个图像上进行手工调整,将预测量的病灶全部都包括在ROI之内,软件自动生成MTV和TLG值。
1.5 统计学分析采用SPSS19.0软件进行统计学分析,两组SUVmax、MTV、TLG数据均用x±s来表示,采用Mann-Whithney U检验,绘制受试者工作特征(receiver operating characteristic,ROC)曲线,找出区分高风险组和低风险组的最佳截断点,并根据曲线下面积评估其诊断效能。P < 0.05表示差异有统计学意义。
2 结果子宫内膜的生理性摄取在PET图像上横断位通常表现为三角形或椭圆形,矢状位和冠状位呈斑片状或短线状;CT图像上未见子宫增大、腹水、盆腔包块等其他恶性征象,并且患者没有不规律阴道流血。PET图像上18F-FDG摄取形式均表现为条状、结节状或肿块状的异常放射性浓聚。
PET/CT图像示结节状或肿块状摄取,高、低风险组的SUVmax分别为14.54±6.54、13.06±8.51,差异无统计学意义(Z=-1.163,P=0.245)。高风险组的MTV[(17.86±19.32)mL]和TLG[(152.00±178.74)g]显著高于低风险组的MTV=[(7.38±5.00)mL]和TLG[(54.89±80.00)g],两组间差异均有统计学意义(Z=-2.808,P=0.005;Z=-3.395,P=0.001)。两组患者的典型18F-FDG PET/CT图像见图 1和图 2。
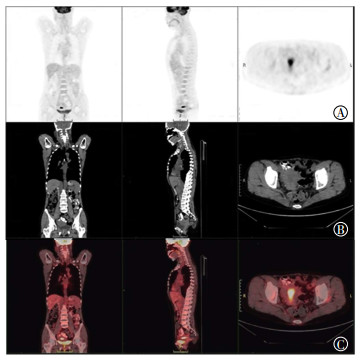
|
图 1 低风险组子宫内膜癌患者的18F-FDG PET/CT图像 Figure 1 18F-FDG PET/CT images of low-risk endometrial carcinoma patientFig.1 患者女性, 51岁, 已绝经。图中, A:PET图像的冠状位、矢状位和横断位; B:CT图像的冠状位、矢状位和横断位; C:PET/CT融合图像的冠状位、矢状位和横断位。病理类型为子宫内膜样腺癌, 分化程度为高分化, 肌层浸润深度 < 1/2, 无宫颈浸润、宫旁侵犯和淋巴结转移; CT上显示宫内膜增厚; PET上呈异常放射性浓聚, 最大标准化摄取值为14.2, 肿瘤代谢体积为2.09 mL, 总糖酵解量为18.12 g。FDG:氟脱氧葡萄糖; PET/CT:正电子发射断层显像计算机体层摄影术。 |
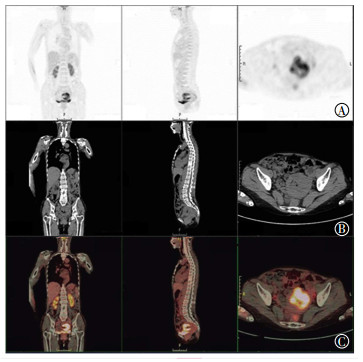
|
图 2 高风险组子宫内膜癌患者的18F-FDG PET/CT图像 Figure 2 18F-FDG PET/CT images of high-risk endometrial carcino-ma patient 患者女性, 67岁, 已绝经。图中, A:PET图像的冠状位、矢状位和横断位; B:CT图像冠状位、矢状位和横断位; C:PET/CT融合图像的冠状位、矢状位和横断位。病理类型为间质肉瘤, 分化程度为低分化, 肌层浸润深度>1/2, 无宫颈浸润、宫旁侵犯和淋巴结转移; CT示宫腔扩大, 宫内膜增厚; PET示呈不均匀放射性浓聚, 最大标准化摄取值为14.92, 肿瘤代谢体积为48.68 mL, 总糖酵解量为411.8 g。FDG:氟脱氧葡萄糖; PET/CT:正电子发射断层显像计算机体层摄影术。 |
ROC曲线分析结果发现,MTV和TLG可以预测高低风险组,曲线下面积分别为0.747和0.799,SUVmax不能预测高低风险组。以MTV=7.44 mL和TLG= 55.52 g为截断点预测效能最佳,其灵敏度、特异度、阳性预测值、阴性预测值和准确率分别为76%、61%、68%、72%、70%和81%、74%、77%、81%、78%(图 3)。
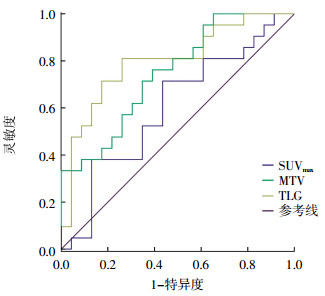
|
图 3 SUVmax、MTV、TLG预测子宫内膜癌风险分层的受试者工作特征曲线 Figure 3 Receiver operating characteristic curves for SUVmax, metabolic tumor volume, and total lesion glycolysis differentiating endometrial cancer risk stratification 图中, SUVmax:最大标准化提取值; MTV:肿瘤代谢体积; TLG:总糖酵解 |
子宫内膜癌的治疗方式以手术为主。其标准手术方案为筋膜外全子宫切除+双侧附件切除+盆腔和(或)腹主动脉旁淋巴结清扫术。然而,相关临床试验表明,盆腔和主动脉旁淋巴结清扫术并不能改善低风险子宫内膜癌患者的无疾病生存期或总生存期,并且淋巴结切除术还会增加手术并发症和发病的风险[17-18]。Kim等[19]发现PET/CT在检测淋巴结转移方面具有较高的特异度和阴性预测值,提示手术分期不佳的患者可以不需要淋巴结清扫术。因为评估淋巴结转移的程度对于治疗计划是必不可少的,而PET/CT在这方面有较大的优势,患者可以从中获益,并且可以提供患者的预后情况。Kitajima等[20]报道PET/CT检出转移性淋巴结的灵敏度、特异度和准确率分别为51.1%、99.8%和98.7%,研究结果提示PET/CT对转移性淋巴结检出的准确率主要取决于淋巴结的大小,直径≥10 mm的淋巴结,其检出率可高达100%,但是对于直径 < 4 mm的淋巴结,其检出率仅为12%。2015年12月欧洲ESMO-ESGO-ESTRO(European Society for Medical Oncology, European Society for Radiotherapy & Oncology, European Society of Gynaecological Oncology)[21]发布的关于子宫内膜癌诊治的专家共识指出,子宫内膜癌低危组(高分化且肌层浸润深度 < 1/2)的患者可以不进行淋巴结切除术,高危组(低分化且肌层浸润深度≥1/2)需进行全面的分期手术。本研究结果表明,18F-FDG PET/CT的代谢参数MTV和TLG可以作为将子宫内膜癌患者进行风险分类的有用参数,特别是那些可能不需要盆腔和腹主动脉旁淋巴结清扫的患者。
在本研究中,MTV和TLG可以区分高风险组和低风险组。此外,也有研究表明,MTV和TLG是预测子宫内膜癌患者复发或死亡的独立因素[11-12, 14]。
关于18F-FDG PET/CT的代谢参数在子宫内膜癌患者术前危险分层中的作用的研究报道较少。Tsujikawa等[22]发现高风险和低风险子宫内膜癌(FIGO分期为IA期和组织学分化为1级)的SUVmax(9.9±2.6和7.1±3.7)差异无统计学意义;Lee等[5]发现高风险组具有较高的SUVmax,将低风险组定义为:FIGO Ⅰ期或Ⅱ期,子宫内膜样腺癌,组织学分级为1级或2级,侵袭程度 < 子宫肌层的50%,肿瘤最大面积 < 2.0 cm,无宫颈浸润和淋巴管间质的浸润;两组的SUVmax分别为12.1±6.1和5.8±2.8,差异有统计学意义。并且SUVmax的最佳截断点为8.7,灵敏度为76%、特异度为90%、准确率为82%。
在本研究中,高风险组和低风险组的SUVmax差异无统计学意义,提示其不能区分高低风险组,这与Tsujikawa等[22]的研究结果相同。而Lee等[5]证明了SUVmax评估术前风险的有效性,同样张凤仙等[23]研究结果也表明SUVmax在子宫内膜癌深肌层浸润评估中有一定的意义,对术前淋巴结转移及其他转移灶的诊断有较高的特异度及阴性预测值,对术前淋巴结转移及复发病灶也具有较高的特异度及阴性预测值。3项研究的差异可能是由于患者数量的差异以及对高低风险分层的定义不同。Haldorsen和Salvesen[24]通过分析确定高风险患者这些参数的临界值具有相对广泛的范围:SUVmax > 9~18,MTV> 9~30 mL,TLG >56~70 g,用于预测高风险截断值的这种变化可能是由于研究中不同的患者队列以及后处理方法的标准化(例如,手动ROI的勾画区域和SUV的不同阈值),因此,需要进一步的研究来验证标准化代谢参数。然而,在本研究中,MTV和TLG在区别高风险组和低风险组间差异有统计学意义,ROC曲线下面积分别为0.747和0.799,表明这两个参数可以区分高低风险组以及对术前风险分层的诊断效能较高。Sudo等[15]评估了18F-FDG PET/CT在子宫内膜癌患者使用MRI进行一线风险评估后的二线风险评估的临床效用,结果发现在MRI上病变如果侵及深肌层,高SUVmax可能表明病变有淋巴管间质的侵犯,但是它可能无法预测病变的组织学分级,而在病变没有侵及深肌层的患者中,高TLG或MTV可能表明有淋巴管间质侵犯的风险。深肌层浸润的肿瘤往往比较大,因此它们的SUVmax相对不受局部容积效应的影响。相反,由于部分容积效应,使SUVmax可能低估了较小肿瘤的代谢活性。已知的可以影响子宫内膜癌患者预后的因素包括FIGO分期、病理类型为非子宫内膜样腺癌、组织学分化较差、子宫肌层浸润深度>1/2、宫颈间质的浸润、卵巢转移、盆腔及腹主动脉淋巴结转移[25],但是这些风险因素都只能通过手术获得,PET/CT作为一种无创性的诊断方法对子宫内膜癌患者进行术前的风险评估,可以预测病变的侵袭程度,从而可以为患者的个体化治疗提供理论依据。
本研究存在的局限性:(1)样本量太小;(2)子宫内膜存在生理性摄取,需注意排除假阴性病例。
总之,18F-FDG PET/CT的代谢参数MTV和TLG可以更有效地区别子宫内膜癌的高低风险,这两个参数可以在术前无创性地对子宫内膜癌患者进行风险分层评估,有助于临床医师为患者制定最佳的治疗方案,特别是针对是否需要盆腔和腹主动脉旁淋巴结清扫术的患者。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 龚伟负责论文撰写、数据处理;于丽娟负责课题建立、整体结构设计、论文审阅、修改;田墨涵负责论文审阅、修改;梁邦玉负责实验数据及方法的选择。
| [1] |
廖琴平, 杨曦.
子宫内膜癌筛查及早期诊断的现状及展望[J]. 实用妇产科杂志, 2015, 31(7): 481–484.
Liao QP, Yang X. Current status and Prospect of screening andearly diagnosis of endometrial cancer[J]. J Pract Obstet Gynecol, 2015, 31(7): 481–484. |
| [2] | Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009[J]. CA Cancer J Clin, 2009, 59(4): 225–249. DOI:10.3322/caac.20006 |
| [3] | Nakamura K, Kodama J, Okumura Y, et al. The SUVmax of 18F-FDG PET correlates with histological grade in endometrial cancer[J]. Int J Gynecol Cancer, 2010, 20(1): 110–115. DOI:10.1111/IGC.0b013e3181c3a288 |
| [4] | Nakamura K, Hongo A, Kodama J, et al. The measurement of SUVmax of the primary tumor is predictive of prognosis for patients with endometrial cancer[J]. Gynecol Oncol, 2011, 123(1): 82–87. DOI:10.1016/j.ygyno.2011.06.026 |
| [5] | Lee HJ, Ahn BC, Hong CM, et al. Preoperative risk stratification using 18F-FDG PET/CT in women with endometrial cancer[J]. Nuklearmedizin, 2011, 50(5): 204–213. DOI:10.3413/nukmed-0375-10-12 |
| [6] | Kitajima K, Kita M, Suzuki K, et al. Prognostic significance of SUVmax (maximum standardized uptake value) measured by[J]. Eur J Nucl Med Mol Imaging, 2012, 39(5): 840–845. DOI:10.1007/s00259-011-2057-9 |
| [7] | Antonsen SL, Jensen LN, Loft A, et al. MRI, PET/CT and ultrasound in the preoperative staging of endometrial cancer-a multicenter prospective comparative study[J]. Gynecol Oncol, 2013, 128(2): 300–308. DOI:10.1016/j.ygyno.2013.01.019 |
| [8] | Walentowicz-Sadlecka M, Malkowski B, Walentowicz P, et al. The preoperative maximum standardized uptake value measured by 18F-FDG PET/CT as an independent prognostic factor of overall survival in endometrial cancer patients[J/OL]. Biomed Res Int, 2014, 2014: 234813[2017-11-28]. https: //www. hindawi. com/journals/bmri/2014/234813/. DOI: 10.1155/2014/234813. |
| [9] | Ghooshkhanei H, Treglia G, Sabouri G, et al. Risk stratification and prognosis determination using 18F-FDG PET imaging in endometrial cancer patients:a systematic review and meta-analysis[J]. Gynecol Oncol, 2014, 132(3): 669–676. DOI:10.1016/j.ygyno.2014.01.039 |
| [10] | Pak K, Cheon GJ, Nam HY, et al. Prognostic value of metabolic tumor volume and total lesion glycolysis in head and neck cancer:a systematic review and meta-analysis[J]. J Nucl Med, 2014, 55(6): 884–890. DOI:10.2967/jnumed.113.133801 |
| [11] | Liu FY, Chao A, Lai CH, et al. Metabolic tumor volume by 18F-FDG PET/CT is prognostic for stage IVB endometrial carcinoma[J]. Gynecol Oncol, 2012, 125(3): 566–571. DOI:10.1016/j.ygyno.2012.03.021 |
| [12] | Chung HH, Lee I, Kim HS, et al. Prognostic value of preoperative metabolic tumor volume measured by 18F-FDG PET/CT and MRI in patients with endometrial cancer[J]. Gynecol Oncol, 2013, 130(3): 446–451. DOI:10.1016/j.ygyno.2013.06.021 |
| [13] | Crivellaro C, Signorelli M, Guerra L, et al. Tailoring systematic lymphadenectomy in high-risk clinica l early stage endometrial cancer:the role of 18F-FDG PET/CT[J]. Gynecol Oncol, 2013, 130(2): 306–311. DOI:10.1016/j.ygyno.2013.05.011 |
| [14] | Shim SH, Kim DY, Lee DY, et al. Metabolic tumour volume and total lesion glycolysis, measured using preoperative 18F-FDG PET/CT, predict the recurrence of endometrial cancer[J]. BJOG, 2014, 121(9): 1097–1106. DOI:10.1111/1471-0528.12543 |
| [15] | Sudo S, Hattori N, Manabe O, et al. FDG PET/CT diagnostic criteria may need adjustment based on MRI to estimate the presurgical risk of extrapelvic infiltration in patients with uterine endometrial cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(5): 676–684. DOI:10.1007/s00259-014-2964-7 |
| [16] | Kitajima K, Suenaga Y, Ueno Y, et al. Preoperative risk stratification using metabolic parameters of 18F-FDG PET/CT in patients with endometrial cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(8): 1268–1275. DOI:10.1007/s00259-015-3037-2 |
| [17] | Benedetti PP, Basile S, Maneschi F, et al. Systematic pelvic lymphadenectomy vs. no lymphadenectomy in early-stage endometrial carcinoma:randomized clinical trial[J]. J Natl Cancer Inst, 2008, 100(23): 1707–1716. DOI:10.1093/jnci/djn397 |
| [18] | Kitchener H, Swart AM, Qian Q, et al. Efficacy of systematic pelvic lymphadenectomy in endometrial cancer (MRC ASTEC trial):a randomised study[J]. Lancet, 2009, 373(9658): 125–136. DOI:10.1016/S0140-6736(08)61766-3 |
| [19] | Kim HJ, Cho A, Yun M, et al. Comparison of FDG PET/CT and MRI in lymph node staging of endometrial cancer[J]. Ann Nucl Med, 2016, 30(2): 104–113. DOI:10.1007/s12149-015-1037-8 |
| [20] | Kitajima K, Murakami K, Yamasaki E, et al. Accuracy of integrated FDG-PET/contrast-enhanced CT in detecting pelvic and paraaortic lymph node metastasis in patients with uterine cancer[J]. Eur Radiol, 2009, 19(6): 1529–1536. DOI:10.1007/s00330-008-1271-8 |
| [21] | Colombo N, Creutzberg C, Amant F, et al. ESMO-ESGO-ESTRO Consensus Conference on Endometrial Cancer:diagnosis, treatment and follow-up[J]. Ann Oncol, 2016, 27(1): 16–41. DOI:10.1093/annonc/mdv484 |
| [22] | Tsujikawa T, Yoshida Y, Kudo T, et al. Functional images reflect aggressiveness of endometrial carcinoma:estrogen receptor expression combined with 18F-FDG PET[J]. J Nucl Med, 2009, 50(10): 1598–1604. DOI:10.2967/jnumed.108.060145 |
| [23] |
张凤仙, 张建, 陈素芸, 等.
18F-FDG PET/CT显像SUVmax对子宫内膜癌术前浸润及转移的评估价值[J]. 中华核医学与分子影像杂志, 2017, 37(2): 75–80.
DOI:10.3760/cma.j.issn.2095-2848.2017.02.003 Zhang FX, Zhang J, Chen SY, et al. Value of 18F-FDG PET/CT SUVmax for preoperative assessment of primary tumor infiltration and metastases in patients with endometrial cancer[J]. Chin J Nucl Med Mol Imaging, 2017, 37(2): 75–80. DOI:10.3760/cma.j.issn.2095-2848.2017.02.003 |
| [24] | Haldorsen IS, Salvesen HB. What is the best preoperative imaging for endometrial cancer?[J]. Curr Oncol Rep, 2016, 18(4): 25. DOI:10.1007/s11912-016-0506-0 |
| [25] | Wright JD, Barrena MNI, Sehouli J, et al. Contemporary management of endometrial cancer[J]. Lancet, 2012, 379(9823): 1352–1360. DOI:10.1016/S0140-6736(12)60442-5 |
 2018, Vol. 42
2018, Vol. 42


