肺癌是全球发病率较高的恶性肿瘤,同时也是我国病死率增长较快的肿瘤,且发病年龄也呈年轻化趋势[1-2]。根据病理类型,肺癌可分为小细胞肺癌和非小细胞肺癌[3]。肺癌的发病原因还不十分清楚,有研究发现其与吸烟、长期遭受空气污染和职业中接触致癌物等密切相关[4-6]。放疗是肺癌治疗的重要手段之一[7-8],随着治疗的进程,肿瘤细胞会产生辐射耐受性,而加大放疗剂量势必给患者带来严重的不良反应及并发症,并严重影响患者的生活质量[9-10]。因此,寻找肺癌细胞产生耐辐射的机制,改变放射敏感性调节相关基因、miRNA等的表达水平和功能,靶向地增加肺癌细胞的放疗敏感性,从而提升患者的放疗疗效,一直是肺癌治疗基础研究的热点。
近年来,有研究发现miRNA能够通过调控某些基因的表达及信号通路来参与调节肿瘤细胞的放射敏感性[11-12]。miR-148a是近年来新发现的一种高度保守的miRNA,其前体序列位于人类第7号染色体短臂1区5带[13]。大量的研究结果表明,miR-148a的表达水平与肺癌的发生发展呈负相关[14-15]。miR-148a能够抑制肺癌细胞增殖,同时抑制非小细胞肺癌的浸润与迁移[16]。miR-148a可以通过抑制雌激素受体(estrogen receptor,ER)的表达水平,进而抑制乳腺癌的发生发展及迁移[17]。但有关miR-148a与ER在肺癌细胞中的关系,以及miR-148a是否能够调控肺癌细胞的放射敏感性,迄今为止尚不清楚。我们通过分析miR-148a过表达对肺癌A549、H460和H1299细胞系放射敏感性的影响,为探索肺癌放疗增敏的新途径提供实验依据和理论基础。
1 材料与方法 1.1 试剂与仪器人肺癌A549、H460和H1299细胞购自美国ATCC细胞库;MTT、聚偏氟乙烯膜、实时定量PCR试剂盒均购自美国赛默飞生物有限公司;姬姆萨染色液(G8220-10 g)购自北京索莱宝生物科技有限公司;兔抗人ER抗体购自美国Proteintech公司;小鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)抗体及山羊抗兔和(或)小鼠免疫球蛋白G购于英国Abcam公司。137Cs γ射线照射源由加拿大原子能有限公司生产(Autocell40);ChemiDoc MP凝胶成像系统由美国BIO-RAD公司生产;ABI 7500型实时荧光定量PCR仪由美国Applied Biosystems公司生产;RT-6500酶标分析仪由深圳雷杜生命科学股份有限公司生产。
1.2 细胞培养、分组及照射 1.2.1 细胞培养人肺癌A549、H460及H1299细胞分别采用含10%胎牛血清的RPMI-1640培养液,于含5% CO2的37 ℃恒温培养箱中培养,待细胞生长至密度约为80%时进行传代亚培养。选择处于对数生长期的肿瘤细胞进行实验。
1.2.2 细胞分组我们前期预实验结果显示,miR-148a在肺癌A549、H1299细胞中的表达水平相对较低,且细胞放射敏感性也较低;而miR-148a在H460细胞中的表达水平较高,且细胞放射敏感性也相对较高。因此,根据细胞放射敏感性的不同以及内源miR-148a的表达情况,分别按以下方式进行分组。(1)将肺癌A549和H460细胞分别分为3组:空白对照组、4 Gy γ射线照射组、8 Gy γ射线照射组,采用实时定量PCR检测miR-148a的表达水平;(2)将肺癌A549细胞分为2组:空白对照组、miR-148a转染组;同时,将肺癌细胞H460分为2组:空白对照组、anti-miR-148a转染组。分别对转染的2组细胞进行不同剂量(0、2、4、8 Gy)的γ射线照射,采用克隆形成实验方法来检测细胞增殖情况;(3)将A549细胞分为2组:ER-3’ UTR(长非编码区域)-野生型报告基因载体转染组、ER-3’ UTR-突变型报告基因载体转染组,同时分别转染不同剂量(0、50、100 nmol)的miR-148a,采用报告基因实验检测荧光素酶活性;(4)将H460细胞分为2组:ER-3’ UTR-野生型报告基因载体转染组,ER-3’ UTR-突变型报告基因载体转染组,同时分别转染不同剂量(0、50、100 nmol)的anti-miR-148a,采用双荧光素酶报告基因实验检测荧光素的酶活性;(5)将肺癌A549和H1299细胞分别分为3组:空白对照组、miR-148a单独处理组、miR-148a和ER共转染组,并对3组细胞进行不同剂量(0、2、4、8 Gy)的γ射线照射,采用克隆形成实验检测细胞增殖情况;(6)将肺癌H460细胞分为3组:空白对照组、anti-miR-148a单独处理组、anti-miR-148a和ER siRNA共转染组,并对3组细胞进行不同剂量(0、2、4、8 Gy)的γ射线照射,采用克隆形成实验检测细胞增殖情况。
1.2.3 细胞照射采用137Cs γ射线照射源进行照射,照射剂量分别为0、2、4和8 Gy,剂量率为1 Gy/min。
1.3 MiR-148a及ER过表达载体的细胞转染转染前1 d,将细胞接种于六孔板中,每孔加入约2 mL无抗生素培养基,使转染时的细胞密度能够达到50%。取2 μL/孔Lipofectamine 3000与50 μL/孔Opti-MEM混匀后室温下孵育5 min;取50/100 nmol miR-148a和(或)anti-miR-148a mimics(由华大基因科技有限公司合成)或pcDNA-ER过表达载体(本次实验构建)/100 nmol ER siRNA(由华大基因科技有限公司合成)与50 μL/孔Opti-MEM混匀后室温孵育5 min。将以上2步所得溶液混匀,室温下放置30 min,即为转染液。将转染液加入含有细胞及培养液的孔中,轻轻摇晃孔板,使转染液与培养液混匀,于37℃的CO2培养箱中培养6 h后可将培养基换成含血清的完全培养基。
1.4 克隆形成实验肺癌细胞接受瞬时转染及不同剂量照射后,按不同的照射剂量接种相同数量细胞至60 mm培养皿中。细胞连续培养2周后用甲醇固定,姬姆萨染液染色,计数细胞数≥50个的克隆个数。计算克隆形成率和存活分数,其中,克隆形成率=(空白对照组克隆数/实验组细胞数)×100%;存活分数=实验组克隆数/(实验组细胞数×克隆形成率),并按多靶单击模型拟合绘制细胞存活曲线。
1.5 Western blot收集瞬时转染并接受γ射线照射后的细胞,用细胞裂解液冰上裂解,提取总蛋白,采用聚氰基丙烯酸正丁酯法进行蛋白定量。取各组等量蛋白用聚丙烯酰胺凝胶电泳分离,转膜、封闭后,分别加入兔抗人ER抗体(1 : 1000稀释)和小鼠抗人GAPDH(1 : 6000稀释)作为内参抗体,4 ℃孵育过夜。次日洗膜,然后加入辣根过氧化物酶标记的山羊抗兔和(或)小鼠免疫球蛋白G(1 : 5000稀释),室温下孵育1 h,洗膜后显色,用凝胶成像系统采集成像。
1.6 双荧光素酶报告基因实验(1)将报告基因载体和真核表达载体等共转染至细胞中,用海肾荧光素酶表达载体pRL-TK作为内参;(2)细胞转染48 h后,室温下用不含钙镁离子的PBS洗两次细胞;(3)裂解细胞:用ddH2O将5×Passive LysisBuffer(PLB)稀释成1× PLB,向细胞中加入1× PLB,每孔100 μL。培养板置于水平摇床上震荡30 min,保证细胞充分裂解,然后用移液器将细胞裂解液转入透光度较好的1.5 mL离心管中;(4)报告基因活性测定:将荧光素酶底物冻干粉溶于10 mL的荧光素酶实验缓冲液Ⅱ(Luciferase Assay Buffer Ⅱ),配置成荧光素酶实验反应液Ⅱ(Luciferase Assay ReagentⅡ,LARⅡ);按50 : 1的比例用Stop & Glo® Buffer稀释Stop & Glo® Substrate,配制所需Stop & Glo® ReagentⅡ;(5)按照仪器说明书操作,测定延迟为2 s,测试时间为10 s,加入100 μL LAR Ⅱ和Stop & Glo® Reagent;吸取待测样品100 μL加入到离心管底部,再吸取LAR Ⅱ 100 μL加入到管底,轻柔吹吸6次混匀,立即进行测定,结果记录为firefly luciferase的发光值;吸取100 μL Stop & Glo® Reagent加入管底,轻轻吹吸6次混匀,立即进行测定,记录Renilla luciferase的发光值;(6)统计数据并分析双荧光报告基因的结果。第1次的荧光数值与第2次数值的比值为报告基因的相对活性值。每组实验均重复3次,以均数±标准差表示。
1.7 实时定量PCR检测miR-148a和ER mRNA的表达收集细胞,采用TRIzol法提取细胞RNA,反转录获得cDNA,检测miR-148a和ER mRNA的表达,同时检测U6及GAPDH mRNA的表达作为内参。PCR扩增条件:95℃预变性30 s,95 ℃变性30 s,60℃退火30 s,72℃延伸30 s,循环40次。数据采用2-ΔΔCt法进行分析。实验所需引物来源于GenBank以及miRBase数据库,通过Primer Premier 5软件进行引物设计,具体序列如下:
① GAPDH引物序列:
正向5′-GGA GCG AGA TCC CTC CAA AAT-3′;
反向5′-GGC TGT TGT CAT ACT TCT CAT GG-3′;
② U6引物序列:
正向5′-AGA GCC TGT GGT GTC CG-3′;
反向5′- CAT CTT CAA AGC ACT TCC CT-3′;
③ miR-148a引物序列:
正向5′- TCA GTG CAC TAC AGA ACT TTG T-3′;
反向5′-GCG AGC ACA GAA TTA ATA CGA C-3′
④ ER引物序列:
正向5′- TAT GCT TCA GGC TAC CAT TAT-3′;
反向5′- TTC GTA TCC CAC CTT TCA T-3′
1.8 TUNEL检测将处理后的肺癌细胞用DNA荧光染料碘化丙啶染色液进行细胞核染色10 min;然后浸入至0.01 mol/L的PBS内清洗3次;4%甲醛固定25 min(4 ℃);0.2% Triton X-100孵育5 min;用PBS洗2次,每次5 min;加入荧光标记反应液,37 ℃避光孵育60 min;再用PBS洗2次,每次5 min;滴加荧光抗萃灭剂封片,荧光显微镜520 nm下观察TUNEL染色结果,620 nm下观察碘化丙啶染色结果。根据实验结果统计并绘制柱状图。
1.9 统计学分析应用IBM SPSS Statistics 21软件进行统计学分析。原始数据均服从正态分布和方差齐性,采用Student t-test进行组间差异性分析,组间比较采用t检验。P < 0.05表示差异有统计学意义。
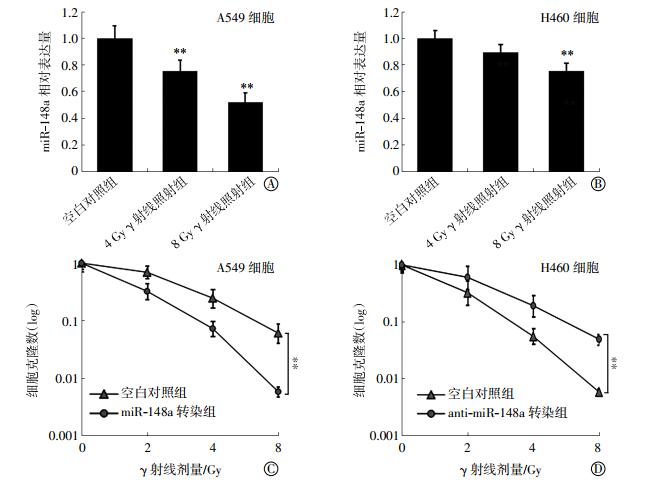
2 结果 2.1 MiR-148a过表达对肺癌细胞放射敏感性的影响实时定量PCR结果显示(图 1中A),与空白对照组相比,4 Gy γ射线照射和8 Gy γ射线照射能够显著下调肺癌A549细胞中miR-148a的表达水平,差异有统计学意义(t=10.18、11.66,均P < 0.01);另外与空白对照组相比,4 Gy γ射线照射对H460细胞中miR-148a表达水平无显著影响,差异无统计学意义(t=3.17,P>0.05),但8 Gy γ射线照射能够显著下调肺癌H460细胞中miR-148a的表达水平,差异有统计学意义(t=10.95,P < 0.01)(图 1中B)。克隆形成实验结果显示(图 1中C、D),与空白对照组相比,miR-148a转染能够显著增强A549细胞的放射敏感性,差异有统计学意义(t=12.16,P < 0.01),而anti-miR-148a转染能够显著降低H460细胞的放射敏感性,差异有统计学意义(t=11.93,P < 0.01)。以上实验结果表明,照射能够诱导肺癌细胞中miR-148a的表达水平下调,而miR-148a过表达能有效增强肺癌细胞对γ射线的放射敏感性。
|
图 1 MiR-148a对肺癌A529和H460细胞放射敏感性的影响 图中,A:实时定量PCR结果显示,与空白对照组比较,4 Gy和8 Gy照射能够显著下调A549细胞中miR-148a的表达水平(**:t=10.18、11.66,均P < 0.01);B:与空白对照组比较,4 Gy γ射线照射对H460细胞中miR-148a表达水平无显著影响(t=3.17,P>0.05),但8 Gy γ射线照射能够显著下调H460细胞中miR-148a的表达水平(**:t= 10.95,P < 0.01);C、D:克隆形成实验结果显示,与空白对照组比较,miR-148a转染能够显著增强A549细胞的放射敏感性(**:t= 12.16,P < 0.01);同时,anti-miR-148a转染能够显著降低H460细胞的放射敏感性(**:t=11.93,P < 0.01)。PCR:聚合酶链反应。 Figure 1 The effect of miR-148a on the radiosensitivity of lung cancer A549 and H460 cells |
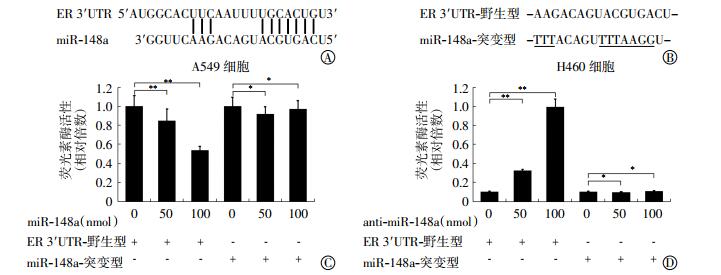
信息学分析(t=_blank>http://www.targetscan.org/vert_71/)提示了ER的3′ UTR(untranslated region)序列中受miR-148a直接调控的模序(图 2中A)。同时,将该模序进行突变并克隆(图 2中B),通过报告基因实验检测miR-148a对突变前后的ER-3′ UTR序列的调控作用。双荧光素酶报告基因实验结果显示,miR-148a能够抑制野生型ER-3′ UTR的荧光素酶活性(t=11.52、12.78,均P < 0.01),但对突变型ER-3′ UTR的荧光素酶活性无显著影响,差异无统计学意义(t=1.97、2.32,均P>0.05)(图 2中C);另外,anti-miR-148a能够增强野生型ER-3′ UTR的荧光素酶活性,差异有统计学意义(t=11.98、13.22,均P < 0.01),但对突变型ER-3′ UTR的荧光素酶活性无显著影响,差异无统计学意义(t=2.11、2.42,均P>0.05)(图 2中D)。以上实验结果表明,miR-148a能够在肺癌细胞中直接靶向调控野生型ER-3′ UTR序列。
|
图 2 MiR-148a对ER 3' UTR序列的靶向调控作用 图中,A:ER的3' UTR序列中受miR-148a直接调控的模序;B:ER-3' UTR序列突变示意图;C:MiR-148a能够抑制野生型ER-3' UTR的荧光素酶活性,差异有统计学意义(**:t=11.52、12.78,均P < 0.01),但对突变型ER-3' UTR的荧光素酶活性无显著影响,差异无统计学意义(*:t=1.97、2.32,均P>0.05);D:Anti-miR-148a能够增强野生型ER-3' UTR的荧光素酶活性(**:t=11.98、13.22,均P < 0.01),但对突变型ER-3' UTR的荧光素酶活性无显著影响,差异无统计学意义(*:t=2.11、2.42,均P>0.05)。ER:雌激素受体。 Figure 2 The direct regulation of miR-148a on the ER-3' UTR |
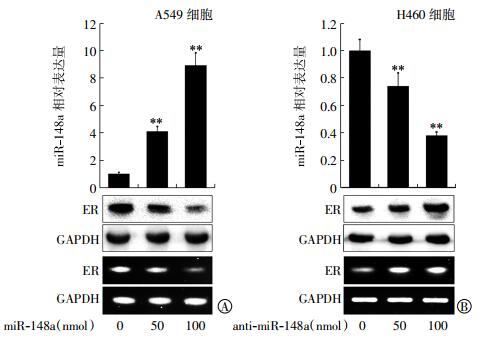
Western blot以及实时定量PCR实验结果显示,miR-148a过表达可以下调肺癌A549细胞中ER的mRNA及蛋白表达水平(图 3中A);另外,anti-miR-148a过表达可以上调肺癌H460细胞中ER的mRNA及蛋白表达水平(图 3中B)。同时,miR-148a及anti-miR-148a的转染差异有统计学意义(t=10.82、12.66、11.31、12.31,均P < 0.01)。这些实验结果表明,miR-148a能够在肺癌细胞中抑制ER的mRNA及蛋白表达水平。
|
图 3 MiR-148a或anti-miR-148a对肺癌A529和H460细胞中ER mRNA表达水平及蛋白表达水平的影响 图中,A:MiR-148a转染下调了A549细胞中ER的mRNA及蛋白表达水平;B:Anti-miR-148a转染上调了H460细胞中ER的mRNA及蛋白表达水平。**:MiR-148a及anti-miR-148a的转染差异有统计学意义(t=10.82、12.66、11.31、12.31,均P < 0.01)。ER:雌激素受体;GAPDH:甘油醛-3-磷酸脱氢酶。 Figure 3 The effects of miR-148a or anti-miR-148a on the expression of estrogen receptor at the mRNA and protein levels in A549 or H460 cells |
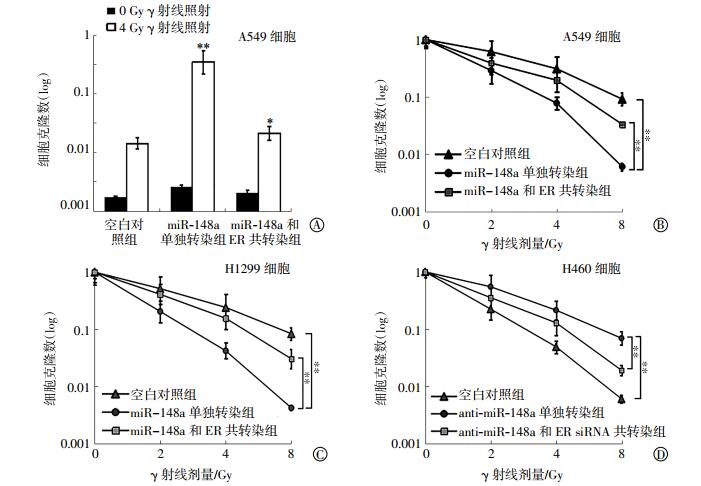
TUNEL染色实验显示(图 4中A),与空白对照组相比,miR-148a单独转染能够显著增强4 Gy γ射线照射对肺癌A549细胞的促凋亡作用,且差异有统计学意义(t=13.38,P < 0.01);而与miR-148a单独转染组比较,共转染了miR-148a和pcDNA-ER的A549细胞中,4 Gy γ射线照射所导致的凋亡作用显著降低,差异有统计学意义(t=6.47,P < 0.05)。克隆形成结果显示(图 4中B、C),与空白对照组相比,miR-148a单独转染能够显著提高肺癌A549和H1299细胞的放射敏感性,差异有统计学意义(t=12.91、13.44,均P < 0.01);而与miR-148a单独转染组比较,共转染了miR-148a和pcDNA-ER的肺癌细胞则出现明显放射敏感性下降,差异有统计学意义(t=11.34、12.68,均P < 0.01)。anti-miR-148a单独转染能够显著降低肺癌H460细胞的放射敏感性,且差异有统计学意义(t=12.51,P < 0.01),而共转染了anti-miR-148a和ER siRNA的肺癌细胞则出现明显放射敏感性升高,差异有统计学意义(t=10.96,P < 0.01)(图 4中D)。上述结果表明,miR-148a可以通过抑制ER的表达水平进而增强肺癌A549和H1299细胞的放射敏感性。
|
图 4 MiR-148a和ER对肺癌细胞凋亡作用及放射敏感性的影响 图中,A:与空白对照组比较,miR-148a单独转染能够显著增强4 Gy γ射线照射对A549细胞的促凋亡作用,差异有统计学意义(**:t=13.38,P < 0.01);而与miR-148a单独转染组比较,共转染了miR-148a和ER的A549细胞中,4 Gy γ射线照射所导致的凋亡作用显著降低,差异有统计学意义(*:t=6.47,P < 0.05);B、C:与空白对照组比较,miR-148a单独转染能够显著提高肺癌A549和H1299细胞的放射敏感性,差异有统计学意义(**:t=12.91、13.44,均P < 0.01),而与miR-148a单独转染组比较,共转染了miR-148a和ER的肺癌A549和H1299细胞则出现明显放射敏感性下降,差异有统计学意义(**:t=11.34、12.68,均P < 0.01);D:与空白对照组比较,anti-miR-148a单独转染能够显著降低肺癌H460细胞的放射敏感性,差异有统计学意义(**:t=12.51,P < 0.01),而与anti-miR-148a单独转染组比较,共转染了anti-miR-148a和ER siRNA的肺癌H460细胞则出现明显放射敏感性升高,差异有统计学意义(**:t=10.96,P < 0.01)。ER:雌激素受体。 Figure 4 Effects of miR-148a and estrogen receptor on the apoptosis and radiosensitivity of lung cancer cells |
肺癌是全球男性和女性发病率最高的肿瘤。同时,中国已成为肺癌发病率增长最快的国家之一,每年约有60万患者死于肺癌[2]。肺癌的引发因素有很多,其中吸烟是诱发肺癌的最主要因素[4]。在全球大部分国家中,90%的肺癌是由吸烟引起的[18]。目前,放疗是肺癌的主要治疗方法之一,但治疗过程中患者出现的放疗抵抗现象使治疗效果大大降低[19-20]。因此,寻找肺癌的耐辐射基因,减低或抑制耐辐射基因的表达或提高辐射增敏基因的表达,有效地增加肺癌的放疗敏感性,是近年对肺癌治疗的研究热点之一。
最近的研究结果发现,miR-148a能够抑制多种肿瘤的发生与发展[14-15]。miR-148a在非小细胞肺癌组织中的表达水平显著低于正常组织,同时miR-148a的表达水平与肺癌细胞的淋巴结迁移水平呈负相关[21]。另外,miR-148a还可以抑制肺癌组织中上皮细胞转化为间充质细胞,进而抑制肺癌细胞的浸润与转移[11]。但有关miR-148a与肺癌细胞放射敏感性的分子机制迄今为止尚不清楚。因此,我们重点探究了人为升高miR-148a的表达水平对肺癌细胞放射敏感性的影响,结果发现miR-148a能够显著提高肺癌细胞的放射敏感性,而且放射敏感性的提高伴随着ER的表达水平降低。研究结果提示miR-148a的增敏作用与其调控的ER相关信号通路有关。前期已有文献报道了miR-148a能够在乳腺癌中通过抑制ER的表达水平,抑制肿瘤的发生与发展[17]。
有文献报道,ER在人非小细胞肺癌组织、正常肺组织中均有表达,其表达与肺癌组织学类型相关[22-23]。ER主要通过雌激素信号途径调节转录,通过生长因子受体途径和类固醇信号途径调节其在肿瘤细胞核的活性,进而影响肿瘤细胞的生长、分裂和代谢等生物学行为[23]。ER与非小细胞肺癌的发生、发展及预后密切相关,因此可作为今后肺癌治疗中的重要靶点[24-25]。本研究结果显示,γ射线照射可以下调肺癌细胞中miR-148a的表达水平,但过表达miR-148a能够显著增强肺癌细胞的放射敏感性,同时抑制ER的表达水平,说明γ射线照射是通过下调miR-148a的表达水平同时上调ER的表达,最终引发辐射抵抗,即照射→miR-148a下调→ER上调→放射敏感性降低。该结论也在miR-148a和pcDNA-ER共转染细胞的凋亡及生存实验中得以验证,即在miR-148a过表达后再提高ER的表达水平可以抑制miR-148a的促凋亡作用以及放射增敏效应。另外,我们旨在探讨miR-148a调控肺癌细胞放射敏感性的分子机制,而细胞的凋亡及生存实验也是为进一步佐证ER通路是miR-148a发挥增敏功能的重要靶点,因此上述结果已充分表明miR-148a所介导的放射敏感性的提高是通过抑制ER的表达水平来实现的。尽管已有文献阐述了ER对三阴性乳腺细胞的放射敏感性具有调控作用[26],但其与肺癌细胞放射敏感性的关系目前尚不清晰。本研究中,我们在阐明miR-148a放射增敏作用的同时,揭示了ER对肺癌细胞辐射抵抗潜在的诱导作用。
综上所述,我们通过本研究发现人为地提高miR-148a的表达水平能够增强肺癌细胞的放射敏感性,而这种作用是通过抑制ER的表达水平来完成的。因此,深入研究miR-148a作为肺癌细胞放疗敏感性调控的新靶点具有临床意义和价值,为肺癌放疗的增敏提供新的实验依据,也为临床肺癌放疗疗效的提高奠定了基础。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李航负责课题设计、相关实验操作、撰写论文;姜勉负责协助进行实验操作、收集数据、论文校对;樊赛军负责实验指导、论文审阅。
| [1] | Yang H, Li S, Sun L, et al. Effects of the Ambient Fine Particulate Matter on Public Awareness of Lung Cancer Risk in China: Evidence from the Internet-Based Big Aata Platform[J/OL]. JMIR Public Health Surveill, 2017, 3(4): e64[2018-03-26]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5645640/. DOI:10.2196/publichealth.8078. |
| [2] | Shi Y, Sun Y, Yu J, et al. China experts consensus on the diagnosis and treatment of advanced stage primary lung cancer(2016 version)[J]. Asia Pac J Clin Oncol, 2017, 13(1): 87–103. DOI:10.1111/ajco.12608 |
| [3] | Osarogiagbon R, Smeltzer M, Faris N. ORAL02.05:Understanding internal differences in N-Category-Stratified non-small cell lung cancer (NSCLC) survival:topic:surgery[J]. J Thorac Oncol, 2016, 11(11S): S255. DOI:10.1016/j.jtho.2016.09.014 |
| [4] | JYY W, Bassig BA, Seow WJ, et al. Lung cancer risk in welders and foundry workers with a history of heavy smoking in the USA:The National Lung Screening Trial[J]. Occup Environ Med, 2017, 74(6): 440–448. DOI:10.1136/oemed-2016-104168 |
| [5] | Malinovsky G, Yarmoshenko I, Zhukovsky M. Radon, smoking and HPV as lung cancer risk factors in ecological studies[J]. Int J Radiat Biol, 2018, 94(1): 62–69. DOI:10.1080/09553002.2018.1399225 |
| [6] | Hart JE. Air pollution affects lung cancer survival[J]. Thorax, 2016, 71(10): 875–876. DOI:10.1136/thoraxjnl-2016-208967 |
| [7] | Salem A, Mistry H, Backen A, et al. Cell death, inflammation, tumor burden, and proliferation blood biomarkers predict lung cancer radiotherapy response and correlate with tumor volume and proliferation imaging[J/OL]. Clin Lung Cancer, 2018, 19(3): 239-248. e7[2018-03-26]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5927801. DOI:10.1016/j.cllc.2017.12.002. |
| [8] | Borghetti P, Bonù ML, Roca E, et al. Radiotherapy and tyrosine kinase inhibitors in stage IV non-small cell lung cancer:real-life experience[J]. In Vivo, 2018, 32(1): 159–164. DOI:10.21873/invivo.11219 |
| [9] | Klein C, Dokic I, Mairani A, et al. Overcoming hypoxia-induced tumor radioresistance in non-small cell lung cancer by targeting DNA-dependent protein kinase in combination with carbon ion irradiation[J]. Radiat Oncol, 2017, 12(1): 208. DOI:10.1186/s13014-017-0939-0 |
| [10] | Son B, Jun SY, Seo H, et al. Inhibitory effect of traditional oriental medicine-derived monoamine oxidase B inhibitor on radioresistance of non-small cell lung cancer[J/OL]. Sci Rep, 2016, 6: 21986[2018-03-26]. https://www.nature.com/articles/srep21986. DOI:10.1038/srep21986. |
| [11] | Luo H, Liang C. MicroRNA-148b inhibits proliferation and the epithelial-mesenchymal transition and increases radiosensitivity in non-small cell lung carcinomas by regulating ROCK1[J]. Exp Ther Med, 2018, 15(4): 3609–3616. DOI:10.3892/etm.2018.5845 |
| [12] | Wu SJ, Chen J, Wu B, et al. MicroRNA-150 enhances radiosensitivity by inhibiting the AKT pathway in NK/T cell lymphoma[J]. J Exp Clin Cancer Res, 2018, 37(1): 18. DOI:10.1186/s13046-017-0639-5 |
| [13] | Ajdarkosh H, Dadpay M, Yahaghi E, et al. Decrease expression and clinicopathological significance of miR-148a with poor survival in hepatocellular carcinoma tissues[J]. Diagn Pathol, 2015, 10: 135. DOI:10.1186/s13000-015-0371-4 |
| [14] | Gong L, Wang C, Gao Y, et al. Decreased expression of microRNA-148a predicts poor prognosis in ovarian cancer and associates with tumor growth and metastasis[J]. Biomed Pharmacother, 2016, 83: 58–63. DOI:10.1016/j.biopha.2016.05.049 |
| [15] | Yang JS, Li BJ, Lu HW, et al. Serum miR-152, miR-148a, miR-148b, and miR-21 as novel biomarkers in non-small cell lung cancer screening[J]. Tumour Biol, 2015, 36(4): 3035–3042. DOI:10.1007/s13277-014-2938-1 |
| [16] | Li J, Yu T, Cao J, et al. MicroRNA-148a suppresses invasion and metastasis of human non-small-cell lung cancer[J]. Cell Physiol Biochem, 2015, 37(5): 1847–1856. DOI:10.1159/000438546 |
| [17] | Ma F, Feng Y, Li W, et al. miR-148a Suppresses estrogen-induced viability and migration of breast cancer cells via inhibition of estrogen receptor α expression[J]. Exp Ther Med, 2017, 13(5): 2515–2522. DOI:10.3892/etm.2017.4255 |
| [18] | Rahal Z, El NS, Sinjab A, et al. Smoking and lung cancer:A geo-regional perspective[J]. Front Oncol, 2017, 7: 194. DOI:10.3389/fonc.2017.00194 |
| [19] |
董佳丽, 罗丹, 李源, 等.
降低B7-H3蛋白对受照肺癌细胞A549细胞周期和凋亡的影响[J]. 国际放射医学核医学杂志, 2017, 41(3): 193–198.
DOI:10.3760/cma.j.issn.1673-4114.2017.03.007 Dong JL, Luo D, Li Y, et al. Study on the effects of B7-H3 down-regulation on cell cycle and apoptosis of lung cancer A549 cells[J]. Int J Radiat Med Nucl Med, 2017, 41(3): 193–198. DOI:10.3760/cma.j.issn.1673-4114.2017.03.007 |
| [20] | Kang J, Kim W, Kwon T, et al. Plasminogen activator inhibitor-1 enhances radioresistance and aggressiveness of non-small cell lung cancer cells[J]. Oncotarget, 2016, 7(17): 23961–23974. DOI:10.18632/oncotarget.8208 |
| [21] | Chen Y, Min L, Zhang X, et al. Decreased miRNA-148a is associated with lymph node metastasis and poor clinical outcomes and functions as a suppressor of tumor metastasis in non-small cell lung cancer[J]. Oncol Rep, 2013, 30(4): 1832–1840. DOI:10.3892/or.2013.2611 |
| [22] | Onitsuka T, Uramoto H, Tanaka F. Lack of direct association between EGFR mutations and ER beta expression in lung cancer[J]. Anticancer Res, 2011, 31(3): 855–860. |
| [23] | Shi S, Tan P, Yan B, et al. ER stress and autophagy are involved in the apoptosis induced by cisplatin in human lung cancer cells[J]. Oncol Rep, 2016, 35(5): 2606–2614. DOI:10.3892/or.2016.4680 |
| [24] | Qiu C, Zhang T, Zhang W, et al. Licochalcone a inhibits he proliferation of human lung cancer cell lines A549 and H460 by inducing G2/M cell cycle arrest and ER stress[J/OL]. Int J Mol Sci, 2017, 18(8): E1761[2018-03-26]. http://www.mdpi.com/1422-0067/18/8/1761. DOI:10.3390/ijms18081761. |
| [25] | Xie WY, Zhou XD, Yang J, et al. Inhibition of autophagy enhances heat-induced apoptosis in human non-small cell lung cancer cells through ER stress pathways[J]. Arch Biochem Biophys, 2016, 607: 55–66. DOI:10.1016/j.abb.2016.08.016 |
| [26] | Chen X, Ma N, Zhou Z, et al. Estrogen receptor mediates the radiosensitivity of triple-negative breast cancer cells[J]. Med Sci Monit, 2017, 23: 2674–2683. DOI:10.12659/MSM.904810 |
 2018, Vol. 42
2018, Vol. 42


