2. 030001 太原, 山西医科大学第一医院普外科;
3. 030001 太原, 山西省肿瘤医院核医学科;
4. 030001 太原, 山西省肿瘤医院乳腺科
2. Department of General Surgery, the First Hospital of Shanxi Medical University, Taiyuan 030001, China;
3. Department of Nuclear Medicine, Tumor Hospital of Shanxi Medical University, Taiyuan 030001, China;
4. Department of Breast Surgery, Tumor Hospital of Shanxi Medical University, Taiyuan 030001, China
乳腺癌是女性常见的恶性肿瘤之一,发病率为29%[1]。全球每年新增乳腺癌病例115万,占全部女性肿瘤患者例数的23%[2]。20~59岁女性因癌症死亡的原因中乳腺癌占首位[3]。因此乳腺癌早期精准诊疗能够提高患者生活质量和减少病死率。乳腺超声检查是筛查乳腺癌的常规方法,通过声像图病灶的特征进行乳腺影像报告和数据系统(breast imaging reporting and data system,BI-RADS)分级。其中,BI-RADS 4级提示可疑恶性,恶性可能性为3%~94%,跨度较大,并且超声征象良恶性病变表现不典型时,BI-RADS分级易受操作者临床经验的影响。分子影像是将分子生物学和影像技术相结合,在分子和细胞水平观察生物体的生物学行为,为临床提供更多的解剖和功能信息[4-5]。整合素αvβ3是一种跨膜异二聚体受体,在正常细胞表面低表达,而高表达于肿瘤细胞表面及新生血管内皮细胞[6-7]。小分子肽Arg-Gly-Asp(RGD)与整合素αvβ3具有高度亲和力及结合特异性[8],可以实现无创血管生成显像。99Tcm-联肼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体(99Tcm-3PRGD2)是一种RGD环肽二聚体,标记简单,高效且可重复性强,近年来已被应用到临床,尤其在肺癌、乳腺癌诊断方面发挥着一定的作用[9-10]。此外,大量研究结果表明肿瘤新生血管与转移和预后关系密切[11-14]。我们旨在探讨99Tcm-3PRGD2整合素受体显像在鉴别乳腺良恶性病变中的价值及与超声检查的对比研究。
1 资料与方法 1.1 一般资料收集2016年10月至2017年6月因乳腺结节或肿块就诊山西医科大学第一医院普外科欲行穿刺或手术治疗的女性患者45例,年龄39~76岁,平均年龄(53.0±9.5)岁。所有患者检查前未进行穿刺或任何治疗。患者入院后先行乳腺超声检查,选取超声提示病灶直径>1 cm的患者行99Tcm-3PRGD2整合素受体SPECT/CT显像。严重肝肾功能损害、怀孕或哺乳期妇女,病灶直径<1 cm患者不纳入本研究。本研究通过了山西医科大学第一医院伦理学委员会的审批(批准号:S-336)。所有患者在接受检查前均签署了知情同意书。
1.2 99Tcm-3PRGD2药物标记用99Mo-99Tcm发生器淋洗新鲜Na99TcmO4-淋洗液,使用注射器抽取1~2 mL Na99TcmO4-淋洗液(740~925 MBq)。将抽取的新鲜Na99TcmO4-淋洗液按11.1 MBq/kg(0.3 mCi)加入到3PRGD2药盒(由北京阜外心血管医院提供)中,充分振荡使二者彻底混合溶解至澄清。将澄清混合物放置于100 ℃水中加热30 min,保持瓶口位于水面以上。反应完毕后,取出药盒放置于常温下冷却。测定放化纯度≥95%后方可使用。
1.3 检查方法超声仪为美国GE公司生产的LOGIQ型彩色多普勒超声仪,探头型号为ML6-15,频率为7.5~13 MHz。患者双臂抱头,采取仰卧位,保证双侧乳房和腋窝充分显示,对乳腺各个象限作放射状、纵向、横向切面扫描。
采用德国SIEMENS公司生产的SymbiaT16型双探头SPECT/CT检查仪进行显像。经肘静脉注射显像剂99Tcm-3PRGD2(740~925 MBq),即刻开机采集早期平面15 min静态显像,2 h后排空膀胱行全身及局部SPECT/CT融合显像,准直器参数为低能高分辨率。全身图像以双探头前后位采集,采集速度为13 cm/min;核医学断层图像采集以乳腺为中心,范围包括乳腺及双侧腋窝,以俯卧位使双乳自然下垂。采集条件为25 s/帧,矩阵为128×128。采集CT定位图像,扫描电压130 keV,电流70 mA,融合层厚为5 mm。最终利用图像后处理工作站NM-CT Fusion Display syngo专用软件进行图像融合。
1.4 图像分析采用常规二维超声观察乳腺病灶的部位、大小、形态、边界、内部回声、后方回声、纵横比值、皮肤有无增厚、导管有无扩张及淋巴结肿大等声像学特征。BI-RADS 0级:单一检查无法全面评价病变,需进一步检查;BI-RADS 1级:未见异常,检查结果阴性;BI-RADS 2级:良性征象;BI-RADS 3级:倾向良性病变;BI-RADS 4级:提示恶性可疑;BI-RADS 5级:高度恶性可能;BI-RADS 6级:病理证实为恶性。BI-RADS 4a级、BI-RADS 4b级、BI-RADS 4c级恶性的可能性分别为2%~10%、10%~50%、50%~95%。
所有图像均由2位副主任医师独立对图像诊断分析,诊断一致时方可认为诊断有效;诊断不一致时通过讨论达成共识或者另请1名主任医师对图像进行判读。SPECT早期15 min静态显像阳性判断标准为目测法,乳腺区以周围胸部本底为参考,未出现异常放射性浓聚为阴性(阴性组),病灶摄取程度大于周围胸部本底为阳性(阳性组)。2 h SPECT显像需观察全身图像放射性核素浓聚的个数及大体解剖位置。测量3次病灶的最大直径,取3次的平均值。利用ROI技术在SPECT/CT融合图像横断位勾画病灶(T)与对侧正常腺体(NT),测量病灶和正常腺体的最大放射性计数,并计算比值,即T/NT值,分别勾画3次,取3次的平均值。
1.5 病理检查所有患者均在显像检查后1周内接受乳腺手术或活组织检查,以判定病灶病理类型及腋窝淋巴结转移情况。
1.6 统计学分析采用IBM SPSS22.0软件进行统计学分析。计量资料以均数±标准差(x ± s)表示,计数资料以率或百分比表示。因数据不满足正态分布和方差齐性,故组间比较采用独立样本非参数检验Mann-Whitney U方法。99Tcm-3PRGD2整合素受体显像与超声诊断效能比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果 2.1 不同检查方法的诊断结果45例入选病例,经病理检查共发现56个病灶,其中,35个病灶为乳腺癌,21个病灶为良性病变。有2例双侧乳腺癌、5例乳腺癌伴对侧良性结节、2例双灶乳腺癌伴对侧良性结节。超声BI-RADS 4级病灶中有7例声像图表现为边界尚清,部分有浅分叶,经病理证实为纤维腺瘤,99Tcm-3PRGD2 SPECT/CT表现为略有显像剂摄取,T/NT值为1.4~2.5;超声BI-RADS 3级病灶中有5例声像图表现为病灶>3 cm,病灶回声与周围腺体组织回声相似,对比不明显,易误诊为纤维腺瘤,经病理证实为浸润性导管癌,99Tcm-3PRGD2 SPECT/CT表现为类圆形显像剂明显摄取,T/NT值为3.5~4.9;有2例乳腺腺病、2例脂肪坏死伴炎症反应病灶,2例乳腺增生伴腺瘤形成超声声像图提示BI-RADS 3级,99Tcm-3PRGD2 SPECT/CT显像可见病灶显像剂摄取,T/NT值为3.1~3.3。此外,有6例病灶在全身显像位于肝脏,经俯卧位SPECT/CT显像定位于右乳。99Tcm-3PRGD2 SPECT/CT阳性判断标准为2 h显像半定量指标T/NT值≥2.9;超声检查阳性判断标准为BI-RADS 4级及以上。病理类型与超声检查、99Tcm-3PRGD2 SPECT/CT的诊断结果见表 1。
| 表1 56个乳腺占位病变病理类型与不同检查方法的诊断结果(个) Table 1 Pathology classification of 56 breast lesions and the results of different inspection method(cases) |
99Tcm-3PRGD2 2 h SPECT/CT经病理证实的乳腺恶性病灶T/NT值(3.92±1.67)高于良性病灶T/NT值(2.04±0.46),且差异有统计学意义(Z=-3.77,P=0.00)。良性病变的典型病例见图 1,乳腺癌典型病例见图 2。取约登指数最大时的临界值2.9,99Tcm-3PRGD2 SPECT/CT显像诊断的灵敏度、特异度、准确率分别为82.9%(29/35)、71.4%(15/21)、78.6%(44/56),诊断乳腺良恶性病变受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)下面积为0.77。超声诊断乳腺良恶性病变ROC曲线下面积为0.76,其诊断的灵敏度、特异度、准确率分别为85.7%(30/35)、66.7%(14/21)、78.6%(44/56)。99Tcm-3PRGD2 SPECT/CT显像与超声诊断效能相近,差异无统计学意义(χ2=0.05,P>0.05)。超声+99Tcm-3PRGD2 SPECT/CT联合检查可提高乳腺良恶性诊断的准确率(92.9%,52/56),且分别与超声检查、99Tcm-3PRGD2 SPECT/CT显像比较,差异均有统计学意义(χ2=77.17、74.87,均P < 0.05)(表 2)。
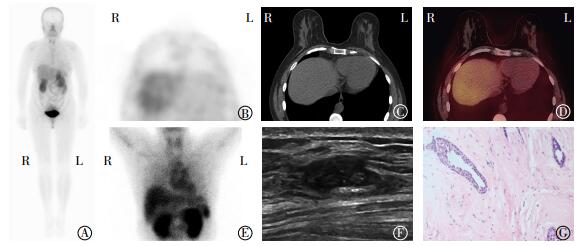
|
图 1 46岁女性患者乳腺99Tcm-3PRGD2整合素受体SPECT/CT显像图、超声BI-RADS 4a级声像图和病理图 图中,A:肘静脉注射99Tcm-3PRGD2 2 h行全身显像,全身未见明显显像剂分布异常影;B:胸部局部SPECT显像,乳腺区域未见明显显像剂分布异常影;C:CT定位像可见左侧乳腺类圆形软组织密度影;D:SPECT/CT融合显像,T/NT值为1.1;E:早期15 min SPECT静态显像,胸部未见明显显像剂分布增高影;F:乳腺超声示左乳外上象限无回声区,边界尚规则,BI-RADS 4a级;G:病理结果为左乳纤维腺瘤(苏木精-伊红染色,伊100);99Tcm-3PRGD2:99Tcm-联胼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体;SPECT/CT:单光子发射计算机体层摄影;BI-RADS:乳腺影像报告和数据系统。 Figure 1 years old females with the breast integrin receptor imaging, of 99Tcm-3PRGD2, ultrasonography of BI-RADS4a and pathology |
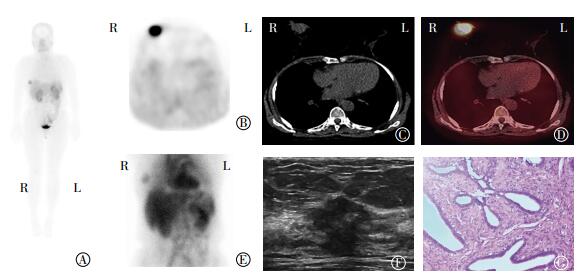
|
图 2 64岁女性患者乳腺99Tcm-3PRGD2整合素受体SPECT/CT显像图、超声BI-RADS 4c级声像图和病理图 图中,A:肘静脉注射99Tcm-3PRGD2 2 h行全身显像,于胸部右侧可见点状显像剂分布增高影;B:胸部局部SPECT显像,右侧乳腺区域可见显像剂分布增高影;C:CT定位像可见右侧乳腺类圆形软组织密度影;D:SPECT/CT融合显像,T/NT值为5.96;E:早期5 min SPECT静态显像,胸部右侧可见片状显像剂分布增高影;F:乳腺超声示右乳外上象限无回声区,呈毛刺征,BI-RADS 4c级;G:病理结果为右乳浸润性导管癌(苏木精-伊红染色,伊100);99Tcm-3PRGD2:99Tcm-联胼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体;SPECT/CT:单光子发射计算机体层摄影术;BI-RADS:乳腺影像报告和数据系统。 Figure 2 64 years old females with the breast integrin receptor imaging of 99Tcm-3PRGD2, ultrasonography of BI-RADS 4c and pathology |
| 表2 99Tcm-3PRGD2 SPECT/CT显像与超声检查诊断效能的比较 Table 2 Comparation of the diagnostic efficiency of 99Tcm-3PRGD2 SPECT/CT imaging and ultrasonography |
99Tcm-3PRGD2 SPECT早期15 min静态显像阳性组和阴性组中的病灶在2 h显像的T/NT值分别为4.59±1.49、3.28±1.27,阳性组高于阴性组,差异有统计学意义(Z=-3.90,P=0.01)。经病理证实的35个恶性病灶中有26个病灶早期静态显像阳性,典型病例见图 2;病理结果证实的14个纤维腺瘤早期静态显像为阴性,其中超声检查为BI-RADS 4a级病灶3个、BI-RADS 4b级病灶4个、BI-RADS 3级病灶7个,典型病例见图 1、图 3。
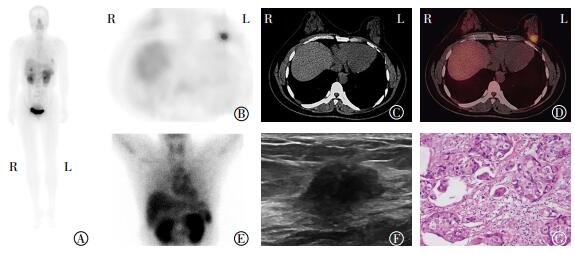
|
图 3 43岁女性患者乳腺99Tcm-3PRGD2整合素受体SPECT/CT显像图、超声BI-RADS 4b级声像图和病理图 图中,A:肘静脉注射99Tcm-3PRGD2 2 h行全身显像,于胸部左侧可见点状显像剂分布增高影;B:胸部局部SPECT显像,左侧乳腺区域可见显像剂分布增高影;C:CT定位像可见左侧乳腺类圆形软组织密度影;D:SPECT/CT融合显像,T/NT值为3.1;E:早期5 min SPECT静态显像,胸部未见明显显像剂分布增高影;F:乳腺超声示左乳外上象限无回声区,边界欠规整,BI -RADS 4b级;G:病理结果为左乳纤维腺瘤(苏木精-伊红染色,伊100);99Tcm-3PRGD2:99Tcm-联胼尼克酰胺-3聚乙二醇-精氨酸-甘氨酸-天冬氨酸环肽二聚体;SPECT/CT:单光子发射计算机体层摄影;BI-RADS:乳腺影像报告和数据系统。 Figure 3 43 years old females with the breast integrin receptor imaging of 99Tcm-3PRGD2, ultrasonography of BI-RADS 4b and pathology |
99Tcm-3PRGD2是整合素受体显像剂,具有以下优势:从肿瘤血管生成角度鉴别乳腺良恶性病变,为进一步筛选适合血管靶向治疗的患者、评估疗效和预后奠定了基础;半定量分析过程简单,相对容易掌握,不易受主观因素影响;99Tcm-3PRGD2全身显像不仅可以观察原发灶,还可以对疾病进展情况如其他部位是否存在转移作出综合判断;99Tcm-3PRGD2 SPECT/CT显像使功能显像与解剖显像完美结合,提高了诊断的准确率。因为乳腺病灶内有不均质或坏死的组织,为确保诊断的灵敏度,我们没有采用平均计数,而采取病灶的最大计数T/NT值作为半定量分析指标[15]。
本研究结果显示99Tcm-3PRGD2 SPECT/CT显像与超声检查诊断效能相近,但当超声检查良恶性病变表现征象不典型时,99Tcm-3PRGD2 SPECT/CT显像可以发挥重要的作用。对于超声BI-RADS 4a、4b级病灶恶性可能性为3%~50%,联合99Tcm-3PRGD2 SPECT/CT显像可以提高诊断的准确率。有研究结果显示,良性病变整合素αvβ3受体不仅高表达于肿瘤细胞表面及肿瘤新生血管,还可表达在中性粒细胞和单核细胞等炎症中[16-17]。本研究结果中有2例乳腺腺病、2例脂肪坏死伴炎症反应病灶,2例乳腺增生伴腺瘤形成超声声像图提示BI-RADS 3级,99Tcm-3PRGD2 SPECT/CT显像可见病灶显像剂摄取,T/NT值为3.1~3.3。这可能是部分乳腺良性病变T/NT值较高的原因。文献报道,T/NT值>3作为临界值可以提高SPECT/CT对乳腺良恶性病变的诊断效能[18],本研究多数结果与其一致。
Cochet等[19]对乳腺癌18F-FDG血流灌注早期120 s动态显像与内皮细胞标志物进行相关分析,结果显示血流灌注与血管生成明显相关。我们起初采集早期血流灌注动态显像,因图像信息量不足,故将采集条件调整为早期15 min静态显像。经病理证实的14个纤维腺瘤早期静态显像阴性,其中超声BI-RADS 4a级病灶3个,BI-RADS 4b级病灶4个,BI-RADS 3级病灶7个,提示早期静态显像在进一步鉴别乳腺良恶性病变中具有潜在价值。
99Tcm-3PRGD2 SPECT全身显像可以直观反映病变,断层显像可以更精准地定位病灶。本研究结果中有6例病灶在全身显像位于肝脏,经俯卧位SPECT/CT显像定位于右乳,体现了SPECT/CT解剖与功能相结合的优势。
综上所述,99Tcm-3PRGD2整合素受体显像与超声检查对乳腺良恶性病变的诊断效能相近。本研究纤维腺瘤在99Tcm-3PRGD2 SPECT早期15 min静态显像阴性,提示其在鉴别乳腺良恶性病变具有潜在价值。超声检查联合99Tcm-3PRGD2整合素受体显像可提高诊断的准确率,尤其对于超声声像图表现不典型时,可进一步鉴别良恶性,减少患者不必要的穿刺等有创性检查。本研究局限性是样本量相对较少。整合素αvβ3受体表达程度与99Tcm-3PRGD2的摄取关系有待进一步验证。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 李万婷负责研究课题的实施和数据分析;刘海燕负责研究命题的提出、论文的最终审阅;秦丽军负责图像后处理;崔雅丽、牛静负责病例的随访及数据的记录;武志芳负责方法学指导;刘静、张国琛、任媛负责协助收集病例;李思进负责研究命题设计。
| [1] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [2] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87–108. DOI:10.3322/caac.21262 |
| [3] | DeSantis C, Ma J, Bryan L, et al. Breast cancer statistics, 2013[J]. CA Cancer J Clin, 2014, 64(1): 52–62. DOI:10.3322/caac.21203 |
| [4] | Pysz MA, Gambhir SS, Willmann JK. Molecular imaging:current status and emerging strategies[J]. Clin Radiol, 2010, 65(7): 500–516. DOI:10.1016/j.crad.2010.03.011 |
| [5] | Wang X, Feng H, Zhao S, et al. SPECT and PET radiopharmaceuticals for molecular imaging of apoptosis:from bench to clinic[J]. Oncotarget, 2017, 8(12): 20476–20495. DOI:10.18632/oncotarget.14730 |
| [6] | Meng Q, Li Z. Molecular imaging probes for diagnosis and therapy evaluation of breast cancer[J]. Int J Biomed Imaging, 2013, 2013: 230487. DOI:10.1155/2013/230487 |
| [7] | Niu G, Chen X. Why integrin as a primary target for imaging and therapy[J]. Theranostics, 2011(1): 30–47. |
| [8] | Wang F, Li Y, Shen Y, et al. The functions and applications of RGD in tumor therapy and tissue engineering[J]. Int J Mol Sci, 2013, 14(7): 13447–13462. DOI:10.3390/ijms140713447 |
| [9] | Liu L, Song Y, Gao S, et al. 99Tcm-3PRGD2 scintimammography in palpable and nonpalpable breast lesions[J]. Mol Imaging, 2014, 13(5): 1–7. DOI:10.2310/7290.2014.00010 |
| [10] | Chen Q, Ma Q, Chen M, et al. An exploratory study on 99mTc-RGD-BBN peptide scintimammography in the assessment of breast malignant lesions compared to 99mTc-3P4-RGD2[J/OL]. PLoS One, 2015, 10(4): e0123401[2017-11-15]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone. 0123401. DOI:10.1371/journal.pone.0123401. |
| [11] | Vasudev NS, Reynolds AR. Anti-angiogenic therapy for cancer:current progress, unresolved questions and future directions[J]. Angiogenesis, 2014, 17(3): 471–494. DOI:10.1007/s10456-014-9420-y |
| [12] | Bohl CR, Harihar S, Denning WL, et al. Metastasis suppressors in breast cancers:mechanistic insights and clinical potential[J]. J Mol Med (Berl), 2014, 92(1): 13–30. DOI:10.1007/s00109-013-1109-y |
| [13] | Brooks SA, Lomax-Browne HJ, Carter TM, et al. Molecular interactions in cancer cell metastasis[J]. Acta Histochem, 2010, 112(1): 3–25. DOI:10.1016/j.acthis.2008.11.022 |
| [14] | Haubner RH, Wester HJ, Weber WA, et al. Radiotracer-based strategies to image angiogenesis[J]. Q J Nucl Med, 2003, 47(3): 189–199. |
| [15] |
陈贵兵, 欧阳忠, 韩成坤, 等.
99Tcm-3PRGD2整合素受体显像在乳腺癌定性诊断中的价值及与钼靶检查的对比研究[J]. 国际放射医学核医学杂志, 2017, 41(1): 1–7.
DOI:10.3760/cma.j.issn.1673-4114.2017.01.001 Chen GB, Ouyang Z, Han CK, et al. Evaluation of 99Tcm-3PRGD2 integrin receptor imaging in qualitative diagnosis of breast cancer and its comparison with mammography[J]. Int J Radiat Med Nucl Med, 2017, 41(1): 1–7. DOI:10.3760/cma.j.issn.1673-4114.2017.01.001 |
| [16] | Pichler BJ, Kneilling M, Haubner R, et al. Imaging of delayed-type hypersensitivity reaction by PET and 18F-galacto-RGD[J]. J Nucl Med, 2005, 46(1): 184–189. |
| [17] | McDonald DM, Choyke PL. Imaging of angiogenesis:from microscope to clinic[J]. Nat Med, 2003, 9(6): 713–725. DOI:10.1038/nm0603-713 |
| [18] | Chen G, Ouyang Z, Wang F, et al. Evaluation of Tc-99m-3PRGD2 Integrin Receptor Imaging in the Differential Diagnosis of Breast Lesions and Comparison With Mammography[J]. Cancer Invest, 2017, 35(2): 108–115. DOI:10.1080/07357907.2016.1270957 |
| [19] | Cochet A, Pigeonnat S, Khoury B, et al. Evaluation of breast tumor blood flow with dynamic first-pass 18F-FDG PET/CT:comparison with angiogenesis markers and prognostic factors[J]. J Nucl Med, 2012, 53(4): 512–520. DOI:10.2967/jnumed.111.096834 |
 2018, Vol. 42
2018, Vol. 42


