2. 100021, 国家癌症中心/中国医学科学院北京协和医学院特需医疗部
2. Department of VIP Medical Services, National Cancer Center, Cancer Hospital, Chinese Academy of Medical Sciences, Peking Union Medical College, Beijing 100021, China
非小细胞肺癌(non-small-cell lung cancer,NSCLC)占全部肺癌的80%,通过手术、放疗和药物的综合治疗,患者生存已得到明显改善[1]。对于行根治性切除术后病理分期为ⅢA-N2(pⅢA-N2)的NSCLC患者,术后辅助化疗可显著提高生存期[2-3],但局部区域复发率仍高达20%~40%[4-5]。在多种实体瘤的治疗中,术后放疗均可有效地杀灭潜在的亚临床病灶,提高局部控制率进而进一步改善生存[6-7]。对于pⅢA-N2 NSCLC患者,相关研究结果显示术后放疗(postoperative radiotherapy, PORT)虽能明显降低局部区域复发率,但对生存的影响仍不确定[8-13]。其原因可能是胸部放疗相关的心肺毒性降低了生存获益,这些不良反应可通过放疗技术的进步逐渐改善。此外,pⅢA-N2 NSCLC患者的异质性很大,可通过亚组分析确定能从PORT获益的亚组人群,达到精准治疗的目的,同时避免无生存获益的患者接受过度治疗。笔者回顾性分析804例ⅢA-N2 NSCLC患者的临床资料,依据简单的术前临床资料,筛选能从PORT获益的亚组人群。
1 资料与方法 1.1 纳入标准① 肺部肿瘤经细胞学或病理学证实为NSCLC;②治疗前均有完善的头部MRI、颈部和腹部B超或CT、胸部CT或PET/CT、全身骨扫描分期检查资料,无远处转移病灶;③患者在我院接受肺部肿瘤根治切除手术,依据2009年第7版美国癌症联合委员会分期,术后病理分期为ⅢA-N2;④患者术后接受含铂类方案的化疗。
1.2 排除标准① 术前行新辅助化疗的患者;②镜下切缘阳性(R1)或术后肿瘤残存(R2)的患者;③其他部位恶性肿瘤病史(既往或同时),不包括可治愈的非黑色素瘤性皮肤癌和子宫颈原位癌;④未控的心脏疾病或者近6个月内发生心肌梗死;⑤有精神疾病史;⑥处于妊娠、哺乳期;⑦间质性肺炎或活动期肺纤维化;⑧活动性感染。
1.3 一般资料我院2006年1月至2015年12月收治的NSCLC根治术后pⅢA-N2患者中,符合入组标准的患者804例,其中男性475例、女性329例,年龄25~80岁,中位年龄56岁。通过增强CT或者PET/CT获取准确的临床淋巴结分期。CT上淋巴结短径≥10 mm或者PET/CT上淋巴结SUV>2.5定义为转移淋巴结。根据化疗后是否行PORT,将804例入组患者分为PORT组和单纯化疗组,其中PORT组276例,单纯化疗组528例。所有患者或其家属均于治疗前签署了知情同意书。
1.4 手术和术后化疗手术方式包括肺叶切除、楔形切除、袖状切除、双叶切除、全肺切除+纵隔淋巴结清扫或系统纵隔淋巴结取样术。术后化疗采用基于铂类的双药方案,另一种药物包括紫杉醇(百时美施贵宝(中国)投资有限公司)、多西他赛(江苏恒瑞医药股份有限公司)、培美曲塞、吉西他滨(江苏豪森药业股份有限公司)、长春瑞滨(齐鲁制药有限公司)。
1.5 PORT患者取仰卧位,面罩或体膜固定身体,模拟定位CT(西门子,Somatom Definition AS,德国)扫描范围为颅底至腰2椎体水平,扫描层距5 mm。采用Pinnacle TPS软件(飞利浦,pinnacle 7.4f,荷兰)进行放疗靶区勾画及计划设计。靶区勾画综合手术前、后的影像学资料,临床靶体积主要包括手术残端、同侧肺门、同侧纵隔和隆凸下淋巴结区域。计划靶体积为临床靶体积外扩5 mm形成。计划靶体积的设计处方剂量为50~60 Gy,剂量分割为1.8~2.2 Gy/次,1次/d,5次/周。处方剂量至少覆盖95%的计划靶体积,且热点最高剂量限制在处方剂量的107%以内,脊髓最大剂量限制为≤45 Gy。使用三维适形或调强放疗技术进行计划设计。射线选择6 MV X射线,通过Pinnacle TPS软件获得剂量体积直方图等相关物理学参数。采用直线加速器(医科达,Agility,瑞典)进行放射治疗。
1.6 随访首程治疗结束后,2年内每3个月检查1次颈部和腹部B超或CT、胸部CT,2年后每6个月检查1次,5年后每年检查1次。每半年检查1次头部MRI,每年检查1次全身骨扫描。804例患者,失访66例,随访率为91.8%。
1.7 统计学方法采用SPSS 22.0软件进行统计学分析。计数资料比较采用卡方检验,采用Log Rank法进行单因素预后分析,Cox回归进行多因素预后分析及亚组分析。生存分析采用Kaplan-Meier法,组间生存率比较采用Log Rank检验。P<0.05表示差异有统计学意义。
2 结果 2.1 一般临床资料PORT组和单纯化疗组患者的中位年龄分别为54.5岁和57.0岁,PORT组 < 60岁的患者更多(χ2=15.48,P < 0.001);化疗周期数为3~4个的患者亦更多(χ2=18.42,P<0.001),差异均有统计学意义。其余一般临床资料两组间差异无统计学意义(χ2=0.48~4.28,均P>0.05)。两组患者的一般临床资料见表 1。
| 表1 PORT组和单纯化疗组804例NSCLC患者的一般临床资料比较 Table 1 Comparison of general clinical data between non-postoperative radiotherapy group and postoperative radiotherapy group of 804 non-small-cell lung cancer patients |
全组患者化疗周期数中位数为4周期。化疗开始日期距离手术日期的中位值为1.1个月,放疗开始日期距化疗开始日期的中位值为3.5个月。计划靶体积的处方剂量中位值为50 Gy(30~64 Gy),单次剂量中位值为2 Gy/次(1.8~2.2 Gy/次)。
2.2 生存及预后因素分析结果截至2017年6月30日,全组患者中位随访时间为32.07个月(2.50~133.98个月),中位生存时间为68.67个月,2年、5年总生存(overall survival,OS)分别为82.1%、54.5%,中位无病生存(disease-free survival, DFS)为19.84个月,中位无局部区域复发生存(locoregional recurrence-free survival, LRFS)为120.31个月,中位无远处转移生存(distant metastasis-free survival, DMFS)为30.52个月。
对与OS相关的多项临床因素(包括性别、年龄、吸烟状态、术前T分期、术前N分期、病理类型、化疗周期数、是否PORT)进行单因素分析,结果显示男性、年龄≥60岁、术前T分期增加、术前N分期为N1~N2、病理类型为非鳞癌非腺癌、化疗周期数为1~2、未行PORT是显著影响OS的不良预后因素(表 2)。
| 表2 804例pⅢA-N2 NSCLC患者单因素预后分析结果 Table 2 Univariate analysis for overall survival of 804 pⅢA-N2 non-small-cell lung cancer patients |
多因素分析结果显示性别、年龄、术前N分期、病理类型、是否PORT为OS相关的独立预后因素(表 3)。
| 表3 804例pⅢA-N2 NSCLC患者Cox模型多因素预后分析结果 Table 3 Multivariate analysis for overall survival of 804 pⅢA-N2 non-small-cell lung cancer patients |
PORT组和单纯化疗组的中位OS、中位DFS、中位LRFS、中位DMFS分别为97.31和64.10个月(χ2=5.253,P=0.022)、25.76和17.97个月(χ2=18.397, P < 0.001)、120.31和101.03个月(χ2=15.358, P < 0.001)、36.83和28.49个月(χ2=6.434, P=0.011),PORT组的各生存参数均显著优于单纯化疗组,且差异有统计学意义(表 4)。
| 表4 804例pⅢA-N2 NSCLC患者PORT与生存相关性的单因素分析结果 Table 4 Stratified analysis for survive of 804 pⅢA-N2 non-small-cell lung cancer patients according to postoperative radiotherapy |
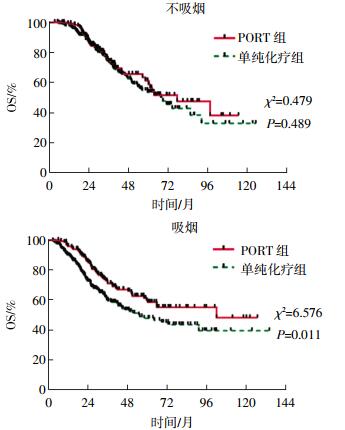
根据以下术前临床因素(包括性别、年龄、吸烟状态、肿瘤位置、术前T分期、术前N分期、术前分期、病理类型)进行预后因素的亚组分析,结果显示以下亚组行PORT能有OS获益(图 1),分别是:男性患者(HR:0.697,95%CI:0.513~0.947,P=0.021)(图 2),吸烟的患者(HR:0.648,95%CI:0.464~0.905,P=0.011)(图 3),术前N分期为N1~N2的患者(HR:0.640,95%CI:0.465~0.881,P=0.006)(图 4),术前分期为Ⅲ期的患者(HR:0.688,95%CI:0.484~0.980,P=0.038),以及病理类型为腺癌的患者(HR:0.726,95%CI:0.527~0.999,P=0.049)。

|
图 1 804例pⅢA-N2非小细胞肺癌患者PORT与生存相关性:术前临床因素亚组分析 图中,pⅢA-N2:病理分期为ⅢA-N2;PORT:术后放疗。 Figure 1 Correlation between postoperative radiotherapy and survival in 804 pⅢA-N2 NSCLC patients—subgroup analysis of preoperative clinical factors |

|
图 2 PORT组和单纯化疗组pⅢA-N2非小细胞肺癌患者的OS曲线:不同性别的亚组分析 图中,OS:总生存;PORT:术后放疗;pⅢA-N2:病理分期为ⅢA-N2。 Figure 2 Overall survival curve for the postoperative radiothrapy and non-postoperative radiothrapy: subgroup analysis of different gender |
|
图 3 PORT组和单纯化疗组pⅢA-N2非小细胞肺癌患者的OS曲线:不同吸烟状态的亚组分析 图中,OS:总生存;PORT:术后放疗;pⅢA-N2:病理分期为ⅢA-N2。 Figure 3 Overall survival curve for postoperative radiothrapy and non-postoperative radiothrapy: subgroup analysis of different smoking status |

|
图 4 PORT组和单纯化疗组pⅢA-N2非小细胞肺癌患者的OS曲线:不同术前N分期亚组分析 图中,OS:总生存;PORT:术后放疗;pⅢA-N2:病理分期为ⅢA-N2。 Figure 4 Overall survival curve for postoperative radiothrapy and non-postoperative radiothrapy: subgroup analysis of different preoperative N staging |
pⅢA-N2 NSCLC患者的术后化疗能明确改善生存,已成为此类患者术后的标准疗法。大量研究结果证实,PORT能显著提高局部控制率,但是否能提高生存期仍无明确结论。对9项行PORT的随机临床研究进行的荟萃分析[8]结果显示,PORT组(n=1056)和单纯手术组(n=1072)的2年OS分别为48%和55%,PORT组的生存率显著降低(P=0.001);进一步的亚组分析结果表明,对于Ⅰ~Ⅱ期和N0~N1期的患者,PORT会导致全组OS显著降低,但能轻度改善Ⅲ期和pN2期亚组患者的生存(差异无统计学意义)。上述研究中,使用落后的二维放疗技术导致了心肺毒性引起的病死率增高,抵消了放疗可能带来的生存获益。随着新放疗技术的逐渐普及,放疗的不良反应显著减少,PORT的价值再次引起关注。Lally等[9]基于监测(Surveillance)、流行病学(Epidemiology)与最终结果(End results)数据库(1988-2000年)的回顾性研究结果显示,PORT可显著改善N2期患者OS,5年OS由20%提高至27%。Douillard等[10]按照术后淋巴结转移状态进行分层的亚组分析结果也显示,术后放疗能显著改善pN2患者的生存,观察组的5年OS由17%提高至21%,术后化疗组由34%提高至47%。2011年Dai等[11]的回顾性研究包括了2003年1月至2005年12月我院收治的221例手术完全切除的pⅢA-N2 NSCLC患者,96例接受PORT的患者中有41例采用适形放疗,结果显示PORT能显著改善OS(P=0.046)、DFS(P=0.009)、LRFS(P=0.025)和DMFS(P=0.001),单因素和多因素分析结果均证实PORT能显著改善患者预后。但2007年Perry等[12]的随机对照研究结果显示,对于根治术后的pⅢA-N2 NSCLC患者,PORT不能显著提高无失败生存和OS。虽然此研究因入组太慢而提前结束,但其仍是至今发表的针对术后化疗后PORT是否能提高生存的唯一的随机研究。此外,欧洲开展的类似的Lung ART随机研究和由我院牵头的CNCI随机研究均尚在进行中。因此,针对pⅢA-N2 NSCLC患者的术后治疗,美国国立综合癌症网络并未把辅助化疗后的PORT作为Ⅰ类证据。2014年Patel等[13]发表的一项荟萃研究结果显示,将使用Co-60二维放疗技术的患者排除后,PORT能改善pⅢA-N2 NSCLC患者的局部控制和OS。Billiet等[14]发表的荟萃分析也得到了相同的结果。本研究中所有患者均使用三维或者调强放疗技术,PORT组的OS、DFS、LRFS、DMFS均显著优于单纯化疗组,多因素分析结果显示PORT是与OS相关的独立预后因素,这与大多数荟萃研究的结果一致。
pⅢA-N2 NSCLC是一组异质性较大的疾病,并非所有患者都能从PORT中获益,需要进一步筛选可获益的亚组人群以达到精确治疗的目的。多项回顾性研究分析了PORT对不同亚组患者的作用,进一步完善了这类患者的个体化治疗的相关信息。Sawyer等[15]回顾性分析发现,PORT能提高局部复发高危患者的局部控制率和生存;Matsuguma等[16]分析发现,多站N2的患者行PORT可以提高生存,而单站N2的患者无明显改善。Hui等[17]回顾性分析了2003年1月至2005年12月我院收治的221例术后pⅢA-N2 NSCLC患者,依据5种预后不良因素(吸烟指数≤400、术前N分期为N2、病理T分期为T3、病理类型为鳞癌、阳性淋巴结≥4)建立了一项预后指数(PORT-I),每个不良因素计1分,0~1分为低危,2分为中危,3~5分为高危,高危患者行PORT能显著改善OS(P = 0.000)、DFS(P=0.000)和LRFS(P=0.006),因此,对于高危患者强烈推荐PORT。
本研究中的亚组分析结果显示男性、吸烟、术前N分期为N1~N2、术前分期为Ⅲ期、病理类型为腺癌的患者行PORT可有OS获益,与Hui等[17]发表的回顾性分析结果有部分不同。究其原因在于Hui等[17]的研究纳入的2003年1月至2005年12月手术的221例患者中,包含了55例采用二维放疗技术的患者,而本研究纳入了2006年1月至2015年12月的804例患者,均采用三维或调强放疗技术,病例数以及放疗技术的差异,均可能导致结果不完全一致。McGovern等[18]分析了831例Ⅰ~Ⅲ期NSCLC患者的性别对放疗疗效的影响,结果显示女性的5年OS、无进展生存率和DMFS均明显高于男性,而本研究中男性患者行PORT能获益,可能与术后男性患者的恢复及放疗耐受性较女性更好有关。Vogelius等[19]发表的一项基于文献的荟萃分析结果显示,吸烟可减少放射性肺炎的发生(P=0.008),肺炎的发生率降低可能转化为一部分行放疗患者的生存获益,这可能是本研究中吸烟的患者PORT获益的原因之一。1997年Ruckdeschel等[20]根据纵隔镜下淋巴结转移数目提出将未手术的ⅢA-N2细分为4类,即ⅢA1~ⅢA4,2003年进一步修订为美国胸科医师学会的分类标准[21]。其中ⅢA1为术后病理发现的淋巴结转移;ⅢA2为术中发现单站淋巴结转移;ⅢA3为术前检查发现的单站或多站淋巴结转移,检查手段包括纵隔镜淋巴结活检、淋巴结活检或PET/CT;ⅢA4为纵隔大块或固定的多站淋巴结转移,不能行手术切除。本研究中术前N0的患者包括ⅢA1~ⅢA2,术前N1~N2等同于ⅢA3。与术前ⅢA1 ~ⅢA2相比,ⅢA3和临床Ⅲ期的患者具有更高的肿瘤负荷和远处转移趋势,即使肿瘤完全切除后,这部分患者仍具有较高的治疗失败率,预后更差[22],因此这部分患者行PORT可通过局部控制的增加转化为生存获益。Asamura等[23]报道了一项包括13 010例可切除肺癌患者的预后研究,其中部分腺癌患者进行了PORT,结果发现腺癌患者的预后更好;本研究结果显示腺癌患者行PORT有生存获益,再次佐证了这一结论。
综上所述,辅助化疗后行PORT能改善根治术后pⅢA-N2 NSCLC患者的OS、DFS、LRFS和DMFS。亚组分析结果发现部分术前临床因素具有预测PORT后有OS获益的亚组人群的价值,包括男性、吸烟、术前N分期为N1~N2、术前分期为Ⅲ期以及病理类型为腺癌的患者。基于本研究的结果,我们可以依据相关的术前临床资料,通过最简单有效的方法筛选出能通过PORT获益的亚组人群,有助于这类患者在术前的多学科讨论中明确综合治疗的模式,指导患者的下一步治疗。因本研究为回顾性研究,组间存在选择性偏倚等不平衡因素,需扩大样本量的前瞻性随机研究进一步证实。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 邓垒负责资料的整理、统计分析和撰写论文;惠周光负责研究命题的提出、设计和论文的最终修订;门玉、王文卿负责资料的整理;肖泽芬、冯勤付、梁军、吕继马、周宗玫、王绿化负责提供病例资料和分析方法、修订论文。
| [1] | Reck M, Heigener DF, Mok T, et al. Management of non-small-cell lung cancer: recent developments[J]. Lancet, 2013, 382(9893): 709–719. DOI:10.1016/S0140-6736(13)61502-0 |
| [2] | Arriagada R, Dunant A, Pignon JP, et al. Long-term results of the international adjuvant lung cancer trial evaluating adjuvant Cisplatin-based chemotherapy in resected lung cancer[J]. J Clin Oncol, 2010, 28(1): 35–42. DOI:10.1200/JCO.2009.23.2272 |
| [3] | NSCLC Meta-analyses Collaborative Group, Arriagada R, Auperin A, et al. Adjuvant chemotherapy, with or without postoperative radiotherapy, in operable non-small-cell lung cancer: two meta-analyses of individual patient data[J]. Lancet, 2010, 375(9722): 1267–1277. DOI:10.1016/S0140-6736(10)60059-1 |
| [4] | Le PC. Role of postoperative radiotherapy in resected non-small cell lung cancer:a reassessment based on new data[J]. Oncologist, 2011, 16(5): 672–681. DOI:10.1634/theoncologist.2010-0150 |
| [5] | Winton T, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observation in resected non-small-cell lung cancer[J]. N Engl J Med, 2005, 352(25): 2589–2597. DOI:10.1056/NEJMoa043623 |
| [6] | Belkacémi Y, Azria D. New tools in adjuvant breast cancer radiotherapy[J]. Bull Cancer, 2007, 94(4): 389–397. DOI:10.1684/bdc.2007.0230 |
| [7] | Ramsey S, Tepper JE. Rectal cancer radiotherapy[J]. Cancer J, 2007, 13(3): 204–209. DOI:10.1097/PPO.0b013e318074def2 |
| [8] | PORT Meta-analysis Trialists Group. Postoperative radiotherapy in non-small-cell lung cancer:systematic review and meta-analysis of individual patient data from nine randomised controlled trials[J]. Lancet, 1998, 352(9124): 257–263. DOI:10.1016/S0140-6736(98)06341-7 |
| [9] | Lally BE, Zelterman D, Colasanto JM, et al. Postoperative radiotherapy for stage Ⅱ or Ⅲ non-small-cell lung cancer using the surveillance, epidemiology, and end results database[J]. J Clin Oncol, 2006, 24(19): 2998–3006. DOI:10.1200/JCO.2005.04.6110 |
| [10] | Douillard JY, Rosell R, De Lena M, et al. Adjuvant vinorelbine plus cisplatin versus observation in patients with completely resected stage IB-ⅢA non-small-cell lung cancer (Adjuvant Navelbine International Trialist Association[J]. Lancet Oncol, 2006, 7(9): 719–727. DOI:10.1016/S1470-2045(06)70804-X |
| [11] | Dai H, Hui Z, Ji W, et al. Postoperative radiotherapy for resected pathological stage ⅢA-N2 non-small cell lung cancer: a retrospective study of 221 cases from a single institution[J]. Oncologist, 2011, 16(5): 641–650. DOI:10.1634/theoncologist.2010-0343 |
| [12] | Perry MC, Kohman LJ, Bonner JA, et al. A phase Ⅲ study of surgical resection and paclitaxel/carboplatin chemotherapy with or without adjuvant radiation therapy for resected stage Ⅲ non-small-cell lung cancer:Cancer and Leukemia Group B 9734[J]. Clin Lung Cancer, 2007, 8(4): 268–272. DOI:10.3816/CLC.2007.n.005 |
| [13] | Patel SH, Ma Y, Wernicke AG, et al. Evidence supporting contemporary post-operative radiation therapy(PORT) using linear accelerators in N2 lung cancer[J]. Lung Cancer, 2014, 84(2): 156–160. DOI:10.1016/j.lungcan.2014.02.016 |
| [14] | Billiet C, Decaluwé H, Peeters S, et al. Modern post-operative radiotherapy for stage Ⅲ non-small cell lung cancer may improve local control and survival: a meta-analysis[J]. Radiother Oncol, 2014, 110(1): 3–8. DOI:10.1016/j.radonc.2013.08.011 |
| [15] | Sawyer TE, Bonner JA, Gould PM, et al. Effectiveness of postoperative irradiation in stage ⅢA non-small cell lung cancer according to regression tree analyses of recurrence risks[J]. Ann Thorac Surg, 1997, 64(5): 1402–1407. DOI:10.1016/S0003-4975(97)00908-9 |
| [16] | Matsuguma H, Nakahara R, Ishikawa Y, et al. Postoperative radiotherapy for patients with completely resected pathological stage ⅢA-N2 non-small cell lung cancer:focusing on an effect of the number of mediastinal lymph node stations involved[J]. Interact Cardiovasc Thorac Surg, 2008, 7(4): 573–577. DOI:10.1510/icvts.2007.174342 |
| [17] | Hui Z, Dai H, Liang J, et al. Selection of proper candidates with resected pathological stage ⅢA-N2 non-small cell lung cancer for postoperative radiotherapy[J]. Thorac Cancer, 2015, 6(3): 346–353. DOI:10.1111/1759-7714.12186 |
| [18] | McGovern SL, Liao Z, Bucci MK, et al. Is sex associated with the outcome of patients treated with radiation for non-small cell lung cancer?[J]. Cancer, 2009, 115(14): 3233–3242. DOI:10.1002/cncr.24361 |
| [19] | Vogelius IR, Bentzen SM. A literature-based meta-analysis of clinical risk factors for development of radiation induced pneumonitis[J]. Acta Oncol, 2012, 51(8): 975–983. DOI:10.3109/0284186X.2012.718093 |
| [20] | Ruckdeschel JC. Combined modality therapy of non-small cell lung cancer[J]. Semin Oncol, 1997, 24(4): 429–439. |
| [21] | Robinson LA, Wagner H, Ruckdeschel JC. Treatment of stage ⅢA non-small cell lung cancer[J]. Chest, 2003, 123(1 Suppl): 202S–220S. DOI:10.1378/chest.123.1_suppl.2023 |
| [22] | Yoshino I, Yoshida S, Miyaoka E, et al. Surgical outcome of stage ⅢA-cN2/pN2 non-small-cell lung cancer patients in Japanese lung cancer registry study in 2004[J]. J Thorac Oncol, 2012, 7(5): 850–855. DOI:10.1097/JTO.0b013e31824c945b |
| [23] | Asamura H, Goya T, Koshiishi Y, et al. A Japanese Lung Cancer Registry study: prognosis of 13, 010 resected lung cancers[J]. J Thorac Oncol, 2008, 3(1): 46–52. DOI:10.1097/JTO.0b013e31815e8577 |
 2018, Vol. 42
2018, Vol. 42


