随着世界各国核应用能力的不断提升,核能作为一种清洁、高效的能源,在发电和医疗等方面得到了广泛的利用。与此同时,核电站事故对人们的生命财产安全也存在着严重威胁。临床上,由于癌症患者的不断增加,放射治疗作为一种有效的医疗手段也已是屡见不鲜。近年来发生的日本福岛核电站事故以及临床上肿瘤患者接受放疗之后对身体状况的影响,表明核能及放射治疗的广泛应用在为人类造福的同时也存在较大的健康隐患[1-3]。因此,为防患于未然,提高放射治疗对恶性肿瘤疾病的治疗效果,寻找有效防护电离辐射损伤的药物就显得尤为重要。临床上用于辐射防护的药物较多,主要有含硫化合物、雌激素、细胞因子类等,但多数都有一定的不良反应,不可长期服用。
甘草是一种古草本植物,在中国传统医学中有着广泛的应用[4]。甘草甜素(glycyrrhizin,Gly)[5]是从药用植物甘草根茎中提取出来的一种具有特殊甜味及多种生理功效的活性成分,又名甘草酸。因其具有抗炎、抗氧化、抗肿瘤、抗病毒、调节免疫等药理活性[6-10],还有甜度高、热能低、起泡性和溶血作用低、安全无毒等特点,具有良好的医疗保健功效及广泛的应用前景[11]。镁是人体不可缺少的重要矿物质元素之一,几乎参与人体所有的新陈代谢过程,而且对神经系统等具有保护作用[12-15]。到目前为止,有关甘草甜素矿物质衍生物应用于辐射损伤防护的研究报道较少。我们通过甘草甜素与金属镁进行取代反应合成甘草甜素镁盐(Gly-Mg),在甘草甜素原有的药理活性上发挥二者的协同作用,可望达到更好的辐射防护效果。
1 材料与方法 1.1 仪器和试剂旋转蒸发器RE-5299(巩义市予华仪器有限责任公司);137Cs γ射线照射源(加拿大原子能公司生产,剂量率为0.99 Gy/min);精密电子天平PL203(梅特勒-托利多仪器有限公司);全自动血液细胞计数仪BC-2800vet(深圳迈瑞生物医疗电子股份有限公司);紫外分光光度计ZW0307060610(上海光谱仪器有限公司)。本实验室自行合成Gly-Mg,纯度≥97%(高效液相色谱法分析结果);Gly(纯度≥98%,郑州鸿祥化工有限公司);镁粉(天津天大化工);生理盐水(中国大冢制药有限公司)。
1.2 实验动物以雄性ICR小鼠为实验对象,其初始体质量为18~20 g,购置于北京维通利华实验动物技术有限公司,生产许可证号[SCXK(京)2016-0011]。饲养于中国医学科学院放射医学研究所实验动物中心SPF级动物房(饲养设施合格证号:SYXK津2009-0002)。
1.3 Gly-Mg的合成称取Gly纯品2.47 g(0.003 mol)放入容积为100 mL的圆底烧瓶中,加入60 mL 70%的乙醇做溶剂。油浴锅中加热搅拌溶解后加入镁粉0.072 g(0.003 mol),70 ℃下搅拌回流4 h,期间有气泡产生说明有反应进行。反应完成后,趁热抽滤,将滤液旋干得固体,用100%乙醇在40 ℃条件下洗涤固体2~3次,置于40 ℃恒温干燥箱干燥,磁共振氢谱和质谱检测确证化合物结构备用。
1.4 致死剂量照射小鼠30 d存活率实验 1.4.1 分组及给药雄性ICR小鼠60只,按体质量随机分为5组,12只/组。分别为单纯照射对照组,Gly给药照射组(50 mg/kg),Gly-Mg低(25 mg/kg)、中(50 mg/kg)和高(75 mg/kg)剂量给药照射组。单纯照射组给予生理盐水,给药组给予用生理盐水溶解的Gly或Gly-Mg。所有小鼠均在照射前3 d开始每天灌胃给药(1次/d,0.2 mL/只),于给药30 min后给予137Cs γ射线一次性全身照射,照射剂量为7.8 Gy,剂量率为0.99 Gy/min。
1.4.2 检测指标观察并记录各组小鼠的存活情况,并对各组照射小鼠的30 d存活率、平均存活天数和保护指数按相应方法进行计算[16]。
保护指数=[(ab+30c)/n]/ [(a′b′+30c′)/n′]。
式中,a、a′分别表示给药组和单纯照射对照组死亡小鼠的平均存活天数;b、b′分别表示给药组和单纯照射对照组的小鼠死亡只数;c、c′分别表示给药组和单纯照射对照组的30 d小鼠存活只数;n、n′分别表示给药组和单纯照射对照组的小鼠总数。
1.5 亚致死剂量照射小鼠体内抗辐射活性实验 1.5.1 分组及给药雄性ICR小鼠40只,按体质量随机分为5组,8只/组。分别为单纯照射对照组(生理盐水),Gly给药照射组(50 mg/kg),Gly-Mg低(25 mg/kg)、中(50 mg/kg)、高(75 mg/kg)剂量给药照射组。单纯照射组给予生理盐水,给药组给予用生理盐水溶解的Gly或Gly-Mg。所有小鼠均在照射前3 d开始每天灌胃给药(1次/d,0.2 mL/只),于给药30 min后给予137Cs γ射线一次性全身照射,照射剂量为6.0 Gy,剂量率为0.99 Gy/min,照射后第7天解剖。
1.5.2 检测脏器、免疫及造血系统指标各组小鼠于照射后第7天,称取其体质量,眼眶取血后颈椎脱臼处死。完整剖取胸腺、心脏、肺脏、肝脏、脾脏、胰腺、肾脏和性腺,准确称取各项脏器质量,计算脏器指数。脾脏称其质量后将其放入Bouin固定液中固定,6~24 h内肉眼计数脾脏表面突出的脾结节数。对WBC计数、骨髓有核细胞数(bone marrow nucleated cells, BMNC)和骨髓DNA含量进行测定[17]。
1.6 数据处理及统计学分析采用ChemBioOffice 13.0.2绘图分析软件进行化学结构的绘制,用SPSS19.0统计学软件进行数据分析。对受照小鼠整体保护性实验30 d存活率实验数据进行分析,并计算存活率、平均存活时间和保护指数。脏器指数、造血免疫系统结果计量资料的实验数据均以平均数±标准差(x±s)表示,使用Student-Newman-Keuls检验进行多组间显著性差异分析,对符合正态分布的数据,两组间比较采用t检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 Gly-Mg的鉴定化合物核磁共振波谱(nuclear magnetic resonance spectroscopy, 1H-NMR)解析[18](D2O,500 MHz):δ 5.49(1H, s),δ4.31(1H, s)化学位移1.60,1.36,1.19,0.90,0.84,0.61为甲基氢,其中1.19处为两个甲基信号,由此可初步判定化合物为皂苷类化合物,δ 5.49(1H, s)为一个H,判断是双键上的一个H,由于其仅有一个H且是单峰,这就表明该H周围是季碳,这又可判断为齐墩果烷型。化学位移4.31处的一个单峰为糖的端基原子,因Gly两个糖应为双峰,说明另一个糖端基H可能被-Mg取代,从其偶合常数可见,其应为β连接构型。可以说明目标化合物是Gly-Mg。
将Gly-Mg进行负离子质谱检测结果:原料Gly的相对分子量为842.93,经反应接上Mg2+后相对分子量为845.23。由于Gly-Mg分子结构中含有3个羧基氢,在质谱图中会出现(-1H)、(-2H)、(-3H)3种碎片离子峰,质/荷比如下:843.39(M-2H)、821.42(M-Mg)、410.22[(M-Mg-2H)/2]、273.15[(M-Mg-3H)/3]。
磁共振波谱和质谱分析Gly-Mg的结构见图 1所示,Gly结构中共有3个羧基,两个糖端基羧基的酸性较强。因此,镁离子应该接在图中箭头所指位置。
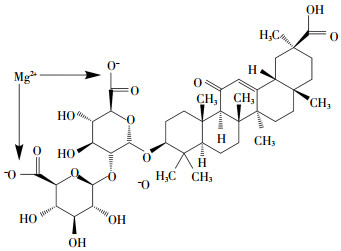
|
图 1 目标化合物Gly-Mg结构式 Figure 1 The structural formula of target compound Gly-Mg |
由表 1可知,与单纯照射组比较,Gly给药组小鼠30 d存活率升高到25.0%;Gly-Mg高剂量给药照射组小鼠30 d存活率提升到41.7%,明显延长了辐射损伤小鼠的平均生存时间,差异有统计学意义(t=3.418,P < 0.05);低剂量给药照射组和中剂量给药照射组小鼠的30 d存活率也有不同程度的升高,分别升高至25.0%和33.3%。结果提示Gly-Mg对辐射损伤小鼠有较好的辐射防护作用。
| 表1 照射小鼠30 d存活率、平均存活时间及保护指数的实验结果(x±s,n=12) Table 1 The results statistics of 30 days survival rate, the average survival time and protection index in irradiated mice(x±s, n=12) |
由表 2可知,与单纯照射组比较,Gly-Mg低、中、高给药照射组对小鼠的胸腺(t=3.259、7.580、t=3.415,均P < 0.01)、性腺(t=1.826,P < 0.05;t=2.631、2.893,均P < 0.01)、肝脏(t=4.615、1.797,均P < 0.05,t=3.341,P < 0.01)的保护作用显著,差异具有统计学意义,但对脾脏的保护作用不明显。Gly给药对照组统计数据显示,对胸腺(t=3.894,P < 0.01)和性腺(t=2.305,P < 0.05)的保护作用也比较明显,但Gly对脾脏和肝脏的保护效果较差。各项数据统计分析结果提示,Gly-Mg对辐射损伤小鼠的脏器组织具有良好的保护作用。
| 表2 Gly-Mg对辐射损伤小鼠脏器保护作用结果(x±s,n=8) Table 2 Protective effects of Gly-Mg in irradiated mice (x±s, n=8) |
由表 3可知,与单纯照射组比较,Gly-Mg低、中、高给药照射组的WBC计数、BMNC数、骨髓DNA含量和脾结节数均升高,以Gly-Mg中剂量给药照射组的辐射防护作用更加显著,差异具有统计学意义(t=2.888,P < 0.01;t=4.570,P < 0.05;t=6.139,P < 0.01;t=1.872,P < 0.01)。而Gly给药照射组各项数据较Gly-Mg给药照射各组均降低。结果提示Gly-Mg对辐射损伤小鼠的造血免疫系统具有较好的保护功效。
| 表3 Gly-Mg对辐射损伤小鼠造血免疫系统保护作用结果(x±s,n=8) Table 3 Protective effects of Gly-Mg on hemopoietic and immune system in irradiated mice(x±s, n=8) |
机体受到一定剂量的辐射后,会产生大量的自由基造成机体氧化损伤和炎性损伤[19]。因Gly具有良好的抗炎和抗氧化的药理活性[11],我们以Gly为原料,Gly化学结构中的双葡萄糖醛酸具有较强的酸性,通过进一步与镁进行取代反应合成Gly-Mg。因镁离子参与体内所有能量代谢,并能激活和催化体内酶系统。另外,镁元素通过激活生物体膜上的Na+-K+-ATP酶,保持细胞内钾的稳定,维持心肌、神经、肌肉的正常功能[20]。因此,镁元素摄入不足会导致人体许多正常组织功能失调。本研究中,Gly经化学结构改造后成功合成Gly-Mg,经化学结构鉴定后表明该方案可行,为进一步的小鼠辐射防护实验提供了目的化合物。
相关研究结果表明,Gly可以通过减少促炎性因子和趋化因子的表达,降低活性氧化物质导致的脂质蛋白变性和器官损伤[8]。Schrfelbauer等[21]也发现,Gly及甘草酸盐不仅抑制核因子-κB介导的炎症反应,而且还抑制Toll样受体4和Toll样受体刺激的丝裂原活化蛋白激酶信号级联放大,及其他Toll样受体介导的促炎症反应。Gly具有一定的辐射防护效果,但是辐射防护效果不十分明显。因此,我们通过化学反应在Gly的化学结构上联结具有辐射防护作用的基团或化合物来提高其整体的辐射防护效果。经前期大量的实验研究,筛选出辐射防护效果明显的改造化合物Gly-Mg,并做了进一步研究。本研究通过经137Csγ酌射线照射小鼠30 d存活率、平均存活时间、保护指数以及受照小鼠第7天解剖指标的脏器指数、WBC、骨髓DNA含量以及BMNC数等实验指标说明Gly-Mg和Gly对受照小鼠的辐射防护效果,结果显示Gly-Mg相较于单纯照射对照组能够明显提高小鼠存活率,延长小鼠的平均存活天数,而且比Gly的作用效果要明显。另外,Gly-Mg对胸腺指数、脾指数、肝指数、性腺指数等都有不同程度的提高,特别是中剂量给药组对造血、免疫系统指标WBC、BMNC数、骨髓DNA含量和脾结节数增幅作用效果明显。本研究数据显示,Gly-Mg较Gly有更加明显的辐射防护效果。结果提示Gly-Mg通过清除照射引起过多的活性氧;抑制核因子-κB介导的炎症反应;活化与炎症相关的细胞信号通路和抑制Toll样受体起到辐射防护作用,其具体的作用机制有待深入研究。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 牟感恩负责研究过程的实施、数据的获取与分析、论文的撰写与修订;贾艺悦、李园园负责研究过程的实施;龙伟负责论文的修订;周则卫负责研究命题的提出与设计、论文的审阅。
| [1] | Coleman CN, Blakely WF, Fike JR, et al. Molecular and cellular biology of moderate-dose(1~10 Gy) radiation and potential mechanisms of radiation protection:report of a workshop at Bethesda, Maryland, December 17-18, 2001[J]. Radiat Res, 2003, 159(6): 812–834. DOI:10.1667/RR3021 |
| [2] | Meng A, Wang Y, Brown SA, et al. Ionizing radiation and busulfan inhibit murine bone marrow cell hematopoietic function via apoptosis-dependent and -independent mechanisms[J]. Exp Hematol, 2003, 31(12): 1348–1356. DOI:10.1016/j.exphem.2003.08.014 |
| [3] | Meng A, Wang Y, Van Zant G, et al. Ionizing radiation and busulfan induce premature senescence in murine bone marrow hematopoietic cells[J]. Cancer Res, 2003, 63(17): 5414–5419. |
| [4] |
张胜.
《伤寒论》中甘草用义浅探[J]. 中医药研究, 2001, 17(1): 6–7.
Zhang S. The use of glycyrrhiza in treatise on febrile diseases[J]. Res Tradit Chin Med, 2001, 17(1): 6–7. |
| [5] |
张明发, 沈雅琴.
甘草酸及其苷元甘草次酸的糖皮质激素样作用[J]. 现代药物与临床, 2011, 26(1): 33–35.
Zhang MF, Shen YQ. Glucocorticoid-like effect of glycyrrhizic acid and its aglycone glycyrrhetic acid[J]. Drugs Clinic, 2011, 26(1): 33–35. |
| [6] |
张明发, 沈雅琴.
甘草酸的抗肿瘤作用[J]. 上海医药, 2010, 31(11): 492–495.
DOI:10.3969/j.issn.1006-1533.2010.11.005 Zhang MF, Shen YQ. The anti-tumor effects of glycyrrhizic acid[J]. Shanghai Med Pharm J, 2010, 31(11): 492–495. DOI:10.3969/j.issn.1006-1533.2010.11.005 |
| [7] | Veratti E, Rossi T, Giudice S, et al. 18 beta-Glycyrrhetinic acid and glabridin prevent oxidative DNA fragmentation in UVB-irradiated human keratinocyte cultures[J]. Anticancer Res, 2011, 31(6): 2209–2215. |
| [8] | Kudo T, Okamura S, Zhang YJ, et al. Topical application of glycyrrhizin preparation ameliorates experimentally inducedcolitis in rats[J]. World J Gastroenterol, 2011, 17(17): 2223–2228. DOI:10.3748/wjg.v17.i17.2223 |
| [9] | Liu Y, Xiang J, Liu M, et al. Protective effects of glycyrrhizic acid by rectal treatment on a TNBS-induced rat colitis model[J]. J Pharm Pharmacol, 2010, 63(3): 439–446. DOI:10.1111/j.2042-7158.2010.01185.x |
| [10] |
丁岗强, 康谊, 刘俊平, 等.
甘草甜素对脓毒症小鼠急性肺损伤保护作用的实验研究[J]. 中华医院感染学杂志, 2014, 24(19): 4742–4744.
DOI:10.11816/cn.ni.2014-140953 Ding GQ, Kang Y, Liu JP, et al. The expriment research about protective effect of glycyrrhizin on sepsis mice with acute lung injury[J]. Chin J Nosocomiol, 2014, 24(19): 4742–4744. DOI:10.11816/cn.ni.2014-140953 |
| [11] |
王肖娜, 金玉姬, 刘洋, 等.
甘草甜素的应用及研究现状[J]. 吉林医药学院学报, 2014, 35(2): 144–147.
Wang XN, Jin YJ, Liu Y, et al. Application and research of glycyrrhizi[J]. J Jilin Med College, 2014, 35(2): 144–147. |
| [12] | Teigen L, Boes CJ. An evidence-based review of oral Magnesium supplementation in the preventive treatment of migraine[J]. Cephalalgia, 2015, 35(10): 912–922. DOI:10.1177/0333102414564891 |
| [13] | Volpe SL. Magnesium in disease prevention and overall health[J]. Adv Nutr, 2013, 4(3): 378S–383S. DOI:10.3945/an.112.003483 |
| [14] | Gröber U, Schmidt J, Kisters K. Magnesium in prevention and therapy[J/OL]. Nutrients, 2015, 7(9): 8199-8226[2017-11-20]. http: //www. com/journal/nutrients. DOI: 10.3390/nu7095388. https://www.ncbi.nlm.nih.gov/pubmed/26404370 |
| [15] |
王晓波, 张乐善, 郭丽莉, 等.
补镁对人体健康的意义[J]. 河北医科大学学报, 2000, 21(5): 311–313.
Wang XB, Zhang LS, Guo LL, et al. Magnesium supplementation on human health significance[J]. Acta Hebei Med University, 2000, 21(5): 311–313. |
| [16] |
龙伟, 牟感恩, 张广慧, 等.
黑茶提取物的辐射防护作用及其机制研究[J]. 国际放射医学核医学杂志, 2017, 41(6): 407–412.
DOI:10.3760/cma.j.issn.1673-4114.2017.06.006 Long W, Mu GE, Zhang GH, et al. Anti-radiation effects of dark tea and its mechanism[J]. Int J Radiat Med Nucl Med, 2017, 41(6): 407–412. DOI:10.3760/cma.j.issn.1673-4114.2017.06.006 |
| [17] |
牟感恩, 龙伟, 李园园, 等.
N-乙酰基-S-烯丙基-L-半胱氨酸的合成及其抗辐射活性[J]. 辐射研究与辐射工艺学报, 2017, 35(5): 9–16.
DOI:10.11889/j.1000-3436.2017.rrj.35.050201 Mu GE, Long W, Li YY, et al. Synthesis and anti-irradiation activities of N-acetyl-S-allyl-L-cysteine[J]. Radiat Res Radiant Process, 2017, 35(5): 9–16. DOI:10.11889/j.1000-3436.2017.rrj.35.050201 |
| [18] |
程娟, 胡长鹰, 徐德平.
甘草甜素与甘草苷的提取分离与结构鉴定[J]. 食品工业科技, 2010, 31(9): 127–129.
Cheng J, Hu CY, Xu DP. Isolation and determination of glycyrrhizin A and liquiritin from licorice[J]. Sci Technol Food Industry, 2010, 31(9): 127–129. |
| [19] |
张广慧, 吴红英, 周则卫, 等.
湖南黑茶对小鼠辐射损伤的保护作用[J]. 天然产物研究与开发, 2016, 28(5): 775–780.
DOI:10.16333/j.1001-6880.2016.5.025 Zhang GH, Wu HY, Zhou ZW, et al. Protective effects of Hunan dark tea against radiation injuries in mice[J]. Nat Prod Res Dev, 2016, 28(5): 775–780. DOI:10.16333/j.1001-6880.2016.5.025 |
| [20] | Berhan Y, Berhan A. Should Magnesium sulfate be administered to women with mild pre-eclampsia? A systematic review of published reports on eclampsia[J]. J Obstetrics Gynaecol Res, 2015, 41(6): 831–842. DOI:10.1111/jog.12697 |
| [21] | Schrfelbauer B, Raffetseder J, Hauner M, et al. Glycyrrhizin, the main active compound in liquorice, attenuates proinflammatory responses by interfering with membrane-dependent receptor signalling[J]. Biochem J, 2009, 421(3): 473–482. DOI:10.1042/BJ20082416 |
 2018, Vol. 42
2018, Vol. 42


