2. 公共卫生学院放射医学教研室
2. Department of Radiation Medicine, School of Public Health, University of South China, Hengyang421001, China
高剂量γ射线照射能引起生物体功能障碍甚至死亡,果蝇因遗传背景清楚、生命周期短及遗传学可操作性高而成为放射生物学研究的良好模式生物[1]。尤其是基因表达调控系统Upstream Activating Sequence-GALactose4(简称UAS-Gal4)的引入使通过杂交获取特定外源基因表达变得更加容易[2]。γ射线照射主要通过两种途径对果蝇造成损害。(1)直接损伤途径:DNA断裂,γ射线使得果蝇DNA双键断裂、组织中体细胞突变,这些结果的累积是老化的基本机制之一[3];(2)间接损伤途径:组织氧化损伤,γ射线可诱导机体产生各种自由基,如超氧阴离子(O2-)、羟自由基(·OH)及各种非自由基氧化物,如过氧化氢、氧原子等[4],这些活性氧成分会对DNA、脂膜及蛋白质等大分子造成氧化损伤。笔者主要研究了γ射线照射对W1118(野生型,白眼)、UAS-EGFP(EGFP转基因果蝇,红眼)和Actin-Gal4(Gal4广泛表达果蝇,红眼)3个品系雌果蝇生存、运动、生殖以及抗氧化能力的影响。本研究结果可为监测核事故泄漏剂量及进一步将抗辐射基因转入果蝇体内的辐射防护研究奠定基础。
1 材料与方法 1.1 果蝇品系和培养条件3种果蝇品系分别为W1118、Actin-Gal4、UAS-EGFP,均由湖南师范大学生命科学院吴秀山教授惠赠[5],均为转基因所需基础品系,为日后转基因果蝇(利用UAS-Gal4系统将外源基因转入W1118果蝇中)实验奠定基础。采用玉米培养基培养果蝇幼虫,每隔8 h收集新羽化未交配雌果蝇至新鲜培养基中,25℃培养3 d,再给予剂量率为144 Gy/h的γ射线照射(HXFSI-IA137Cs γ辐照仪由中国核动力源设备制造厂生产)。
1.2 试剂和仪器二喹啉甲酸(bicichoninic acid,BCA)蛋白浓度测定试剂盒(北京必拓生物技术有限公司),过氧化氢酶(catalase,CAT)和丙二醛(malondialdehyde,MDA)检测试剂盒(南京建成生物工程有限公司),其他试剂均为分析纯。LRH-150B生化培养箱(广东省珠江医疗器械厂),centrifuge5804R高速冷冻离心机(德国Eppendorf有限公司),P.O.BOX649 -80℃超低温冰箱(美国Thermo scientific公司),Synergy TMHT酶标仪(美国BIO-TEK公司)。
1.3 γ射线照射后雌果蝇生存率的测定不同品系3日龄雌果蝇,以未照射组为对照组,每200 Gy设置一个照射组,每个照射剂量设置3个重复,每个重复30只果蝇,经不同剂量137Cs γ射线照射后24 h,记录每组果蝇存活数量,绘制剂量生存曲线,计算半数致死剂量LD50。
1.4 γ射线照射后雌果蝇运动能力的测定照射与分组方法同1.3节,经不同剂量137Cs γ射线照射后24 h后,轻晃培养管,使果蝇置于管底,培养管底部距顶部棉塞6 cm之间的区域作为果蝇攀爬运动区域,拍照记录3 s后果蝇攀爬高度。最后根据公式:攀爬分数=1 cm果蝇数×1+2 cm果蝇数×2+3 cm果蝇数×3+4 cm果蝇数×4+5 cm果蝇数×5+6 cm果蝇数×6来评价果蝇的运动能力[6]。
1.5 γ射线照射后雌果蝇生殖能力的测定不同品系3日龄雌果蝇,以未照射组为对照组,每40 Gy设置一个照射组,每个照射剂量设置3个重复,每个重复10只果蝇,经不同剂量137Cs γ射线照射后,与正常雄果蝇交配,产卵后倒出亲本果蝇,从第一个蛹产生开始连续记录30 d羽化的子代果蝇数。
1.6 γ射线照射后雌果蝇氧化损伤的测定每个品系果蝇分为未照射组(0 Gy)、生殖不育剂量照射组(160 Gy)和半数致死剂量照射组(1550 Gy)3个组,每组设置3个重复,每个重复10只果蝇。将处理后的果蝇于冰浴中进行组织匀浆,果蝇重量与PBS缓冲液比例为1 : 9,离心15 min(4℃,3500转/min,离心半径为7.8 cm),取上清液进行CAT和MDA的测定。
1.7 统计学方法采用SPSS18.0软件进行统计学分析。果蝇成虫的攀爬高度分数、生育能力、CAT活力和MDA含量均用x±s表示。所有数据均服从正态分布,方差齐,各组均数间比较采用LSD-t检验。P < 0.05表示差异有统计学意义。
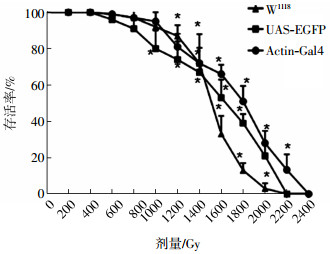
2 结果 2.1 γ射线照射对雌果蝇生存率的影响经不同剂量的γ射线照射后,W1118、UAS-EGFP、Actin-Gal4 3种果蝇的半数致死剂量LD50分别为1513、1643、1809 Gy。与对照组相比,1000 Gy可致UAS-EGFP品系生存率下降,差异有统计学意义(t=4.34,P < 0.05);1200 Gy可致W1118和Actin-Gal4品系雌果蝇生存率下降,差异有统计学意义(t=11.55、4.72,均P < 0.05),且果蝇生存率随照射剂量的增加而逐渐降低(图 1)。
|
图 1 γ射线照射后不同品系雌果蝇的生存曲线 Figure 1 Survival curves of different female Drosophila strains after gamma irradiation 图中,*表示:与对照组相比,W1118、UAS-EGFP、Actin-Gal4果蝇生存率显著降低,差异有统计学意义(t=11.55~50.23、4.34~19.69、4.72~32.51,均P < 0.05)。 |
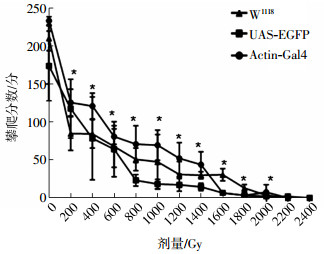
与对照组相比,W1118、UAS-EGFP、Actin-Gal4 3种果蝇的攀爬高度分数均降低,差异均有统计学意义(t=7.17~21.26、3.72~24.12、10.13~24.11,P < 0.05)(图 2),且果蝇运动能力随照射剂量的增加而逐渐降低。
|
图 2 γ射线照射后不同品系雌果蝇的运动攀爬曲线 Figure 2 Sport climbing curves of different female Drosophila strains after gamma irradiation 图中,*表示:与对照组相比,W1118、UAS-EGFP、Actin-Gal4果蝇的攀爬高度分数均降低,差异均有统计学意义(t=7.17~21.26、3.72~24.12、10.13~24.11,均P < 0.05)。 |
在γ射线照射下,W1118、UAS-EGFP和Actin-Gal4果蝇的生殖阈值分别为240、160和200 Gy,且γ射线照射剂量越大,生殖损害越大(图 3)。当照射剂量达到40 Gy时,UAS-EGFP的生殖能力显著降低,与对照组相比,差异有统计学意义(t=4.22,P < 0.05);当照射剂量达到80 Gy时,W1118和Actin-Gal4的生殖能力均显著降低,与对照组相比,差异有统计学意义(t=4.91、5.17,均P < 0.05),且果蝇的生殖能力随照射剂量的增加而逐渐降低。

|
图 3 γ射线照射后3种不同品系雌果蝇的生殖曲线 Figure 3 Reproductive curves of different female Drosophila strains after gamma irradiation 图中,*表示:与对照组相比,W1118、UAS-EGFP和Actin-Gal4果蝇生殖能力显著下降,差异有统计学意义(t=4.91~9.72、4.22~17.42、5.17~10.32,均P < 0.05)。 |
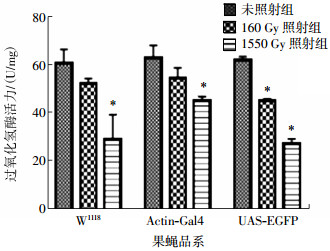
与未照射组相比,照射后不同雌果蝇CAT活力随剂量的升高而逐渐降低,当照射达到1550 Gy时,3种果蝇的CAT活力显著降低,差异有统计学意义(t=10.76、13.84、11.22,均P < 0.05)(图 4),而MDA含量随剂量的升高而逐渐升高,当照射达到1550 Gy时,3种果蝇的MDA含量显著减少,差异有统计学意义(t=4.51、4.26、4.35,均P < 0.05)(图 5)。
|
图 4 γ射线照射对3种不同品系雌果蝇过氧化氢酶活力的影响 Figure 4 Effect of gamma irradiation on different female Drosophila in catalase activity 图中,*表示:与未照射组相比,1550 Gy照射组W1118、UAS-EGFP和Actin-Gal4果蝇过氧化氢酶活力显著降低,差异有统计学意义(t= 10.76、13.84、11.22,均P < 0.05)。 |

|
图 5 γ射线照射对3种不同品系雌果蝇丙二醛含量的影响 Figure 5 Effect of gamma irradiation on different female Drosophila in malondialdehyde content 图中,*表示:与未照射组相比,1550 Gy照射组W1118、UAS-EGFP和Actin-Gal4果蝇丙二醛含量显著减少,差异有统计学意义(t=4.51、4.26、4.35,均P < 0.05)。 |
纵观生物历史,地球自然辐射背景一直是影响演化速率的关键环境因素[7-8]。由于受到核武器试验、核事故和核燃料循环活动的影响,地球环境大面积遭受人造放射性核素的污染[9-11]。因此,研究电离辐射的生物学效应显得尤为重要。有研究发现,X射线以剂量依赖的方式减少昆虫的寿命[12],影响攀爬运动活力[13],且X射线可使昆虫绝育[14]。本研究结果显示高剂量γ射线照射会损害果蝇的寿命、运动及生殖能力,与之前的研究结果相符,与高剂量下组织中积累的不良影响依赖于剂量的观点[15]一致。
昆虫受到各种非生物和生物胁迫的影响后会产生过多的活性氧[16-17]。低水平的活性氧对人体无害且在细胞信号转导中起着重要作用[18]。然而,在压力环境下,活性氧水平可能大幅增加从而导致氧化应激损伤[19]。为了防止活性氧对机体的破坏,昆虫形成了一个复杂的抗氧化系统网络,其中包括酶和非酶组分[20]。氢氧自由基是化学性质最活泼的活性氧,破坏性极强,但它可以被CAT分解,保护机体内环境稳定[21]。氧化应激产生的活性氧与脂质发生过氧化反应生成多种脂质过氧化物如MDA和新的氧自由基羟基等[22],所以通过检测果蝇组织中MDA含量能间接反映生物体内脂质氧化水平,比较其氧化损伤程度。γ射线照射会引起昆虫体内的氧化应激[23],本研究的3个品系雌果蝇体内CAT活力的下降说明γ射线降低了组织对自由基及其产物的清除能力;而MDA含量越高,脂质氧化水平越高,MDA含量的增加说明高剂量的γ射线照射能氧化损伤果蝇体内的蛋白质和脂质等大分子,从而造成机体功能障碍。
本研究结果显示,果蝇生存、运动和生殖能力的下降与体内CAT活力的下降以及MDA含量的增加有关,说明γ射线照射对成体雌蝇生存、运动和生殖能力的不利影响与其诱发的自由基氧化损伤有关,很可能的机制是通过降低果蝇体内抗氧化酶活力和非酶组分含量从而降低果蝇抵抗氧化损伤的能力,同时增加了活性氧和脂质过氧化物的生成,使损伤不断积累,从而加速了死亡的进程。本研究结果提示:一方面通过果蝇的损伤程度可以推算出核事故中区域内辐照剂量范围,对辐射环境剂量监测有参考意义;另一方面为课题组之后研究转耐辐射基因的果蝇提供依据,为进一步加强辐射防护基因治疗的研究奠定基础。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 何淑雅负责实验设计的指导、研究结果的分析及论文的修订;蒋雨薇、王五洲负责实验设计、实施、分析及论文的撰写;贺俊彦、郭忠忠、贺特、肖方竹负责实验实施与分析;马云负责实验设计的指导、研究结果的分析及论文的修订。
| [1] | Markow TA. The secret lives of Drosophila flies[J/OL]. Elife, 2015, 4: e06793[2017-11-14]. https://elifesciences.org/articles/06793. DOI: 10.7554/eLife.06793. |
| [2] |
霍桂桃, 吕建军, 屈哲, 等.
果蝇在肿瘤学研究中的优势及应用前景[J]. 遗传, 2014, 36(1): 30–40.
DOI:10.3724/SP.J.1005.2014.0041 Huo GT, Lyu JJ, Qu Z, et al. The applications and advantages of Drosophila melanogaster in cancer research[J]. Hereditas (Beijing), 2014, 36(1): 30–40. DOI:10.3724/SP.J.1005.2014.0041 |
| [3] | Jeon HJ, Kim YS, Park JS, et al. Age-related change in γH2AX of Drosophila muscle:its significance as a marker for muscle damage and longevity[J]. Biogerontology, 2015, 16(4): 503–516. DOI:10.1007/s10522-015-9573-0 |
| [4] | Comparative studies on the discrepant fragmentation mechanisms of the GLy-Asp-Gly-Argand Arg-Gly-Asp-Gly: evidence for the mobile proton model[J]. Eur J Mass Spectrom(Chichester), 2014, 20(4): 317-325. http://journals.sagepub.com/doi/abs/10.1255/ejms.1287?journalCode=emsa |
| [5] | Huang W, Deng Y, Dong W, et al. The effect of excess expression of GFP in a novel heart-specific green fluorescence zebrafish regulated by nppa enhancer at early embryonic development[J]. Mol Biol Rep, 2011, 38(2): 793–799. DOI:10.1007/s11033-010-0168-1 |
| [6] | Gargano JW, Martin I, Bhandari P, et al. Rapid iterative negative geotaxis(RING):a new method for assessing age-related locomotor decline in Drosophila[J]. Exp Gerontol, 2005, 40(5): 386–395. DOI:10.1016/j.exger.2005.02.005 |
| [7] | Müller AP, Mousseau TA. The effects of natural variation in background radioactivity on humans, animals and other organisms[J]. Biol Rev Camb Philos Soc, 2013, 88(1): 226–254. DOI:10.1111/j.1469-185X.2012.00249.x |
| [8] | Shahbazi-Gahrouei D, Gholami M, Setayandeh S. A review on natural background radiation[J]. Adv Biomed Res, 2013, 2: 65. DOI:10.4103/2277-9175.115821 |
| [9] | Nies H, Harms IH, Karcher MJ, et al. Anthropogenic radioactivity in the Arctic Oceanreview of the results from the joint German project[J]. Sci Total Environ, 1999, 237-238: 181–191. DOI:10.1016/S0048-9697(99)00134-5 |
| [10] | Lou Y, Wan L, Ma Y, et al. Survey on radioactive contamination in Beijing following the Japanese Fukushima nuclear accident[J]. J Radiol Prot, 2013, 33(3): 661–668. DOI:10.1088/0952-4746/33/3/661 |
| [11] | Kozhakhanov TE, Lukashenko SN, Larionova NV. Accumulation of artificial radionuclides in agricultural plants in the area used for surface nuclear tests[J]. J Environ Radioact, 2014, 137: 217–226. DOI:10.1016/j.jenvrad.2014.06.026 |
| [12] | Yamada H, Parker AG, Oliva CF, et al. X-ray-induced sterility in Aedes albopictus (Diptera:Culicidae) and male longevity following irradiation[J]. J Med Entomol, 2014, 51(4): 811–816. DOI:10.1603/ME13223 |
| [13] | Siddique YH, Haidari M, Khan W, et al. Toxic potential of copper-doped ZnO nanoparticles in Drosophila melanogaster (Oregon R)[J]. Toxicol Mech Methods, 2015, 25(6): 425–432. DOI:10.3109/15376516.2015.1045653 |
| [14] | Chang CL, Villalun M, Geib SM, et al. Pupal X-ray irradiation influences protein expression in adults of the oriental fruit fly, Bactrocera dorsalis[J]. J Insect Physiol, 2015, 76: 7–16. DOI:10.1016/j.jinsphys.2015.03.002 |
| [15] | Moskalev AA, Plyusnina EN, Shaposhnikov MV. Radiation hormesis and radioadaptive response in Drosophila melanogaster flies with different genetic backgrounds:the role of cellular stress-resistance mechanisms[J]. Biogerontology, 2011, 12(3): 253–263. DOI:10.1007/s10522-011-9320-0 |
| [16] | Ye K, Ji CB, Lu XW, et al. Resveratrol attenuates radiation damage in Caenorhabditis elegansby preventing oxidative stress[J]. J Radiat Res, 2010, 51(4): 473–479. DOI:10.1269/jrr.10009 |
| [17] | Ali A, Rashid MA, Huang QY, et al. Influence of UV-A radiation on oxidative stress and antioxidant enzymes in Mythimna separata (Lepidoptera:Noctuidae)[J]. Environ Sci Pollut Res Int, 2017, 24(9): 8392–8398. DOI:10.1007/s11356-017-8514-7 |
| [18] | Kim MJ, Johnson WA. ROS-mediated activation of Drosophila larval nociceptor neurons by UVC irradiation[J]. BMC Neurosci, 2014, 15: 14. DOI:10.1186/1471-2202-15-14 |
| [19] | Hansen PJ. Effects of heat stress on mammalian reproduction[J]. Philos Trans R Soc Lond B Biol Sci, 2009, 364(1534): 3341–3350. DOI:10.1098/rstb.2009.0131 |
| [20] | Sahoo A, Sahu S, Dandapat J, et al. Pro-oxidative challenges and antioxidant protection during larval development of non-mulberry silkworm, Antheraea mylitta (Lepidoptera:Saturniidae)[J]. Ital J Zool, 2015, 83(1): 1–12. DOI:10.1080/11250003.2015.1103319 |
| [21] | Quiñonez-Flores CM, González-Chávez SA, Del Río Nájera D, et al. Oxidative Stress Relevance in the Pathogenesis of the Rheumatoid Arthritis: A Systematic Review[J/OL]. Biomed Res Int, 2016, 2016: 6097417[2017-11-14]. https: //www. hindawi. com/journals/bmri/2016/6097417/citations. DOI: 10.1155/2016/6097417. https://www.hindawi.com/journals/bmri/2016/6097417/ |
| [22] | Abdel-Rafei M, Amin MM, Hasan HF. Novel effect of Daflon and low-dose γ-radiation in modulation of thioacetamide-induced hepatic encephalopathy in male albino rats[J]. Hum Exp Toxicol, 2016, 36(1): 62–81. DOI:10.1177/0960327116637657 |
| [23] | Seong KM, Yu M, Lee KS, et al. Curcumin mitigates accelerated aging after irradiation in Drosophila by reducing oxidative stress[J/OL]. Biomed Res Int, 2015, 2015: 425380[2017-11-14]. https://www.hindawi.com/journals/bmri/2015/425380. DOI: 10.1155/2015/425380. |
 2018, Vol. 42
2018, Vol. 42


