单发肺结节是影像学诊断中最常见的临床问题之一,同时也是 18F-FDG PET/CT 诊断工作中经常遇见的问题,但就目前而言,即使有 PET/CT 这样的高端诊断仪器,总体来看 18F-FDG PET/CT 显像对肺结节定性诊断的正确率较单纯 CT 诊断并无明显提升。究其原因,除了与单发恶性肺结节在 CT 上的表现复杂多样,所表现的征象与炎性肺结节有较多重叠相关外,也与 18F-FDG PET/CT 显像上恶性结节呈非特异性 18F-FDG 摄取,与炎性结节的 18FFDG 摄取有较多的类似有关。CT 影像对肺结节的诊断主要是通过观察结节的各种边缘征象来分析其良恶性的,恶性结节的边缘征象主要包括:毛刺征、分叶征、胸膜牵拉征及血管集束征。但在 18F-FDG PET/CT 显像上,不同边缘征象所在区域的 18F-FDG 代谢程度是否一致,是否与边缘征象存在一定联系,则是值得探讨的问题,也具有重要的临床意义。笔者通过总结 50 例恶性肺结节的 18F-FDG PET/CT 显像资料,同机对比 CT 上显示恶性肺结节的边缘征象与 PET 上对应部位 18F-FDG 的代谢程度,分析不同边缘征象所在区域 18F-FDG 摄取程度的差异,从而明确各种边缘征象与所对应区域 18F-FDG 摄取程度的关系。
1 资料与方法 1.1 一般资料收集2015年7月至2017年6月于我院核医学科行18F-FDG PET/CT显像且经病理证实的50例单发恶性肺结节患者的影像资料,同机对比CT影像上结节的边缘征象与PET显像上对应区域的18F-FDG摄取程度。50例单发恶性肺结节患者中,男性32例、女性18例,年龄30~78岁,平均年龄为(52.3±10.6)岁,其中鳞癌23例、腺癌27例。
本研究中所有患者在行18F-FDG PET/CT检查前均签署了知情同意书。
1.2 纳入和排除标准(1)为避免容积效应对病灶18F-FDG摄取程度的影响,所选结节的直径范围为1.0~5.0 cm;(2)入选病例均为实性结节,纯磨玻璃结节或混杂磨玻璃结节者不纳入研究;(3)病例均经病理证实为原发性肺癌,肺转移瘤及其他少见恶性肿瘤者不纳入研究;(4)入组病例均出现≥1个边缘征象,无明确边缘征象者或局部区域边缘征象重叠者不纳入研究;(5)中央性肺癌及与胸膜相邻紧密的周围性肺癌因可分别影响血管集束征及胸膜牵拉征的显示而未纳入研究;(6)入组病例肺结节内部无明显坏死及含气囊腔,周围无合并明显炎症病灶;(7)因呼吸运动及体位运动影响,PET/CT图像融合不佳者不纳入研究。
1.3 PET/CT显像50例患者均为术前行18F-FDG PET/CT显像,显像设备为上海联影医疗公司的uMI 510型超清PET/CT仪,显像剂18F-FDG由上海原子科兴药业公司生产,放化纯度>95%。患者显像前空腹4~6 h,按3.7 MBq/kg剂量经静脉注射显像剂,休息45~60 min后行全身18F-FDG PET/CT显像。扫描参数:体部CT电压120 kV,电流140 mA,螺距5.0 mm,球管单圈旋转时间0.8 s,层厚5.0 mm。图像采集方式:三维采集模式,每个床位采集时间为3 min,常规采集5~7个床位。经CT衰减校正、有序子集最大期望值重建算法进行图像重建,分别得到全身断层CT及PET图像,由北京麦迪克斯公司提供的PET/CT医学影像工作站进行图像融合。全身PET/CT显像结束后,加扫胸部薄层高分辨率CT,层厚1.0 mm,采用高分辨骨算法进行图像重建。
1.4 结节边缘征象分析及对应区域18F-FDG摄取程度的测量两位从事PET/CT诊断10年以上的高年资核医学科医师在不知病理结果的前提下对结节出现的毛刺征、分叶征、胸膜牵拉征、血管集束征作出判断,如对结节边缘征象判断不能肯定者,可结合薄层CT扫描进一步明确。各边缘征象的阳性判断标准如下。(1)毛刺征:瘤体表面不光滑,形成突出结节主体的线状、刺状或棘样结构。(2)分叶征:瘤体表面不平坦,形成局部圆隆状突起。(3)胸膜牵拉征:肿瘤牵拉周围胸膜形成V形、伞形或三角状结构。(4)血管集束征:结节肺门侧的气管血管束聚集进入肺结节。两位医师对边缘征象判定一致时为边缘征象阳性,并对入选病例每一结节的长径、宽径及高径进行测量。
在PET/CT融合图像上阳性边缘征象所在层面,选择边缘征象所在区域直径1.0 cm的固定圆作为ROI测定范围,并记录计算机软件自动测得的平均标准化摄取值(average standardized uptake value,SUVave)、SUVmax及标准化摄取均峰差(以ΔSUV表示,即SUVmax- SUVave)。毛刺征选择毛刺所在瘤体基底部作为ROI;分叶征选择突出轮廓最为明显的圆隆突起区域作为ROI;胸膜牵拉征选择结节牵拉胸膜集中点的瘤体基底部作为ROI;血管集束征选择气管血管束进入瘤体基底部作为ROI。肺结节各边缘征象所在区域ROI部位选择见图 1。
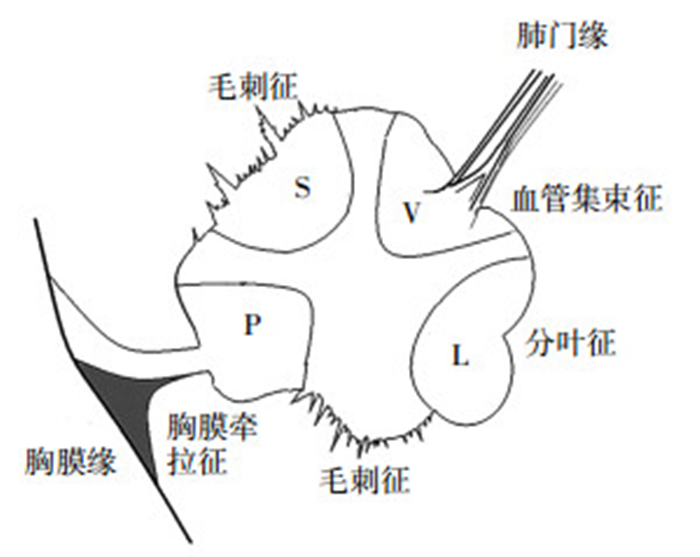
|
图 1 肺结节各边缘征象所在区域感兴趣区部位选择示意图 Figure 1 Illustration of selected corresponding regions of interest in various edge sign areas of malignant solitary pulmonary nodules 图中,S:毛刺征感兴趣区区域;P:胸膜牵拉征感兴趣区区域;L:分叶征感兴趣区区域;V:血管集束征感兴趣区区域。 |
运用SPSS19.0软件进行统计学分析。对各组边缘征象对应区域的SUVave、SUVmax及ΔSUV分别进行统计学计算,均数以x±s表示;各组SUVave、SUVmax及ΔSUV的比较以多组间均数比较LSD法进行检验,P<0.05表示差异有统计学意义。
2 结果 2.1 恶性单发肺结节出现边缘征象及对应区域18F-FDG摄取情况50例恶性单发肺结节所在肺叶情况为:右肺上叶14例、右肺中叶2例、右肺下叶10例、左肺固有上叶13例、左肺舌叶3例、左肺下叶8例。结节最大径(d)情况为: 1.0 cm < d ≤ 2.0 cm者8例、2.0 cm < d ≤3.0 cm者15例、3.0 cm < d ≤ 4.0 cm者17例、4.0 cm < d ≤5.0 cm者10例。结节出现边缘征象情况为:出现1个边缘征象者9例、2个边缘征象者14例、3个边缘征象者13例、4个边缘征象者14例。50例恶性单发肺结节出现边缘征象及对应区域18F-FDG摄取情况具体见表 1。
| 表1 50例恶性单发肺结节出现的边缘征象及对应区域SUVave、SUVmax及ΔSUV情况 Table 1 Edge signs and SUYave, SUVmax and ΔSUV of malignant solitary pulmonary nodules on the corresponding areas in 50 studied cases |
50例单发肺结节病例中,出现毛刺征者35例,SUVave=4.99±2.98,SUVmax=5.87±3.48,ΔSUV=0.88±0.67;出现分叶征者41例,SUVave=6.95±3.30,SUVmax=8.43±3.98,ΔSUV=1.48±1.04;出现胸膜牵拉征者26例,SUVave=4.45±2.03,SUVmax=5.40±2.45,ΔSUV=0.95±0.82;出现血管集束征者30例,SUVave=6.36±3.94,SUVmax=7.78±5.22,ΔSUV=1.42±1.52。分叶征组的SUVave、SUVmax及ΔSUV明显大于毛刺征组及胸膜牵拉征组,差异有统计学意义(LSD法,P=0.008、0.006、0.015及P=0.002、0.003、0.049),见图 2及图 3;血管集束征组的SUVave及SUVmax明显大于胸膜牵拉征组,差异有统计学意义(LSD法,P=0.026、0.026),见图 4。
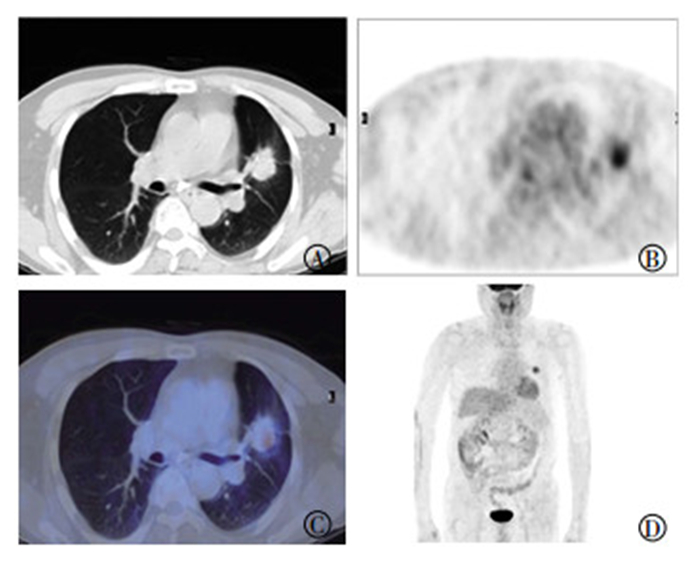
|
图 2 左上肺恶性肺结节18F-FDG PET/CT显像图 Figure 2 18F-FDG PET/CT imaging of malignant solitary pulmonary nodules in the upper left lung of a 54-year old male patient 患者男性,54岁,图中,A、B、C、D分别显示肺结节所在横断层面CT图像、PET图像、融合PET/CT图像及全身PET显像最大密度投影图像,结节左后缘(分叶征所在边缘区域)18FFDG摄取程度高,SUVmax=4.6,SUVave= 4.0,结节前缘(毛刺征所在边缘区域)18F-FDG摄取程度低,SUVmax=3.0,SUVave= 2.6;SUVmax:最大标准化摄取值;SUVave:平均标准化摄取值。 |
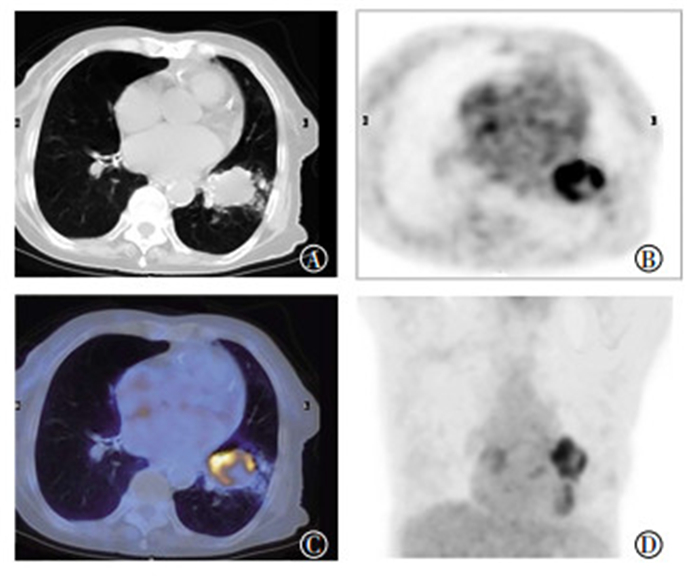
|
图 3 左上肺恶性肺结节18F-FDG PET/CT显像图 Figure 3 18F-FDG PET/CT imaging of malignant solitary pulmonary nodules in the upper left lung of a 65-year old male patient 患者男性,65岁,图中,A、B、C、D分别显示肺结节所在横断层面CT图像、PET图像、融合PET/CT图像及肺部PET显像最大密度投影图像,显示结节肺门缘(分叶征所对应区域)18F-FDG摄取程度最高,前游离缘(毛刺征所对应区域)18F-FDG摄取程度较高,胸膜缘(胸膜牵拉征所对应区域)18F-FDG摄取明显减低,肿瘤18F-FDG摄取呈现由肺门缘向胸膜缘依次递减表现。 |
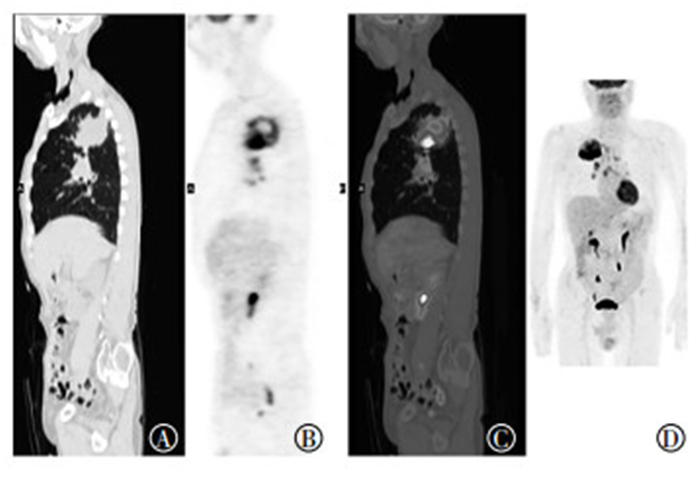
|
图 4 右上肺恶性肺癌18F-FDG PET/CT显像图 Figure 4 18F-FDG PET/CT imaging of malignant solitary pulmonary nodules in the upper right lung of a 67-year old male patient 患者男性,67岁,图中,A、B、C、D分别显示肺结节所在矢状层面CT图像、PET图像、融合PET/CT图像及全身PET显像最大密度投影图像,显示肿瘤近肺门缘(血管集束征所对应区域)18F-FDG摄取程度高,而肿瘤外后方近胸膜缘(胸膜牵拉征所对应区域)18F-FDG摄取程度低。 |
单发恶性肺结节边缘征象分析是传统肺部影像诊断学研究的热点内容,也是临床诊断中经常遇到的问题。随着影像学技术的发展及民众健康意识的提高,单发肺结节的检出率越来越高。目前,虽然对肺结节影像的认识逐步提高,特别是肺结节边缘征象,如分叶征、毛刺征、胸膜牵拉征与血管集束征等[1-4]的征象分析已作为判断结节良恶性的重点内容,但就目前临床实践而言,准确运用各种征象判定结节的良恶性仍存在一定的困难,原因在于影像医师对各种征象的把握准确性不一,并且上述各种边缘征象在非肿瘤性结节中也存在一定的交叉性。18F-FDG PET/CT一体机问世以来,肺结节的研究进入了一个崭新的阶段,肺结节诊断的准确率也有了明显的提高,但不可否认的是PET/CT在准确判定结节性质方面仍存在一定的困难,原因在于:诊断医师对于病灶18F-FDG摄取的机制不甚了解,对结节病灶的18F-FDG摄取无法准确地判断其所蕴含的信息;18F-FDG PET显像肺结节亦存在不少假阳性及假阴性的情况,对肺结节性质的判断造成较大的迷惑性,如对于早期肺部恶性肿瘤或以浸润性生长为主的肿瘤,结节的18F-FDG摄取值可以很低[5],而各种炎性病变特别是肉芽肿性病变,如结核、结节病、霉菌及炎性假瘤等病变都存在18F-FDG高摄取,与恶性结节的区分存在较大的困难[6]。因此,即使PET/CT作为目前诊断肿瘤的最先进仪器,但仍有不少亟需解决的问题。特别是反映肿瘤生长特性的结节边缘形态与反映肿瘤代谢特性的结节的18F-FDG分布特点是否存在某种联系,目前尚无明确的阐释,相关的研究工作也并不多。笔者回顾性分析了50例恶性肺结节CT边缘征象及所对应区域18F-FDG摄取程度的差异,由于结节不同边缘征象反映了肿瘤不同的生长特性,其所对应的肿瘤代谢活性也不相同,通过归纳与结节边缘征象相关的18F-FDG摄取的变化规律,以期更深入地理解恶性肺结节边缘征象在18F-FDG PET/CT显像中所蕴含的代谢方面的信息,这对于准确把握肺结节性质具有重要的临床价值和意义。
本研究结果显示,50例恶性肺结节边缘征象所对应区域的18F-FDG摄取程度差异具有统计学意义,分叶征区域18F-FDG摄取值明显大于胸膜牵拉征区域及毛刺征区域,血管集束征区域18F-FDG摄取值明显大于胸膜牵拉征区域,同一肿瘤组织的不同区域出现不同程度的18F-FDG摄取,这说明恶性肿瘤存在异质性[7]。恶性肿瘤的分化、增殖、浸润是恶性肿瘤最重要的生物学特征,对于生长至一定阶段具有一定分化程度的恶性肿瘤而言,增殖与浸润这两种生长方式不同程度地贯穿于肿瘤不同的发展阶段及部位,即肿瘤的生长具有时间异质性与空间异质性[8],前者是指在某一生长阶段中,这两种生长方式有高低水平不同;后者是指在具有一定分化程度的肿瘤的不同区域,这两种生长方式亦存在高低水平不同[9]。
18F-FDG PET/CT能够客观地反映肿瘤增殖与浸润的生长方式的不同。增殖是指肿瘤细胞不断繁衍,其增生程度不受限制与自我调控的生物学特性,恶性肿瘤细胞的增殖程度为正常细胞的几何倍数。肿瘤增殖活性是决定其18F-FDG摄取的最关键的因素,这是因为肿瘤细胞分裂所需能量的主要物质腺苷是通过糖酵解产生的,在恶性肿瘤中,肿瘤增殖能力越高,细胞内糖酵解则越强,体内营养物质葡萄糖源源不断进入肿瘤组织以加强糖酵解过程[10]。由于18F-FDG的结构与葡萄糖类似,但其代谢途径与葡萄糖有所不同,进入肿瘤细胞内的18F-FDG无法像正常葡萄糖一样进行进一步代谢而聚集在肿瘤细胞内,一定体积的肿瘤组织通过18F-FDG PET/CT显像呈现放射性高活性浓聚灶,即肿瘤代谢高活性“热点”[11]。因此,在全身18F-FDG代谢显像上可以理解成细胞能量代谢显像,即所需消耗能量物质较多的及增殖活性较高的组织,其在PET/CT显像上表现为18F-FDG摄取增强。
肿瘤的另一种重要生长方式是浸润,是指肿瘤细胞失去细胞间黏合、水解周围基质成分、向外扩散并侵袭破坏周围正常组织的过程[12]。以浸润为主的肿瘤生长方式与以增殖为主的生长方式比较而言,两者的肿瘤细胞成分及间质含量分布存在不同:以增殖为主要生长方式的肿瘤组织其细胞间有紧密连接,肿瘤间质形成较少,肿瘤细胞密度高;而以浸润为主要生长方式的肿瘤组织其细胞间黏合消失,肿瘤间质成分较多,肿瘤细胞排列分散[13-14]。
肿瘤膨胀性生长是肿瘤以增殖为主要生长方式的外在反映,在CT影像上表现为肿瘤边缘分叶征象,肿瘤膨胀性生长时,生长较快的区域形成局部边缘膨隆状外观,其反映了内部肿瘤细胞旺盛增殖的特性。本研究结果显示,分叶征组的18F-FDG摄取程度明显高于其他边缘征象组,印证了该区域肿瘤高增殖活性的特性。
肿瘤侵袭性生长是肿瘤以浸润为主要生长方式的外在反映,CT影像上的血管集束征、毛刺征及胸膜牵拉征是肿瘤分别向邻近气管血管束、小叶间隔及胸膜侵袭生长的表现形式。以浸润为主要生长方式的肿瘤由于细胞分布稀疏及间质明显增多,能有效摄取18F-FDG的肿瘤细胞单位减少,因而表现为该区域18F-FDG放射性分布较以增殖生长方式为主的肿瘤区域低。本研究结果显示,毛刺征及胸膜牵拉征所对应区域的18F-FDG摄取程度明显低于分叶征所对应区域,虽然血管牵拉征与分叶征所对应区域18F-FDG摄取程度差异并无统计学意义,但分叶征与胸膜牵拉征的差异(PSUVave=0.002,PSUVave=0.003),较血管集束征与胸膜牵拉征的差异(PSUVave=0.047,PSUVave=0.026)更为显著,因此说明以膨胀性生长为主要特征的分叶征所对应区域的18F-FDG摄取值较包括血管集束征在内的以侵袭性生长为主要方式的边缘征象对应区域的18F-FDG摄取值更高。
本研究结果显示,以侵袭性生长为主要方式的征象所对应区域的18F-FDG放射性分布程度以血管集束征区域、毛刺征区域、胸膜牵拉征区域的顺序递减,笔者推测这可能是由于这些边缘征象与肿瘤供养血管在空间上的远近有重要关系。血管集束征、毛刺征、胸膜牵拉征分别代表肿瘤于肺门缘、游离缘及胸膜缘方向的侵袭,对大多数肺肿瘤而言,其供养血管往往由肺门侧支气管动脉供应,靠近供养血管越近,其氧耗越明显,血流带来的能量物质源源不断被供养血管近侧肿瘤组织所攫取,而供养血管远侧肿瘤组织的氧供明显不足,肿瘤组织依靠较低能量代谢维持生长。因此,不同边缘征象18F-FDG摄取程度有差异,可能是由于肿瘤血管异质性分布造成的。
本研究结果显示,有3例患者胸膜牵拉征所对应区域18F-FDG摄取并非明显降低,其中1例为所有边缘征象中18F-FDG摄取值最高者,另2例略低于分叶征象所对应区域,但明显高于其他区域。同时,在平时的PET/CT工作实践中,有时也发现肺结节胸膜牵拉征边缘区域放射性分布反而较其他区域更高,笔者认为这些病例占比较少,可能是由于入组病例排除了与胸膜紧密贴邻的肺结节所造成的,由于与胸膜贴邻的肺癌可能出现胸膜侵犯,新生肿瘤血管逐渐与肋间动脉连通,使肋间动脉作为肿瘤主要的滋养血管,在这种情况下,肿瘤滋养血管在空间位置上发生变化,结节的胸膜缘邻近肿瘤滋养血管而结节的肺门缘远离肿瘤滋养血管,因而出现了与上述不一致的情况。
必须指出,肿瘤血管分布异质性是一个假设,其虽可以合理解释肿瘤边缘区域18F-FDG分布差异,但需要进一步对肿瘤微循环灌注显像方能得以证实,同时需要收集更多的病例加以验证。
本研究结果显示,分叶征组ΔSUV较毛刺征组及胸膜牵拉征组差异也有统计学意义,ΔSUV是该区域SUVmax与SUVave的差值,是该区域18F-FDG摄取值变化的差异性的参数,反映了该区域肿瘤增殖活性的潜能大小。ΔSUV越大,代表该区域肿瘤组织中进入细胞周期的肿瘤细胞增多,肿瘤组织内变为更大增殖活性肿瘤细胞的潜能较高,肿瘤组织生长趋于炽盛;ΔSUV越小,代表该区域的肿瘤细胞增殖活性已基本一致,肿瘤组织内变为更高增殖活性肿瘤细胞的潜能较低,肿瘤组织生长趋于平静。分叶征组ΔSUV较其他边缘征象组更高,从另一角度说明了分叶征所对应区域肿瘤组织增殖活跃,且印证了分叶征所对应的18F-FDG高摄取区是代表肿瘤以增殖为主要生长方式的特征性反映。
总之,恶性肺结节CT边缘征象与该部位18F-FDG摄取程度存在密切的联系,以增殖为主要生长方式的肿瘤区域18F-FDG摄取水平明显增高,而以浸润为主要生长方式的肿瘤区域18F-FDG摄取水平较低,且浸润病灶在不同边缘征象对应区域18F-FDG摄取程度也存在一定的差异,这种差异反映了肿瘤生长方式及血流分布的异质性,肿瘤边缘征象与对应区域18F-FDG摄取程度的关系既解释了肿瘤外观形态与内部功能代谢之间的联系,对于更深入及准确地理解肺结节边缘特征与代谢特性有重要作用,同时也对提高18F-FDG PET/CT诊断肺结节的准确率有重要的临床价值和作用。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 寿毅负责论文撰写;姜建隽、王海岩负责病灶边缘征象确定及 18F-FDG 摄取值测定;蒋艳负责参考文献查阅;宋结平 负责医学统计;尤志雯、孟庆元负责入组病例的收集及常规的 PET/CT 扫描;陈兴负责论文文字校正及格式修改;赵军负责论文 构思及方法建立。
| [1] | Pasławski M, Krzyzanowski K, Złomaniec J, et al. Morphological characteristics of malignant solitary pulmonary nodules[J]. Ann Univ Mariae Curie Sklodowska Med, 2004, 59(1): 6–13. |
| [2] | Hu H, Wang Q, Tang H, et al. Multi-slice computed tomography characteristics of solitary pulmonary ground-glass nodules:Differences between malignant and benign[J]. Thorac Cancer, 2016, 7(1): 80–87. DOI:10.1111/1759-7714.12280 |
| [3] | Zhang Y, Qiang JW, Ye JD, et al. High resolution CT in differentiating minimally invasive component in early lung adenocarcinoma[J]. Lung Cancer, 2014, 84(3): 236–241. DOI:10.1016/j.lungcan.2014.02.008 |
| [4] | Snoeckx A, Reyntiens P, Desbuquoit D, et al. Evaluation of the solitary pulmonary nodule:size matters, but do not ignore the power of morphology[J]. Insights Imaging, 2018, 9(1): 73–86. DOI:10.1007/s13244-017-0581-2 |
| [5] | Groheux D, Hindié E, Trédaniel J, et al. PET-CT for evaluation of the solitary pulmonary nodule:an update[J]. Rev Mal Respir, 2009, 26(10): 1041–1055. DOI:10.1019/20094129 |
| [6] | Li Y, Su M, Li F, et al. The value of 18F-FDG-PET/CT in the differential diagnosis of solitary pulmonary nodules in areas with a high incidence of tuberculosis[J]. Ann Nucl Med, 2011, 25(10): 804–811. DOI:10.1007/s12149-011-0530-y |
| [7] | Jögi A, Vaapil M, Johansson M, et al. Cancer cell differentiation heterogeneity and aggressive behavior in solid tumors[J]. Ups J Med Sci, 2012, 117(2): 217–224. DOI:10.3109/03009734.2012.659294 |
| [8] | Asselin MC, O'Connor JP, Boellaard R, et al. Quantifying heterogeneity in human tumours using MRI and PET[J]. Eur J Cancer, 2012, 48(4): 447–455. DOI:10.1016/j.ejca.2011.12.025 |
| [9] | Burrell RA, McGranahan N, Bartek J, et al. The causes and consequences of genetic heterogeneity in cancer evolution[J]. Nature, 2013, 501(7467): 338–345. DOI:10.1038/nature12625 |
| [10] |
寿毅, 陆建平, 陈涛, 等.
PET/CT显像淋巴瘤病灶18F-FDG摄取程度与肿瘤增殖性抗原Ki-67相关性研究[J]. 中国医学计算机成像杂志, 2009, 15(3): 278–284.
DOI:10.3969/j.issn.1006-5741.2009.03.018 Shou Y, Lu JP, Chen T, et al. Study of the correlation between 18F-FDG uptake value of lymphoma lesion and tumor's proliferative antigen Ki-67[J]. Chin Comput Med Imag, 2009, 15(3): 278–284. DOI:10.3969/j.issn.1006-5741.2009.03.018 |
| [11] | Khan N, Islam MM, Mahmood S, et al. 18F-fluorodeoxyglucose uptake in tumor[J]. Mymensingh Med J, 2011, 20(2): 332–342. |
| [12] |
吴剑, 杨湛.
肿瘤浸润前沿细胞的生物学特性[J]. 医学综述, 2007, 13(13): 986–988.
DOI:10.3969/j.issn.1006-2084.2007.13.012 Wu J, Yang Z. Bionomics of advancing front cell in tumor invasion[J]. Med Recapit, 2007, 13(13): 986–988. DOI:10.3969/j.issn.1006-2084.2007.13.012 |
| [13] | Eberhard A, Kahlert S, Goede V, et al. Heterogeneity of angiogenesis and blood vessel maturation in human tumors:implications for antiangiogenic tumor therapies[J]. Cancer Res, 2000, 60(5): 1388–1393. |
| [14] | Dvorak HF. Tumor Stroma, Tumor Blood Vessels, and Antiangioge-nesis Therapy[J]. Cancer J, 2015, 21(4): 237–243. DOI:10.1097/PPO.0000000000000124 |
 2018, Vol. 42
2018, Vol. 42


