原发性帕金森病(Parkinson′s disease,PD)是一种慢性进行性神经系统变性疾病,病理变化主要是黑质多巴胺能神经元脱失变性,黑质和蓝斑区神经元内路易(Lewy)小体形成[1]。PD的主要症状包括静止时手、头或嘴不自主震颤,肌肉僵直,运动缓慢等,严重的可导致患者生活不能自理,该病主要影响中老年人,尤其是60岁以上的老年人的健康[2]。影响PD诊断的因素主要有以下几个方面:PD的确诊需要组织病理学上路易小体出现;没有持续、可靠的诊断标准,无法评估患者病情发展;临床症状多样性且部分患者症状不典型[3]。目前临床上主要依据患者的症状、体征以及对多巴制剂有无治疗反应等方面进行综合评价来对PD进行诊断,但由于PD症状出现时黑质多巴胺能神经元毁损往往已经达到50%~80%,因而早期诊断出PD是十分重要的[4]。
多巴胺转运蛋白(dopamine transporter,DAT)是位于黑质纹状体多巴胺能神经元末梢突触前膜的一种膜蛋白,属于Na+/Cl-依赖性膜转运体家族,是多种神经精神药物潜在的作用靶点。它的主要功能是将突触间隙多余的多巴胺再摄取,中止多巴胺对突触后膜多巴胺受体的刺激,再由去甲肾上腺素转运体输送至神经元内,供下次传递冲动再释放[5]。DAT能调控突触间隙多巴胺水平、维系突触前多巴胺合成和存储,而多巴胺与多种神经系统疾病有关,因此,DAT功能活动的密度变化是反映多巴胺递质系统功能的重要指标。
2 DAT PET显像研究表明,PD患者黑质纹状体多巴胺能神经元的变性脱失伴随突触前膜DAT数量及功能的明显下降,两者的变化一致;然而在PD早期,多巴脱羧酶的活性以及多巴胺受体的数量均存在一定的代偿现象[6]。因此,基底节DAT更直接、灵敏的异常变化,更适用于PD的早期诊断。DAT显像剂可以与DAT特异性结合,具有很高的亲和力和摄取特异性,脑清除率较慢,静脉注射后能直接、灵敏地反映突触前多巴胺能神经元变化,与PD的严重程度存在良好的相关性[7];同时DAT显像剂与5-羟色胺受体、去甲肾上腺素受体的结合率低,用于PET显像时不易受到患者服药因素的影响,可应用于PD的早期诊断中[8]。
PET是利用正电子放射性药物进行体内成像,具有较高的灵敏度,可以无创、动态、定量地研究人体内的化学过程和生理生化过程,是探知脑功能的重要手段之一[9-10]。PET能较早且准确地揭示和捕获机体的异常生物学信息,甚至可在出现临床体征或结构形态改变之前发现病变,可以与DAT显像进行有效结合,在PD的诊断和病情评价方面发挥着重要的作用[11]。
正电子放射性药物大多为组成生命的最基本元素的放射性同位素,如11C(半衰期20.4 min)、13N(半衰期10 min)、15O(半衰期122 s)、18F(半衰期109.8 min)等标记的有机化合物[12]。由于生物体内的有机物绝大多数含有C原子,可用于标记的体内分子较其他元素更广泛,同时11C标记药物所用靶材料价格低廉,制备过程比18F标记药物简便,可广泛应用于PET/CT的研究和诊断中[13]。
3 药物概况11C-Altropane(C1711CH21FINO2),化学名称为11C-甲基-2β-甲酯基-3β-(4-氟苯基)-N-(3-碘-E-烯丙基)托烷,英文名称为11C-2β-carbomethoxy-3β-4-(fluorophenyl)-N-(3-iodo-E-allyl)nortropane,相对分子质量为428.27,CAS(化学文摘服务编号): 180468-34-2,研发代码为CFT、NAV-5001、O-587、IACFT等,由美国哈佛大学原创性研究,属于DAT抑制剂,作为PET显像剂用于PD诊断和病情评价。11C-Altropane的结构式见图 1。
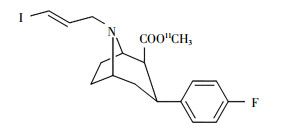
|
图 1 11C-Altropane的结构式 Figure 1 Structure of 11C-Altropane |
Elmaleh等[14]报道了Altropane的合成方法(图 2)。首先以化合物1为原料,在PPh3和CCl4存在的条件下回流发生取代得到2;然后以2和3为原料,在KF-celite和CH3CN存在的条件下于70℃反应得到4;化合物4再与NIS(N-碘代丁二酰亚胺)、THF(四氢呋喃)室温反应得到Altropane。Fischman等[15]报道了11C标记Altropane的方法,首先Altropane经0.8 mol/L HCl酯水解,然后与11C-CH3I进行甲基化反应,最后经高效液相层析纯化后可得到终产物11C-Altropane。
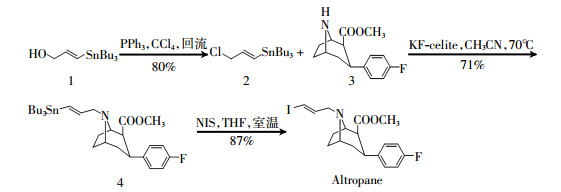
|
图 2 Altropane的合成 Figure 2 Synthesis of Altropane 图中,KF-celite:氟化钾-硅藻土;NIS:N-碘代丁二酰亚胺;THF:四氢呋喃。 |
DAT显像剂的发展得益于DAT抑制剂的广泛研究,根据结构可以分为6类:托烷类(Tropane)、苯托品类(Benztropine)、GBR12909衍生物类、哌甲酯类(Methylphenidate)、马吲哚类(Mazindol)和苯环利定类(Phencyclidine)。其中,托烷衍生物成为研究最多的DAT显像剂[16]。11C-甲基-N-2β-甲基酯-β-(4-氟-苯基)托烷(11C-methyl-N-2β-carbomethoxy-3β-(4-fluorophenyl)-tropanel,11C-β-CFT)和11C-甲基-N-2β-甲基酯-3β-(4-碘-苯基)托烷(11C-methyl-N-2β-carbomethoxy-3β-(4-iodophenyl)-tropanel,11C-β-CIT)是研究较多的DAT显像剂,对二者的DAT显像研究结果表明:纹状体与小脑对11C-β-CFT的摄取量差异较大,而对11C-β-CIT的摄取量差异不大,11C-β-CFT与DAT的亲和力略低于11C-β-CIT,但其与5-羟色胺转运体、去甲肾上腺素转运体的亲合力很低,所以对于早期PD的诊断,11C-β-CFT优于11C-β-CIT[17];11C-β-CFT的体内吸收速度相对较慢,225 min时纹状体吸收才达到峰值,由于11C半衰期仅为20.4 min,11C标记β-CFT不如18F(半衰期109.8 min)[17];11C-β-CIT对DAT的选择性不高,体内吸收速度慢,注射药物24 h后才能得到DAT定量数据,CIT的代谢产物具有亲脂性,可能通过血脑屏障影响影像的半定量分析[19]。CIT和CFT均需进行结构改造以适应对DAT显像的需要。
β-CIT的N取代衍生物123I-N-3-氟乙基-2β-甲基酯-3β-(4-碘-苯基)去甲基托烷(FE-123I-CIT)和123I-N-3-氟丙基-2β-甲基酯-3β-(4-碘-苯基)去甲基托烷(FP-123I-CIT),在欧洲已在人体中得到应用,FP-123I-CIT已被用于PD的早期诊断、随访和DAT的变化监测。Djaldetti等[20]选取了19例早期特发性PD患者对FP-123I-CIT SPECT预测PD严重程度进行了评价,所有患者采用FP-123I-CIT进行成像诊断,结果表明,对侧壳核和纹状体中的FP-123I-CIT摄取与基线统一PD评分量表的评分相关,在1年间隔后重新评分结果更为显著,FP-123I-CIT在所有区域的摄取仅与随访时的运动迟缓和刚性分值相关。这些结果表明疾病的严重程度可能在疾病的早期阶段通过FP-123I-CIT单一SPECT来预测。由于吸收速度相对较快,FP-CIT也被11C和18F标记作为PET显像剂使用,但是药代动力学速度还是不能满足11C成像需求,另外二者均与其母体β-CIT一样,对DAT和5-羟色胺转运体的特异性选择差[21]。
Fischman等[15]对β-CFT的N原子进行了结构改造,以3-碘-烯丙基取代N原子得到其衍生物Altropane,并进行了同位素标记和活性测试,体外结合实验结果证明,Altropane(Ki=6.8 nmol/L)与DAT的亲和力和β-CFT(Ki=12.6 nmol/L)相当,对DAT的选择性是5-羟色胺转运体的27倍,表现出更高的选择性[22-25]。体内成像实验结果表明,11C-Altropane能迅速进入大脑并与DAT结合,注射15 min后纹状体吸收达到峰值,纹状体-小脑峰值比率为6[14-15]。由此可见,11C-Altropane作为DAT的PET显像剂可用于PD的诊断和病情评价,具有很好的应用价值和开发潜力。
5 11C-Altropane的临床研究和应用Spencer等[26]选取12名受试者研究了口服低剂量和高剂量Armodafinil对人脑多巴胺能活动的影响,Armodafinil最早用来治疗嗜睡症,他们认为Armodafinil通过调节DAT的活动来影响清醒度,因此通过PET显像技术研究了DAT占用率和细胞外多巴胺水平的变化。其中,体内Armodafinil对纹状体DAT占用率用11C-Altropane与DAT的结合进行检测,细胞外多巴胺水平的变化用11C-Raclopride与D2受体的结合能力来检测。该研究结果表明,DAT占用率存在剂量依赖性,Armodafinil低剂量(100 mg)时DAT占用率(34%~40%)明显低于高剂量(250 mg,61%~65%)时,两种剂量下DAT占用率在1~2.5 h均保持稳定;另外,Armodafinil与细胞外多巴胺水平的变化有关,PET结果间接表明两种剂量下细胞外多巴胺水平在2.5 h时均有轻微增长。由此得出结论,Armodafinil是非常有潜力的治疗嗜睡等疾病的药物。
Spencer等[27]研究了注意力缺陷多动症(attention deficit hyperactivity disorder,ADHD)人群和正常人纹状体中DAT结合的差异,考察了DAT基因(SLC6A3)的3′-非编码区(3′-untranslated region,3′-UTR)和内含子8的可变数目串联重复序列的多态性对纹状体DAT结合的影响。实验选取了68名18~55岁的无精神障碍和吸烟嗜好的志愿者,使用标准方法对两种DAT基因3′-UTR和内含子8的可变数目串联重复序列进行基因分型,以11C-Altropane为PET显像剂与纹状体DAT结合。每个基因多态性评估的基因频率在ADHD患者和正常志愿者之间没有差异。该实验结果表明,无论是ADHD患者还是正常志愿者,3′-UTR基因型都会增加DAT的结合,而内含子8的可变数目串联重复序列对DAT的结合没有影响,ADHD状态和3′-UTR多态状态对DAT的结合都有加成作用,3′-UTR的ADHD风险多态性对人中枢神经系统DAT的结合具有功能性影响。
Marquie等[28]采用11C-Altropane为PET显像剂对DAT进行成像,研究了多巴胺的缺乏与PD认知能力和路易体痴呆(dementia with Lewy Bodies,DLB)之间的关系。他们对19例失智PD、10例DLB患者以及17名健康志愿者进行了PET显像、MRI显像和认知诊断。研究结果表明,PD组和DLB组壳核和尾状核处DAT浓度相似,却远远低于健康志愿者组;尾状核DAT浓度的减少与DLB患者较低的临床痴呆表评分和空间视觉能力有关;调整壳核DAT浓度作为运动疾病严重度的量度,DLB组尾状核DAT浓度低于PD组;前扣带高DAT浓度与DLB组壳核低DAT浓度、PD组壳核高DAT浓度相关;DLB组前扣带DAT浓度越高语义记忆和语言的损伤程度越大。
Rieckmann等[29]研究了脑黑质纹状体多巴胺损失患者(PD和DLB患者)的中脑纹状体连接性的个体差异是否与多巴胺系统的完整性成正比,他们使用11C-Altropane PET显像评估了20例患者壳核静息状态下功能性MRI显像和中脑纹状体DAT可用性的功能连通性,与假设相同,中脑和壳核之间的功能连通性反映了多巴胺能神经递质系统的完整性,即使对头部运动的影响进行严格控制,壳核-中脑功能连通性与纹状体DAT可用性亦显著相关。DAT可用性与尾状和丘脑/前额区之间的功能连接无关,因此,中脑-纹状体通路中的静息状态功能连通性可以为黑质纹状体多巴胺损失患者提供潜在有用的病理学指标。
Rieckmann等[30]同样进行了临床正常老化中DAT的可用性与白质完整性之间关系的研究,他们的研究从53名临床正常个体(年龄65~87岁)展开,每名受试者均接受MRI扫描评价白质完整性,以11C-Altropane为PET显像剂评价突触前膜DAT可用性,以2-(4′-N-11C-甲胺基苯)-6-羟基苯并噻唑PET显像评价淀粉样蛋白沉积,并以此为评价指标来进行相关研究。该实验结果证明临床正常老化中白质完整性可以显著地预测DAT的可用性,以前单独作为脑老化神经生物学级联研究的两种脑衰老成像生物标志物有一定程度的相关性,白质完整性的个体差异与多巴胺突触功能障碍相关的机制有待进一步研究。
6 安全性PET显像的实现依赖于正电子显像剂,特异性PET显像剂的开发是未来发展的方向,以多巴胺能神经递质系统为靶点的显像剂是近年来脑神经受体显像剂研究和转化的热点[31]。11C-Altropane显像属于脑内神经递质转运体成像,将正电子放射性核素11C标记在DAT的特异性分子上,可以与DAT高亲和力、特异性结合,且在脑内的非特异性摄取率低,清除速率相对较慢,能直接、清晰地显示DAT的密度、功能状况、分布状态等,从而判断多巴胺能神经元的变性程度[32]。
7 小结11C-Altropane作为正电子放射性显像剂的重要组成部分,与18F标记的正电子化合物相互补充、相辅相成,共同推进了PET显像技术的发展。目前一些科学家将11C-Altropane应用在了多巴胺能神经递质系统疾病的机理研究以及一些PD患者的诊断和病情评价方面,将来11C-Altropane这类显像剂不仅可以用来诊断,还有望作为DAT抑制剂应用到PD甚至是其他神经系统疾病的治疗中。
随着分子影像学、核医学、神经学等多种学科的日益发展和核医学成像技术的日趋完善,PET显像技术以其特异性强、无创伤性、灵敏度高等优点越来越多地应用在活体细胞分子水平的研究中。多种显像剂联合起来将进一步用于疾病的诊断和鉴别中,并将越来越多地用于PD、药物成瘾等疾病的研究中。总之,DAT显像剂11C-Altropane PET显像将为多巴胺系统的功能监测、早期鉴别和疾病诊断、治疗效果评价及病情的评估监测提供有效的研究手段,其在精神疾病等方面的应用前景将越来越广阔。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 于江负责论文的撰写;段玉清、毕常芬负责论文指导和审阅;李祎亮负责论文立意和审核。
| [1] | Wang J, Zuo CT, Jiang YP, et al. 18F-FP-CIT PET imaging and SPM analysis of dopamine transporters in Parkinson's disease in various Hoehn & Yahr stages[J]. J Neurol, 2007, 254(2): 185–190. DOI:10.1007/s00415-006-0322-9 |
| [2] | Ma Y, Dhawan V, Mentis M, et al. Parametric mapping of[18F]FPCIT binding in early stage Parkinson's disease:a PET study[J]. Synapse, 2002, 45(2): 125–133. DOI:10.1002/syn.10090 |
| [3] |
许靖, 李肖红, 秦永德, 等.
帕金森病脑部葡萄糖代谢和脑多巴胺转运体PET显像特点的临床研究[J]. 国际放射医学核医学杂志, 2016, 40(5): 338–344.
DOI:10.3760/cma.j.issn.1673-4114.2016.05.003 Xu J, Li XH, Qin YD, et al. Clinical study of brain glucose metabolism and brain dopamine transporter PET imaging in patients with Parkinson's disease[J]. Int J Radiat Med Nucl Med, 2016, 40(5): 338–344. DOI:10.3760/cma.j.issn.1673-4114.2016.05.003 |
| [4] | Jankovic J. Parkinson's disease:clinical features and diagnosis[J]. J Neurol Neurosurg Psychiatry, 2008, 79(4): 368–376. DOI:10.1136/jnnp.2007.131045 |
| [5] | Morón JA, Brockington A, Wise RA, et al. Dopamine uptake through the norepinephrine transporter in brain regions with low levels of the dopamine transporter:evidence from knock-out mouse lines[J]. J Neurosci, 2002, 22(2): 389–395. |
| [6] | Thobois S, Jahanshahi M, Pinto S, et al. PET and SPECT functional imaging studies in Parkinsonian syndromes:from the lesion to its consequences[J]. Neuroimage, 2004, 23(1): 1–16. DOI:10.1016/j.neuroimage.2004.04.039 |
| [7] |
李英华, 关锋, 代玉银, 等.
正电子放射性分子显像剂诊断帕金森氏病的研究进展[J]. 核技术, 2012, 35(3): 211–215.
Li YH, Guan F, Dai YY, et al. Positron radioactive molecular imaging agents for early diagnosis of Parkinson's disease[J]. Nucl Tech, 2012, 35(3): 211–215. |
| [8] | Huang T, Wang H, Tang G, et al. The influence of residual nor-β-CFT in 11C CFT injection on the Parkinson disease diagnosis:a 11C CFT PET study[J]. Clin Nucl Med, 2012, 37(8): 743–747. DOI:10.1097/RLU.0b013e31824c5fae |
| [9] | Hung JC. Bringing new PET drugs to clinical practice-a regulatory perspective[J]. Theranostics, 2013, 3(11): 885–893. DOI:10.7150/thno.5513 |
| [10] | Zhu L, Ploessl K, Kung HF. Chemistry. expanding the scope of fluorine tags for PET imaging[J]. Science, 2013, 342(6157): 429–430. DOI:10.1126/science.1245011 |
| [11] |
乔晋萍, 乔洪文, 武仙英, 等.
多巴胺神经系统显像分子探针研究[J]. 生命的化学, 2014, 34(2): 154–165.
DOI:10.13488/j.smhx.20140204 Qiao JP, Qiao HW, Wu XY, et al. Recent advances in PET tracers for imaging of the dopaminergic system[J]. Chem Life, 2014, 34(2): 154–165. DOI:10.13488/j.smhx.20140204 |
| [12] |
甘红梅, 乔晋萍, 孔爱英, 等.
正电子放射性显像剂代谢及其研究方法进展[J]. 国际放射医学核医学杂志, 2010, 34(2): 65–71.
DOI:10.3760/cma.j.issn.1673-4114.2010.02.001 Gan HM, Qiao JP, Kong AY, et al. The progress on researching method and metabolism of positron radiopharmaceutical[J]. Int J Radiat Med Nucl Med, 2010, 34(2): 65–71. DOI:10.3760/cma.j.issn.1673-4114.2010.02.001 |
| [13] | Quincoces G, Peñuelas I, Valero M, et al. Simple automated system for simultaneous production of 11C-labeled tracers by solid supported methylation[J]. Appl Radiat Isot, 2006, 64(7): 808–811. DOI:10.1016/j.apradiso.2006.03.001 |
| [14] | Elmaleh DR, Fischman AJ, Shoup TM, et al. Preparation and biological evaluation of iodine-125-IACFT:a selective SPECT agent for imaging dopamine transporter sites[J]. J Nucl Med, 1996, 37(7): 1197–1202. |
| [15] | Fischman AJ, Bonab AA, Babich JW, et al. [11C, 127I] Altropane:a highly selective ligand for PET imaging of dopamine transporter sites[J]. Synapse, 2001, 39(4): 332–342. DOI:10.1002/1098-2396(20010315)39:4<332::AID-SYN1017>3.0.CO;2-X |
| [16] | Dutta AK, Zhang S, Kolhatkar R, et al. Dopamine transporter as target for drug development of cocaine dependence medications[J]. Eur J Pharmacol, 2003, 479(1/3): 93–106. DOI:10.1016/j.ejphar.2003.08.060 |
| [17] |
张锦明, 田嘉禾, 郭喆, 等.
在线自动化制备多巴胺转运蛋白显像剂11C-β-CFT[J]. 中华核医学杂志, 2005, 25(3): 142–145.
DOI:10.3760/cma.j.issn.2095-2848.2005.03.006 Zhang JM, Tian JH, Guo Z, et al. Automated on-line preparation of 11C-β-CFT, a dopamine transporter imaging agent[J]. Chin J Nucl Med, 2005, 25(3): 142–145. DOI:10.3760/cma.j.issn.2095-2848.2005.03.006 |
| [18] | Rinne JO, Bergman J, Ruottinen H, et al. Striatal uptake of a novel PET ligand, [18F]beta-CFT, is reduced in early Parkinson's disease[J]. Synapse, 1999, 31(2): 119–124. DOI:10.1002/(SICI)1098-2396(199902)31:2<119::AID-SYN4>3.0.CO;2-O |
| [19] | Laruelle M, Wallace E, Seibyl JP, et al. Graphical, kinetic, and equilibrium analyses of in vivo[123I] β-CIT binding to dopamine transporters in healthy human subjects[J]. J Cereb Blood Flow Metab, 1994, 14(6): 982–994. DOI:10.1038/jcbfm.1994.131 |
| [20] | Djaldetti R, Treves TA, Ziv I, et al. Use of a single[123I]-FP-CIT SPECT to predict the severity of clinical symptoms of Parkinson disease[J]. Neurol Sci, 2009, 30(4): 301–305. DOI:10.1007/s10072-009-0100-4 |
| [21] | Abi-Dargham A, Gandelman MS, DeErausquin GA, et al. SPECT imaging of dopamine transporters in human brain with iodine-123-fluoroalkyl analogs of β-CIT[J]. J Nucl Med, 1996, 37(7): 1129–1133. |
| [22] | Madras BK, Meltzer PC, Liang AY, et al. Altropane, a SPECT or PET imaging probe for dopamine neurons:Ⅰ. Dopamine transporter binding in primate brain[J]. Synapse, 1998, 29(2): 93–104. DOI:10.1002/(SICI)1098-2396(199806)29:2<93::AID-SYN1>3.0.CO;2-5 |
| [23] | Madras BK, Gracz LM, Meltzer PC, et al. Altropane, a SPECT or PET imaging probe for dopamine neurons: Ⅱ. Distritution to dopamine-rich region of primate brain[J]. Synapse, 1998, 29(2): 105–115. DOI:10.1002/(SICI)1098-2396(199806)29:2<105:AID-SYN2>3.0.CO;2-B |
| [24] | Madras BK, Gracz LM, Fahey MA, et al. Altropane, a SPECT or PET imaging probe for dopamine neurons:Ⅲ. Human dopamine transporter in postmortem normal and Parkinson's diseased brain[J]. Synapse, 1998, 29(2): 116–127. DOI:10.1002/(SICI)1098-2396(199806)29:2<116:AID-SYN3>3.0.CO;2-A |
| [25] | Fischman AJ, Bonab AA, Babich JW, et al. Rapid detection of Parkinson's disease by SPECT with altropane:a selective ligand for dopamine transporters[J]. Synapse, 1998, 29(2): 128–141. DOI:10.1002/(SICI)1098-2396(199806)29:2<128:AID-SYN4>3.0.CO;2-9 |
| [26] | Spencer TJ, Madras BK, Bonab AA, et al. A positron emission tomography study examining the dopaminergic activity of armodafinil in adults using[11C] altropane and[11C] raclopride[J]. Biol Psychiatry, 2010, 68(10): 964–970. DOI:10.1016/j.biopsych.2010.08.026 |
| [27] | Spencer TJ, Biederman J, Faraone SV, et al. Functional genomics of attention-deficit/hyperactivity disorder(ADHD) risk alleles on dopamine transporter binding in ADHD and healthy control subjects[J]. Biol Psychiatry, 2013, 74(2): 84–89. DOI:10.1016/j.biopsych.2012.11.010 |
| [28] | Marquie M, Locascio JJ, Rentz DM, et al. Striatal and extrastriatal dopamine transporter levels relate to cognition in Lewy body diseases: an 11C altropane positron emission tomography study[J/OL]. Alzheimers Res Ther, 2014, 6(5-8): 52[2017-10-07]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4245149. DOI: 10.1186/s13195-014-0052-7. |
| [29] | Rieckmann A, Gomperts SN, Johnson KA, et al. Putamen-midbrain functional connectivity is related to striatal dopamine transporter availability in patients with Lewy body diseases[J/OL]. Neuroimage Clin, 2015, 8: 554-559[2017-10-07]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4484547. DOI: 10.1016/j.nicl.2015.06.001. |
| [30] | Rieckmann A, Hedden T, Younger AP, et al. Dopamine transporter availability in clinically normal aging is associated with individual differences in white matter integrity[J]. Hum Brain Mapp, 2016, 37(2): 621–631. DOI:10.1002/hbm.23054 |
| [31] | Elsinga PH, Hatano K, Ishiwata K. PET tracers for imaging of the dopaminergic system[J]. Curr Med Chem, 2006, 13(18): 2139–2153. DOI:10.2174/092986706777935258 |
| [32] |
李海峰, 张晓军, 张锦明, 等.
多巴胺转运蛋白显像剂11C-β-CFT在帕金森病中的应用研究[J]. 国际放射医学核医学杂志, 2016, 40(3): 218–224.
DOI:10.3760/cma.j.issn.1673-4114.2016.03.011 Li HF, Zhang XJ, Zhang JM, et al. Review of the use of dopamine transporter imaging agent 11C-β-CFT for diagnosing Parkinson disease[J]. Int J Radiat Med Nucl Med, 2016, 40(3): 218–224. DOI:10.3760/cma.j.issn.1673-4114.2016.03.011 |
 2018, Vol. 42
2018, Vol. 42


