2. 201321, 上海市质子重离子医院核医学科
2. Department of Nuclear Medicine, Shanghai Proton and Heavy Ion Center, Shanghai 201321, China
1946年,Robert Wilso首先提出了粒子治疗的设想[1],1954年在美国Lawrence Berkeley实验室进行了第一例肿瘤患者的粒子治疗[2]。质子和重离子射线治疗是近5年临床应用增加较快的粒子放疗技术。质子是指氢原子剥去电子后带有正电荷的粒子;重离子是指原子序数≥2的剥离或者部分剥离外围电子后的带正电荷的原子核,即比粒子4He重的离子,如12C、22Ne、45Ca等。质子重离子射线与常规光子射线相比具有更好的放射物理学和生物学特性,是目前最先进的放疗技术[3]。本文以碳离子为例,概述碳离子射线的物理和生物学特性,并着重综述其在诱导细胞凋亡方面的进展。
1 碳离子的物理学特点常规光子的辐射剂量随穿透组织的深度而呈指数衰减,从皮肤表面到达肿瘤病灶之前,沿途不断释放能量,使得照射路径上的正常组织受到了一定量的电离辐射。碳离子射线在射程的浅层区域剂量相对保持恒定,形成低剂量的坪区,而在射程末端,释放剩余的巨大能量,其后能量迅速跌落,形成一个高剂量能量释放峰--布拉格峰(Bragg peak)(图 1)。碳离子射线放疗使高剂量分布区调整嵌合在肿瘤的靶区上,在三维空间上与肿瘤形状吻合,增加肿瘤组织的照射剂量,减少周围正常组织器官损伤[4-5]。在具体实施中,可以通过扩展的布拉格峰技术获得较宽以及均匀的剂量分布,使肿瘤体积区域能量提高,增加靶区辐射、降低对正常组织的损害[6]。
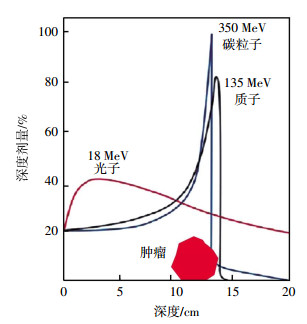
|
图 1 碳离子射线物理学优势-布拉格峰 Figure 1 The favorable physical properties of Carbon ion beam-Bragg peak |
相对生物学效应与射线的线性能量传递(linear energy transfer, LET)有关,高LET射线具有更高的相对生物学效应[7-8]。常规光子射线是稀疏的电离辐射,LET值在0.2~2.0 keV/μ之间,被称为低LET射线[9]。重离子射线是致密的电离辐射,LET值高于10.0 keV/μ,属于高LET射线。碳离子射线相较于光子射线,具有更高的相对生物学效应,使DNA双键断链且难以修复,导致肿瘤细胞死亡[3, 8]。高LET射线辐射刚结束时,布拉格峰区与其他坪区双键断裂比约2:1,3 h后测得峰区与坪区的双键断裂比约达到6:1。可见坪区照射的分子存在较强的双链断裂的修复能力,而在峰区断裂的DNA双链修复能力大幅减小或消失。细胞存活数据与双链断裂修复是一致的,即在坪区照射时细胞具有修复辐射损伤的能力,而峰区照射由于修复能力减小或消失,癌细胞辐射损伤得不到修复而致死。碳离子射线这种修复效应有利于肿瘤组织的杀灭和正常组织的保护。在常规光子射线采用分次治疗中,正常组织在每次照射之间得到一定的修复的同时肿瘤组织也得到了修复。因此碳离子射线治疗肿瘤的效果要明显强于光子射线的治疗效果。
2.2 受细胞周期影响小肿瘤细胞属于快增生细胞,其细胞周期的不同阶段(复制前期G1、复制期S、复制后期G2、有丝分裂期M)对低LET射线的辐射敏感性不同,S期细胞对光子射线具有辐射耐受性,G2期和M期细胞的辐射敏感性则较强[10]。碳离子射线对各个周期时相的细胞都具有相似的杀伤力,受细胞周期的影响小[11]。而且临床前研究表明,S期细胞可能对高LET射线辐射更加敏感[12],进一步支持碳离子射线可以有效治疗耐常规光子肿瘤的论点。
2.3 受氧合状态的影响小“氧效应”是指射线和生物体相互作用所起的效应,其大小可以用氧增殖比(oxygen enhancement ratio,OER)来定量,OER为在乏氧和有氧的状态下,达到同等生物效应所需要的射线照射剂量之比。OER依细胞组织类型、电离辐射类型及氧合状态不同而异,通常介于1~3之间,OER值越高,放射抗性越强。在含氧量正常的条件下,肿瘤细胞对低LET射线的敏感度是乏氧条件下的2.5~3倍,相比之下,高LET值射线,如碳离子射线的OER在细胞实验中可达到1,对乏氧细胞的杀伤效率是光子射线的3倍。Hirayama等[13]发现即使实体肿瘤包含大量乏氧细胞,高LET射线依然具有强大的生物学效应。无论乏氧或含氧量正常,相对生物学效应均随LET值的增加而增加,并且体内和体外细胞的OER值都随着LET值的增加而下降。
3 碳离子射线对细胞凋亡的影响 3.1 对细胞凋亡相关基因依赖性小细胞凋亡是电离辐射杀死肿瘤细胞的关键机制。它受细胞促凋亡因子(如Bax、Bak、Bok、Bcl-Xs等基因的产物)和抗凋亡因子(如Bcl-2、Bcl-XL、Bcl-w、Bfl-1等基因的产物)双重调节,其中Bax和Bcl-2是主要的促凋亡因子和抗凋亡因子[14-16]。抗凋亡因子Bcl-2最初被鉴定为滤泡型B细胞淋巴瘤中的致癌因子,约35%~50%的癌症患者肿瘤细胞Bcl-2过表达,导致肿瘤细胞对光子放疗具有强烈的耐受性[17]。Hamada等[18]分别用碳离子以及光子射线照射人宫颈癌细胞系Hela细胞以及Neo细胞(前者为Bcl-2过表达细胞[19])来验证碳离子克服Bcl-2的过表达引起的光子耐受,实验数据表明,Hela细胞的凋亡指数在所有时间和剂量点均明显低于Neo细胞(P < 0.01);未受到照射的Neo细胞凋亡指数是Hela细胞的2.3倍,在2 Gy的同等剂量下,γ射线照射的Hela和Neo细胞的凋亡指数分别是未受到照射细胞的3.2倍和7.5倍,碳离子射线照射组分别是11.5倍和20.8倍(P < 0.005),因此,碳离子射线诱导的细胞凋亡在Hela和Neo细胞中分别是γ射线的3.6倍和2.8倍;γ射线与未受到照射组相比,G2/M期细胞数基本相同,差异无统计学意义;碳离子射线在照射24 h后具有更显著的G2/M期细胞阻滞,尤其是Bcl-2过表达的Hela细胞;γ射线照射96 h后Hela和Neo细胞的G2/M期细胞均降低至对照水平,但暴露于碳离子射线的Hela细胞仍具有较高的G2/M期细胞;表明Bcl-2过表达的细胞在碳离子射线照射下具有更显著的G2/M期细胞阻滞。同样,Xue等[20]和Di等[21]的体外研究也表明相较于光子射线,碳离子射线可以诱导更多的肿瘤细胞阻滞于G2/M期,引起显著的细胞凋亡,提高抗肿瘤效果。
Bax和Bcl-2又受到抑癌基因p53的调控,p53基因通过提高Bax的表达和抑制Bcl-2的表达来影响Bax/Bcl-2的比例,诱导细胞凋亡[22-24]。同光子的放疗敏感性具有p53依赖性不同[25-27],碳离子射线在诱导细胞凋亡方面并不依赖p53的状态[27-31]。Yamakawa等[32]用碳离子射线照射突变型p53的人牙龈癌细胞Ca9-22细胞,发现碳离子照射后的细胞出现高灵敏度以及高频率的凋亡诱导结果可能是由碳离子射线通过直接激活细胞凋亡Caspase-9通路引起的。类似的报道见Tomiyama等[33],他们在碳离子射线照射的胶质母细胞瘤细胞的Caspase级联反应中发现有Caspase-8的活化。因此,碳离子射线可能是通过直接激活Caspase-9通路以及Caspase-8通路来诱导细胞凋亡。
3.2 激活Caspase通路以及聚腺苷酸二磷酸核糖转移酶-1(poly(ADP-ribose)polymerase-1,PRAP-1)对碳离子射线诱导凋亡的影响Xu等[34]用不同剂量的12C6+照射人p53缺陷型非小细胞肺癌细胞H1299,发现照射后48 h内Caspase-3活性随辐射剂量的增加不断增加(P < 0.05)。同时Xu等[34]分别用RT-PCR、western bolt等方法检测12C6+处理细胞内Caspase-3 mRNA以及Caspase-3蛋白的表达,结果表达均随碳离子射线辐射剂量的增加而显著增加,表明Caspase-3可能在碳离子射线诱导p53缺陷型肿瘤细胞的凋亡反应中发挥着重要作用。
PARP-1是DNA修复的关键参与者,其抑制剂是常规光子放疗的增敏剂[35]。Ghorai等[36]用碳离子射线分别照射HisⅠ细胞(敲除PRAP-1的人宫颈癌Hela细胞)以及H-vector细胞(未敲除PRAP-1的Hela细胞),结果显示对于HisⅠ细胞,碳离子射线诱导的凋亡是通过激活Caspase-8以及Caspase-9两种途径最终激活Caspase-3,引起Caspase依赖性的细胞凋亡以及提高p53基因的表达而实现的。而在H-vector细胞中,碳离子射线引起的凋亡则是以Caspase依赖性以及非Caspase依赖性的细胞凋亡(细胞凋亡诱导因子介导的凋亡)共同作用。碳离子射线照射后的HisⅠ细胞比H-vector细胞在整体上具有更显著的细胞凋亡。未受到照射的HisⅠ细胞中线粒体膜电位下降约37%,其Caspase-9和Caspase-3的活性约高于H-vector细胞的66%,线粒体膜电位的下降可以通过激活线粒体凋亡通路启动凋亡信号,随后激活Caspase-9以及Caspase-3。因此作者得出结论:在未受到辐射的细胞中,PARP-1表达的减少激活了细胞凋亡的内在和外在途径。碳离子射线照射HisⅠ细胞又进一步加强了细胞凋亡的内在和外在途径以及提高p53基因的表达,从而在敲除PRAP-1的HisⅠ细胞中观察到更显著的细胞凋亡。
4 展望碳离子射线具有优越的物理学剂量分布和良好的生物学特性,能够突破常规光子放疗的“瓶颈”,治疗那些光子放疗耐受的肿瘤,且对周围正常组织的损害很小。随着碳离子技术应用的增加,寻找最佳时间-剂量分割的相关研究也越来也多。鉴于碳离子治疗费用昂贵,对碳离子治疗的疗效进行早期评估是必要的。光子或碳离子放疗均可诱导肿瘤细胞凋亡,而碳离子相较于常规光子,可以克服细胞周期、相关凋亡基因以及凋亡通路的影响诱导更加显著的细胞凋亡,提高抗肿瘤效果。因此研究碳离子治疗后早期细胞凋亡的发生情况进行疗效预测,无疑会为临床治疗决策提供有价值的参考信息。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘成负责论文设计及撰写;程竞仪负责论文设计及修改;章英剑负责论文审阅。
| [1] | Hall E. Protons for radiotherapy:a 1946 proposal[J]. Lancet Oncol, 2009, 10(2): 196. DOI:10.1016/s1470-2045(09)70022-1 |
| [2] | Tobias CA, Lyman JT, Chatterjee A, et al. Radiological physics characteristics of the extracted heavy ion beams of the bevatron[J]. Science, 1971, 174(4014): 1131–1134. DOI:10.1126/science.174.4014.1131 |
| [3] | Okayasu R. Repair of DNA damage induced by accelerated heavy ions-a mini review[J]. Inter J Cancer, 2012, 130(5): 991–1000. DOI:10.1002/ijc.26445 |
| [4] | Matsumoto Y, Matsuura T, Wada M, et al. Enhanced radiobiological effects at the distal end of a clinical proton beam:in vitro study[J]. J Radiat Res, 2014, 55(4): 816–822. DOI:10.1093/jrr/rrt230 |
| [5] | Loeffler JS, D urante M. Charged particle therapy-optimization, challenges and future directions[J]. Nat Rev Clin Oncol, 2013, 10(7): 411–424. DOI:10.1038/nrclinonc.2013.79 |
| [6] | Yoo SH, Cho I, Cho S, et al. Effective Generation of the spread-out-Bragg peak from the laser accelerated proton beams using a carbon-proton mixed target[J]. Australas Phys Eng Sci Med, 2014, 37(4): 635–644. DOI:10.1007/s13246-014-0292-7 |
| [7] | Paganetti H. Relative biological effectiveness (RBE) values for proton beam therapy. Variations as a function of biological endpoint, dose, and linear energy transfer[J]. Phys Med Biol, 2014, 59(22): R419–R472. DOI:10.1088/0031-9155/59/22/R419 |
| [8] | Held KD, Kawamura H, Kaminuma T, et al. Effects of charged particles on human tumor cells[J/OL]. Front Oncol, 2016, 6: 23[2017-11-10]. https://www.frontiersin.org/articles/10.3389/fonc.2016.00023/full. DOI: 10.3389/fonc.2016.00023. |
| [9] | Tsujii H, Kamada T. A review of update clinical results of Carbon ion radiotherapy[J]. Jpn J Clin Oncol, 2012, 42(8): 670–685. DOI:10.1093/jjco/hys104 |
| [10] | Alexander BM, Pinnell N, Wen PY, et al. Targeting DNA repair and the cell cycle in glioblastoma[J]. J Neurooncol, 2012, 107(3): 463–477. DOI:10.1007/s11060-011-0765-4 |
| [11] | Suetens A, Konings K, Moreels M, et al. Higher initial DNA damage and persistent cell cycle arrest after Carbon ion irradiation compared to X-irradiation in prostate and colon cancer cells[J/OL]. Front Oncol, 2016, 6: 87[2017-11-10]. https://www.frontiersin.org/articles/10.3389/fonc.2016.00087/full. DOI: 10.3389/fonc.2016.00087. |
| [12] | Wang H, Liu S, Zhang P, et al. S-phase cells are more sensitive to high-linear energy transfer radiation[J]. Int J Radiat Oncol Biol Phys, 2009, 74(4): 1236–1241. DOI:10.1016/j.ijrobp.2008.12.089 |
| [13] | Hirayama R, Uzawa A, Obara M, et al. Determination of the relative biological effectiveness and Oxygen enhancement ratio for micronuclei formation using high-LET radiation in solid tumor cells:An in vitro and in vivo study[J]. Mut Res Genet Toxicol Environ Mutagen, 2015, 793: 41–47. DOI:10.1016/j.mrgentox.2015.08.003 |
| [14] | Lin BR, Li D, Zhang L. Oxymatrine mediates Bax and Bcl-2 expression in human breast cancer MCF-7 cells[J]. Pharmazie, 2016, 71(3): 154–157. DOI:10.1691/ph.2016.5765 |
| [15] | Li C, Wu X, Sun R, et al. Croton tiglium extract induces apoptosis via Bax/Bcl-2 pathways in human lung cancer a549 cells[J]. Asian Pac J Cancer Prev, 2016, 17(11): 4893–4898. DOI:10.22034/APJCP.2016.17.11.4893 |
| [16] | Khodapasand E, Jafarzadeh N, Farrokhi F, et al. Is Bax/Bcl-2 ratio considered as a prognostic marker with age and tumor location in colorectal cancer?[J]. Iran Biomed J, 2015, 19(2): 69–75. DOI:10.6091/ibj.1366.2015 |
| [17] | Delbridge AR, Grabow S, Strasser A, et al. Thirty years of Bcl-2:translating cell death discoveries into novel cancer therapies[J]. Nat Rev Cancer, 2016, 16(2): 99–109. DOI:10.1038/nrc.2015.17 |
| [18] | Hamada N, Hara T, Omura-Minamisawa MA, et al. Energetic heavy ions overcome tumor radioresistance caused by overexpression of Bcl-2[J]. Radiother Oncol, 2008, 89(2): 231–236. DOI:10.1016/j.radonc.2008.02.013 |
| [19] | Sato T, Hamada N. Model assembly for estimating cell surviving fraction for both targeted and nontargeted effects based on microdosimetric probability densities[J/OL]. PLoS One, 2014, 9(11): 0114056[2017-11-10]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0114056. DOI: 10.1371/journal.pone.0114056. |
| [20] | Xue L, Furusawa Y, Okayasu R, et al. The complexity of DNA double Strand break is a crucial factor for activating ATR signaling pathway for G2/M checkpoint regulation regardless of ATM function[J]. DNA repair, 2015, 25: 72–83. DOI:10.1016/j.dnarep.2014.11.004 |
| [21] | Di CX, Yang LN, Zhang H, et al. Effects of carbon-ion beam or X-ray irradiation on anti-apoptosisΔNp73 expression in HeLa cells[J]. Gene, 515(1): 208–213. DOI:10.1016/j.gene.2012.11.040 |
| [22] | Abdelhaleem EF, Abdelhameid MK, Kassab AE, et al. Design and synthesis of thienopyrimidine urea derivatives with potential cytotoxic and pro-apoptotic activity against breast cancer cell line MCF-7[J]. Eur J Med Chem, 2018, 143: 1807–1825. DOI:10.1016/j.ejmech,2017.10.075 |
| [23] | Moshrefi M, Spotin A, Kafil HS, et al. Tumor suppressor p53 induces apoptosis of host lymphocytes experimentally infected by Leishmania major, by activation of Bax and caspase-3:a possible survival mechanism for the parasite[J]. Parasitol Res, 2017, 116(8): 2159–2166. DOI:10.1007/s00436-017-5517-8 |
| [24] | Song HY, Deng XH, Yuan GY, et al. Expression of bcl-2 and p53 in induction of esophageal cancer cell apoptosis by ECRG2 in combination with cisplatin[J]. Asian Pa J Cancer Prev, 2014, 15(3): 1397–1401. DOI:10.7314/APJCP.2014.15.3.1397 |
| [25] | Zhao YF, Wang LX, Huang QY, et al. Radiosensitization of non-small cell lung cancer cells by inhibition of TGF-beta 1 signaling with SB431542 is dependent on p53 status[J]. Oncol Res, 2016, 24(1): 1–7. DOI:10.3727/096504016X14570992647087 |
| [26] | Mirzayans R, Andrais B, Scott A, et al. New insights into p53 signaling and cancer cell response to DNA damage: implications for cancer therapy[J/OL]. J Biomed Biotechnol, 2012: 170325[2017-11-10]. https://www.hindawi.com/journals/bmri/2012/170325/. DOI: 10.1155/2012/170325. |
| [27] | Amornwichet N, Oike T, Shibata AA, et al. Carbon-Ion beam irradiation kills X-ray-resistant p53-Null cancer cells by inducing mitotic catastrophe[J/OL]. PLoS One, 2014, 9(12): 0115121[2017-11-10]. http://dx.org/10.1371/journal.pone.0115121. DOI: 10.1371/journal.pone.0115121. |
| [28] | He M, Dong C, Konishi T, et al. Differential effects of p53 on bystander phenotypes induced by gamma ray and high LET heavy ion radiation[J]. Life Sci Space Res(Amst), 2014, 1: 53–59. DOI:10.1016/j.lssr.2014.02.003 |
| [29] | Nakagawa Y, Takahashi A, Kajihara AA, et al. Depression of p53-independent Akt survival signals in human oral cancer cells bearing mutated p53 gene after exposure to high-LET radiation[J]. Biochem Biophys Res Commun, 2012, 423(4): 654–660. DOI:10.1016/j.bbrc.2012.06.004 |
| [30] | Liu K, Zhao XK, Gu J, et al. Effects of C-12(6+) heavy ion beam irradiation on the p53 signaling pathway in HepG2 liver cancer cells[J]. Acta Biochim Biophys Sin (Shanghai), 2017, 49(11): 989–998. DOI:10.1093/abbs/gmx096 |
| [31] | Alphonse G, Maalouf M, Battiston MP, et al. p53-independent early and late apoptosis is mediated by ceramide after exposure of tumor cells to photon or Carbon ion irradiation[J]. BMC Cancer, 2013, 13: 151. DOI:10.1186/1471-2407-13-151 |
| [32] | Yamakawa N, Takahashi A, Mori E, et al. High LET radiation enhances apoptosis in mutated p53 cancer cells through Caspase-9 activation[J]. Cancer Sci, 2008, 99(7): 1455–1460. DOI:10.1111/j.1349-7006.2008.00818.x |
| [33] | Tomiyama A, Tachibana K, Suzuki K, et al. MEK-ERK-dependent multiple caspase activation by mitochondrial proapoptotic Bcl-2 family proteins is essential for heavy ion irradiation-induced glioma cell death[J/OL]. Cell Death Disease, 2010, 1: e60[2017-11-10]. https://www.nature.com/articles/cddis201037. DOI: 10.1038/cddis,2010.37. |
| [34] | Xu H, Gao L, Che TJ, et al. The effects of C-12(6+) irradiation on cell cycle, apoptosis, and expression of caspase-3 in the human lung cancer cell line H1299[J]. Cancer Biotherapy Radiopharm, 2012, 27(2): 113–118. DOI:10.1089/cbr.2011.1037 |
| [35] | Ghorai A, Bhattacharyya NP, Sarma A, et al. Radiosensitivity and induction of apoptosis by high LET Carbon ion beam and low LET gamma radiation: a comparative study[J/OL]. Scientifica (Cairo), 2014: 438030[2017-11-10]. https://www.hindawi.com/journals/scientifica/2014/438030/.DOI:10.1155/2014/438030. |
| [36] | Ghorai A, Sarma A, Bhattacharyya NP. Carbon ion beam triggers both caspase-dependent and caspase-independent pathway of apoptosis in HeLa and status of PARP-1 controls intensity of apoptosis[J]. Apoptosis, 2015, 20(4): 562–580. DOI:10.1007/s10495-015-1107-3 |
 2018, Vol. 42
2018, Vol. 42


