2. 366000, 福建省三明市第二医院核医学科;
3. 361102, 厦门大学分子影像暨转化医学研究中心;
4. 350001 福州, 福建医科大学附属协和临床医学院
2. Department of Nuclear Medicine, the Second Hospital of Sanming in Fujian Province, Sanming 366000, China;
3. Center for Molecular Imaging and Translational Medicine, Xiamen University, Xiamen 361102, China;
4. Union Clinical Medical College of Fujian Medical University, Fuzhou 350001, China
位于线粒体外膜的相对分子质量为18 000的转运蛋白(translocator protein, TSPO),曾被称为外周的苯二氮卓类受体(peripheral benzodiazepine receptor, PBR),是在进化上具有高度保守性的转运蛋白家族成员之一,主要位于肾上腺、睾丸、卵巢等细胞的线粒体外膜上,介导类固醇的合成[1]。在中枢神经系统炎症中,TSPO高表达于激活的小胶质细胞和星形胶质细胞[2]。近年的研究结果显示,在外周组织炎症中,TSPO也高表达于巨噬细胞和单核细胞[3-4],这表明TSPO可作为参与炎症反应的免疫细胞显像的靶点。目前,在TSPO显像中主要是用11C或18F标记TSPO配体行PET显像,如11C-(R)-PK11195、11C-PBR28、11C-DAA1106、18F-FEPPA、18F-PBR06和18F-DPA-714等[5],且有些已进入临床应用。与发射正电子的放射性核素11C和18F相比,发射单光子的放射性核素99Tcm具有价格较低廉,来源、运输方便,半衰期长,操作方便,使用范围较广等优点,且SPECT较PET便宜、普及,因此,研发新型99Tcm标记的TSPO靶向的分子探针具有较重要的临床价值。本研究以具有与TSPO较高亲合力的新型配体CB86[6]为母体,借助其表面的氨基偶联双功能螯合剂DTPA获得DTPA-CB86,进行99Tcm标记后获得新型探针99Tcm-DTPA-CB86,行左踝关节炎症小鼠Micro SPECT/CT显像,并研究其在体内的分布情况,现报道如下。
1 材料与方法 1.1 材料与仪器99Mo/99Tcm发生器购自北京原子高科股份有限公司;CB86由苏新辉课题组与武汉大学药学院洪学传课题组合作制备,并已纯化、鉴定[6];DTPA购自生工生物工程(上海)股份有限公司;CRC-25R型放射性核素活度计为美国CAPINTEC公司产品;WIZARD 2480型γ计数仪为美国珀金埃尔默仪器公司产品;Dionex Ulti-Mate 3000型高效液相色谱(high performance liquid chromatography, HPLC)仪为美国Thermo Scientific公司产品;FM-2000型锝分析仪为北京东方圆通科技发展有限公司产品;Sep-Pak C18 Plus固相萃取柱(简称C18色谱柱)为美国Waters公司产品;nanoScan型SPECT/CT仪为匈牙利Mediso Medical Imaging System公司产品;DMEM培养基购自美国Gibco BRL公司;胎牛血清购自美国Gemini公司;小鼠巨噬细胞RAW264.7由厦门大学生命科学学院俞春东课题组赠送;BALB/c小鼠由厦门大学实验动物中心提供(4~5周龄,雌性,体重18~20 g)。其余试剂均为国产分析纯。
1.2 99Tcm-DTPA-CB86的制备向溶解有50 mg CB86的二甲基亚砜溶液中加入200 mg DTPA,在20℃下于转速为1200 r/min的磁力加热搅拌器上避光反应30 h,用C18柱纯化,得到DTPA-CB86。取1 mL高锝酸钠洗脱液(约370 MBq)加入200 μL DTPA-CB86中,再加入20 μL新鲜配制的SnCl2,置于振荡模块上100℃避光反应约30 min,冷却至室温。取出反应液,以生理盐水为展开剂,用HPLC测定标记产物的标记率。将上述反应液通过C18柱,以2 mL PBS(pH值7.4)为淋洗液进行纯化,将纯化后的反应液用上述同样的方法测定标记产物的放化纯度。取100 μL纯化后的反应液99Tcm-DTPA-CB86置于1 mL PBS中,室温放置,分别在1、2、4 h后取出反应液,用上述同样的方法测定99Tcm-DTPA-CB86的稳定性。
1.3 体外细胞摄取实验按文献报道方法,在37℃、5% CO2培养箱中常规培养RAW264.7细胞[7-9]。待细胞生长至对数生长期,用0.25%胰酶消化,将RAW264.7细胞悬液铺于24孔板中(2×105个/孔),于37℃、5% CO2培养箱中培养过夜并分成两组,一组为未抑制组,另一组为抑制组,每组设3个复孔。先将99Tcm-DTPA-CB86用无血清的DMEM培养基稀释成1.11×10-1 MBq/mL。在未抑制组中加入100 μL 1.11 × 10-2 MBq 99Tcm-DTPA-CB86;在抑制组中同时加入100 μL 1.11×10-2 MBq 99Tcm-DTPA-CB86和10 μg未标记的DTPA-CB86,上述各孔用无血清培养基补充总体积至1 mL。将两组放置在37℃、5%CO2培养箱中培养,温育的时间点均为0.5、2、3和4 h。将孔板中所有的培养基完全吸出,然后加入0.5 mL冰冷的PBS洗2次,向所有孔板中加入1 mL 1 mol/L NaOH,室温下放置5~10 min。然后,用细胞刮刀轻刮孔板底部,使细胞完全脱离,吸取孔板内所有溶液和细胞,放入离心管中,用γ计数仪测定细胞的放射性计数(即反应管)以及总T管和空白管的放射性计数(各3支)。细胞摄取率= [(反应管计数-空白管计数)/总T管计数]×100%,绘制出细胞摄取曲线。
1.4 体外细胞释放实验细胞按文献[10]报道方法培养,将细胞悬液铺于24孔板中(2×105个/孔),每孔加入100 μL 1.11×10-2 MBq 99Tcm-DTPA-CB86共同培养,放入37℃、5%CO2培养箱中培养4.5、5.5、7和8 h。在每个时间点上,将孔内的细胞培养基吸走丢弃,用冷的PBS冲洗细胞2次,再加入1 mL 1 mol/L NaOH裂解细胞,收集于离心管内。将收集有细胞裂解液的离心管在γ计数仪上测定细胞的放射性计数(即反应管)以及总T管和空白管的放射性计数(各3支)。细胞摄取率=[(反应管计数-空白管计数)/总T管计数]×100%,绘制出细胞摄取曲线,间接反映99Tcm-DTPA-CB86从细胞的释放情况。
1.5 99Tcm-DTPA-CB86在左踝关节炎症小鼠体内的生物学分布取体重为18~20 g的BALB/c雌鼠,按文献报道方法于左下足跖皮内注射100 μL弗氏佐剂,4周时左踝关节出现炎症肿胀,视为造模成功,即可备用[11]。采用直接抽样方法选取体重相近、左踝关节中度红肿的模型鼠12只,分为3组,每组4只,经尾静脉注射100 μL、0.37 MBq 99Tcm-DTPA-CB86,并于注射后不同时间点(0.5、1.5和3 h)处死裸鼠,取心、肝、脾、肺、肾、骨、肌肉、胃、肠和左踝关节炎症组织等主要脏器及组织,测量其质量及放射性计数,经参考源校正后计算每克组织百分注射剂量率(%ID/g),以及左踝关节炎症组织与血液(arthritic ankle to blood,A/B)、左踝关节炎症组织与正常肌肉(arthritic ankle to muscle,A/M)的放射性比值。
1.6 左踝关节炎症小鼠Micro SPECT/CT显像采用直接抽样方法选取体重相近、左踝关节中度红肿的模型小鼠6只,分为未阻断组和竞争性抑制组,每组3只。未阻断组小鼠经尾静脉注射100 μL 3.7 MBq 99Tcm-DTPA-CB86;竞争性抑制组小鼠经尾静脉注射100 μL 3.7 MBq 99Tcm-DTPA-CB86和300 μg未标记的DTPA-CB86。两组小鼠均用5%的水合氯醛经腹腔麻醉,俯卧位固定于鼠板上,分别于注射0.5、1.5和3 h时行Micro SPECT/CT显像,使用平行孔准直器,将小鼠放置于视野中心,进行Micro SPECT断层扫描成像。然后进行CT扫描,通过电脑重建后得到短轴、水平长轴及垂直长轴的小鼠SPECT/CT融合图像。
1.7 统计学方法采用SPSS 18.0软件进行统计学分析,所得数据均以均数±标准差(x± s)表示。采用Kolmogorov-Smirnov test(柯尔莫诺夫-斯米尔诺夫检验)分析数据是否符合正态分布(P > 0.1为符合正态分布标准),用Levene检验分析数据是否符合方差齐性(sig >0.05为符合方差齐性),对符合正态性分布及方差齐性的数据采用t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 99Tcm-DTPA-CB86的制备结果经HPLC分析99Tcm-DTPA-CB86具有较高的标记率[(95.86 ±2.45)%]和放化纯度[(97.45 ± 0.69)%]。稳定性实验结果显示,99Tcm-DTPA-CB86在室温下的PBS溶液中稳定性良好,放置4 h后其标记率仍>90%。
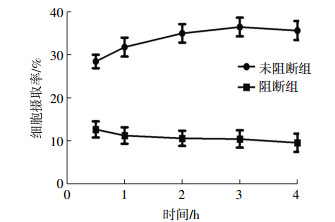
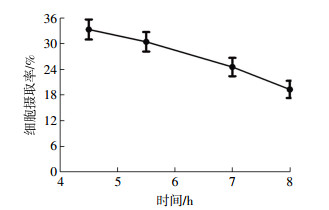
2.2 体外细胞实验结果细胞摄取实验结果如图 1所示,小鼠RAW264.7巨噬细胞对99Tcm-DTPA-CB86的摄取率在0.5 h为(28.45 ± 1.56)%,3 h时达到最高峰[(36.45 ± 2.18)%],4 h时摄取率虽然有所下降,仍保持在较高水平[(35.63 ± 2.21)%]。在加入过量未标记的DTPA-CB86时,RAW264.7细胞对99Tcm-DTPA-CB86的摄取明显下降,且随时间的延长而逐渐下降,与未阻断组相比,细胞摄取下降差异具有统计学意义(t=6.217,P < 0.05)。细胞释放实验结果如图 2所示,RAW264.7细胞对99Tcm-DTPA-CB86的摄取随着时间的延长而减少,4.5 h时的摄取率为(33.31±2.34)%,8 h时为(19.32±2.01)%,减少了13.99%。
|
图 1 RAW264.7巨噬细胞对99Tcm-DTPA(二亚乙基三胺五乙酸)-CB86的摄取曲线(n=3) Figure 1 In vitro uptake of 99Tcm-DTPA-CB86 in RAW264.7 cells (n=3) |
|
图 2 RAW264.7巨噬细胞对99Tcm-DTPA(二亚乙基三胺五乙酸)-CB86的摄取曲线(n=3) Figure 2 In vitro uptake of 99Tcm-DTPA-CB86 in RAW264.7 cells (n=3) |
尾静脉注射示踪剂后,除了左踝关节炎症组织外,99Tcm-DTPA-CB86在各组织器官中的放射性分布随着时间的延长逐渐下降(表 1)。左踝关节炎症组织的放射性分布0.5 h时为(1.33±0.16)%ID/g,3 h时为最高值(2.35 ± 0.10)%ID/g;肝脏0.5 h时为最高值(5.56 ± 0.76)%ID/g,3 h时仍有较高的摄取,为(2.14 ± 0.23)%ID/g;血液中0.5 h时为(0.78 ± 0.07)%ID/g,3 h时为(0.56 ± 0.09)%ID/g。A/B和A/M的放射性比值随时间的延长逐渐增高,0.5 h时分别为(1.71 ± 0.05)和(1.32 ± 0.43),3 h时为(4.19 ± 0.21)和(3.01 ± 0.16)。
| 表1 99Tcm-DTPA-CB86在左踝关节炎症小鼠体内的生物学分布[x± s(%ID/g)](n= 4) Table 1 Biodistribution for 99Tcm-DTPA-CB86 in mice models of arthritis[x± s %ID/g)] (n = 4 for each group) |
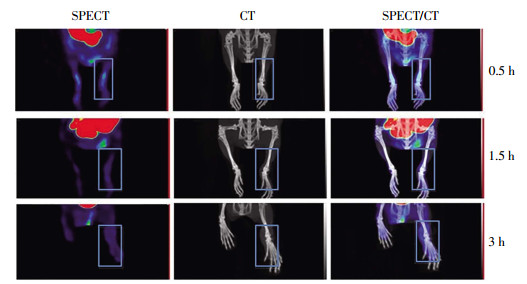
左踝关节炎症小鼠注射99Tcm-DTPA-CB86后Micro SPECT/CT显像结果如图 3、图 4所示。未阻断组注射99Tcm-DTPA-CB86后0.5 h时左踝关节炎症部位可见放射性分布,且随时间的延长逐渐增浓,3 h时炎症部位显像最清晰(图 3),而正常组织的放射性分布随时间的延长逐渐减淡;竞争性抑制组始终未见明显的炎症部位显影(图 4)。

|
图 3 未阻断组左踝关节炎症小鼠注射99Tcm-DTPA-CB86后不同时间的Micro SPECT/CT显像图(方框示左踝关节炎症) Figure 3 Micro SPECT/CT imaging of 99Tcm-DTPA-CB86 in mice models of arthritis in the unblocked group at various times after injection (box showing left arthritis) |
|
图 4 竞争性抑制组左踝关节炎症小鼠注射99Tcm-DTPA-CB86后不同时间的Micro SPECT/CT显像图(方框示左踝关节炎症) Figure 4 Micro SPECT/CT imaging of 99Tcm-DTPA-CB86 in mice models of arthritis in the blocked group at various times after injection (box showing left arthritis) |
CB86是一种新型TSPO拮抗剂,其IC50(半抑制浓度)(1.2 nmol/L)比TSPO特异性拮抗剂PK 11195(2.2 nmol/L)低[12],这表明CB86对TSPO的特异性较强。CB86分子上带有氨基,且对温度和pH值有较高的耐受性,适合在特异性结合位点上进行化学修饰,且其在连接显像或治疗的药效基团后仍对TSPO有很高的亲和性。Musacchio等[13]报道在含有紫杉醇PEG-PE(聚乙二醇磷脂酰乙醇胺)微球上修饰CB86(13.6 μmol/L)能大大增强紫杉醇的抗癌效果。TSPO作为线粒体外膜的重要组成部分,参与线粒体膜渗透性转换孔的开放,调控细胞的凋亡[1]。CB86分子不能直接用于99Tcm标记,需引入双功能螯合剂,DTPA在较低的配体浓度下即对99Tcm或111In等金属核素有很高的标记率[14]。本研究中笔者先将CB86与DTPA偶联,制成DTPA-CB86,再进行99Tcm标记获得99Tcm-DTPA-CB86,且经放射性HPLC结果证实放化纯度较好。另外,99Tcm-DTPA-CB86的体外稳定性较好,放置4 h未出现放化纯度降低,有利于进行远距离配送。
体外细胞研究结果显示:小鼠RAW264.7巨噬细胞对99Tcm-DTPA-CB86的特异性摄取率在3 h时达到最高峰[(36.45 ± 2.18)%],但同时加入过量未标记的DTPA-CB86后,细胞的摄取率显著下降;RAW264.7细胞对99Tcm-DTPA-CB86的摄取随着时间的延长而略有减少,4.5 h时摄取率为(33.31 ± 2.34)%,8 h时为(19.32 ± 2.01)%,减少13.99 %,这表明99Tcm-DTPA-CB86可以特异性地与小鼠RAW264.7巨噬细胞的TSPO结合,且亲和力高,外排少。
99Tcm-DTPA-CB86在左踝关节炎症小鼠体内的生物学分布和Micro SPECT/CT显像的研究结果表明,显像剂99Tcm-DTPA-CB86在小鼠体内的稳定性尚好,随时间延长左踝关节炎症部位仍有较高摄取,而正常组织如肝、血液、肌肉等的摄取逐渐降低,提高了A/B和A/M的放射性比值以及炎症的检出率。注射后0.5 h时左踝关节炎症部位已略见显影,3 h时炎症部位摄取仍可达(2.35 ± 0.10)%ID/g,这表明99Tcm-DTPA-CB86在炎症部位中的清除率较慢且停留时间较长,有利于炎症的显像。肝、血液、肌肉中的放射性随时间延长逐渐减低,A/B和A/M的放射性比值分别从0.5 h时的(1.71 ± 0.05)和(1.32 ± 0.43)增高至3 h时的(4.19 ± 0.21)和(3.01 ± 0.16),这表明99Tcm-DTPA-CB86在血液、肌肉等非炎症组织中的清除率较快(主要从肝脏代谢),A/B和A/M的放射性比值随时间延长逐渐增高,炎症显像更清晰,提示99Tcm-DTPA-CB86在左踝关节炎症小鼠模型中的靶向性良好,且在体内的停留时间长。在竞争性抑制实验中各时间段均未见炎症显影,未标记DTPA-CB86明显抑制了99Tcm-DTPA-CB86与炎症巨噬细胞的TSPO的结合,这表明显像剂99Tcm-DTPA-CB86能够与TSPO特异性结合。
综上所述,我们成功制备的99Tcm-DTPA-CB86可与巨噬细胞特异性结合,且经标记后保留了生物学活性。小鼠体内分布及SPECT/CT显像结果表明,其有望成为一种应用于关节炎症的SPECT显像的分子显像剂。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 刘鹏、董文涛负责研究过程的实施;苏新辉负责研究命题的提出、设计和论文撰写;黄剑全、王亮亮、蒋怡臻负责研究过程的数据采集和分析统计;郭志德、马超、苏福负责研究命题的提出、研究思路和实验步骤的设计等。
| [1] | Fan J, Lindemann P, Feuilloley MG, et al. Structural and functional evolution of the translocator protein(18 kDa)[J]. Curr Mol Med, 2012, 12(4): 369–386. DOI:10.2174/1566524011207040369 |
| [2] | Crawshaw AA, Robertson NP. The role of TSPO PET in assessing neuroinflammation[J]. J Neurol, 2017, 264(8): 1825–1827. DOI:10.1007/s00415-017-8565-1 |
| [3] | Narayan N, Mandhair H, Smyth E, et al. The macrophage marker translocator protein(TSPO) is down-regulated on pro-inflammatory 'M1' human macrophages[J/OL]. PLoS One, 2017, 12(10): e0185767[2017-11-19]. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/28968465. DOI: 10.1371/journal.pone.0185767.eCollection2017. |
| [4] | Shao X, Wang X, English SJ, et al. Imaging of carrageenan-induced local inflammation and adjuvant-induced systemic arthritis with[11C]PBR28PET[J]. Nucl Med Biol, 2013, 40(7): 906–911. DOI:10.1016/j.nucmedbio.2013.06.008 |
| [5] | Dupont AC, Largeau B, Santiago Ribeiro MJ, et al. Translocator protein-18 kDa (TSPO) positron emission tomography (PET) imaging and its clinical impact in neurodegenerative diseases[J/OL]. Int J Mol Sci, 2017, 18(4): E785[2017-11-19]. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/28387722. DOI: 10.3390/ijms18040785. |
| [6] | Wen M, Qu CR, Su XH, et al. A practical process for the synthesis of translocator protein 18 kDa imidazopyridine ligand[J]. Wuhan Univ J Nat Sci, 2014, 19(1): 19–26. DOI:10.1007/s11859-014-0973-9 |
| [7] | Su X, Cheng K, Liu Y, et al. PET imaging of insulin-like growth factor type 1 receptor expression with a 64Cu-labeled Affibody molecule[J]. Amino Acids, 2015, 47(7): 1409–1419. DOI:10.1007/s00726-015-1975-4 |
| [8] | Su X, Cheng K, Jeon J, et al. Comparison of two site-specifically 18F-labeled affibodies for PET imaging of EGFR positive tumors[J]. Mol Pharm, 2014, 11(11): 3947–3956. DOI:10.1021/mp5003043 |
| [9] |
豆晓锋, 张亚飞, 蒋怡臻, 等.
131I标记抗NRP-1单克隆抗体A6在荷瘤裸鼠体内分布和显像研究[J]. 中华核医学与分子影像杂志, 2014, 34(6): 495–499.
DOI:10.3760/cma.j.issn.2095-2848.2014.06.017 Dou XF, Zhang YF, Jiang YZ, et al. Biodistribution and imaging of 131I labeled anti-neuropilin-1 monoclonal antibody in malignant gliomas xenografts[J]. Chin J Nucl Med Mol Imaging, 2014, 34(6): 495–499. DOI:10.3760/cma.j.issn.2095-2848.2014.06.017 |
| [10] | Neyt S, Vliegen M, Verreet B, et al. Synthesis, in vitro and in vivo small-animal SPECT evaluation of novel technetium labeled bile acid analogues to study(altered) hepatic transporter function[J]. Nucl Med Biol, 2016, 43(10): 642–649. DOI:10.1016/j.nucmedbio.2016.07.001 |
| [11] | Chang Y, Wu Y, Wang D, et al. Therapeutic effects of TACI-Ig on rats with adjuvant-induced arthritis via attenuating inflammstory responses[J]. Rheumatology(Oxford), 2011, 50(5): 862–870. DOI:10.1093/rheumatology/keq404 |
| [12] | Laquintana V, Denora N, Musacchio T, et al. Peripheral benzodiazepine receptor ligand-PLGA polymer conjugates potentially useful as delivery systems of apoptotic agents[J]. J Control Release, 2009, 137(3): 185–195. DOI:10.1016/j.jconrel.2009.04.007 |
| [13] | Musacchio T, Laquintana V, Latrofa A, et al. PEG-PE micelles loaded with paclitaxel and surface-modified by a PBR-ligand:synergistic anticancer effect[J]. Mol Pharm, 2009, 6(2): 468–479. DOI:10.1021/mp800158c |
| [14] |
张伟, 蔡亮, 陈跃, 等.
双功能制剂99Tcm-Gd-DTPA-DG的制备及在荷瘤裸鼠体内的生物分布[J]. 中华核医学杂志, 2011, 31(2): 117–120.
DOI:10.3760/cma.j.issn.0253-9780.2011.02.011 Zhang W, Cai L, Chen Y, et al. Synthesis and biodistribution of a bi-functional agent 99Tcm-Gd-DTPA-DG in tumor bearing nude mice[J]. Chin J Nucl Med, 2011, 31(2): 117–120. DOI:10.3760/cma.j.issn.0253-9780.2011.02.011 |
 2018, Vol. 42
2018, Vol. 42


