2. 030013 太原, 山西省肿瘤医院病理科;
3. 030013 太原, 山西省肿瘤医院结直肠肛门外科
2. Department of Pathology, Shanxi Tumor Hospital, Taiyuan 030013, China;
3. Department of Colorectal and Anus Surgery, Shanxi Tumor Hospital, Taiyuan 030013, China
结直肠癌(colorectal cancer, CRC)是消化道常见的恶性肿瘤之一,严重威胁人类生命健康,全球发病率居恶性肿瘤第3位,病死率排第4位,且发病率呈逐年上升的趋势[1],早期诊断和准确分期是制定个体化治疗方案和预后评估的基础,PET/CT实现了功能影像与解剖影像的同机融合,为CRC的诊断及分期提供了新方法[2]。SUVmax是PET/CT衡量18F-FDG摄取程度的半定量分析指标,了解SUVmax与临床特征、肿瘤分期的相关性可进一步指导临床治疗、评估预后。笔者对83例手术确诊为CRC患者的临床病理资料和术前18F-FDG PET/CT检查结果进行了回顾性分析,评估术前SUVmax与CRC患者临床病理资料、TNM分期、临床分期的相关性,探讨术前18F-FDG PET/CT显像在CRC分期中的价值。
1 资料与方法 1.1 一般资料选取2014年1月至2016年12月在我院确诊为CRC并接受手术治疗的初诊患者83例,其中女性30例、男性53例,年龄29~90岁,中位年龄63岁。所有患者均于手术前1周内行PET/CT检查,患者影像资料(包括增强CT或MRI、超声)齐全。所有患者或其家属均于检查前签署了知情同意书,且本研究获得本院医学伦理委员会批准,批准号:201763。
1.2 检查方法采用美国GE Discovery STE PET/CT扫描仪,18F-FDG由医用回旋加速器(Minitrace,美国GE公司)和Tracelab Fx-FN(美国GE公司)生产,18F-FDG放化纯度>95%。患者禁食6 h以上,测量空腹血糖≤11.1 mmol/L,按体重注射18F-FDG 5.55 MBq/kg,平静休息45~60 min后依次采集CT、PET图像,显像范围均为股骨上段至颅顶,三维采集3 min/床位,CT扫描条件:120 kV、200 mA、层厚3.75 mm、螺距1.375 : 1,采集完成后利用CT数据对PET图像进行衰减校正。数据经迭代重建后获得横断、冠状、矢状位的PET、CT、PET/CT融合图像。
1.3 图像分析由2位经验丰富的PET/CT主治医师分别阅片,观察相应区域是否有软组织密度影和放射性浓聚灶,选择横断面放射性摄取程度最高层面,沿CRC原发病灶及区域淋巴结的边缘勾画ROI,由计算机自动计算SUVmax,选取CT图像上肿瘤最大层面手动测量肿瘤最大径,并多次重复测量取均值为肿瘤长径。
1.4 TNM分期及临床分期TNM分期参照2016年国际抗癌联盟(UICC)CRC术前TNM分期(第八版)标准[3],T1为肿瘤侵犯黏膜下层,T2为肿瘤侵犯固有肌层,T3为肿瘤穿透固有肌层到达浆膜下层,或侵犯无腹膜覆盖的结直肠旁组织,T4为肿瘤穿透腹膜脏层或肿瘤直接侵犯或粘连于其他器官或结构;N0是指无区域淋巴结转移,N1是指有1~3个区域淋巴结受侵,N2是指有4个或以上区域淋巴结受侵;M0为无远处转移,M1为伴随远处转移。临床分期依据病理结果及影像学检查结果来确定。
1.5 统计学方法采用SPSS17.0软件进行统计学分析,计量资料以x± s来表示,组间比较采用单因素方差分析和两独立样本t检验,采用Spearman相关分析评价SUVmax与TNM分期及临床分期的相关性。采用Pearson相关分析评价原发病灶SUVmax与淋巴结SUVmax的相关性。以病理结果为金标准,绘制受试者工作特征(receiver operating characteristic curve,ROC)曲线,分析原发灶SUVmax对CRC转移的诊断效能。P < 0.05表示差异有统计学意义。
2 结果 2.1 临床及病理结果83例患者中直肠癌37例,右半结肠癌27例(升结肠癌24例、结肠肝曲癌1例、横结肠癌2例),左半结肠癌19例(乙状结肠癌17例、降结肠癌2例);中分化腺癌64例,低分化腺癌14例,黏液腺癌5例;参照2016年国际抗癌联盟(UICC)CRC术前TNM分期(第八版)标准进行分期:原发灶T2期10例,T3期19例,T4期54例;N0期32例,N1期19例,N2期32例;M0期50例,M1期33例;临床分期:Ⅰ期5例,Ⅱ期20例,Ⅲ期24例,Ⅳ期34例。
2.2 CRC原发灶及区域转移淋巴结的SUVmax83例CRC患者原发病灶均表现为18F-FDG高摄取,平均SUVmax为14.63±8.10(4.43~48.19);51例(N1+N2期)CRC患者共有190枚淋巴结转移病灶,平均SUVmax为3.61±1.90(0.69~12.57)。
2.3 原发灶SUVmax与临床病理特征间的关系原发灶SUVmax与年龄、性别、肿瘤部位无关(t=0.041、0.414、F=1.098,均P>0.05),而与肿瘤长径、病理及分化程度有关:肿瘤长径≥3 cm患者的SUVmax高于肿瘤长径 < 3 cm的患者(t=2.497,P < 0.05);低分化腺癌SUVmax高于中分化腺癌和黏液腺癌(F=3.727,P < 0.05)(表 1)。
| 表1 原发灶SUVmax与结直肠癌不同临床病理特征的关系 Table 1 The relationship between the SUVmax of colorectal cancer primary lesions and different clinic pathological features |
不同T分期CRC原发灶的SUVmax差异无统计学意义(F=2.492,P>0.05);不同N分期、M分期CRC原发灶的SUVmax差异有统计学意义:有淋巴结转移组SUVmax高于无淋巴结转移组(t=2.081,P < 0.05),有远处转移组SUVmax高于无远处转移组(t=2.168,P < 0.05);不同临床分期SUVmax组间比较差异有统计学意义(F=2.839,P < 0.05)(表 2、图 1、图 2),但组内比较仅Ⅱ期和Ⅳ期的SUVmax差异有统计学意义(t=2.579,P < 0.05),Ⅰ期和Ⅱ期、Ⅰ期和Ⅲ期、Ⅰ期和Ⅳ期、Ⅱ期和Ⅲ期、Ⅲ期和Ⅳ期组内比较SUVmax差异均无统计学意义(t=0.294、1.342、1.694、1.824、0.802,均P>0.05)。
| 表2 不同TNM分期的结直肠癌原发灶SUVmax的比较 Table 2 The SUVmax comparation of the colorectal cancer primary lesions with different TNM staging |

|
图 1 Ⅱ期升结肠癌患者的18F-FDG PET/CT图像 Figure 1 18F-FDG PET/CT imagings of ascending colon cancer with Ⅱ staging 患者男性,62岁,升结肠中分化腺癌,T4N0M0,A:全身PET/CT三维图;B:CT图示升结肠管壁局限性增厚(约0.7 cm);C:PET/CT融合图示升结肠管壁局灶性代谢增高,SUVmax=5.6,未见区域淋巴结转移。SUVmax:最大标准化摄取值。 |
|
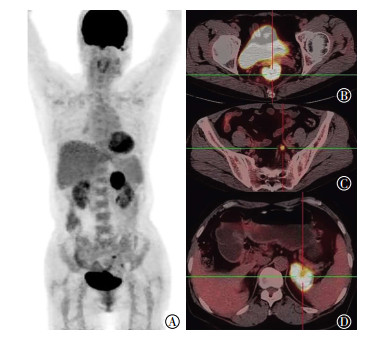
图 2 Ⅳ期直肠癌患者的18F-FDG PET/CT图像 Figure 2 18F-FDG PET/CT imagings of rectal cancer with Ⅳ staging 患者女性,60岁,直肠低分化腺癌,T4N1M1,A:全身PET/CT三维图;B:PET/CT融合图示直肠管壁不均匀增厚且18F-FDG分布明显增高,SUVmax=26.61;C:PET/CT融合图示肠系膜间隙见18F-FDG分布增高淋巴结影,大小约1.5 cm×1.3 cm,SUVmax=5.51;D:PET/CT融合图示左侧肾上腺见不规则软组织肿块影,大小约4.2 cm×5.1 cm,18F-FDG分布明显增高,SUVmax=15.07。SUVmax:最大标准化摄取值。 |
原发灶SUVmax与T分期无相关性(r=0.004,P>0.05),与N分期、M分期、临床分期呈正相关,相关性由大到小依次为临床分期(r=0.324,P < 0.05)、M分期(r=0.273,P < 0.05)、N分期(r=0.248,P < 0.05)。
2.6 转移淋巴结SUVmax与原发灶SUVmax、TNM分期的相关性转移淋巴结SUVmax与原发灶SUVmax呈正相关(r=0.312,P < 0.05),转移淋巴结SUVmax与原发灶T分期呈正相关(r=0.287,P < 0.05),与M分期及临床分期无关(r=0.083、0.125,P>0.05)。
2.7 原发灶SUVmax对CRC转移的诊断效能分析本研究中55例CRC患者经病理证实伴随淋巴结和(或)远处转移,28例无转移,ROC曲线示原发灶SUVmax预测CRC转移的曲线下面积为0.731,Youden指数为0.443,阈值为10.13,原发灶SUVmax=10.13时诊断淋巴结和(或)远处转移的灵敏度为80%,特异度为64.3%,SUVmax>10.13时,病灶出现转移的可能性更大(图 3)。

|
图 3 原发灶最大标准化摄取值对结直肠癌发生转移诊断效能的受试者工作特征曲线 Figure 3 Receiver operating characteristic curve analysis of the SUVmax for predicting metastasis in patients with primary colorectal cancer |
CRC准确的术前分期是制定个体化治疗方案的前提,也是影响预后的重要因素[4]。18F-FDG PET/CT实现了代谢信息与解剖信息的同机融合,且一次检查即可获得全身信息,能全面探测肿瘤病变的累及范围,目前关于18F-FDG PET/CT在CRC中的应用较多,但多数集中在肿瘤的复发转移及疗效判断上[5-6],关于术前原发灶代谢参数与CRC患者临床病理资料、TNM分期、临床分期的相关性的研究较少。SUV是衡量肿瘤18F-FDG摄取程度的常用指标,恶性肿瘤细胞代谢活跃,糖酵解水平高,18F-FDG摄取增多并在细胞内积聚,能反映肿瘤部分组织的代谢活性。
目前关于SUVmax与各临床病理特征的关系还存在一定的争议,Uchiyama等[7]回顾性分析了77例CRC患者的18F-FDG PET/CT资料,结果表明CRC原发灶SUVmax仅与肿瘤大小有关,而与原发灶的组织学分级、有无癌栓、淋巴结转移、肝转移等均无关;王晓燕等[8]研究中CRC原发灶SUVmax与肿瘤大小、部位、分化程度有关;本研究结果显示术前SUVmax与患者性别、年龄、部位无关,与病灶的长径、病理及分化程度有关,与吴珊等[9]的研究结果一致。长径≥3 cm的病灶SUVmax高于长径 < 3 cm者,说明原发灶体积越大,肿瘤组织内无氧糖酵解水平越高,因此病灶SUVmax越高;黏液腺癌由于含黏液成分较多,实性成分少,病灶对18F-FDG的摄取较低[10],低分化肿瘤细胞代谢活跃,糖酵解水平高,故而对18F-FDG的摄取程度较高[11],本研究中低分化腺癌患者的SUVmax高于中分化腺癌和黏液腺癌患者。丁重阳等[12]认为右半结肠管腔较大,肠壁薄易扩张,较少出现肠梗阻,病灶较左半结肠大,而病灶SUVmax与病灶大小呈正相关,故原发灶SUVmax与肿瘤部位有关,且右半结肠的SUVmax均高于左半结肠和直肠[13],本研究中肿瘤部位间比较差异无统计学意义,可能与病例选择不同有关。
我们选取SUVmax作为评估指标,分析其与TNM分期、临床分期的相关性,发现不同N、M分期及临床分期的CRC患者术前原发灶SUVmax组间比较差异有统计学意义,且原发灶SUVmax与N、M分期及临床分期均呈正相关,伴有淋巴结转移或远处转移患者的SUVmax高于无转移者,且肿瘤分期越高SUVmax越大,因此,我们认为原发灶SUVmax越高,肿瘤的侵袭性也越强,与其他文献的差异主要在于T分期,吴珊等[9]研究发现,病灶的SUVmax与是否侵犯浆膜层有关,王晓燕等[8]研究发现,CRC原发灶的SUVmax与肿瘤TNM分期均有关,但本研究的结果显示,原发病灶SUVmax与T分期无关,与Kekelidze等[14]研究结果一致。差异产生的原因主要是由于SUVmax受较多因素的影响,病灶较小时,原发灶SUVmax受部分容积效应的影响,原发灶较大时,易与肠周淋巴结融合,不易分辨,从而导致SUVmax偏高,另外,肠道的生理性摄取、血糖水平、图像采集的时间等均可能会干扰SUVmax的测定[15-17]。
在本研究中我们还探讨了转移淋巴结SUVmax与原发灶SUVmax及肿瘤分期的相关性,结果显示,转移淋巴结的SUVmax与原发灶SUVmax呈正相关,转移淋巴结SUVmax与原发灶T分期相关,进一步说明原发病变SUVmax越高,肿瘤的增殖能力越强,越易出现区域淋巴结的转移。随后我们进一步分析了原发灶SUVmax对于肿瘤转移的诊断效能,绘制的ROC中曲线下面积为0.731,原发灶SUVmax预测CRC发生转移的阈值为10.13,原发灶SUVmax>10.13时,病灶出现转移的可能性更大。
综上,原发灶SUVmax越高,肿瘤的侵袭性、增殖能力也越强,与CRC的术前分期密切相关,对指导临床治疗方案的选择有重要的意义,但SUVmax仅能反映部分肿瘤组织的代谢活性,并不能代表肿瘤组织的全部代谢信息,本研究仍需进一步行肿瘤代谢体积、病灶糖酵解总量及生存期的相关性分析。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 田蓉蓉负责课题设计、实施和论文撰写;薄云峰负责病理资料收集、阅片;张毅勋负责临床资料的收集;原凌负责图像分析;赵铭负责课题的提出、设计和论文修改;张红雨负责图像处理和技术支持。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [2] | Maffione AM, Lopci E, Bluemel C, et al. Diagnostic accuracy and impact on management of 18F-FDG PET and PET/CT in colorectal liver metastasis:a meta-analysis and systematic review[J]. Eur J Nucl Med Mol Imaging, 2015, 42(1): 152–163. DOI:10.1007/s00259-014-2930-4 |
| [3] | O'Sullivan B, Brierley J, Byrd D, et al. The TNM classification of malignant tumours-towards common understanding and reasonable expectations[J]. Lancet Oncol, 2017, 18(7): 849–851. DOI:10.1016/S1470-2045(17)30438-2 |
| [4] | Lee JY, Yoon SM, Kim JT, et al. Diagnostic and prognostic value of preoperative 18F-fluorodeoxyglucose positron emission tomography/computed tomography for colorectal cancer:comparison with conventional computed tomography[J]. Intest Res, 2017, 15(2): 208–214. DOI:10.5217/ir.2017.15.2.208 |
| [5] | Altini C, Niccoli Asabella A, De Luca R, et al. Comparison of 18F-FDG PET/CT methods of analysis for predicting response to neoadjuvant chemoradiation therapy in patients with locally advanced low rectal cancer[J]. Abdom Imaging, 2015, 40(5): 1190–1202. DOI:10.1007/s00261-014-0277-8 |
| [6] | Jo HJ, Kim SJ, Kim IJ, et al. Predictive value of volumetric parameters measured by 18F-FDG PET/CT for lymph node status in patients with surgically resected rectal cancer[J]. Ann Nucl Med, 2014, 28(3): 196–202. DOI:10.1007/s12149-014-0809-x |
| [7] | Uchiyama S, Haruyama Y, Asada T, et al. Role of the standardized uptake value of 18-fluorodeoxyglucose positron emission tomography-computed tomography in detecting the primary tumor and lymph node metastasis in colorectal cancers[J]. Surg Today, 2012, 42(10): 956–961. DOI:10.1007/s00595-012-0225-6 |
| [8] |
王晓燕, 彭桂娟, 张祥松, 等.
基于18氟-脱氧葡萄糖正电子发射计算机断层成像术的最大标准化摄取值和放射线基线比值与结直肠癌术后预后的关系[J]. 中华胃肠外科杂志, 2015, 18(3): 232–237.
DOI:10.3760/cma.j.issn.1671-0274.2015.03.008 Wang XY, Peng GJ, Zhang XS, et al. Correlation of 18F-FDG PET-CT maximum standard uptake value and T/N ratio with the prognosis of postoperative colorectal cancer[J]. Chin J Gastrointest Surg, 2015, 18(3): 232–237. DOI:10.3760/cma.j.issn.1671-0274.2015.03.008 |
| [9] |
吴珊, 刘长存, 宋建华, 等.
18F-FDG PET/CT在结肠癌术前TNM分期中的价值及SUVmax与患者临床特征的相关性研究[J]. 肿瘤影像学, 2017, 26(1): 35–42.
DOI:10.3969/j.issn.1008-617X.2017.01.007 Wu S, Liu CC, Song JH, et al. Clinical value of 18F-FDG PET/CT in preoperative TNM staging and SUVmax in patients with colon cancer[J]. Oncoradiol, 2017, 26(1): 35–42. DOI:10.3969/j.issn.1008-617X.2017.01.007 |
| [10] |
陈虞梅, 刘建军, 陈涛, 等.
PET诊断结直肠癌复发价值及误诊原因的Meta分析[J]. 中华核医学杂志, 2007, 27(3): 131–134.
DOI:10.3760/cma.j.issn.2095-2848.2007.03.002 Chen YM, Liu JJ, Chen T, et al. Meta-analysis on the diagnostic value of PET in recurrent colorectal cancer and on factors inducing misdiagnosis[J]. Chin J Nucl Med, 2007, 27(3): 131–134. DOI:10.3760/cma.j.issn.2095-2848.2007.03.002 |
| [11] | Tang-Christensen M, Vrang N, Larsen PJ. Glucagon-like peptide 1(7-36) amide's central inhibition of feeding and peripheral inhibition of drinking are abolished by neonatal monosodium glutamate treatment[J]. Diabetes, 1998, 47(4): 530–537. DOI:10.2337/diabetes.47.4.530 |
| [12] |
丁重阳, 李天女, 孙晋.
18F-FDG PET/CT代谢参数与结直肠癌临床病理特征的关系[J]. 临床肿瘤学杂志, 2017, 22(1): 53–57.
DOI:10.3969/j.issn.1009/0460.2017.01.011 Ding CY, Li TN, Sun J. The relationship between 18F-FDG PET/CT metabolic parameters and clinicopathological factors of colorectal Cancer[J]. Chin Clin Oncol, 2017, 22(1): 53–57. DOI:10.3969/j.issn.1009/0460.2017.01.011 |
| [13] |
胡俊杰, 周志祥, 梁建伟, 等.
左、右半结肠癌患者临床病理特点及预后差异分析[J]. 中华医学杂志, 2015, 95(28): 2268–2271.
DOI:10.3760/cma.j.issn.0376-2491.2015.28.006 Hu JJ, Zhou ZX, Liang JW, et al. Analysis of clinicopathologic and survival characteristics in patients with right-or left-sided colon cancer[J]. Natl Med J China, 2015, 95(28): 2268–2271. DOI:10.3760/cma.j.issn.0376-2491.2015.28.006 |
| [14] | Kekelidze M, D'Errico L, Pansini M, et al. Colorectal cancer:current imaging methods and future perspectives for the diagnosis, staging and therapeutic response evaluation[J]. World J Gastroenterol, 2013, 19(46): 8502–8514. DOI:10.3748/wjg.v19.i46.8502 |
| [15] | Kendi AT, Corey A, Magliocca KR, et al. Is there a role for PET/CT parameters to differentiate thyroid cartilage invasion from penetration?[J]. Eur J Radiol, 2016, 85(2): 319–323. DOI:10.1016/j.ejrad.2015.11.039 |
| [16] | Chang S, Koo PJ, Kwak JJ, et al. Changes in total lesion glycolysis evaluated by repeated 18F FDG PET/CT as prognostic factor in locally advanced esophageal cancer patients treated with preoperative chemoradiotherapy[J]. Oncology, 2016, 90(2): 97–102. DOI:10.1159/000443018 |
| [17] | Chen S, Ibrahim NK, Yan Y, et al. Risk stratification in patients with advanced-stage breast cancer by pretreatment 18F-FDG PET/CT[J]. Cancer, 2015, 121(22): 3965–3974. DOI:10.1002/cncr.29565 |
 2018, Vol. 42
2018, Vol. 42


