2. 518000, 中国医学科学院肿瘤医院深圳医院放疗科;
3. 100122, 北京市朝阳区三环肿瘤医院放疗科
2. Department of Radiation Oncology, Cancer Hospital, Chinese Academy of Medical Sciences, Shenzhen Center, Shenzhen 518000, China;
3. Department of Radiation Oncology, Beijing Chaoyang District Sanhuan Cancer Hospital, Beijing 100122, China
小细胞肺癌(small cell lung cancer,SCLC)占全部肺癌的13%~20%[1],其倍增时间短,生长迅速且早期易出现血运转移,恶性程度高,治疗后易复发和出现远处转移。70%的SCLC患者初诊时已处于广泛期(extensive stage,ES)[2-3],包括处于2009年第7版美国癌症联合委员会分期中的Ⅳ期或是多发肺内转移结节和(或)肿瘤病灶[4]。ES-SCLC的标准治疗方法为基于铂类的全身化疗,治疗后的中位生存时间仅为8~10个月,更大强度的化疗方案并未改善其生存状况[4-6]。而胸内肿瘤进展是ES-SCLC患者死亡的主要原因,化疗后仍有75%~90%的患者胸内有残存病灶,其中近90%的患者胸内病灶在1年之内发生进展[7]。笔者回顾性分析327例ES-SCLC患者,对比有无胸部放疗(thoracic radiation therapy,TRT)患者的临床资料,探讨胸部精确放疗可否提高ES-SCLC患者化疗后的疗效。
1 资料与方法 1.1 入组标准① 经细胞学或病理学证实为SCLC;②治疗前均有完善的头部MRI、颈部和腹部B超或CT、胸部CT、全身骨扫描分期检查资料,按照第7版美国癌症联合委员会肺癌的分期诊断标准符合ES-SCLC;③患者在中国医学科学院肿瘤医院接受首程至少4周期的含铂类化疗,疗效评价无疾病进展[完全缓解(complete response,CR)+部分缓解(partial response,PR)+疾病稳定(stable disease,SD)];④TRT患者在中国医学科学院肿瘤医院放疗科进行调强放疗。
1.2 排除标准① 其他部位恶性肿瘤病史(既往或同时),不包括可治愈的非黑色素瘤性皮肤癌和子宫颈原位癌;②未控的心脏疾病或者近6个月内发生过心肌梗死;③有精神疾病史;④处于妊娠、哺乳期;⑤有未控制的糖尿病、高血压;⑥间质性肺炎或活动期肺纤维化;⑦活动性感染。
1.3 一般资料中国医学科学院肿瘤医院2007年1月至2012年12月收治的ES-SCLC患者中,符合入组标准的患者327例,其中失访16例,随访率为95.1%。所有患者或其家属均于治疗前签署了知情同意书。所有患者中男性256例、女性71例,年龄19~81岁,中位年龄60岁。初诊时伴脑转移的患者46例(14.1%),肝脏转移84例(25.7%),骨转移90例(27.5%),恶性胸腔积液95例(29.1%),颈部淋巴结转移75例(22.9%),肾上腺转移50例(15.3%),肺内转移53例(16.2%),腹腔转移51例(15.6%)。根据化疗后是否行胸部调强放疗,将327例入组患者分为化放疗组(化疗+TRT)和单纯化疗组,其中化放疗组130例,单纯化疗组197例,两组患者的一般临床资料见表 1。化放疗组的女性比例稍高(χ2=4.539,P=0.040),吸烟的患者更少(χ2=5.464,P=0.027),初诊时转移器官数≥3的患者更少(χ2=43.480,P < 0.001),化疗后达PR以上疗效的患者比例更高(χ2=4.651,P=0.038),其余一般临床资料差异无统计学意义(χ2=0.234~3.702,P>0.05)。
| 表1 化放疗组和单纯化疗组广泛期小细胞肺癌患者的一般临床资料比较 Table 1 Comparison of the general clinical data between the patients with extensive-stage small cell lung cancer of thoracic radiation therapy and non-thoracic radiation therapy groups |
患者均先行不少于4周期的化疗。化疗采用基于铂类的方案,以依托泊苷+顺铂(EP)、卡铂+依托泊苷(CE)的治疗方案为主。每21 d为1个周期,中位化疗周期数为5个周期。化疗开始日期距TRT开始日期的中位值为4.5个月。
1.4.2 TRT患者取仰卧位,面罩或体膜固定身体,CT扫描范围为颅底至腰2椎体水平,扫描层距5 mm。采用Pinnacle TPS软件(飞利浦,pinnacle 7.4f,荷兰)进行放疗靶区勾画及计划设计。靶区勾画综合化疗前、后影像学资料,大体肿瘤体积为化疗后影像学可见的原发灶,转移淋巴结为化疗前影像学可见转移淋巴结。临床靶体积为大体肿瘤体积外扩5~8 mm并包括化疗前转移淋巴结的受侵范围。中心型肺癌临床靶体积需包括原发灶放疗前生长部位的支气管。计划靶体积为临床靶体积外扩5 mm形成。计划靶体积平均处方剂量为56 Gy(32~67 Gy),剂量分割为1.8~2.3 Gy/次,1次/d,5次/周。处方剂量至少覆盖95%的计划靶体积,且热点最高剂量限制在处方剂量的107%以内,脊髓最大剂量限制为≤45 Gy。使用调强放疗技术进行计划设计。射线选择6 MV X线,通过Pinnacle TPS软件获得剂量体积直方图等相关物理学参数。
1.4.3 预防性全脑照射共35例患者行预防性全脑照射,采用全颅左右对穿野的二维常规放疗技术,处方剂量为25 Gy(2.5 Gy/次,共10次)。
1.4.4 脑部转移灶放疗共84例患者进行了脑部转移灶放疗,采用全颅左右对穿野的二维常规放疗技术,处方剂量为30 Gy(3 Gy/次,共10次)或37.5 Gy(2.5 Gy/次,共15次)。
1.5 疗效及毒性评价标准近期疗效评价按RECIST1.1标准(实体瘤的疗效评价标准1.1版本),分为CR、PR、SD和疾病进展。对于患者不可测量的病灶(如骨转移、恶性胸腔或心包积液等),疗效评价时一般不作为靶病灶参与评价,仅在提示明确的病灶病情进展时参与疗效评价(如骨转移骨痛明显加重、发生压缩骨折,心包积液或胸腔积液明显增多)。急性不良反应评价根据CTCAE 3.0标准(通用不良反应术语标准3.0版本),主要记录血液学改变、急性放射性肺炎、急性放射性食管炎等。晚期不良反应评价根据RTOG(放射肿瘤协作组)晚期放射损伤分级标准评价。
1.6 随访首程治疗结束后,2年内每2个月检查1次颈部和腹部B超或CT、胸部CT,2年后每3个月检查1次,5年后每1年检查1次。每半年检查1次头部MRI,每1年检查1次全身骨扫描。
1.7 统计学方法采用SPSS 22.0软件进行统计学分析。计数资料比较采用卡方检验,采用Log Rank法进行单因素预后分析,Cox回归模型进行多因素预后分析。生存分析采用Kaplan-Meier法,组间生存率比较采用Log Rank检验。P < 0.05表示差异有统计学意义。
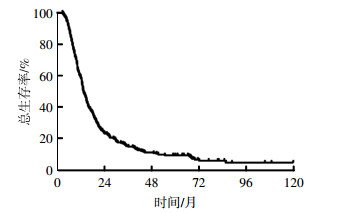
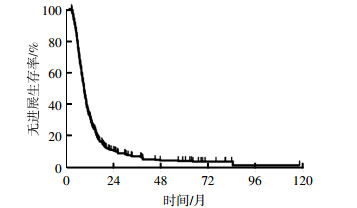
2 结果 2.1 生存及预后因素分析结果截至2017年1月31日,存活患者的中位随访时间为69个月(41.1~118.1个月),全组患者中位生存时间为13.7个月。全组患者的2年、3年、5年总生存率(overall survival,OS)分别为24.2%、15.6%、9.8%(图 1)。全组患者的中位PFS为9.3个月(图 2)。
|
图 1 327例广泛期小细胞肺癌患者综合治疗后的总生存率曲线 Figure 1 Overall survival curve of 327 patients with extensive-stage small cell lung cancer treated with chemotherapy combined with or without thoracic radiation therapy |
|
图 2 327例广泛期小细胞肺癌患者综合治疗后的无进展生存率曲线 Figure 2 Progression-free survival curve of 327 patients with extensive-stage small cell lung cancer treated with chemotherapy combined with or without thoracic radiation therapy |
在全组患者中对与OS相关的多项临床因素(包括性别、年龄、卡氏功能状态评分、吸烟史、T分期、N分期、初诊时脑转移状态、初诊时转移器官数、化疗周期数、化疗疗效、是否脑预防照射、是否TRT)进行单因素分析,结果显示男性、化疗未达PR、未行脑预防照射、未行TRT是显著影响OS的不良预后因素(表 2)。
| 表2 327例化疗后无进展的广泛期小细胞肺癌患者单因素预后分析结果 Table 2 Univariate analysis for overall survival of 327 extensive-stage small cell lung cancer patients reaching complete response+partial response+stable disease after chemotherapy |
多因素分析结果显示化疗周期数、化疗疗效、脑预防照射及TRT是与OS相关的独立预后因素(表 3)。
| 表3 327例化疗后无进展的广泛期小细胞肺癌患者Cox模型多因素预后分析结果 Table 3 Multivariate analysis for overall survival of 327 patients with extensive-stage small cell lung cancer reaching complete response+partial response+stable disease after chemotherapy |
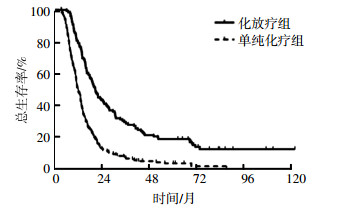
化放疗组的中位生存时间以及2年、3年、5年OS分别为20.0个月、42.5%、27.8%、18.8%,单纯化疗组分别为11.4个月、11.6%、6.6%、3.5%,两组比较差异有统计学意义(χ2=50.730,P < 0.001);化放疗组的中位PFS为10.8个月,单纯化疗组为7.7个月,两组比较差异有统计学意义(χ2=27.530,P < 0.001)。化放疗组的OS和PFS均显著高于单纯化疗组(图 3、图 4)。
|
图 3 化放疗组和单纯化疗组广泛期小细胞肺癌患者的总生存率曲线 Figure 3 Overall survival curve for the thoracic radiation therapy and non-thoracic radiation therapy groups of patients with extensive-stage small cell lung cancer |

|
图 4 化放疗组和单纯化疗组广泛期小细胞肺癌患者的无进展生存率曲线 Figure 4 Progression-free survival curve for the thoracic radiation therapy and non-thoracic radiation therapy groups of extensive-stage small cell lung cancer |
化疗后疗效评价为CR+PR的患者中,化放疗组的中位生存时间和中位PFS显著高于单纯化疗组,分别为20.2个月vs. 12.7个月(χ2=34.280,P < 0.001)和11.2个月vs. 9.1个月(χ2=12.590,P < 0.001),差异有统计学意义;化疗后疗效评价为SD的患者中,化放疗组和单纯化疗组的中位生存时间和中位PFS分别为17.6个月vs. 8.7个月(χ2=15.910,P < 0.001)和9.3个月vs. 5.7个月(χ2=10.590,P=0.001),差异有统计学意义。
2.4 初诊脑转移患者的生存结果初诊时即出现脑转移的患者有46例(14.1%),与初诊无脑转移患者相比,2年、3年、5年OS分别为:21.8% vs. 24.6%、12.1% vs. 16.1%、7.3% vs. 10.2%,差异无统计学意义(χ2=0.279,P=0.597);PFS分别为:9.9% vs. 11.7%、4.9% vs. 8.3%、2.5% vs. 5.3%,差异无统计学意义(χ2=0.408,P=0.523)。
无论初诊是否有脑转移,化疗后行TRT均能显著提高生存率。无脑转移患者在化放疗组的中位生存时间为20.1个月,明显高于单纯化疗组患者(11.2个月),差异有统计学意义(χ2=42.560,P < 0.001);有脑转移患者在化放疗组的中位生存时间为20.0个月,明显高于单纯化疗组患者(11.5个月),差异有统计学意义(χ2=6.510,P=0.011)。
无脑转移的患者中,化疗后行TRT能显著提高中位PFS(11.1个月vs. 7.9个月,χ2=21.120,P < 0.001);但有脑转移患者行TRT不能显著提高中位PFS(9.5个月vs. 7.0个月,χ2=0.567,P=0.451)。
2.5 失败模式全组患者中疾病进展275例(84.1%),其中局部区域进展、远处进展、局部区域和远处同时进展分别为159例(48.6%)、101例(30.9%)和15例(4.6%),包括化放疗组的22例(16.9%)、66例(50.8%)和3例(2.3%)以及单纯化疗组的137例(69.5%)、35例(17.8%)和12例(6.1%)。化放疗组的局部区域复发率为19.2%,而单纯化疗组患者的局部区域复发率为75.6%,TRT大大降低了局部区域复发率,两者间差异有统计学意义(χ2=100.080,P=0.001)。
2.6 不良反应化放疗组在放疗后有46例患者出现3级以上血液学毒性,发生率为35.4%(46/130);单纯化疗组有63例患者出现3级以上血液学毒性,发生率为31.9%(63/197),两组间差异无统计学意义(χ2=0.409,P=0.550)。放疗的加入并未明显增加化疗后的血液学毒性。放疗相关不良反应主要表现为放射性肺炎和放射性食管炎,化放疗组≥2级的放射性肺炎和放射性食管炎的发生率分别为28.5%(37/130)和12.3%(16/130)。
3 讨论SCLC对放疗非常敏感,对于局限期SCLC,TRT已作为标准治疗方法,其与化疗联合应用可明显提高胸内病灶的控制率并改善总生存状况[8]。对于ES-SCLC,放疗以往主要用于姑息治疗,如骨转移的止痛治疗、上腔静脉综合征的急症治疗、脑转移的放疗等,在缓解局部症状和提高患者生活质量方面起到了重要作用。本研究回顾性多因素分析结果显示,化疗周期数、化疗疗效、脑预防照射及TRT是与ES-SCLC患者生存相关的独立预后因素,提示放疗的作用不仅局限于姑息减症,针对原发病灶的放疗还会带来生存获益。此外,多项研究中探索了化疗后行TRT是否可提高ES-SCLC的疗效、改善预后,但结果存在争议[9-12]。
1999年,Jeremic等[9]开展的一项单中心的临床试验入组210例经依托泊苷+顺铂(EP)方案化疗有效的ES-SCLC患者,随机分为同步放化疗组和单纯化疗组,TRT采用超分割方式,54 Gy/36次[BED(生物等效剂量)=52.2 Gy]。该结果显示同步放化疗组患者的中位生存时间较单纯化疗组患者延长了6个月(17个月vs. 11个月),5年OS提高了5.4%(9.1% vs. 3.7%),差异有统计学意义(P=0.041)。2011年,Zhu等[11]报道了119例化疗有效接受TRT的ES-SCLC患者,放疗方案为常规分割(总剂量40~60 Gy,单次剂量1.8~2.0 Gy),治疗后患者中位生存期达13个月,2年和5年OS可达26.1%和6.5%,多因素分析结果显示TRT是长期生存的独立预后因素(P=0.005)。
2009年一项国际多中心Ⅲ期随机对照研究--CREST(Chest Radiotherapy Extensive-Stage Small Cell Lung Cancer Trial)研究入组化疗有效的ES-SCLC患者,接受25 Gy预防性全脑照射后随机分为TRT组和对照组,TRT放疗方案为30 Gy/10次(BED=34.05 Gy),最终498例患者入组,495例可供分析,TRT组的2年OS显著高于对照组(13% vs. 3%,P=0.004)[13]。这项随机对照试验仍有局限性,研究中并未详述两组患者化疗前后转移灶的情况,而有研究结果显示不同转移灶个数及部位是ES-SCLC患者生存的独立预后因子[14],很可能因为临床特点不均衡而导致两组结果发生偏倚,并且研究中的放疗剂量偏低,TRT后仍有超过40%的患者出现胸部肿瘤复发,单纯胸部复发率为20%。2016年,张文珏等[15]发表的回顾性研究结果显示,TRT剂量是ES-SCLC患者生存的独立预后因素,常规2 Gy分次放射等效生物剂量达54 Gy可改善OS(HR=1.615,95%CI为1.016~2.567;P=0.043),并有改善PFS的趋势(HR=1.49,95%CI为0.965~2.299,P=0.072),全组患者中仅有11例TRT的2 Gy分次放射等效生物剂量未达50 Gy,并且所采用的放疗技术均为调强放疗,较之前研究中的常规放疗更能提高靶区的照射剂量,其1年、2年OS分别为72.3%、38.3%,显著高于CREST研究结果。
笔者回顾性分析了化疗后无进展的ES-SCLC患者是否行TRT的疗效。长期随访结果显示化放疗组的2年、3年、5年OS分别为42.5%、27.8%、18.8%,明显高于同期单纯化疗组的11.6%、6.6%、3.5%,TRT组所取得的生存获益考虑与TRT后局部控制的大幅度提高关系密切。Zhu等[11]报道的放化疗组胸内复发率为29.6%(21/89),化疗组胸内复发率为64.1%(42/65),两组间差异有统计学意义(P=0.000)。本研究中化放疗组局部区域复发率能显著降低至19.2%,而单纯化疗组则高达75.6%(P=0.001)。此外,无论是化放疗综合治疗还是单纯化疗的中位生存时间均高于既往文献报道的10个月左右的生存期,其中,化放疗组的2年OS高于Zhu等[11]、CREST研究[13]以及张文珏等[15]报道的26.1%、13%和38.3%,5年OS高于Zhu等[11]报道的6.5%,另外,本研究中化放疗组的PFS也有明显提高。原因考虑与以下因素有关:一方面,本研究中仅包括了化疗后CR+PR+SD的患者,未纳入疾病进展的患者;另一方面,本研究中的放疗平均剂量为56 Gy(1.8~2.3 Gy/次),高于既往文献报道中给予的30~45 Gy、分10~15次或50 Gy/25次的剂量分割[9-11]。与既往研究一致的是,本研究结果显示TRT能降低ES-SCLC局部失败的发生率,延长患者的总生存时间和PFS。但由于回顾性资料的局限性,两组基线因素不完全平衡,化放疗组的女性比例稍高,吸烟患者更少,初诊时转移器官数≥3的患者更少,化疗后疗效达PR以上的患者比例更高,这些因素有可能干扰两组间的生存差异,需进一步的随机研究予以验证。
初诊时即发现脑转移的ES-SCLC患者,脑部病灶进展迅速且生存率低,这部分患者可否从TRT中获益仍存在争议。此外,既往研究结果显示对于ES-SCLC,化疗后疗效达CR或PR的患者能从TRT中获益[9, 16],但仍有部分患者化疗后疗效为SD,这部分患者行TRT可否获益缺少前瞻性证据。本研究按初诊时是否有脑转移和化疗后疗效(CR+PR、SD)进行分层分析,结果显示TRT的加入均能提高各亚组的OS,但不能提高初诊时有脑转移患者的PFS,对化疗后行TRT可获益人群的选择有一定的提示作用。
综上所述,对于化疗后无进展的ES-SCLC患者,TRT可提高局部控制率,延长患者的总生存时间和PFS,并且未明显增加化疗相关的血液学毒性,但初诊时有脑转移患者的PFS无明显获益。因本研究为回顾性研究,尚需扩大样本量的前瞻性随机研究进一步证实。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 邓垒负责资料的整理、统计分析和论文撰写;张文珏、李景涛负责资料的整理;周宗玫负责研究命题的提出、设计和论文的最终修订;肖泽芬、陈东福、冯勤付、梁军、李晔雄、王绿化负责提供病例资料和分析方法、修订论文。
| [1] | Govindan R, Page N, Morgensztern D, et al. Changing epidemiology of small-cell lung cancer in the United States over the last 30 years:analysis of the surveillance, epidemiologic, and end results database[J]. J Clin Oncol, 2006, 24(28): 4539–4544. DOI:10.1200/JCO.2005.04.4859 |
| [2] | van Meerbeeck JP, Fennell DA, De Ruysscher DK. Small-cell lung cancer[J]. Lancet, 2011, 378(9804): 1741–1755. DOI:10.1016/S0140-6736(11)60165-7 |
| [3] | Vallières E, Shepherd FA, Crowley J, et al. The IASLC Lung Cancer Staging Project:proposals regarding the relevance of TNM in the pathologic staging of small cell lung cancer in the forthcoming (seventh) edition of the TNM classification for lung cancer[J]. J Thoracic Oncol, 2009, 4(9): 1049–1059. DOI:10.1097/JTO.0b013e3181b27799 |
| [4] | Karve SJ, Price GL, Davis KL, et al. Comparison of demographics, treatment patterns, health care utilization, and costs among elderly patients with extensive-stage small cell and metastatic non-small cell lung cancers[J/OL]. BMC Health Serv Res, 2014, 14: 555[2017-12-04]. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/25392276. DOI: 10.1186/s12913-014-0555-8. |
| [5] | Fiegl M, Pircher A, Waldthaler C, et al. Small steps of improvement in small-cell lung cancer(SCLC) within two decades:a comprehensive analysis of 484 patients[J]. Lung Cancer, 2014, 84(2): 168–174. DOI:10.1016/j.lungcan.2014.02.005 |
| [6] | Kalemkerian GP. Running in place:the 20th anniversary of the NCCN small cell lung cancer guidelines panel[J]. JNatl Compr Canc Netw, 2015, 13(6): 704–706. DOI:10.6004/jnccn.2015.0084 |
| [7] | Eckert F, Müller AC. SCLC extensive disease-treatment guidance by extent or/and biology of response?[J/OL]. Radiat Oncol, 2008, 3: 33[2017-12-04]. https://www.ncbi.nlm.nih.gov/pmc/articles/pmid/18831728. DOI: 10.1186/1748-717X-3-33. |
| [8] | Socinski MA, Bogart JA. Limited-stage small-cell lung cancer:the current status of combined-modality therapy[J]. J Clin Oncol, 2007, 25(26): 4137–4145. DOI:10.1200/JCO.2007.11.5303 |
| [9] | Jeremic B, Shibamoto Y, Nikolic N, et al. Role of radiation therapy in the combined-modality treatment of patients with extensive disease small-cell lung cancer:A randomized study[J]. J Clin Oncol, 1999, 17(7): 2092–2099. DOI:10.1200/JCO.1999.17.7.2092 |
| [10] | Giuliani ME, Atallah S, Sun A, et al. Clinical outcomes of extensive stage small cell lung carcinoma patients treated with consolidative thoracic radiotherapy[J]. Clin Lung Cancer, 2011, 12(6): 375–379. DOI:10.1016/j.cllc.2011.03.028 |
| [11] | Zhu H, Zhou Z, Wang Y, et al. Thoracic radiation therapy improves the overall survival of patients with extensive-stage small cell lung cancer with distant metastasis[J]. Cancer, 2011, 117(23): 5423–5431. DOI:10.1002/cncr.26206 |
| [12] | Gore EM, Hu C, Sun AY, et al. Randomized phase Ⅱ study comparing prophylactic cranial irradiation alone to prophylactic cranial irradiation and consolidative extracranial irradiation for extensive-disease small cell lung cancer (ED SCLC):NRG oncology RTOG 0937[J]. J Thorac Oncol, 2017, 12(10): 1561–1570. DOI:10.1016/j.jtho.2017.06.015 |
| [13] | Slotman BJ, van Tinteren H, Praag JO, et al. Use of thoracic radiotherapy for extensive stage small-cell lung cancer:a phase 3 randomised controlled trial[J]. Lancet, 2015, 385(9962): 36–42. DOI:10.1016/S0140-6736(14)61085-0 |
| [14] | Bremnes RM, Sundstrom S, Aasebø U, et al. The value of prognostic factors in small cell lung cancer:results from a randomised multicenter study with minimum 5 year follow-up[J]. Lung Cancer, 2003, 39(3): 303–313. DOI:10.1016/S0169-5002(02)00508-1 |
| [15] |
张文珏, 周宗玫, 陈东福, 等.
广泛期SCLC化疗后IMRT的疗效分析[J]. 中华放射肿瘤学杂志, 2016, 25(1): 14–17.
DOI:10.3760/cma.j.issn.1004-4221.2016.01.004 Zhang WJ, Zhou ZM, Chen DF, et al. Clinical outcomes of extensive stage small cell lung cancer patients treated with intensive modified radiotherapy[J]. Chin J Radiat Oncol, 2016, 25(1): 14–17. DOI:10.3760/cma.j.issn.1004-4221.2016.01.004 |
| [16] | Yee D, Butts C, Reiman A, et al. Clinical trial of post-chemotherapy consolidation thoracic radiotherapy for extensive-stage small cell lung cancer[J]. Radiother Oncol, 2012, 102(2): 234–238. DOI:10.1016/j.radonc.2011.08.042 |
 2018, Vol. 42
2018, Vol. 42


