黑茶是中国特有的茶类,属于后发酵茶,主要分布在云南、湖南、湖北、四川和广西。黑茶经过较长时间的渥堆和后发酵过程,由于微生物的参与,形成了其特殊的药理作用[1-2]。Xiao等[3-4]研究发现,黑茶的有效成分主要有黑茶多糖、茶多酚、茶褐素和咖啡碱等。黑茶多糖是一类分子质量较大的复杂多糖,其化学本质是一类与蛋白质结合在一起的酸性多糖或酸性糖蛋白[5]。黑茶中的水溶性糖和游离蛋白质含量普遍高于其他茶类,这是因为黑茶在后发酵过程中溶解性较差的大分子多糖和蛋白质分子分解成较小的可溶性游离多糖、寡糖、蛋白质或肽链等[6]。我们的前期研究发现,黑茶提取物有较好的辐射防护作用[7],由于黑茶成分复杂,其辐射防护作用的机制尚不清楚。本研究通过对小鼠30 d存活率和氧化损伤防护实验,观察黑茶提取物的辐射防护作用,并通过黑茶主要成分——黑茶多糖测试其对Toll样受体5(Toll-like receptors 5, TLR5)的激活作用,研究黑茶发挥辐射防护作用的分子机制。
1 材料与方法 1.1 试剂黑茶提取物和黑茶多糖(由本实验室提取),HEK-BlueTM Detection培养基(美国InvivoGen),HEK-BlueTM hTLR5细胞、鞭毛蛋白(美国,Sigma,P21931204),RPMI 1640培养液(美国,Hclone公司,sh30809.01B),胎牛血清(美国,Gibco,1662775),胰蛋白酶(中国,Solarbio, T1320),总超氧化物歧化酶(total superoxide dismutase, T-SOD)试剂盒、丙二醛(methylene dioxyamphetamine, MDA)测定试剂盒、过氧化氢酶(catalase, CAT)测定试剂盒和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)测定试剂盒均由南京建成生物工程研究所提供。
1.2 实验动物CD-1(institute of cancer research, ICR)雄性小鼠(SPF级)由北京维通利华实验动物技术有限公司提供,合格证号[SCXK(京)2012-0001],体重18~20 g。每笼5只饲养于中国医学科学院放射医学研究所动物实验中心SPF级动物房(饲养设施合格证号:SVXK津2009-0002)。
1.3 主要仪器137Cs辐射源(型号USD,Autocell40)购自加拿大原子能有限公司;流式细胞仪(型号accuri c6)由美国BD公司生产;酶标仪(synergy HT)由美国Thermo公司生产。
1.4 小鼠30 d存活率实验 1.4.1 实验动物分组及给药方式将75只ICR小鼠按随机数字表法分为5组,即空白对照组、单纯照射组和黑茶提取物照射给药高、中、低(200、100、50 mg/kg)剂量组,每组15只。单纯照射组和黑茶提取物照射给药高、中、低组均接受137Cs-γ射线一次性全身照射,照射剂量为7.0 Gy,剂量率为0.99 Gy/min。黑茶提取物照射给药高、中、低组于照射前14 d开始每天灌胃给药(规定剂量),照射后继续给药7 d,单纯照射组同时给予蒸馏水。
1.4.2 观察指标照射后观察每组小鼠30 d存活率、保护指数、平均生存天数:
30 d存活率=(每组小鼠30 d存活数/每组小鼠总数)×100%。
保护指数=[(a×b+30×c)/n]/[(a′×b′+30×c′)/n′]
式中,a、a′分别为给药组与空白对照组死亡小鼠平均存活天数;b、b′分别为给药组与空白对照组小鼠的死亡只数;c、c′分别为给药组与空白对照组小鼠的30 d存活只数;n、n′分别为给药组与空白对照组小鼠总只数。
1.5 氧化损伤防护实验 1.5.1 实验动物分组及给药方式将18只ICR小鼠按体重随机分成3组,即空白对照组、单纯照射组和黑茶水提物照射给药组,每组6只。黑茶提取物照射给药组于照射前14 d开始灌胃,给予规定剂量(200 mg/kg)的黑茶提取物,同时空白对照组和单纯照射组灌胃给予0.01 mL/g体积的蒸馏水,137Cs γ射线6.0 Gy,剂量率为0.99 Gy/min一次性全身照射后继续给药和蒸馏水,7 d后取材。
1.5.2 组织匀浆的制备照射后第7天,将小鼠摘眼球取血(尽可能多取),然后颈椎脱臼处死,解剖取肝组织和肺组织,放入预冷的生理盐水中清洗干净残留的血液,用滤纸拭干水,取肝组织和肺组织约0.2 g(尽可能取相同位置,减少误差),放入10 mL离心管中,按重量(g):体积(mL)= 1 : 9的比例加入生理盐水,在冰水浴低温条件下进行机械匀浆,以离心半径=9 cm,2 500 r/min离心10 min,取上清液即10%的组织匀浆,分装成4份,-20℃冰箱保存备用。
1.5.3 检测指标根据T-SOD试剂盒、MDA试剂盒、CAT试剂盒和GSH-Px试剂盒说明书中的方法,测定小鼠肝组织和肺组织中SOD、CAT、GSH-Px的活性和MDA的含量。
1.6 TLR5激活实验 1.6.1 HEK-BlueTM hTLR5细胞培养实验前采用0.25%的胰酶消化,利用HEK-BlueTM Detectuin培养液将处于对数生长期的HEK-BlueTM hTLR5细胞和HEK-BlueTM Null1细胞(阴性对照细胞)分别制备成单细胞悬液,8×103个细胞/孔接种于96孔板中,每孔培养液为200 μL,置于37 ℃、5% CO2饱和湿度培养箱培养1 h后,分别用阳性对照鞭毛蛋白(25 ng/mL)、1 ng/mL和100 ng/mL黑茶多糖作用于HEK-BlueTM hTLR5细胞和HEK-BlueTM Null1细胞,于培养箱中继续培养24 h后测定吸光度。
1.6.2 观察指标细胞转录因子κB(nuclear factor-κB,NF-κB)途径被激活时,胎盘碱性磷酸酶释放入含有磷酸酶显色底物的HEK-BlueTM Detection培养液中,培养液的颜色从粉红色变为蓝/紫色,培养24 h后采用紫外分光光度法定量分析每孔培养液的吸光度(620~655 nm)。
1.7 统计学处理采用Graphpad 5软件计算作图并绘制生存率曲线,实验数据以平均数±标准差(x±s)表示,应用SPSS19.0统计软件进行组内方差分析和组间t检验,使用Student-Newman-Keuls进行多组间显著性差异分析。P<0.05表示差异有统计学意义。
2 结果 2.1 小鼠30 d存活率实验结果由图 1和表 1可知,与单纯照射组相比较,黑茶水提物能显著提高辐射损伤小鼠的30 d存活率,高剂量给药组提高幅度达53.4%,保护指数为1.32,明显延长辐射损伤小鼠的平均生存时间,差异有统计学意义(t=3.126,P<0.05),低剂量给药组和中剂量给药组也可在不同程度上提高辐射损伤小鼠的存活率,分别提高26.7%和33.4%,结果提示黑茶水提物对辐射损伤小鼠有较好的整体性保护作用。
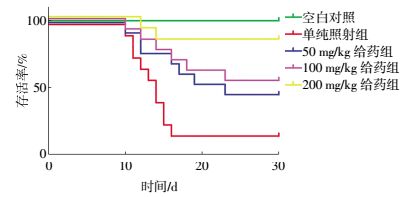
|
图 1 黑茶提取物对辐射损伤小鼠30 d存活率的影响 Figure 1 Effects of dark tea extract on the 30 d survival rates of irradiated mice |
| 表1 辐射损伤小鼠30 d存活率实验结果(x±s) Table 1 Results statistics of 30 days survival rate in irradiated mice |
由表 2可见,受照小鼠血清、肝组织和肺组织中SOD活性较空白对照组都有显著降低;与单纯照射组相比,黑茶提取物(200 mg/kg)给药组小鼠血清、肝组织和肺组织中的SOD活性均提高,特别是肝组织和肺组织的SOD活性显著提高,差异有统计学意义(t=2.993,P<0.05;t=4.049,P<0.01)。结果提示黑茶水提物对血清、肝组织和肺组织中的SOD活性均有一定的保护作用。
| 表2 黑茶提取物对辐射损伤小鼠血清和组织中SOD活性的影响(x±s) Table 2 Effects of dark tea extract on superoxide dismutase activity in serum and tissue of radiation injured mice |
黑茶提取物对辐射损伤小鼠肝组织和肺组织MDA含量的影响见表 3。由表 3可见,与空白对照组相比, 单纯照射组小鼠肺组织和肝组织中的MDA含量有明显升高,差异有统计学意义(t=3.873、2.989,均P<0.05)。黑茶提取物(200 mg/kg)照射给药组辐射损伤小鼠肺组织的MDA含量较单纯照射组有所降低,且降低幅度并不是十分明显;未发现对肝组织中MDA含量降低作用。研究结果提示,黑茶水提物对辐射损伤小鼠肺组织中MDA含量有一定的降低作用。
| 表3 黑茶提取物对辐射损伤小鼠肺组织和肝组织中MDA含量的影响(x±s) Table 3 Effects of dark tea extract on methylene dioxyamphetamine level in lung and liver tissue of radiation injured mice |
由表 4可见,受照小鼠肝组织和肺组织中的CAT活性均低于空白对照组,黑茶提取物(200 mg/kg)给药组小鼠肝组织中CAT的活性较单纯照射组明显升高,差异有统计学意义(t=4.883,P<0.01),肺组织中CAT活性则没有明显的差别。研究结果提示,黑茶提取物可提高辐射损伤小鼠肝组织和肺组织的CAT活性,对辐射致氧化损伤有一定的保护作用。
| 表4 黑茶提取物对辐射损伤小鼠肝组织和肺组织CAT活性的影响(x±s) Table 4 Effects of dark tea extract on catalase activity in liver and lung tissue of radiation injured mice |
由表 5可见,所有受照组小鼠肝组织中GSH-Px活性显著低于空白对照组,差异有统计学意义(t=4.807,P<0.01)。与单纯照射组相比,黑茶提取物照射给药组(200 mg/kg)小鼠肝组织和肺组织中GSH-Px活性有明显的提高作用,差异有统计学意义(t=2.702,t=2.959, 均P<0.05)。结果提示黑茶提取物对辐射损伤导致的氧化损伤有一定的保护作用。
| 表5 黑茶提取物对辐射损伤小鼠肝组织和肺组织中GSH-Px活性的影响(x±s) Table 5 Effects of dark tea extract on glutathione peroxidase activity in liver and lung tissue of radiation injured mice |
图 2实验结果显示,空白对照组HEK-BlueTM hTLR5细胞中TLR5受体活性与HEK-BlueTM Null1细胞(阴性对照组细胞)相比没有提高;黑茶多糖低剂量(1 ng/mg)给药组HEK-BlueTM hTLR5细胞与HEK-BlueTM Null1细胞相比,黑茶多糖低剂量给药组和阳性对照组鞭毛蛋白可显著激活HEK-BlueTM hTLR5细胞表面的TLR5受体,差异有统计学意义(t=9.537,P<0.05);黑茶多糖高剂量(10 ng/mg)对HEK-BlueTM hTLR5细胞中TLR5受体也具有一定的激活作用,差异有统计学意义(t=9.222,P<0.05);但黑茶多糖低剂量给药组对TLR5受体的激活作用更加显著,甚至可以达到阳性对照鞭毛蛋白的激活效果,以上数据提示这种作用在黑茶多糖低浓度时更为显著。结果提示,黑茶的主要成分黑茶多糖可能是通过激活TLR5受体来发挥药效以起到辐射防护作用。
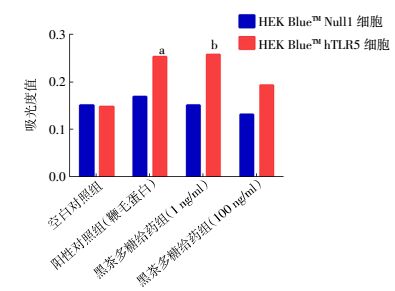
|
图 2 黑茶多糖对TLR5受体的影响 图中,a,b:与空白对照组比较,差异有统计学意义(t=9.537、9.222,均P<0.05) Figure 2 Effect of dark tea extract polysaccharide on Toll-like receptors 5 |
小鼠受到致死剂量的辐射后,其机体在短时间内发生一系列的生物学反应,出现细胞、组织甚至器官损伤,引起机体生理病理的变化甚至死亡[8]。评价辐射防护药物最简单最直接的方法是观察受到致死剂量照射的小鼠30 d存活率、平均生存时间及保护指数。本研究结果显示,与单纯照射组相比,200、100、50 mg/kg 3个剂量黑茶提取物给药组小鼠的存活率均有不同程度的提高,平均生存时间也显著延长,尤其是高剂量200 mg/kg给药组;与单纯照射组比较,小鼠的存活率提高幅度达53.4%,辐射损伤的保护效果最好。综合以上实验数据发现,黑茶提取物对受到致死剂量照射的小鼠有较好的整体保护作用。
3.2 抗氧化损伤机体经射线照射后,首先直接作用于机体组织细胞中的水分子,使水分子电离产生大量活性氧类物质,其具有较强的氧化活性,打破了机体内的氧化还原平衡[9]。氧化和抗氧化的平衡是决定细胞生存的条件,及时清除体内过剩的自由基,才能维持自由基的动态平衡,也是机体的自我保护。过剩的活性氧类可攻击生物膜中的不饱和脂肪酸,诱导产生MDA,其含量的多少可反应氧化损伤的程度。SOD、CAT和GSH-Px均为抗氧化防御系统中用来防止活性氧类对机体的损伤的抗氧化酶,SOD专门清除超氧阴离子自由基,其作用是将氧自由基歧化,发生
本研究的数据结果显示,200 mg/kg黑茶提取物可显著提高肝组织和肺组织中SOD、CAT和GSH-PX活性,降低MDA含量,提示黑茶提取物对辐射致氧化损伤有一定的保护作用。
3.3 TLR5受体激活实验Toll样受体在人类固有免疫和获得性免疫应答中发挥重要作用[10-11],TLR家族通过细胞外区感应组织中的危险信号,经相应接头蛋白进行信号传导,激活相关的核内基因,从而诱导感染性炎症和非感染性炎症。其中TLR5受体是广泛存在于树突细胞、巨噬细胞以及肠黏膜固有层内皮细胞的表面,能够被细菌鞭毛蛋白及其衍生物识别,并激活NF-κB信号通路,从而抑制细胞凋亡、抵抗机体氧化损伤。文献报道,TLR5受体的激动剂能发挥辐射防护作用[12-13]。TLR5激活时,利用髓样分化因子88(MyD88)和接头蛋白(TRIF)作为接合子,诱导NF-κB的活化,从而激活天然固有免疫反应,介导急性炎性反应,直接杀伤入侵病原微生物。NF-κB激活后,一方面参与细胞增殖和分化,抑制细胞的凋亡,从而增强细胞及组织的辐射适应性[14];另一方面启动下游多种靶基因转录表达,合成多种具有抗辐射作用的蛋白,如TNF-α、巨噬细胞集落刺激因子等。TLR5识别配体后激活NF-κB,在辐射之前NF-κB被活化,可以先上调促炎性因子,活化抗氧化保护基因的表达,如γ-谷氨酰半胱氨酸合酶(γ-GCS)基因(参与谷胱甘肽合成)、锰超氧化物歧化酶基因、血小板膜糖蛋白基因和金属硫蛋白基因的表达均上调,这是细胞自我保护的重要途径之一,从而拮抗辐射产生的氧化自由基所引起的损伤,减轻氧化应激导致的损伤,在适应性防御过程中起重要作用。本研究结果发现黑茶提取物能显著延长辐射损伤小鼠的平均生存时间,提高生存率,同时黑茶多糖在低浓度时对TLR5受体有一定的激活作用,这可能是黑茶发挥辐射防护作用的机制之一,其具体的作用机制有待进一步深入研究。
综上所述,黑茶提取物具有非常显著的辐射防护作用,有望开发成为辐射损伤防护药物。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 龙伟负责论文命题的提出、方法的设计与实施、论文的起草和最终的修订;牟感恩、张广慧、周则卫负责实验的实施与数据的提供;孙元明负责论文的审阅。
| [1] |
袁华芳. 黑茶化学成分及其抗氧化性的研究[D]. 大连: 辽宁师范大学, 2008.
Yuan HF. Research of dark green tea's chemical composition and anticccoxidation[D]. Dalian:Liaoning Normal University, 2008. http://cdmd.cnki.com.cn/article/cdmd-10165-2009122081.htm |
| [2] |
杨抚林, 邓放明, 赵玲艳, 等.
黑茶微生物学研究进展[J]. 微生物学杂志, 2006, 26(1): 81–84.
Yang FL, Deng FM, Zhao LY, et al. Development of black tea Microbiology[J]. J Microbiol, 2006, 26(1): 81–84. |
| [3] | Xiao J, Ni X, Kai G, et al. A review on structure-arelationship of dietary polyphenols inhibiting α-amylase[J]. Crit Rev Food Sci Nutr, 2013, 53(5): 497–506. DOI:10.1080/10408398.2010.548108 |
| [4] | Xiao J, Kai G, Yamamoto K, et al. Advance in dietary polyphenols as α-glucosidases inhibitors:a review on structure-activity relationship aspect[J]. Crit Rev Food Sci Nutr, 2013, 53(8): 818–836. DOI:10.1080/10408398.2011.561379 |
| [5] |
黄建安, 刘仲华, 施兆鹏.
茯砖茶制造中主要酶类的变化[J]. 茶叶科学, 1991, 11(Supple): 63–68.
Huang JA, Liu ZH, Shi ZP. Changes of main enzymes in fuzhuan tea[J]. J Tea Sci, 1991, 11(Supple): 63–68. |
| [6] |
陈文峰, 屠幼英, 吴媛媛, 等.
黑茶紧压茶浸提物对胰蛋白酶活性的影响[J]. 中国茶叶, 2002, 24(3): 16–17.
Chen WF, Tu YY, Wu YY, et al. Effect of pressed dark tea extracts on trypsin activity[J]. China Tea, 2002, 24(3): 16–17. |
| [7] |
张广慧, 吴红英, 周则卫, 等.
湖南黑茶对小鼠辐射损伤的保护作用[J]. 天然产物研究与开发, 2016, 28(5): 775–780.
DOI:10.16333/j.1001-6880.2016.5.025 Zhang GH, Wu HY, Zhou ZW, et al. Protective effects of hunan dark tea against radiation injuries in mice[J]. Nat Prod Res Dev, 2016, 28(5): 775–780. DOI:10.16333/j.1001-6880.2016.5.025 |
| [8] | Cook T, Wang Z, Alber S, et al. Nitric oxide and ionizing radiation synergistically promote apoptosis and growth inhibition of cancer by activating p53[J]. Cancer Res, 2004, 64(21): 8015–8021. DOI:10.1158/0008-5472.CAN-04-2212 |
| [9] | Milligan JR, Aguilera JA, Paglinawan RA, et al. DNA strand break yields after post-high LET irradiation incubation with endonuclease-Ⅲand evidence for hydroxyl radical clustering[J]. Int J Radiat Biol, 2001, 77(2): 155–164. DOI:10.1080/09553000010013445 |
| [10] |
张斌, 张军帅, 刘培勋.
辐射防护剂研究现状及其进展[J]. 核化学与放射化学, 2012, 34(1): 8–13.
Zhang B, Zhang JS, Liu PX. Present status and progress in research on radioprotective agents[J]. J Nucl Radiochem, 2012, 34(1): 8–13. |
| [11] |
路璐, 李德冠, 张俊伶, 等.
6 Gy 137Cs γ射线照射对小鼠造血功能损伤的动态观察研究[J]. 国际放射医学核医学杂志, 2015, 39(6): 393–396.
DOI:10.3760/cma.j.issn.1673-4114.2015.05.009 Lu L, Li DG, Zhang JL, et al. Effects of 6 Gy 137Cs γ-irradiattion on the hematopoietic system of mice[J]. Int J Radiat Med Nucl Med, 2015, 39(6): 393–396. DOI:10.3760/cma.j.issn.1673-4114.2015.05.009 |
| [12] | Van Landeghem L, Blue RE, Dehmer JJ, et al. Localized intestinal radiation and liquid diet enhance survival and permit evaluation of long-term intestinal responses to high dose radiation in mice[J/OL]. PLoS One, 2012, 7(12):e51310[2017-07-06]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0051310. DOI:10.1371/journal.pone.0051310. |
| [13] |
李悦妍, 关玉庆, 苗伟, 等.
阿托伐他汀对动脉粥样硬化模型兔Toll样受体4及其下游信号表达的影响[J]. 山东大学学报(医学版), 2014, 52(6): 1–6.
DOI:10.6040/j.issn.1671-7554.0.2013.748 Li YY, Guan YQ, Miao W, et al. Effect of atorvastatin on TLR4 expression and downstream signaling in atherosclerotic rabbits[J]. J Shandong Univ(Health Sci), 2014, 52(6): 1–6. DOI:10.6040/j.issn.1671-7554.0.2013.748 |
| [14] |
刘一凡, 王正冠, 唐红卫, 等.
乌司他丁对黑火药烟雾所致吸入性肺损伤大鼠的保护作用以及对IL-1β、TNF-α基因表达的抑制作用[J]. 解放军医学杂志, 2014, 39(3): 235–239.
DOI:10.11855/j.issn.9577-7402.2014.03.14 Liu YF, Wang ZG, Tang HW, et al. Protective effect of ulinastatin on inhalation lung injury caused by black gunpowder smoke in rats and its inhibitory effect on the mRNA expression of IL-1β and TNF-α[J]. Med J Chin PLA, 2014, 39(3): 235–239. DOI:10.11855/j.issn.9577-7402.2014.03.14 |
 2017, Vol. 41
2017, Vol. 41


