宫颈癌是妇女中最常见的恶性肿瘤之一,在发展中国家尤为常见,位居各种恶性肿瘤之首[1-2]。我国每年死于宫颈癌的患者有五万余人[3]。宫颈癌是一种感染性的疾病,大量分子生物学研究和流行病学结果证实,高危型人类乳头状瘤病毒感染是宫颈癌发生的必要条件之一[4-6]。辅助外科手术的放疗是治疗宫颈癌的常用手段。然而,中晚期宫颈癌患者会对放疗产生耐辐射性,对放疗逐渐变得不敏感,需加大治疗照射剂量,然而剂量的增加会给肿瘤患者带来比较严重的不良反应,降低了患者的生活质量[7-8]。因此,研究宫颈癌辐射耐受产生的机制,改变放射敏感性调节相关基因的表达水平,靶向地增加宫颈癌的放疗敏感性,一直是宫颈癌放疗临床和基础研究的热点。
乙肝病毒X 蛋白结合蛋白(hepatitis B X-inter-acting protein,HBXIP)是一种细胞组成型表达的蛋白,首次于肝癌细胞株HepG2 中被发现,通过酵母双杂交技术筛选作为乙肝病毒编码的蛋白HBx 的作用因子。HBXIP 基因定位于人染色体1p13.3,其开放阅读框可编码173 个氨基酸,相对分子质量约为19 000[9]。研究结果显示,HBXIP蛋白在多种恶性肿瘤疾病中都显著高表达,包括乳腺癌、肺癌、宫颈癌、结肠癌以及前列腺癌[10-11]。同时,HBXIP 作为一个多功能的调节蛋白,可通过不同的分子机制促进肿瘤细胞的增殖和迁移,抑制肿瘤细胞的凋亡,进而促进肿瘤的发生与发展[12-15]。我们选用宫颈癌ME-180细胞系为研究对象,研究人为降低HBXIP基因表达对宫颈癌ME-180细胞放射敏感性的影响,为探索宫颈癌放疗增敏的新途径提供实验依据和理论基础。
1 材料与方法 1.1 试剂与仪器人类宫颈癌ME-180细胞购自美国ATCC细胞库;MTT购自赛默飞生物有限公司;二甲基亚砜(DMSO)购自美国Sigma股份有限公司;姬姆萨染色液(G8220-10 g)购自北京索莱宝生物科技有限公司;PVDF(聚偏氟乙烯)膜购自赛默飞生物有限公司;小鼠抗人HBXIP蛋白抗体购于美国Sigma公司;兔抗人Bcl-2和Bid抗体、兔抗人AKT抗体和鼠抗人pAKT(S473)抗体均购自美国Proteintech公司;小鼠抗人GAPDH抗体及山羊抗小鼠 IgG 购于英国Abcam公司;Real-Time PCR试剂盒购自赛默飞生物有限公司;137Cs γ射线照射源购自加拿大原子能有限公司(Autocell40);ChemiDoc MP凝胶成像系统购于美国BIO-RAD公司;RT-6500酶标分析仪购于深圳雷杜生命科学股份有限公司。
1.2 细胞培养和照射用含10%胎牛血清的D-MEM培养液于含5% CO2的 37℃恒温培养箱中培养人类宫颈癌ME-180细胞,待细胞铺满培养皿约80%后进行传代亚培养。选择处于对数生长期的肿瘤细胞进行实验。采用137Cs γ射线照射源照射,照射剂量分别为2、4和8 Gy,剂量率为1 Gy/min。
1.3 HBXIP-siRNA及AKT过表达载体(pCMV-AKT)的细胞转染及其分组根据不同的处理方法,分别按照两种分组方式对宫颈癌ME-180细胞进行分组:(1)分为4组:空白对照组、4 Gy γ射线照射组、HBXIP-siRNA转染组以及HBXIP-siRNA+γ射线照射联合组;(2)分为3组:空白对照组(不作任何处理)、HBXIP-siRNA单独处理组(将HBXIP-siRNA单独转染至ME-180细胞中)、HBXIP-siRNA和AKT共转染组(将HBXIP-siRNA和AKT过表达载体(pCMV-AKT)共转染到宫颈癌ME-180细胞中)。转染前1 d,将1.2×106个细胞接种于六孔板中,每孔加入约2 mL无抗生素培养基,使转染时的细胞密度能够达到六孔板面积的50%;取2 μL /孔 Lipofectamine 3000 与50 μL Opti-MEM 混匀后室温下孵育 5 min;取2 μL /孔siRNA或0.5 μg/孔AKT过表达载体与50 μL Opti-MEM(减血清培养基)混匀后室温孵育5 min;将以上2步所得溶液混匀,室温放置30 min,即转染液。将转染液加入含有细胞及培养液的孔中,轻轻摇晃孔板混和;在37℃的CO2培养箱中培养6 h后将培养基换成含血清的完全培养基。
1.4 MTT法检测细胞增殖取对数生长期宫颈癌ME-180细胞,调整细胞浓度为1.0×104个/mL,接种于96孔培养板中,HBXIP-siRNA转染或(和)γ射线照射处理后48 h,弃去培养基,每孔加入20 μL MTT,继续培养4 h;加120 μL二甲基亚砜并振摇10 min。采用酶标仪检测细胞在490 nm波长下的光密度值,以A490代表细胞活力。以未作任何处理的细胞作为对照组,其细胞存活率为100%,其余各实验组(4 Gy γ射线照射组、HBXIP-siRNA转染组以及HBXIP-siRNA+γ射线照射联合组)按存活率=(各组吸光值/对照组吸光值) × 100%与之比较。
1.5 克隆形成实验宫颈癌ME-180细胞接受瞬时转染及不同剂量(0、2、4、8 Gy)照射后,接种2000个细胞到60 mm培养皿中。细胞连续培养3周后用甲醇固定,加姬姆萨应用液染色30 min,流水洗净,计数细胞数≥50个的克隆数。通过以下两个公式计算克隆形成率(plating efficiency,PE)和存活分数:
PE=(形成克隆数/种植细胞数)×100%
存活分数=克隆数/(实验组细胞数×PE)
按多靶单击模型拟合绘制细胞存活曲线,并计算D0值(一次辐照能杀灭63%的细胞的剂量)、准阈剂量Dq值。放射增敏比=对照组D0/实验组D0。
1.6 Western blotting收集瞬时转染并接受γ射线照射后的细胞,用细胞裂解液冰上裂解,提取总蛋白,采用 BCA 蛋白检测法进行蛋白定量。取各组等量蛋白十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,恒流180 mA湿转90 min至PVDF膜,用含 5% 脱脂奶粉的 TBST 缓冲液室温封闭 1 h后,分别加入小鼠抗人HBXIP蛋白抗体(1 ∶ 5000稀释)、兔抗人Bcl-2和Bid抗体(1 ∶ 2000稀释)、兔抗人AKT抗体(1 ∶ 1000稀释)、鼠抗人pAKT (S473)抗体(1 ∶ 1000稀释)和小鼠抗人GAPDH(1 ∶ 6000稀释)作为内参抗体,4℃ 孵育过夜。次日用TBST缓冲液 洗涤3次,并在摇床上振摇,每次10 min,加入辣根酶标记山羊抗小鼠 IgG[H+L(1 ∶ 5000 稀释)],室温孵育1 h;TBST 洗涤3次,每次10 min。用化学发光法显色,凝胶成像系统采集成像。
1.7 实时定量聚合酶链反应(qRT-PCR)检测Bcl-2和Bid mRNA表达收集细胞,采用TRIzol法提取细胞总RNA,采用反转录试剂盒反转录 mRNA生成cDNA,用PCR扩增试剂盒检测Bcl-2和Bid mRNA的表达,同时以GAPDH mRNA的表达作为内参。扩增条件: 95℃预变性30 s,95℃变性3 s,60℃退火30 s,72℃ 延伸30 s,循环 40次,数据采用2-ΔΔCt 法进行分析。
GAPDH引物序列:
正向5’-GGAGCGAGATCCCTCCAAAAT-3’
反向 5’-GGCTGTTGTCATACTTCTCATGG-3’
Bcl-2引物序列:
正向 5’-TGGTCCACCTGACCCTC-3’
反向 5’-CCCACCGAACTCAAAGAA-3’
Bid引物序列:
正向5’-AACGGTTCCAGCCTCAG-3’
反向 5’-GCCTCTATTCTTCCCAAGC-3’
1.8 统计学分析应用IBM SPSS Statistics 21软件进行统计学分析。原始数据均服从正态分布和方差齐性,采用t 检验比较组间差异,分析方法为Student t-test。P<0.05表示差异有统计学意义。
2 结果 2.1 HBXIP-siRNA可提高宫颈癌ME-180细胞的放射敏感性MTT实验结果显示(图 1中A),与空白对照组相比,虽然单独的γ射线(4 Gy)或HBXIP-siRNA转染都抑制了宫颈癌ME-180细胞的生长,但差异无统计学意义(24 h、48 h、72 h)(t=2.45、2.88、2.91,均P> 0.05;t=2.52、2.66、2.98,均P>0.05)。与4 Gy γ射线照射组相比,HBXIP-siRNA+γ射线照射联合组可以明显抑制细胞生长,且生长程度的差异有统计学意义(24 h、48 h、72 h)(t=9.83、10.28、11.63,均P<0.01);采用克隆形成实验得到了类似的结果(t=5.36、4.98,均P<0.05;t=12.17,P<0.01)(图 1中B)。这些实验结果表明,通过HBXIP-siRNA转染降低HBXIP表达能有效提高宫颈癌ME-180细胞对γ射线的放射敏感性。

|
图 1 MTT 实验(A)和克隆形成实验(B)检测 γ 射线(4 Gy)和(或)HBXIP-siRNA 对宫颈癌 ME-180 细胞生长的影响 图中,A:与 4 Gyγ 射线照射组相比,HBXIP-siRNA+γ 射线照射联合组可以明显抑制细胞生长,且生长程度的差异有统计学意义(24 h、48 h、72 h),** :t=9.83、10.28、11.63,均 P<0.01;B:与 4 Gyγ 射线照射组相比,HBXIP-siRNA+γ 射线照射联合组可以明显抑制细胞生长,且生长程度的差异有统计学意义(24 h、48 h),* :t=9.83 和 10.28,均 P<0.05;**:t= 12.17,P<0.01。HBXIP:乙肝病毒 X 蛋白结合蛋白。 Figure 1 Effects of 4 Gy γ ray and (or) HBXIP-siRNA on growth of cervical cancer ME-180 cells was detected by MTT (A) and clonogenic (B) assays. |
与空白对照组比较,4 Gy γ射线照射组对Bcl-2和Bid mRNA表达无显著影响,差异无统计意义(t=1.28、1.77,均P>0.05);HBXIP-siRNA转染组的细胞出现了一定程度的Bcl-2 mRNA表达降低和Bid mRNA表达增加,差异均有统计学意义(t=4.97、5.62,均P<0.05);HBXIP-siRNA+γ射线照射联合组中,Bcl-2 mRNA的表达水平出现了明显降低,而Bid mRNA的表达水平出现了明显增加,两者之间表达量的差异有统计学意义(t=10.88、9.31,均P<0.01)(图 2中A)。同时,这一结果也在蛋白表达水平上得到了验证(图 2中B)。这些实验结果表明,HBXIP-siRNA联合γ射线照射可明显改变宫颈癌ME-180细胞中凋亡基因的表达水平。
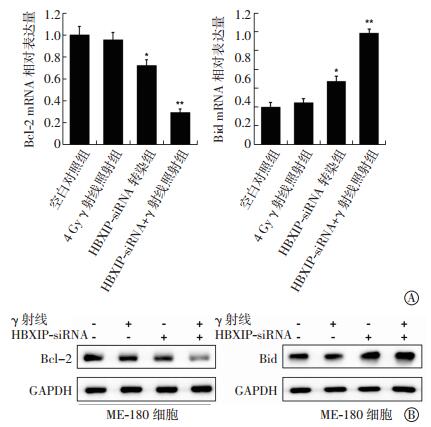
|
图 2 HBXIP-siRNA 和 γ 射线照射对宫颈癌 ME-180 细胞中 Bcl-2 和 BidmRNA 表达水平(A)以及蛋白表达水平(B)的影响 图中,与空白对照组比较,HBXIP-siRNA 转染组的细胞出现了一定程度的 Bcl-2 mRNA 表达降低和 Bid mRNA 表达增加,*:t=4.97、5.62,均 P<0.05;与空白对照组比较,HBXIP-siRNA+γ 射线照射联合组中,Bcl-2 mRNA 的表达水平出现了明显降低,而 Bid mRNA 的表达水平出现了明显增加,同时两者之间表达量的差异有统计学意义,**:t=10.88、9.31,均 P<0.01。HBXIP:乙肝病毒 X 蛋白结合蛋白。 Figure 2 Effects of HBXIP-siRNA and radiation on expression of Bcl-2 and Bid mRNA (A) and protein (B) in cervical cancer ME-180 cells. |
与空白对照组细胞相比,4 Gy或8 Gy γ射线照射可上调宫颈癌ME-180细胞中HBXIP的蛋白表达水平以及蛋白激酶AKT的磷酸化水平,并显示出一定的剂量依赖改变,但对总AKT蛋白的表达水平没有显著影响(图 3中A)。而降低HBXIP表达则有效地阻断了γ射线对HBXIP表达和AKT磷酸化水平的上调作用(图 3中B)。这些实验结果表明,γ射线照射能够通过上调HBXIP的表达水平进而增强AKT的磷酸化水平。
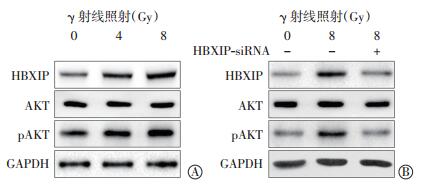
|
图 3 γ 射线照射对宫颈癌 ME-180 细胞中 HBXIP 与磷酸化AKT 的蛋白水平的影响 图中,HBXIP:乙肝病毒 X 蛋白结合蛋白;A:γ 射线照射提高了 HBXIP 蛋白表达和 AKT 蛋白的磷酸化;B:γ 射线照射抑制了 HBXIP siRNA 对蛋白的 HBXIP 表达和 AKT 蛋白的磷酸化。 Figure 3 Effects of γ ray on expression of HBXIP and pAKT protein in cervical cancer ME-180 cells |
如图 4所示,与单独照射组细胞相比,HBXIP-siRNA转染明显提高了细胞的放射敏感性,差异有统计学意义(t=11.24,P<0.01);而共转染了HBXIP-siRNA和pCMV-AKT的细胞则出现明显放射敏感性下降,差异有统计学意义(t=8.96,P<0.01),这表明HBXIP-siRNA可以通过抑制AKT蛋白信号通路进而增强宫颈癌ME-180细胞的放射敏感性。
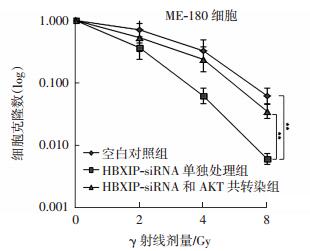
|
图 4 HBXIP siRNA 和 pCMV-AKT 共转染对 ME-180 细胞放射敏感性的影响 图中,与单独照射组细胞相比,HBXIPsiRNA 转染明显提高了细胞的放射敏感性,而共转染了HBXIP-siRNA 和 pCMV-AKT 的细胞则出现明显放射敏感性下降,**:t=11.24、8.96,均 P<0.01。HBXIP:乙肝病毒 X 蛋白结合蛋白。 Figure 4 Effects of HBXIP siRNA 和 pCMV-AKT co-transfection on radiosenstivity of cervical cancer ME-180 cells. |
放疗是治疗宫颈癌常用的手段。然而在放疗过程中,宫颈癌放疗敏感性会受到人体形态、肿瘤大小、分化程度、病理类型等因素的影响,严重减弱了放疗的效果[16-20]。因此,寻找宫颈癌耐辐射产生的机制,靶向地提高宫颈癌细胞的放射敏感性,从而提升患者放疗疗效,一直是宫颈癌放疗临床和基础研究的热点。
HBXIP是一种细胞组成型表达蛋白,是通过酵母双杂交技术筛选出的乙肝病毒蛋白HBx的一种作用因子[9]。对HBXIP二级结构的预测分析显示,其存在一个潜在的亮氨酸拉链模序,进一步研究结果表明HBXIP 的蛋白残基Thr36以及连接两个单体的亮氨酸拉链模序上的残基Leu48、Leu55 和Ile62,都参与了与HBx 蛋白的相互作用,从而改变了乙肝病毒(hepatitis B virus)的复制周期[21]。近来研究结果表明,HBXIP蛋白在多种癌症的发生发展中都发挥着重要的作用[10]。
在本研究中,我们探究了采用HBXIP-siRNA转染人为降低HBXIP蛋白表达对宫颈癌ME-180细胞放射敏感性的影响,结果发现HBXIP-siRNA确实可以明显提高ME-180细胞的放射敏感性,而且放射敏感性的提高伴随着细胞凋亡蛋白Bcl-2的表达明显降低,促凋亡蛋白Bid的表达明显升高,这些实验结果揭示了HBXIP-siRNA的增敏作用可能与其调节细胞的凋亡通路相关蛋白有关。
蛋白激酶AKT在肿瘤的发生、发展以及存活过程中占有重要位置[22]。活化的AKT具有多种生物学功能,可通过催化一系列蛋白质磷酸化促进肿瘤细胞的生长、增殖,抑制凋亡,促进侵袭和转移,调控内皮生长、血管生成等[23-25]。目前也有研究结果表明它还参与了肿瘤的辐射抵抗和化疗耐药机制,特别是AKT信号通路所介导的DNA损伤修复在辐射抵抗中起关键作用[26-27]。HBXIP作为转录辅激活子,可以通过激活蛋白激酶AKT及其信号通路进而促进肿瘤生长[28]。本研究结果显示,γ射线照射可以增加HBXIP蛋白的表达水平,同时也上调了细胞蛋白激酶AKT的磷酸化水平,但是HBXIP-siRNA明显抑制了辐照导致的AKT的磷酸化,这一结果提示γ射线照射是通过上调HBXIP的表达水平进而增强AKT磷酸化水平的,即辐照→HBXIP↑→AKT磷酸化↑→敏感性↓。同时揭示HBXIP-siRNA所介导的放射增敏性的提高是通过影响AKT磷酸化水平进而调控AKT信号通路来完成的。这一结论也在HBXIP-siRNA和pCMV-AKT共转染细胞的生存实验中得以验证,即抑制AKT的磷酸化水平可以进一步增强HBXIP-siRNA的放射增敏效应。
总之,我们发现人为地降低HBXIP的蛋白表达水平能够提高宫颈癌细胞系ME-180的放射敏感性,而这种作用是通过抑制AKT的磷酸化水平及其信号通路来完成的。因此,深入研究HBXIP蛋白作为宫颈癌放疗敏感性调控的新靶点具有非常重要的临床意义和价值。本研究为宫颈癌的放疗增敏提供了新的实验依据和治疗靶点,也为临床宫颈癌放疗疗效的提高奠定了基础。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突
作者贡献声明 姜勉负责相关实验操作、收集数据、撰写论文;董佳丽负责提供实验方法并协助进行实验操作;李航负责设计实验方案、技术指导、论文修订等;樊赛军负责实验指导、论文审阅等。
| [1] | Ghib Para CG, Sferdian MF, Daȿcǎu V, et al. Clinical and morphological considerations in one case with cervical cancer and right ureterohydronephrosis[J]. Rom J Morphol Embryol, 2016, 57(3): 1155–1158. |
| [2] | Baker S, Dahele M, Lagerwaard FJ, et al. A critical review of recent developments in radiotherapy for non-small cell lung cancer[J]. Radiat Onco, 2016, 11(1): 115. DOI:10.1186/s13014-016-0693-8 |
| [3] | Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115–132. DOI:10.3322/caac.21338 |
| [4] | Larson H. The world must accept that the HPV vaccine is safe[J]. Nature, 2015, 528(7580): 9. DOI:10.1038/528009a |
| [5] | Adey A, Burton JN, Kitzman JO, et al. The haplotype-resolved genome and epigenome of the aneuploid HeLa cancer cell line[J]. Nature, 2013, 500(7461): 207–211. DOI:10.1038/nature12064 |
| [6] | Wardak S. Human Papillomavirus (HPV) and cervical cancer[J]. Med Dosw Mikrobiol, 2016, 68(1): 73–84. |
| [7] | da Silva RM, Pinezi JC, Macedo LE, et al. Current situation of high-dose-rate brachytherapy for cervical cancer in Brazil[J]. Radiol Bras, 2014, 47(3): 159–164. DOI:10.1590/0100-3984.2013.1859 |
| [8] | Vargo JA, Beriwal S. Image-based brachytherapy for cervical cancer[J]. World J Clin Oncol, 2014, 5(5): 921–930. DOI:10.5306/wjco.v5.i5.921 |
| [9] | Melegari M, Scaglioni PP, Wands JR. Cloning and characterization of a novel hepatitis B virus x binding protein that inhibits viral replication[J]. J Virol, 1998, 72(3): 1737–1743. |
| [10] | Zhao Y, Li H, Zhang Y, et al. Oncoprotein HBXIP modulates abnormal lipid metabolism and growth of breast cancer cells by activating the LXRs/SREBP-1c/FAS signaling cascade[J]. Cancer Res, 2016, 76(16): 4696–4707. DOI:10.1158/0008-5472.CAN-15-1734 |
| [11] | Li L, Fang R, Liu B, et al. Deacetylation of tumor-suppressor MST1 in Hippo pathway induces its degradation through HBXIP-elevated HDAC6 in promotion of breast cancer growth[J]. Oncogene, 2016, 35(31): 4048–4057. DOI:10.1038/onc.2015.476 |
| [12] | Wang Y, Fang R, Cui M, et al. The oncoprotein HBXIP up-regulates YAP through activation of transcription factor c-Myb to promote growth of liver cancer[J]. Cancer Lett, 2017, 385: 234–242. DOI:10.1016/j.canlet.2016.10.018 |
| [13] | Li N, Wang Y, Che S, et al. HBXIP over expression as an Independent biomarker for cervical cancer[J]. Exp Mol Pathol, 2017, 102(1): 133–137. DOI:10.1016/j.yexmp.2017.01.009 |
| [14] | Li Y, Wang Z, Shi H, et al. HBXIP and LSD1 scaffolded by lncRNA hotair mediate transcriptional activation by c-Myc[J]. Cancer Res, 2016, 76(2): 293–304. DOI:10.1158/0008-5472.CAN-14-3607 |
| [15] | Li H, Liu Q, Wang Z, et al. The oncoprotein HBXIP modulates the feedback loop of MDM2/p53 to enhance the growth of breast cancer[J]. J Biol Chem, 2015, 290(37): 22649–22661. DOI:10.1074/jbc.M115.658468 |
| [16] | Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7–30. DOI:10.3322/caac.21332 |
| [17] | Torre LA, Sauer AM, Chen MS, et al. Cancer statistics for Asian Americans, Native Hawaiians, and Pacific Islanders, 2016:Converging incidence in males and females[J]. CA Cancer J Clin, 2016, 66(3): 182–202. DOI:10.3322/caac.21335 |
| [18] | Desantis CE, Siegel RL, Sauer AG, et al. Cancer statistics for African Americans, 2016:Progress and opportunities in reducing racial disparities[J]. CA Cancer J Clin, 2016, 66(4): 290–308. DOI:10.3322/caac.21340 |
| [19] | Fu ZC, Wang FM, Cai JM. Gene expression changes in residual advanced cervical cancer after radiotherapy:indicators of poor prognosis and radioresistance[J]. Med Sci Monit, 2015, 21: 1276–1287. DOI:10.12659/MSM.893689 |
| [20] | Zhao Y, Moran MS, Yang Q, et al. Metadherin regulates radioresistance in cervical cancer cells[J]. Oncol Rep, 2012, 27(5): 1520–1526. DOI:10.3892/or.2012.1692 |
| [21] | Garcia-Saez I, Lacroix FB, Blot D, et al. Structural characterization of HBXIP:the protein that interacts with the anti-apoptotic protein survivin and the oncogenic viral protein HBx[J]. J Mol Biol, 2011, 405(2): 331–340. DOI:10.1016/j.jmb.2010.10.046 |
| [22] | Du G, Cao D, Meng L. miR-21 inhibitor suppresses cell proliferation and colony formation through regulating the PTEN/AKT pathway and improves paclitaxel sensitivity in cervical cancer cells[J]. Mol Med Rep, 2017, 15(5): 2713–2719. DOI:10.3892/mmr.2017.6340 |
| [23] | Zhang E, Shi H, Yang L, et al. Ginsenoside Rd regulates the Akt/mTOR/p70S6K signaling cascade and suppresses angiogenesis and breast tumor growth[J]. Oncol Rep, 2017, 38(1): 359–367. DOI:10.3892/or.2017.5652 |
| [24] | Wu J, Hu G, Dong Y, et al. Matrine induces Akt/mTOR signalling inhibition-mediated autophagy and apoptosis in acute myeloid leukaemia cells[J]. J Cell Mol Med, 2017, 21(6): 1171–1181. DOI:10.1111/jcmm.13049 |
| [25] | Tan Y, Huang N, Zhang X, et al. KIAA0247 suppresses the prolif-eration, angiogenesis and promote apoptosis of human glioma through inactivation of the AKT and Stat3 signaling pathway[J]. Oncotarget, 2016, 7(52): 87100–87113. DOI:10.18632/oncotarget.13527 |
| [26] | Song L, Liu S, Zhang L, et al. MiR-21 modulates radiosensitivity of cervical cancer through inhibiting autophagy via the PTEN/Akt/HIF-1α feedback loop and the Akt-mTOR signaling pathway[J]. Tumour Biol, 2016, 37(9): 12161–12168. DOI:10.1007/s13277-016-5073-3 |
| [27] | Shimura T. Targeting the AKT/cyclin D1 pathway to overcome intrinsic and acquired radioresistance of tumors for effective radiotherapy[J]. Int J Radiat Biol, 2017, 93(4): 381–385. DOI:10.1080/09553002.2016.1257832 |
| [28] | Liu S, Li L, Zhang Y, et al. The oncoprotein HBXIP uses two pathways to up-regulate S100A4 in promotion of growth and migration of breast cancer cells[J]. J Biol Chem, 2012, 287(36): 30228–30239. DOI:10.1074/jbc.M112.343947 |
 2017, Vol. 41
2017, Vol. 41


