131I-radiotracers(131I-PAMAM(G5.0)-SR and 131I-PAMAM(G5.0)) was determined in a blocking uptake study where TT tumor cells were used. The median lethal dose of the two probes was then calculated. GraphPad Prism 5.01 analysis software was used to conduct a t-test for the data that fit the normal distribution and homogeneity of variance. Results The labeling yields of the two types of 131I radiotracers all exceeded 70%, and the radiochemical purity levels were higher than 90% after purification. The stability of the two probes in the PBS system was satisfactory, and both probes showed excellent water solubility. The results of the blocking uptake study on the TT cells showed that the cell uptake rate decreased significantly (t=7.315, 22.590, 22.570, all P < 0.01) after the PAMAM (G5.0)-SR blocked the 131I-PAMAM (G5.0)-SR. This result indicated that 131I-PAMAM (G5.0)-SR achieved excellent targeting and that its median lethal dose was only 513.6 kBq/mL. The cell uptake results showed that the cell uptake rate of 131I-PAMAM (G5.0)-SR with a median lethal dose gradually decreased with time. However, cell uptake rate increased for 48 h before it decreased again. Conclusion 131I-PAMAM (G5.0)-SR can target medullary thyroid carcinoma cells and thus inhibit cell proliferation.
甲状腺髓样癌细胞(medullary thyroid carcinoma cell,MTC)来源于不表达钠碘共同转运体的甲状腺滤泡旁细胞(又称C细胞),不能直接摄取131I并对其产生相应的生物学效应[1]。有报道指出MTC在病程中易向肺、骨等远处器官转移,因此手术也难以将MTC肿瘤组织彻底切除[2]。聚酰胺-胺 (polyamidoamine,PAMAM)是纳米分子树枝状聚合物中应用最广泛的一种,它具有稳定、无免疫原性、五代以下使用剂量无毒性的优点,其因分散性低、通透性高、分子表面具有大量官能团而易于修饰的特点,已应用于包括药物、DNA、siRNA的递送以及MRI探针的研究等领域。同时PAMAM容易有效地通过细胞小窝蛋白内吞而被摄入,且随着浓度的升高,PAMAM还可进入细胞器和细胞核[3-4]。MTC表面能表达丝氨酸-精氨酸-谷氨酸-丝氨酸-脯氨酸-组氨酸-脯氨酸(Ser-Arg-Glu-Ser-Pro-His-Pro,SRESPHP)(简称SR)特异性受体,且有学者发现多肽SR作为靶向肽连接在腺病毒上可以特定靶向和杀伤MTC细胞[5]。因此,我们对第五代聚酰胺-胺(PAMAM(G5.0))表面进行修饰使其便于连接靶向肽SR,并用131I标记形成靶向和诊治MTC的新型探针,现报道如下。
1 材料与方法 1.1 主要材料Na131I购自成都中核高通同位素股份有限公司,靶向肽SR修饰的树枝状聚合物PAMAM (G5.0)-SR由项目合作方美国堪萨斯州立大学合成并提供;胎牛血清、F12培养基以及胰酶为美国Gibco公司产品;C18固相萃取柱为美国安捷伦公司产品(来源于江苏省原子医学研究所);24孔细胞培养板为美国Clone公司产品;PBS和Cell Counting Kit-8(简称CCK-8)来自上海碧云天生物技术有限公司;新华1号层析纸为杭州新华纸业公司产品;人MTC细胞株(TT细胞株)购自广州吉妮欧生物科技有限公司;氯胺T为南京化学试剂股份有限公司产品;偏重亚硫酸钠为无锡市晶科化工有限公司产品;甲醇为浙江三鹰化学试剂有限公司产品;正辛醇为天津市福晨化学试剂厂产品。
1.2 主要仪器CRC-25R放射性核素活度计为北京华瑞森科技发展有限公司产品;1470全自动γ计数仪为美国Perkin Elmer公司产品;MINI-SCAN TLC薄层放射性扫描仪为美国BIOSCAN公司产品;Bio-TekELX800酶标仪为美国BioTek公司产品;DT5-1B台式离心机为北京时代北利离心机有限公司产品。
1.3 131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的制备于含有100 μL(质量浓度为1 mg/mL)的PAMAM- (G5.0)-SR和PAMAM(G5.0)的离心管中分别加入约37 MBq的Na131I和50 μL(质量浓度为1 mg/mL)氯胺T,充分混匀后室温下反应10 min,反应结束后加入50 μL(质量浓度为30 mg/mL)偏重亚硫酸钠终止反应。将上述混合物分别用C18萃取柱过滤杂质,最后获得标记探针131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)。
1.4 131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的标记率和放化纯度的测定131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的标记率及放化纯度测定采用薄层层析(thin layer chromatography,TLC)法,用毛细管取原液点样于新华1号层析纸上,于甲醇 ∶ 生理盐水体积比为8.5 ∶ 1.5的展开剂中上行展开,空气中自然晾干。用薄层放射性扫描仪进行扫描,计算两种探针的标记率和放化纯度。
1.5 131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的体外稳定性测定取131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)约1.85 MBq分别置于200 μL PBS(pH=7.2、0.01 mol/L)中,混匀,室温下孵育0、1、2、24 h后采用TLC法检测并观察其体外稳定性。
1.6 脂水分配系数的测定取100 μL 131I-PAMAM(G5.0)-SR和131I-PAMAM (G5.0)分别加入含有1 mL正辛醇和1 mL PBS(pH=7.2、0.01 mol/L)的10 mL离心管中,盖上盖子充分震荡混匀,4000 r/min离心5 min(离心半径为8 cm)。取等体积有机相和水相测量放射性计数,计算标记物的脂水分配系数P(常用logP表示)。
1.7 TT细胞的毒性实验将TT细胞以1 × 104个/孔接种于96孔板,贴壁24 h后,实验组加入不同质量浓度(200、400、600、800、1000 μg /mL)的PAMAM(G5.0)-SR和 PAMAM (G5.0),另设加入生理盐水的为对照组,培养24 h后,用CCK-8检测各组OD450值,计算细胞抑制率。细胞抑制率(%) = (OD实验组 - OD对照组)/OD对照组 × 100%。
1.8 TT细胞的剂量效应实验将TT细胞以1×104个/孔接种于96孔板,贴壁24 h后,实验组加入不同放射性活度(37、74、148、296、444 kBq/mL)的131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0),另设加入生理盐水的为对照组,培养24 h后,用CCK-8检测各组OD450值,计算细胞抑制率。细胞抑制率(%)=(OD实验组-OD对照组)/OD对照组×100%。
1.9 阻断实验将TT细胞以1×105个/孔接种于24孔板,贴壁24 h后,实验组加入20 μL质量浓度为0.1 μg/μL的PAMAM(G5.0)-SR处理细胞1 h,弃去原培养液,再加入37 kBq/mL的131I-PAMAM(G5.0)-SR继续培养30 min、1 h、2 h,冷PBS冲洗3遍细胞,100 μL(0.01 mol/L)NaOH裂解细胞,并用γ计数仪测量放射性计数。对照组分别为同浓度131I-PAMAM(G5.0)-SR组(未阻断)以及同浓度PAMAM-(G5.0)阻断的 131I-PAMAM(G5.0)-SR组。细胞摄取率(%)=细胞放射性计数/(细胞放射性计数+上清培养液放射性计数)×100%。
1.10 TT细胞对半数致死剂量的131I标记物的摄取实验将TT细胞以1×105个/孔接种于24孔板,贴壁24 h后,实验组用半数致死剂量的131I-PAMAM (G5.0)-SR 孵育6、12、24、48、72 h,另设加入131I-PAMAM(G5.0)和Na131I的为对照组,冷PBS冲洗3遍细胞,100 μL(0.01 mol/L)NaOH裂解细胞,并用γ计数仪测量放射性计数。细胞摄取率(%)=细胞放射性计数/(细胞放射性计数+上清培养液放射性计数)×100%。
1.11 TT细胞杀伤实验将TT细胞以1×105个/孔接种于96孔板,贴壁24 h后,实验组用半数致死剂量的131I-PAMAM(G5.0)-SR作用细胞6、12、24、48、72 h,另设加入131I-PAMAM(G5.0)和Na131I的为对照组,加入生理盐水的为空白组,用CCK-8检测各组OD450值,计算各组的细胞存活率。细胞存活率(%)=OD实验组/OD空白组×100%。
1.12 统计学方法使用GraphPad Prism 5.01软件对实验数据进行分析,所有实验均重复3次,所得数据均以均数±标准差(x±s)表示。采用Kolmogorov-Smirnov法检验数据是否符合正态分布(若P>0.1为符合正态分布标准),用参数检验数据是否符合方差齐性(若P>0.1为符合方差齐性),对符合正态性分布及方差齐性的数据采用t检验进行分析,P<0.05为差异有统计学意义。
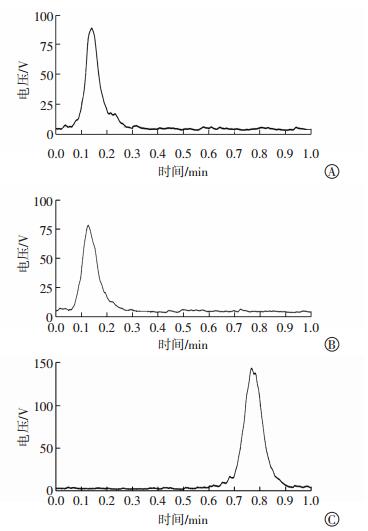
2 结果 2.1 探针的一般特性131I-PAMAM(G5.0)-SR的标记率为73.21%,131I-PAMAM(G5.0)的标记率为77.48%,纯化后的产物经TLC法检测放化纯度,结果显示标记物集中在原点(图 1中A、B),而游离的Na131I随溶剂迁移到层析纸前沿(图 1中C),TLC法检测131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的放化纯度分别是94.4%和93.3%。
|
图 1 纯化后的标记物及Na131I的薄层层析图 图中,A:131I- PAMAM(G5.0)-SR的薄层层析图;B:131I-PAMAM(G5.0)的薄层层析图;C:Na131I的薄层层析图;PAMAM(G5.0):第五代聚酰胺-胺;SR:丝氨酸-精氨酸-谷氨酸-丝氨酸-脯氨酸-组氨酸-脯氨酸(SRESPHP)的简称。 Figure 1 TLC diagrams of purified tracers from 131I-radiotracers and free Na131I |
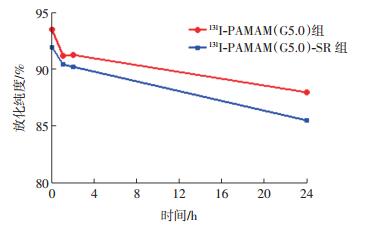
探针131I-PAMAM(G5.0)-SR和131I-PAMAM (G5.0)在PBS中放置24 h后的放化纯度均在85%以上(图 2)。
|
图 2 131I-PAMAM(G5.0)-SR 和 131I-PAMAM(G5.0)在 PBS 中的稳定性 图中,PAMAM(G5.0):第五代聚酰胺-胺;SR:丝 氨酸 -精氨酸 -谷氨酸 -丝氨酸 -脯氨酸 -组氨酸 -脯氨酸(SRESPHP)的简称。 Figure 2 Stability of 131I-PAMAM(G5.0)-SR and 131I-PAMAM(G5.0) in PBS |
131I-PAMAM(G5.0)-SR的脂水分配系数P为0.085,logP为-1.07;131I-PAMAM(G5.0)的脂水分配系数P为0.046,logP为-1.34,说明131I标记物表现出良好的水溶性。
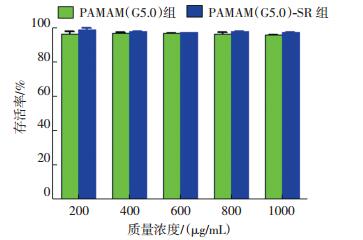
2.4 TT细胞的毒性实验结果在不同质量浓度的实验前体PAMAM(G5.0)-SR和PAMAM(G5.0)作用下,细胞存活率均大于95%,说明上述两种实验前体对细胞的毒性较小(图 3)。
|
图 3 不同质量浓度的 PAMAM(G5.0)和 PAMAM(G5.0)-SR对甲状腺髓样癌 TT 细胞的毒性影响 图中,PAMAM(G5.0):第五代聚酰胺-胺;SR:丝氨酸-精氨酸-谷氨酸-丝氨酸-脯氨酸-组氨酸-脯氨酸(SRESPHP)的简称。 Figure 3 Cytotoxicity of different concentrations of PAMAM(G5.0)- SR and PAMAM(G5.0)on TT cells |
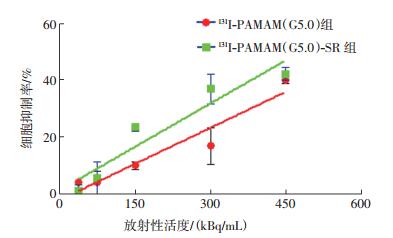
通过GraphPad Prism 5.01软件计算得出,加入不同放射性活度的131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)作用细胞24 h后,当131I-PAMAM- (G5.0)-SR 的放射性活度为513.6 kBq/mL时,可导致细胞生长抑制率达50%;当131I-PAMAM(G5.0)的放射性活度为596.8 kBq/mL时,可导致细胞生长抑制率达50%(图 4)。
|
图 4 不同放射性活度的 131I - PAMAM(G5 . 0)- SR 和 131I - PAMAM(G5.0)探针对甲状腺髓样癌 TT 细胞的抑制作用 图中,PAMAM(G5.0):第五代聚酰胺-胺;SR:丝氨酸-精氨酸-谷氨酸-丝氨酸-脯氨酸-组氨酸-脯氨酸(SRESPHP)的简称。 Figure 4 Inhibition of TT cells by different radioactivity levels of 131I-PAMAM(G5.0)-SR and 131I-PAMAM(G5.0) |
随着时间的推移,PAMAM(G5.0)-SR阻断组的摄取率逐渐降低,2 h时的摄取率达最低,为5.83%;而131I-PAMAM(G5.0)-SR组及PAMAM (G5.0)阻断组的摄取率则随时间的推移保持在7%以上(图 5)。结果显示,PAMAM(G5.0)-SR阻断组的131I-PAMAM(G5.0)-SR细胞摄取率与131I-PAMAM(G5.0)-SR组相比明显降低,差异均有统计学意义(t=7.315、22.590和22.570,均P<0.01),而PAMAM(G5.0)阻断组的131I-PAMAM(G5.0)-SR细胞摄取率与131I-PAMAM (G5.0)-SR组相比无明显降低(t=0.937、4.304和1.115,P分别为>0.05、<0.05和>0.05)。
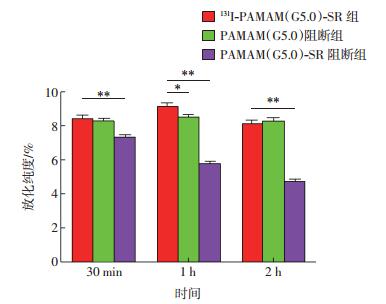
|
图 5 PAMAM(G5.0)-SR 和 PAMAM(G5.0)对细胞摄取 131I-PAMAM(G5.0)-SR 的阻断作用 图中,PAMAM(G5.0):第五代聚酰胺-胺;SR:丝氨酸-精氨酸-谷氨酸-丝氨酸-脯氨酸-组氨酸-脯氨酸(SRESPHP)的简称;与 131I-PAMAM(G5.0)-SR 组比较,差异有统计学意义,*:t=4.304,P<0.05;**:t= 7.315、22.590 和 22.570,均 P<0.01。 Figure 5 Effects of blocking the uptake of 131I-PAMAM(G5.0)-SR by PAMAM(G5.0)-SR or PAMAM(G5.0)on cells |
6~48 h时TT细胞对131I-PAMAM(G5.0)的摄取高于131I-PAMAM(G5.0)-SR,说明131I-PAMAM(G5.0)-SR对TT细胞的影响较大,易导致细胞死亡,但随着时间的推移,TT细胞对131I标记物的摄取均降低,48 h时,TT细胞对131I标记物的摄取均出现上升的现象(表 1)。
| 表1 甲状腺髓样癌 TT 细胞对半数致死剂量131I 标记物的摄取(x±s) Table 1 Uptake of the median lethal dose of 131I tracers in medullary thyroid carcinoma TT cells(x±s) |
在半数致死剂量下,随着时间的延长,Na131I组的TT细胞存活率差异不大,但131I-PAMAM (G5.0)-SR组及131I-PAMAM (G5.0)组的TT细胞存活率随时间的延长而逐渐下降,说明只加入Na131I对TT细胞生长影响不大,但131I-PAMAM(G5.0)-SR及131I-PAMAM(G5.0)对TT细胞的生长存在不同程度的抑制作用(表 2)。
| 表2 半数致死剂量的探针处理甲状腺髓样癌 TT 细胞不同时间对细胞生存的影响(x±s)半数致死剂量的探针处理甲状腺髓样癌 TT 细胞不同时间对细胞生存的影响(x±s) Table 2 Effect on half lethal dose of probes on medullary thyroid carcinoma cell survival at different times after treatment(x±s) |
研究证明与前四代相比,PAMAM(G5.0)呈三维空旷的球状结构,粒径依旧较小,但其装载药量更多,应用的前景更广阔[6-7]。另一方面,PAMAM(G5.0)以正电荷形式存在,表面具有大量的氨基基团,因此更便于修饰和被细胞摄取[8]。我们的前期研究结果也表明,经过修饰的PAMAM (G5.0)装载131I能被不具有钠碘转运体的TT细胞摄取[9],本研究进一步重点考察了131I标记靶向肽SR修饰的PAMAM(G5.0)所构建的探针能否靶向TT细胞并抑制TT细胞生长。
我们首先制备并获得了标记率及放化纯度均较好且具有良好水溶特性的131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)。结果显示单纯的纳米材料PAMAM(G5.0)-SR和PAMAM(G5.0)对细胞均无显著毒性,表明对 PAMAM (G5.0)的表面氨基进行修饰可避免对细胞产生更大的细胞毒性。这一结果与Wang等[10]发现的将目的药物α-生育酚琥珀酸酯与经修饰的PAMAM(G5.0)共轭后可对溃疡性结肠炎起到有效的治疗效果但对正常细胞几乎无毒性的结果相似。另外,131I标记物对TT细胞的生长影响的研究结果提示,相同放射性活度下的131I-PAMAM (G5.0)-SR较131I-PAMAM(G5.0) 对TT细胞的辐射损伤作用更强,这与学者研究的应用SR作为靶向肽连接在腺病毒上可以特定靶向和杀伤MTC细胞的结果相似[5]。131I-PAMAM(G5.0)-SR中的靶向肽SR能够靶向TT细胞并产生相应的生物学效应,从而抑制TT细胞生长。此外,我们还观察了TT细胞对半数致死剂量的131I-PAMAM(G5.0)-SR探针的摄取情况,与对照组(131I-PAMAM(G5.0)组)比较呈现较低的摄取率,即可导致细胞死亡,进一步揭示了131I-PAMAM(G5.0)-SR能更好地靶向TT细胞并被TT细胞摄取,从而促进放射性核素治疗作用的发挥。
大部分的高分子药物包括纳米载体主要利用高通透性和滞留效应实现肿瘤的靶向作用,延长药物在体内的作用时间,降低药物毒性[11]。本研究的细胞摄取实验结果提示,131I-PAMAM(G5.0)-SR比131I-PAMAM(G5.0)对细胞的杀伤力更大,并导致细胞死亡,然而细胞对不具有靶向性的131I-PAMAM(G5.0)也有摄取,暗示肿瘤细胞对纳米材料分子确实存在高通透性和滞留效应[3-4]。同时,本实验结果还显示,给予一定剂量的131I标记物作用TT细胞后,随着时间的延长,细胞对标记物的摄取减少,但到达某一个时间点时,即在48 h时细胞对131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)的摄取升高,而随后一段时间细胞的摄取率再次下降。这一现象类似“顿抑现象”,即探针131I-PAMAM(G5.0)-SR和131I-PAMAM(G5.0)在半数致死剂量下由于TT细胞对SR的特异靶向性和PAMAM纳米分子内吞所致摄取率的差异,使得残留的不同放射性活度的131I -PAMAM(G5.0)-SR和131I-PAMAM (G5.0)出现重吸收。此现象与李承霞等[12]发现的131I标记的免疫纳米脂质体对体外胶质母细胞瘤细胞的生长作用影响过程中出现的“顿抑现象”类似。
另一方面,131I能发射0.64 MeV的β射线且最大射程为1~2 mm,同时能发射364 keV的γ射线,因此131I是肿瘤治疗与显像一体化的理想的放射性核素。探针对细胞生存的影响实验结果显示,131I-PAMAM(G5.0)-SR和131I-PAMAM (G5.0) 两种探针均可抑制TT细胞生长,表明细胞能吞噬生物大分子物质,而上述的两种纳米探针中均存在能发射β射线的131I,所以能对TT细胞造成杀伤和抑制作用。
综上所述,纳米靶向探针131I-PAMAM(G5.0)-SR具有更好的生物学性质,该探针具有SR靶向TT细胞的特性以及131I介导的在MTC的细胞水平上的治疗效果,是具有潜在临床应用价值的靶向探针。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 陈礼林负责研究方法的设计及论文的撰写;谢丽君负责论文相关实验的检测;张海波、杨洪文负责实验数据的分析;何蕊负责数据的收集及协助实验进行;冯成涛负责细胞培养;朱高红负责研究命题的提出及论文的最终版本修订。
| [1] | Faggiano A, Milone F, Ramundo V, et al. A decrease of calcitonin serum concentations less than 50 percent 30 minutes after thyroid surgery suggests incomplete C-cell tumor tissue removal[J]. J Clin Endocrinol Metab, 2010, 95(9): E32–E36. DOI:10.1210/jc.2010-0045 |
| [2] |
董薇, 陈晓红.
甲状腺髓样癌研究进展[J]. 国际耳鼻咽喉头颈外科杂志, 2013, 37(1): 42–46.
DOI:10.3760/cma.j.issn.1673-4106.2013.01.011 Dong W, Chen XH. Advances in medullary thyroid carcinoma[J]. Int J Otolaryngol Head Neck Surg, 2013, 37(1): 42–46. DOI:10.3760/cma.j.issn.1673-4106.2013.01.011 |
| [3] | Mukherjee SP, Lyng FM, Garcia A, et al. Mechanistic studies of in vitro cytotoxicity of poly(amidoamine) dendrimers in mammalian cells[J]. Toxicol Appl Pharmacol, 2010, 248(3): 259–268. DOI:10.1016/j.taap.2010.08.016 |
| [4] | Kannan S, Kolhe P, Raykova V, et al. Dynamics of cellular entry and drug delivery by dendritic polymers into human lung epithelial carcinoma cells[J]. J Biomater Sci Polym Ed, 2004, 15(3): 311–330. DOI:10.1163/156856204322977201 |
| [5] | Böckmann M, Hilken G, Schmidt A, et al. Novel SRESPHP peptide mediates specific binding to primary medullary thyroid carcinoma after systemic injection[J]. Hum Gene Ther, 2005, 16(11): 1267–1275. DOI:10.1089/hum.2005.16.1267 |
| [6] | Urbiola K, Blanco-Fernández L, Navarro G, et al. Evaluation of improved PAMAM-G5 conjugates for gene delivery targeted to the transferrin receptor[J]. Eur J Pharm Biopharm, 2015, 94: 116–122. DOI:10.1016/j.ejpb.2015.05.007 |
| [7] |
刘金剑, 刘鉴峰.
纳米材料在核医学中的应用[J]. 国际放射医学核医学杂志, 2010, 34(6): 326–329.
DOI:10.3760/cma.j.issn.1673-4114,2010.06.002 Liu JJ, Liu JF. The applications of nanomaterials in nuclear medicine[J]. Int J Radiat Med Nucl Med, 2010, 34(6): 326–329. DOI:10.3760/cma.j.issn.1673-4114,2010.06.002 |
| [8] | Zeng Y, Kurokawa Y, Win-Shwe TT, et al. Effects of PAMAM dendrimers with various surface functional groups and multiple generations on cytotoxicity and neuronal differentiation using human neural progenitor cells[J]. J Toxicol Sci, 2016, 41(3): 351–370. DOI:10.2131/jts.41.351 |
| [9] | He R, Wang HW, Su YL, et al. Incorporating 131I into a PAMAM (G5.0) dendrimer-conjugate:design of a theranostic nanosensor for medullary thyroid carcinama[J]. RSC Adv, 2017, 7: 16181–16188. DOI:10.1039/C7RA00604G |
| [10] | Wang YA, Shen WW, Shi XY, et al. Alpha-Tocopheryl SuccinateConjugated G5 PAMAM dendrimer enables effective inhibition of ulcerative colitis[J/OL]. Adv Healthc Mater, 2017, 6(14):1700276[2017-08-15]. http://onlinelibrary.wiley.com/doi/10.1002/adhm.201700276/pdf.DOI:10.1002/adhm.201700276. |
| [11] | Pourianazar NT, Mutlu P, Gunduz U. Bioapplications of poly (amidoamine) (PAMAM) dendrimers in nanomedicine[J/OL]. J Nanopart Res, 2014, 16:2342[2017-08-15]. https://www.researchgate.net/publication/266991692_bioapplications_of_polyamidoamine_pamam_dendrimers_in_nanomedicine.DOI:10.1007/s11051-014-2342-1. |
| [12] |
李承霞, 李玮, 张富海, 等.
131I标记抗表皮生长因子受体抗体靶向性纳米载体治疗胶质母细胞瘤的可行性实验研究[J]. 中华放射医学与防护杂志, 2016, 36(3): 161–167.
DOI:10.3760/cma.j.issn.0254-5098.2016.03.001 Li CX, Li W, Zhang FH, et al. Targeting therapeutic effect of radioiodine-labeled anti-EGFR binding nanoparticles on glioblastoma cells[J]. Chin J Radiol Med Prot, 2016, 36(3): 161–167. DOI:10.3760/cma.j.issn.0254-5098.2016.03.001 |
 2017, Vol. 41
2017, Vol. 41


