2. 529070, 中山大学附属江门医院核医学科
2. Department of Nuclear Medicine, the Afffiliated Jiangmen Hospital of Sun Yat-sen University, Jiangmen 529070, China
在1920年最早由Krukenberg提出主动脉壁间血肿(aortic intramural hematoma,AIH),AIH定义为主动脉壁间发生的血肿,没有游离内膜片,无明显内膜撕裂或血流交通[1]。急性期主动脉壁间血肿(acute aortic intramural hematoma,AAIH)是指2周内发病并确诊的AIH。笔者回顾性分析AAIH的多层螺旋CT血管造影(multiple slice computed tomography angiography,MSCTA)影像学特征,探讨MSCTA的应用价值,为临床个性化治疗提供参考。
1 资料与方法 1.1 研究对象收集我院2009年5月至2016年10月收治的76例AAIH患者的MSCTA资料,其中男性53例、女性23例,年龄41~89岁,平均年龄(65.6±11.2)岁。76例患者中有高血压病史患者56例;临床表现为突发胸背部疼痛或上腹部疼痛患者69例,气促5例,意识障碍2例。所有患者均接受主动脉MSCTA检查。纳入标准:① 临床表现为急性胸痛并确诊为AAIH;② 发病时间为2周内;③ 均接受MSCTA检查。排除标准:① 主动脉夹层(aortic dissection,AD)和穿透性主动脉粥样硬化性溃疡;② 发病时间超过2周;③ MSCTA图像质量不能满足影像学诊断[2-3]。
1.2 检查方法所有患者均使用64排CT(Aquilion 64,日本东芝)行胸腹主动脉MSCTA检查。扫描参数:管电压120 kV,管电流300~400 mAs,扫描层厚0.5 mm,扫描野320 mm,重建层厚3 mm,层间距3 mm。先行CT平扫,扫描范围:胸廓入口水平至耻骨联合水平。MSCTA增强扫描保持与平扫相同的体位、扫描范围和方向。自动对比剂跟踪技术启动扫描,ROI置于降主动脉近段肺动脉分叉水平,ROI CT值阈值150 HU。采用双筒高压注射器经肘前静脉注射碘对比剂,剂量1.0~1.5 mL/kg,流速4.0~5.0 mL/s。注射对比剂后再以相同速度注射生理盐水40 mL。0.5 mm层厚的原始容积数据传至Vitrea工作站,通过多平面重建、曲面重建、最大密度投影及容积再现等技术进行图像后处理。本研究经我院伦理委员会批准。所有患者均签署了知情同意书。
1.3 图像分析图像由2名具备10年以上工作经验的胸部放射科医师共同阅读,并测量和记录相关参数、指标,最终意见由两人协商后决定。AAIH的MSCTA诊断标准:① 主动脉管壁环形或新月形增厚;② 厚度>7 mm或钙化内膜明显内移;③ 平扫增厚主动脉管壁内CT值>60 HU,增强扫描增厚的主动脉壁内没有对比剂显影[4]。
记录AAIH的分型:依据Stanford分型标准[4]分为A型和B型,A型累及升主动脉,B型未累及升主动脉。在MSCTA横断位图像上,测量AAIH累及主动脉最大管径及壁间血肿最大厚度。记录AAIH受累主动脉有无合并溃疡类病变及其深度、局灶性强化。测量指标均在横断位图像上完成。溃疡类病变指增强后AAIH内形成的龛影;局灶性强化定义为壁间血肿内局限性的对比剂充盈影,伴有与主动脉的小分支动脉连通。记录有无心包积液、胸腔积液等其他阳性发现。
1.4 AAIH的短期随访按照病情发展将患者分为进展组、稳定和缓解组。进展组:壁间血肿厚度增加;进展为AD或主动脉瘤;主动脉破裂。稳定和缓解组:壁间血肿完全吸收或部分吸收;临床胸痛症状明显缓解;无其他并发症。随访方法采用查阅医院电子病案系统及图像存储和传输系统。随访时间为自AAIH发病后3个月。
1.5 统计学方法采用SPSS 20.0软件进行统计学分析,符合正态分布的资料采用均数±标准差(x±s)表示,年龄、受累主动脉最大管径采用两独立样本t检验;不符合正态分布的定量资料(包括壁间血肿最大厚度、溃疡类病变深度)采用Mann-Whitney U检验;定性资料包括性别、溃疡类病变、局灶性强化、心包积液、胸腔积液,采用χ2检验。对比Stanford A型和B型在不同因素间的差异有无统计学意义。将疾病进展与否作为因变量,将性别、年龄、Stanford分型、主动脉管径、壁间血肿厚度、溃疡类病变、溃疡类病变深度、局灶性强化、心包积液、胸腔积液作为自变量,采用单因素检验分析有统计学意义的指标,再将有统计学意义的指标纳入多因素Logistic回归分析,建立回归模型,分析影响疾病进展的危险预测因素。以P < 0.05为差异有统计学意义。
2 结果 2.1 AAIH患者一般资料的对比分析76例AAIH患者中Stanford A型27例(35.5%)(图 1),其中男性18例、女性9例,平均年龄(64.0±12.6)岁;B型49例(64.5%)(图 2),男性35例、女性14例,平均年龄(66.5±10.3)岁。Stanford A型与B型AAIH患者在性别、年龄分布上的差异的均无统计学意义(χ2=0.187,P =0.665;t=-0.964,P =0.338)。
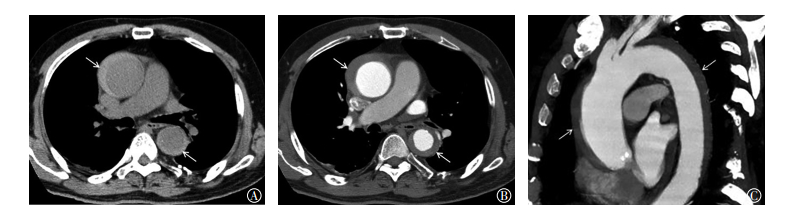
|
图 1 患者男性,72岁,急性期主动脉壁间血肿Stanford A型,MSCTA平扫横断位、增强横断位和矢状位最大密度投影图像图中,A:MSCTA平扫横断位显示升主动脉和降主动脉管径增粗,外围新月形稍高密度影(白色箭头所示);B:MSCTA增强横断位显示壁间血肿,内部无对比剂充盈(白色箭头所示);C:MSCTA增强矢状位最大密度投影重建直观显示壁间血肿累及范围(白色箭头所示)。MSCTA:多层螺旋CT血管造影。 Figure 1 Male, 72-year-old, Stanford A acute aortic intramural hematoma. Multiple slice computed tomography angiography plain axial image, enhancement axial image and maximum intensity projection image |
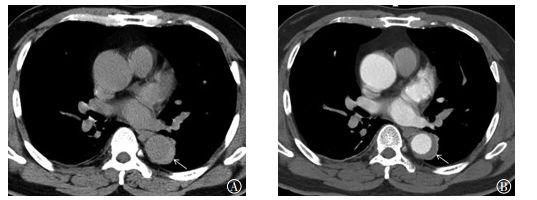
|
图 2 患者男性,51岁,急性期主动脉壁间血肿Stanford B型,MSCTA平扫横断位和增强横断位图像图中,A:MSCTA平扫横断位显示降主动脉外围新月形稍高密度影(白色箭头所示);B:MSCTA增强横断位显示壁间血肿无对比剂充盈,升主动脉未受累(白色箭头所示)。MSCTA:多层螺旋CT血管造影。 Figure 2 Male, 51-year-old, Stanford B acute aortic intramural hematoma. Multiple slice computed tomography angiography plain axial image and enhancement axial image |
76例患者的MSCTA均能清晰显示AAIH的累及范围和程度。CT平扫表现为主动脉管壁增厚,沿主动脉管壁纵向延伸,新月形增厚46例(60.5%),环形增厚30例(39.5%)。CT平扫壁间血肿CT值均>60 HU,内膜钙化影内移48例(63.2%)。MSCTA扫描示主动脉管腔均匀强化,壁内无假腔形成。AAIH溃疡类病变32例(42.1%),局限性强化11例(14.4%),合并心包积液15例(19.7%),胸腔积液39例(64.5%)。
Stanford A型与B型AAIH患者在壁间血肿厚度、合并溃疡类病变、局灶性强化、合并胸腔积液之间的差异均无统计学意义(P>0.05)。Stanford A型与B型AAIH患者在受累主动脉最大管径、溃疡类病变深度、合并心包积液之间的差异均有统计学意义(t=5.020、Z=-2.345、χ2=16.138,均P < 0.05)(表 1)。
| 表1 Stanford A型与Stanford B型AAIH患者的临床特征和MSCTA影像学表现 Table 1 Clinical characteristics and multiple slice computed tomography angiography features between Stanford A and B acute aortic intramural hematoma |
76例AAIH患者中,41例患者有短期随访。其中进展组20例,男性14例、女性6例,平均年龄(65.0±10.8)岁;稳定和缓解组21例,男性17例、女性4例,平均年龄(62.4±12.3)岁。进展组Stanford A型9例(进展为AD 4例;进展为主动脉瘤2例;死亡3例),B型11例[进展为AD 4例,进展为主动脉瘤3例,均接受主动脉腔内隔绝修补术(图 3);壁间血肿厚度增加4例]。稳定和缓解组Stanford A型5例、B型16例(图 4)。进展组受累主动脉最大管径和壁间血肿最大厚度分别为(39.6±9.7)mm和(10.7±3.0)mm;稳定组为(38.4±6.9)mm和(9.8±3.7)mm。进展组有12例合并溃疡类病变,平均溃疡深度为(3.9±4.0)mm;稳定和缓解组有3例合并溃疡类病变,平均溃疡深度为(1.3±3.5)mm。进展组及稳定和缓解组合并局灶性强化均为4例。进展组出现心包积液和胸腔积液分别为5例和13例,其中3例心包积液密度较高,提示为心包积血,短期随访死亡;稳定和缓解组分别为2例和7例。
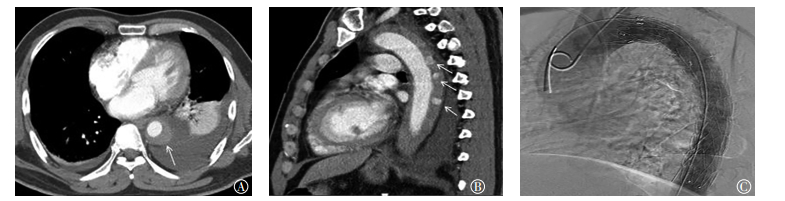
|
图 3 患者男性,50岁,急性期主动脉壁间血肿Stanford B型,MSCTA增强横断位、矢状位和数字减影血管造影图像图中,A:MSCTA增强横断位显示降主动脉外围新月形稍高密度影,合并左侧胸腔积液和左肺下叶压迫性膨胀不全(白色箭头所示);B:MSCTA增强冠状位显示壁间血肿,内部多个溃疡类病变(白色箭头所示);C:两天后该患者接受主动脉腔内隔绝术。MSCTA:多层螺旋CT血管造影。 Figure 3 Male, 50-year-old, Stanford B acute aortic intramural hematoma. Multiple slice computed tomography angiography enhancement axial, saggital and digital subtraction angiography images |
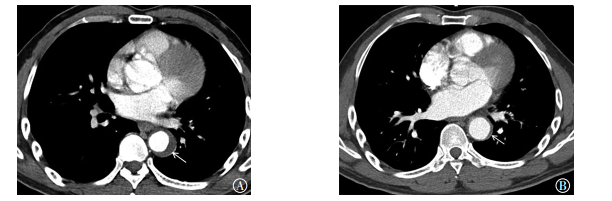
|
图 4 患者男性,45岁,急性期主动脉壁间血肿Stanford B型,首次检查和复查MSCTA增强横断位图像图中,A:MSCTA横断位显示降主动脉外围新月形稍高密度影,厚度约为8.7 mm(白色箭头所示);B:患者保守治疗3个月后复查,MSCTA横断位显示壁间血肿厚度明显缩小约为2.0 mm(白色箭头所示)。AAIH:急性主动脉壁间水肿;MSCTA:多层螺旋CT血管造影。 Figure 4 Male, 45-year-old, Stanford B acute aortic intramural hematoma. Multiple slice computed tomography angiography axial images in acute stage and follow up |
采用单因素检验方法分析,结果显示进展组、稳定和缓解组在合并溃疡类病变、溃疡类病变深度、胸腔积液间差异均有统计学意义(χ2=9.227、Z=-2.689、χ2=4.111,均P < 0.05);进展组、稳定和缓解组在性别、年龄、Stanford分型、受累主动脉管径、壁间血肿厚度、局灶性强化、心包积液方面差异均无统计学意义(χ2=0.666、t=0.723、χ2=1.453、t= -0.439、Z=-0.874、χ2=0.006、χ2=1.733,均P > 0.05)(表 2)。
| 表2 进展组与稳定和缓解组AAIH患者的临床特征和MSCTA影像表现 Table 2 Clinical characteristics and multiple slice computed tomography angiography features between progression and stable acute aortic intramural hematoma in 41patients |
将单因素分析中具有统计学意义的指标(溃疡类病变、溃疡深度、胸腔积液)纳入多因素Logistic回归分析,以AAIH是否进展Y为因变量,以溃疡类病变、溃疡类病变深度、胸腔积液为自变量,分别以X1、X2、X3表示,采用逐步向前法进行逐步回归分析,对各因素进行进一步筛选,结果显示仅溃疡类病变纳入回归方程(95% CI:0.024~0.505,P =0.004),回归方程:
| $ P{\rm{ = 1/}}\left\{ {{\rm{1 + exp}}\left[{-\left( {{\rm{0}}{\rm{.811-2}}{\rm{.197X1}}} \right)} \right]} \right\} $ |
式中,X1表示自变量溃疡类病变,说明溃疡类病变是AAIH疾病进展的独立危险预测因学。
3 讨论急性主动脉综合征包括急性AD、AAIH和主动脉穿透性动脉粥样硬化性溃疡,其中AAIH占5%~20%。急性主动脉综合征临床表现和风险因素相似,包括急性胸痛和长期高血压,但是病理生理学机制不同。既往认为AIH为主动脉中层滋养血管的破裂,没有合并内膜撕裂,但是也有少数文献报道在影像上或术中发现小的内膜撕裂口[2-3]。AAIH在CT平扫上有特异性,表现为主动脉管壁新月形或环形高密度影,Knollmann等[5]将MSCTA平扫主动脉密度高于45 HU作为临界值鉴别急性主动脉综合征3种疾病,其诊断AIH的灵敏度和特异度分别为100%(19/19)和94%(16/17)。本研究中所有患者CT平扫壁间血肿区域CT值均>60 HU,其中新月形增厚46例(60.5%)、环形增厚30例(39.5%)。
AAIH按照Stanford分型方法分为A型和B型,与AD分型方法相同,但40% AIH表现为A型,而70%的AD表现为A型[6]。本研究中AAIH患者中Stanford A型占35.5%(27/76),与文献报道接近[6]。AAIH的Stanford A和B型平均发病年龄为(69.6±9.6)岁和(68.6±11.7)岁,高于AD的Stanford A型和B型平均发病年龄(61.4±14.6)岁和(62.9±14.3)岁,并且风险低于AD患者[7]。本研究AAIH男女发病率之间的差异无统计学意义,但男性发病率(53/76;69.7%)高于女性(23/76;30.3%),可能与雌性激素(特别是雌二醇)等女性内源性抗动脉粥样硬化的作用有关。
Park等[8]研究结果发现,Stanford A型AAIH受累主动脉管径≥48 mm预示不良进展,Stanford B型受累主动脉管径≥41 mm预示不良进展。本研究中,受累主动脉最大管径为26.6~63.5 mm,其中A型平均管径为(45.1±9.1)mm,Stanford B型平均管径为(35.7±4.7)mm。Song等[9]研究认为,AAIH受累主动脉的最大管径是疾病预后独立预测因子,主动脉管径小提示血肿可以完全吸收,主动脉管径大提示可能进展为AD或动脉瘤,所以常规测量受累主动脉管径非常重要。本研究中进展组受累主动脉最大管径(39.6 ±9.7)mm高于稳定和缓解组壁间血肿(38.4±6.9)mm。壁间血肿的厚度亦是影响AAIH预后的重要危险因素。壁间血肿径线越厚,并发症的风险越大。Choi等[10]的随访结果显示,壁间血肿厚度>11~16 mm,风险明显增加,而壁间血肿厚度<10~11mm预示并发症风险降低,血肿消失的可能性增加。本研究中AAIH厚度为7.0~18.5 mm,Stanford A型平均厚度为(10.6±3.8)mm,Stanford B型平均厚度为(10.4±3.2)mm。
AAIH如发生动脉内膜局限性破裂、真腔与壁间血肿狭颈状沟通, 并在血肿内形成点状或团状对比剂填充区,即为溃疡性病变,需要与穿透性主动脉粥样硬化性溃疡相鉴别[11]。穿透性主动脉粥样硬化性溃疡和主动脉粥样硬化密切相关,邻近主动脉内膜管壁粗糙,多伴有钙化或低密度脂质斑块。AAIH伴发溃疡性病变多提示预后不好,尤其是出现在升主动脉和主动脉弓部,会进展为主动脉夹层、动脉瘤或动脉破裂[12]。Kitai等[13]回顾分析38例AAIH,71%(27/38)患者有溃疡类病变,高于本研究的发生率42.1%,原因可能为其观察1.0 mm薄层CT图像,检测出更小的病变,而本研究观察的图像为3.0 mm层厚。在Kitai等[13]研究中,11例没有溃疡性病变的患者随访过程中壁间血肿均全部吸收,而溃疡类病变深度≥5 mm预测疾病进展的灵敏度、特异度、阳性预测值和阴性预测值分别为84%、95%、94%和86%。
我们对比进展组与稳定和缓解组多项影响因素发现,AAIH伴有溃疡性病变,以及溃疡性病变深度之间的差异具有统计学意义,Logistic回归分析进一步显示溃疡性病变是AAIH的独立危险预测因素,说明在AAIH的随访中溃疡类病变需要密切监测。Sueyoshi等[14]研究认为,溃疡类病变无论是初诊发现还是在随访中发现,都是预测并发症的危险因素,伴有复杂溃疡性病变的AAIH患者,在接受主动脉腔内隔绝手术后,壁间血肿的压力减轻,有利于受累主动脉管壁的重塑,预后较好。
AAIH发生时,主动脉小分支开口处内膜被壁间血肿掀起,血肿向外推挤主动脉外膜和肌层,使主动脉小分支开口处陷入血肿内,由于血流的压力而扩张形成局限性强化影。局限强化影与主动脉腔不直接相连,而与主动脉壁间的肋间动脉、支气管动脉、腰动脉相连,冠状位、矢状位重组图像可以更好地帮助显示其走行。Wu等[15]分析了65例AAIH患者,其中10例(15.4%)发生局灶性强化,主要发生在降主动脉和腹主动脉,随访过程中(平均36个月)大部分稳定或消失,结果得出局灶性强化与AAIH进展无明显相关。本研究中有11例(14.4%)患者发现局灶性强化,检出率与其接近,起源多来自肋间动脉开口区。在41例随访病例中,8例(19.5%)发现局灶性强化,其中进展组4例、稳定和缓解组4例,两者之间差异无统计学意义。Park等[8]研究认为,AAIH伴有局灶性强化没有增加风险,危险程度明显低于溃疡类病变,不需要急诊介入手术治疗。
AAIH发病年龄较大,高血压和动脉粥样硬化疾病患者发生率高,病变靠近外膜,容易导致急性液体外渗。本研究中AAIH患者中合并心包积液A型12例、B型3例,两者间差异有统计学意义,因为升主动脉起始部的壁间血肿更容易向下累及心包膜,引起心包的渗出、积血甚至心包填塞。Stanford A型进展组3例死亡病例,发现均伴有明显心包积液,其中2例密度较高提示为心包积血。Song等[16]对比分析60例Standord A型和127例B型AAIH,发现A型胸腔积液发生率(7%)明显多于B型(1%)。本研究结果发现,在AAIH进展组的胸腔积液发生率为65.0%(13/20),高于稳定和缓解组的33.3%(7/21),是影响AAIH是否进展的重要因素。
本研究尚具有一定的局限性:① 本研究为回顾性研究,难免存在选择性偏倚,AAIH患者的监测时间难以统一;② 病例样本量较小,有较完整随访记录的患者较少;③ 随访时间较短,我们只对AAIH的短期演变进行了对比分析。下一步研究我们会增加样本数量,并对患者进行长期的随访和监测。
综上所述,MSCTA检查可以对AAIH做出快速、准确诊断。溃疡性病变是影响AAIH进展的独立危险因素。AAIH早期需要密切随访,监测有无进展。
利益冲突 本研究由署名作者按照以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 陈相猛负责论文命题的提出、实施、病例收集、数据分析和论文写作;段晓蓓负责论文修改和指导;金志发、张朝桐、李卓永负责图像阅读、分析;龙晚生负责论文审阅。
| [1] | Nienaber CA, von Kodolitsch Y, Petersen B, et al. Intramural hemorrhage of the thoracic aorta. Diagnostic and therapeutic[J]. Circulation, 1995, 92(6): 1465–1472. DOI:10.1161/01.CIR.92.6.1465 |
| [2] | Erbel R, Aboyans V, Boileau C, et al. 2014 ESC guidelines on the diagnosis and treatment of aortic diseases[J]. Kardiol Pol, 2014, 72(12): 1169–1252. DOI:10.5603/KP.2014.0225 |
| [3] | Gutschow SE, Walker CM, Mart-Nez-Jimenez S, et al. Emerging concepts in intramural hematoma imaging[J]. Radiographics, 2016, 36(3): 660–674. DOI:10.1148/rg.2016150094 |
| [4] | Morris JH, Mix D, Cameron SJ. Acute aortic syndromes:update in current medical management[J]. Curr Treat Options Cardiovasc Med, 2017, 19(4): 29. DOI:10.1007/s11936-017-0523-9 |
| [5] | Knollmann FD, Lacomis JM, Ocak I, et al. The role of aortic wall CT attenuation measurements for the diagnosis of acute aortic syndromes[J]. Eur J Radiol, 2013, 82(12): 2392–2398. DOI:10.1016/j.ejrad.2013.09.007 |
| [6] | Mussa FF, Horton JD, Moridzadeh RA, et al. Acute aortic dissection and intramural hematoma a systematic review[J]. JAMA, 2016, 316(7): 754–763. DOI:10.1001/jama.2016.10026 |
| [7] | Harris KM, Braverman AC, Eagle KA, et al. Acute aortic intramural hematoma:an analysis from the International Registry of Acute Aortic Dissection[J]. Circulation, 2012, 126(11 Suppl 1): S91–96. DOI:10.1161/CIRCULATIONAHA.111.084541 |
| [8] | Park GM, Ahn JM, Kim DH, et al. Distal aortic intramural hematoma:clinical importance of focal contrast enhancement on CT images[J]. Radiology, 2011, 259(1): 100–108. DOI:10.1148/radiol.11101557 |
| [9] | Song JK, Yim JH, Ahn JM, et al. Outcomes of patients with acute type a aortic intramural hematoma[J]. Circulation, 2009, 120(21): 2046–2052. DOI:10.1161/CIRCULATIONAHA.109.879783 |
| [10] | Choi SH, Choi SJ, Kim JH, et al. Useful CT findings for predicting the progression of aortic intramural hematoma to overt aortic dissection[J]. J Comput Assist Tomogr, 2001, 25(2): 295–299. DOI:10.1097/00004728-200103000-00025 |
| [11] | Lee YK, Seo JB, Jang YM, et al. Acute and chronic complications of aortic intramural hematoma on follow-up computed tomography:incidence and predictor analysis[J]. J Comput Assist Tomogr, 2007, 31(3): 435–440. DOI:10.1097/01.rct.0000250112.87585.8e |
| [12] | Schlatter T, Auriol J, Marcheix B, et al. Type B intramural hematoma of the aorta:evolution and prognostic value of intimal erosion[J]. J Vasc Interv Radiol, 2011, 22(4): 533–541. DOI:10.1016/j.jvir.2010.10.028 |
| [13] | Kitai T, Kaji S, Yamamuro A, et al. Detection of intimal defect by 64-row multidetector computed tomography in patients with acute aortic intramural hematoma[J]. Circulation, 2011, 124(11 Suppl): S174–178. DOI:10.1161/CIRCULATIONAHA.111.037416 |
| [14] | Sueyoshi E, Nagayama H, Hashizume K, et al. Computed tomography evaluation of aortic remodeling after endovascular treatment for complicated ulcer-like projection in patients with type B aortic intramural hematoma[J]. J Vasc Surg, 2014, 59(3): 693–699. DOI:10.1016/j.jvs.2013.08.100 |
| [15] | Wu MT, Wang YC, Huang YL, et al. Intramural blood pools accompanying aortic intramural hematoma:CT appearance and natural course[J]. Radiology, 2011, 258(3): 705–713. DOI:10.1148/radiol.10101270 |
| [16] | Song JK, Kim HS, Song JM, et al. Outcomes of medically treated patients with aortic intramural hematoma[J]. Am J Med, 2002, 113(3): 181–187. DOI:10.1016/S0002-9343(02)01171-3 |
 2017, Vol. 41
2017, Vol. 41


