2. 300192 天津, 北京协和医学院中国医学科学院放射医学研究所, 天津市放射医学与分子核医学重点实验室
2. Tianjin Key Laboratory of Radiation Medicine and Molecular Nuclear Medicine, Institute of Radiation Medicine, Chinese Academy of Medical Sciences, Peking Union Medical College, Tianjin 300192, China
间充质干细胞(mesenchymal stem cells,MSC)是一类具有自我更新和多向分化能力的纤维细胞样成体干细胞,最初是由Friedenstein等[1]在骨髓中发现的。目前,在骨髓外其他多种组织中也发现MSC,例如脐带、脂肪组织、胎盘等[2],其中脐带来源的MSC具有增殖能力更强的特点,且其取材无创,细胞提取效率更高。大量研究证实,MSC通过分泌IL-10、转化生长因子β(transforming growth factor-β,TGF-β)、吲哚胺-2, 3-双加氧酶(indoleamine 2, 3-dioxy-genase,IDO)和肝细胞生长因子(hepatocyte growth factor,HGF)等细胞调节因子或与免疫细胞直接接触调节机体固有免疫和适应性免疫能力[3]。与免疫抑制药物相比,MSC的免疫调节能力使其成为一种不良反应小的生物免疫抑制剂,可以用于炎症性肠病、系统性红斑狼疮和全身性硬化症等自身免疫疾病的治疗[4]。然而,MSC的免疫抑制功能需要大量细胞才能达到治疗作用,而回输大剂量的MSC可能会诱发急性肺栓塞、肝栓塞、肾栓塞、发热和皮疹等不良反应[5]。因此,提高单个MSC的免疫调节能力对于提高细胞治疗效力、减少不良反应、降低治疗成本等临床应用具有重要意义。
电磁场作为一种理疗手段,具有镇痛、抗炎和促进血管新生等功效。大量临床试验和动物实验证实,电磁场辐射可改善非愈合性溃疡、陈旧性骨折和慢性炎症性疾病的预后,作为一种无创、安全、有效的治疗手段,电磁场已成功应用于多种临床疾病的治疗[6],并且美国食品药品监督管理局已批准电磁场用于骨折等骨相关疾病的治疗[7]。研究证实,频率低于100 Hz、磁通量小于3 mT的低频脉冲电磁场(pulsed electromagnetic field,PEMF)的治疗作用更为有效[8]。近年来,已有学者开始探讨PEMF对MSC生物学效应的影响,但这些研究主要集中在细胞增殖和分化能力方面,而PEMF对脐带MSC免疫调节能力的影响的研究尚未涉及。本研究中笔者探讨了PEMF对脐带来源MSC的免疫调节能力、DNA损伤及细胞凋亡等方面的影响。
1 材料与方法 1.1 材料DMEM/F-12培养基、RPMI 1640培养基、胎牛血清购自美国Gibco公司;MTT、活性氧(reactive oxygen species,ROS)检测试剂盒、细胞周期试剂盒购自上海碧云天生物技术有限公司;干扰素γ(interferon-γ,IFN-γ)购自美国Peprotech公司;脂多糖(lipopolysaccharide,LPS)购自美国Sigma公司;PCR引物由上海生工生物工程股份有限公司合成;Trizol试剂购自美国Invitrogen公司;cDNA反转录试剂盒购自日本Takara公司;Eva Green荧光染料购自加拿大ABM公司;AnnexinⅤ-FITC/PI(其中,FITC为异硫氰酸荧光素;PI为碘化丙啶)细胞凋亡双染试剂盒购自美国BD公司。
1.2 细胞培养脐带MSC、THP-1源性巨噬细胞由国家工程研究中心赠送。MSC用含10%胎牛血清的DMEM/F-12培养基培养,THP-1用含10%胎牛血清的RPMI 1640培养基培养,两种细胞均培养于37℃、5% CO2细胞培养箱中。取第2~5代处于对数生长期的脐带MSC用于实验。
1.3 PEMF辐照PEMF发生装置由天津大学材料学院与中国医学科学院放射医学研究所合作研制,磁场强度、频率及脉冲宽度均可调节,此装置采用双电源控制可使磁场强度更为均匀、稳定。参考文献报道,调节装置参数使PEMF的磁场稳定在50 Hz、1 mT,脉冲宽度设置为50%[8, 14]。将对数生长期脐带MSC置于磁场强度区域内,25℃环境中密闭培养。
1.4 MTT实验取对数生长期MSC,调整浓度至4×104个/mL,以每孔100 μL接种于96孔板,每组设12个复孔。过夜后,将96孔板密封并置于室温、50 Hz 1 mT PEMF中每天分别辐照3、4、5 h,连续处理3 d。PEMF辐照后继续培养24 h,每孔加入10 μL 5×103 mg/L MTT,37℃孵育4 h,吸弃培养液,每孔加入150 μL二甲基亚砜,置摇床震荡10 min后,于酶标仪490 nm波长下检测各孔光吸收值。对照组的处理除了不接受磁场辐照外,其他均与实验组相同。
1.5 实时荧光定量PCR法检测实验共分4组,分别是空白对照组、PEMF辐照组、IFN-γ组以及IFN-γ+PEMF组。取对数生长期MSC,调整细胞浓度至5×104个/mL,以每孔2 mL接种于六孔板。培养过夜后,取5 μL 20 ng/μL IFN-γ分别加入IFN-γ组和IFN-γ+PEMF组,使其终浓度为50 ng/mL。PEMF辐照组和IFN-γ+PEMF组连续接受PEMF辐照3 d,每天4 h。收集处理好的细胞,用Trizol试剂提取总RNA,按照cDNA反转录试剂盒说明书操作反转录mRNA为cDNA,再用Eva Green荧光染料配置20 μL PCR反应体系,于实时荧光定量PCR仪(美国Bio-rad公司,Bio-rad CFX96型)上测定MSC细胞内环氧合酶2(cyclooxygenase 2,COX2)、IL-10、HGF、TGF-β和IDO等基因的相对表达情况,结果用荧光强度相对值表示,每组设3个平行孔。
收集上述IFN-γ组和IFN-γ+PEMF组MSC的上清。取对数生长期THP-1细胞,分别用含50 ng/mL IFN-γ的DEMF/F-12完全培养基、IFN-γ组上清、IFN-γ+PEMF组上清重悬细胞,调整细胞浓度至5×105个/mL,以每孔2 mL接种于六孔板,并在各孔中加入200 μL 1 ng/μL LPS,使其终浓度为100 ng/mL。在37℃、5%CO2环境中培养24 h后,收集THP-1细胞,采用实时荧光定量PCR法检测IL-1β和核因子κB(nuclear factor kappa B,NF-κB)基因相对表达情况,结果用荧光强度相对值表示。
实时荧光定量PCR反应中所用引物见表 1。
| 表1 实时荧光定量PCR引物序列 Table 1 Primers for real-time PCR |
取对数生长期脐带MSC,以1×105的接种量接种于T25培养瓶中。培养过夜后,将培养瓶密封并置于PEMF中每天辐照4 h,连续处理3 d。收集细胞于1.5 mL离心管中,无血清培养液清洗2遍后,离心(1000×g,3 min)并弃上清。按照1:1000比例用无血清培养液稀释2′,7′-二氢二氯荧光黄双乙酸钠(2′,7′-dichlorodihydrofluoresein diacetate,DCFH-DA),使其终浓度为10 μmol/L,每个样本中加入1 mL DCFH-DA使细胞悬浮,于37℃细胞培养箱内孵育20 min,并每隔3~5 min震荡混匀一次,用无血清细胞培养液洗涤细胞3次,以除去未进入细胞内的DCFH-DA。染色结束后,用流式细胞仪(迈瑞公司,Bricyte E6型)检测细胞荧光强度。对照组的处理除了不接受磁场辐照外,其他均与实验组相同。
1.6.2 细胞凋亡取对数生长期脐带MSC,以1×105的接种量接种于六孔板中。培养过夜后,将六孔板密封并置于50 Hz 1 mT PEMF中每天辐照4 h,连续处理3 d。收集细胞,并用预冷的PBS清洗2次,离心(1000×g,5 min)并弃上清。加入300 μL Binding Buffer使细胞重悬,然后加入5 μL的Annexin V-FITC混匀后,避光,室温孵育15 min,上机前5 min再加入5 μL的PI染色。染色结束后用流式细胞仪检测不同处理组细胞凋亡比例。
1.6.3 细胞周期先将脐带MSC用血清饥饿法进行同步培养,然后以1×105的接种量接种于T25培养瓶中。预培养过夜后,将培养瓶密封并置于50 Hz 1 mT PEMF中每天辐照4 h,分别连续处理3 d和5 d。收集细胞于1.5 mL离心管中,并用PBS清洗2遍。70%预冷乙醇固定24 h后,用PBS清洗2遍。离心(1000×g,3 min)并弃上清,加入0.5 mL染色缓冲液、25 μL PI染色液、10 μL RNase A使细胞悬浮,37℃避光孵育30 min后,用流式细胞仪检测细胞周期。对照组的处理除了不接受磁场辐照外,其他均与实验组相同。
1.7 单细胞凝胶电泳实验取对数生长期脐带MSC,以1×105的接种量接种于六孔板中。培养过夜后,将六孔板密封并置于50 Hz 1 mT PEMF中每天辐照4 h,连续处理3 d。取300 μL 7.5%正常熔点琼脂糖凝胶均匀铺于自制微电泳槽内,取30 μL 5×105个/mL细胞悬液与70 μL 7.5%低熔点凝胶混匀后铺于第一层凝胶上面。微电泳槽置于碱性裂解液中于4℃裂解2.5 h,用双蒸水漂洗掉多余的盐分,于4℃电泳液中解旋20 min,然后在30 V、40 mA电泳条件下电泳20 min。将微电泳槽置于4℃中和液中中和20 min。用2 μg/mL溴化乙锭染色10 s,超纯水漂洗后于荧光显微镜绿色激发光下观察并随机拍照,用CASP软件分析彗星尾长、尾距及尾部DNA百分含量。
1.8 统计学方法采用SPSS19.0软件对数据进行统计学分析,原始数据均服从正态分布和方差齐性,组间比较采用独立样本t检验,数据采用均数±标准差(x±s)表示。P<0.05表示差异有统计学意义。
2 结果 2.1 50 Hz 1 mT PEMF辐照不同时间对脐带MSC活性的影响探究不同辐照时间对脐带MSC活性的影响,可为后续实验选取合适的处理时间。由图 1可见,与对照组相比,PEMF辐照后脐带MSC活性增强,其中辐照4 h对细胞活性的促进作用最为明显,差异有统计学意义(t=3.505,P<0.05)。对照组细胞密封后置于培养箱外室温环境,3 h组与4 h组细胞活性无明显变化,5 h组细胞活性受到抑制;PEMF辐照组细胞4 h组的细胞活性较3 h组升高,差异有统计学意义(t=3.325,P<0.05),而连续辐照5 h后细胞活性显著降低。
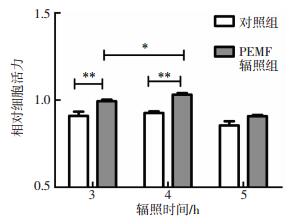
|
图 1 50 Hz 1 mT PEMF辐照不同时间对脐带MSC活性的影响(n=3) Figure 1 Effect of 50-Hz, 1-mT PEMF on the viability of MSC 图中,*:PEMF辐照组细胞4 h组与3 h组相比,t=3.325,P<0.05;**:与对照组相比,t=2.662~3.505,均P<0.01;PEMF:脉冲电磁场;MSC:间充质干细胞。 |
探究50 Hz 1 mT PEMF辐照对脐带MSC自身免疫调节因子mRNA表达水平的影响,为PEMF增强脐带MSC免疫调节能力的后续研究和临床应用提供理论依据。由图 2可见,PEMF辐照可促进COX2、HGF、IL-10、IDO和TGF-β等免疫调节因子mRNA的表达,但差异无统计学意义(t=0.982~2.376,P>0.05);对于IFN-γ激活的脐带MSC,PEMF辐照可显著上调COX2、HGF、IDO和TGF-β等免疫调节因子mRNA表达水平,差异有统计学意义(t=2.436~3.747,均P<0.05)。上述结果表明,PEMF辐照可促进MSC自身免疫调节因子表达,为进一步验证PEMF是否能增强MSC的抗炎能力,选择THP-1细胞进行验证。由图 3可见,IFN-γ激活的MSC经PEMF辐照后,其上清液可显著抑制炎性细胞NF-κB炎性通路的激活,差异有统计学意义(t=3.804,P<0.05),而对炎性因子IL-1β的抑制作用不明显。
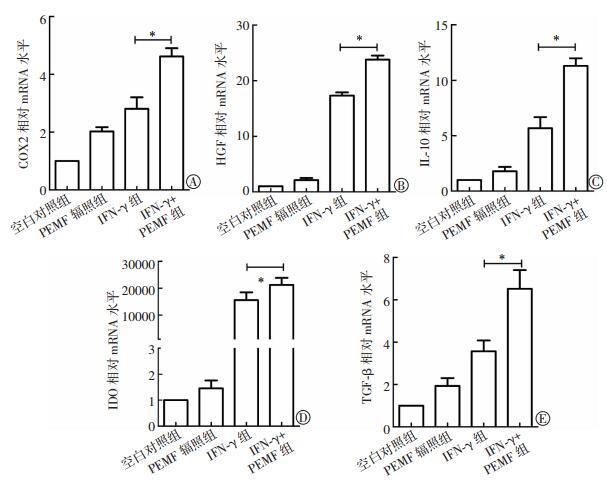
|
图 2 50 Hz 1 mT PEMF对脐带MSC免疫相关因子mRNA表达水平的影响(n=3) Figure 2 Effect of 50-Hz, 1-mT PEMF on the expression levels of immunomodulatory factors 图中,*:IFN-γ组与IFN-γ+PEMF组相比,t=2.436~3.747,均P<0.05;PEMF:脉冲电磁场;MSC:间充质干细胞;IFN-γ:干扰素γ;COX2:环氧合酶2;HGF:肝细胞生长因子;IDO:吲哚胺-2,3-双加氧酶;TGF-β:转化生长因子β。 |
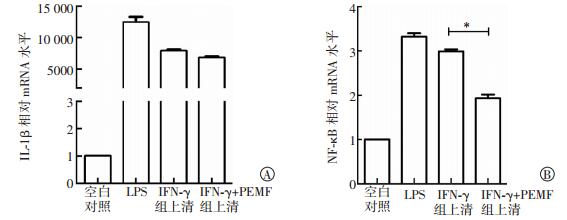
|
图 3 50 Hz 1 mT PEMF辐照提高脐带MSC抑制THP-1细胞炎性因子表达的能力(n=3) Figure 3 50-Hz, 1-mT PEMF inhibits inflammatory factors expression in THP-1 by improving the properities of umbilical cord MSC 图中,*:INF-γ组与INF-γ+PEMF组比较,t=3.804,P<0.05;PEMF:脉冲电磁场;MSC:间充质干细胞;LPS:脂多糖;IFN-γ:干扰素γ;NF-κB:核因子κB。 |
探究50 Hz 1 mT PEMF对脐带MSC ROS水平的影响,从而为PEMF临床应用的安全性提供理论依据。由图 4可见,经PEMF辐照后,脐带MSC ROS水平没有显著变化,差异无统计学意义(t=0.241,P>0.05)。
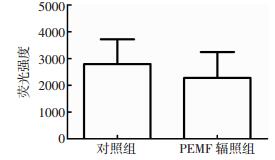
|
图 4 50 Hz 1 mT PEMF对脐带MSC活性氧水平的影响(n=3) Figure 4 Effect of 50-Hz, 1-mT PEMF on the intracellular reactive oxygen species level of MSC 图中,PEMF:脉冲电磁场;MSC:间充质干细胞。 |
探究50 Hz 1 mT PEMF对脐带MSC DNA的影响,为PEMF的安全性提供初步评估。单细胞凝胶电泳实验结果如图 5所示,PEMF辐照组细胞未出现明显拖尾现象。CASP软件定量分析结果如表 2所示,PEMF辐照组的尾部DNA含量、尾长和尾距与对照组相比无明显变化,差异无统计学意义(t=0.386~0.632,均P>0.05)。

|
图 5 单细胞凝胶电泳后脐带MSC显微镜下彗星图像(溴化乙锭染色,×400) Figure 5 Fluorescence microscopy images of umbilical cord MSC in single cell gel eleclrophoresis assay(×400) 图中,A:对照组;B:PEMF辐照组;PEMF:脉冲电磁场;MSC:间充质干细胞。 |
| 表2 单细胞凝胶电泳分析50 Hz 1 mT PEMF辐照对MSC DNA损伤的影响(x±s,n=3) Table 2 Effect of PEMF on DNA damage by comet assay(x±s, n=3) |
探究50 Hz 1 mT PEMF对脐带MSC凋亡的影响,为PEMF用于细胞治疗的可行性提供依据。由图 6可见,PEMF辐照对脐带MSC凋亡没有明显影响。
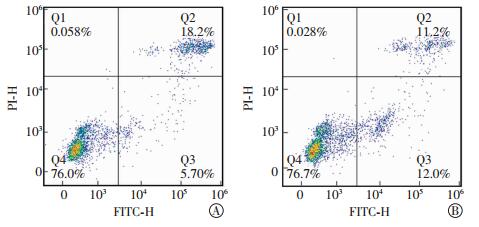
|
图 6 50 Hz 1 mT PEMF对脐带MSC凋亡的影响 Figure 6 Effect of 50-Hz, 1-mT PEMF on the apoptosis of umbilical cord MSC 图中,A:对照组;B:PEMF辐照组;FITC:异硫氰酸荧光素;PI:碘化丙啶;PEMF:脉冲电磁场;MSC:间充质干细胞。 |
探究经50 Hz 1 mT PEMF辐照后脐带MSC周期的变化,明确PEMF辐照对脐带MSC增殖的影响。从图 7可以看出,PEMF连续辐照3 d对细胞周期没有明显影响,连续辐照5 d后细胞周期亦无明显变化,差异无统计学意义(t=0.382~0.721,均P>0.05)。
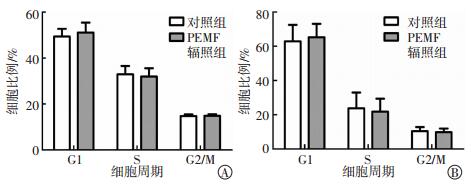
|
图 7 50 Hz 1 mT PEMF辐照3 d、5 d对脐带MSC周期的影响(n=3) Figure 7 Effect of 50-Hz, 1-mT PEMF on the cell cycle of umbilical cord MSC after 3 or 5 days of radiation 图中,A:辐照3 d;B:辐照5 d;PEMF:脉冲电磁场;MSC:间充质干细胞。 |
电磁场疗法作为一种安全无侵入的理疗手段已广泛应用于骨关节炎、骨折、慢性炎症等疾病的治疗[9-10]。最近,有研究报道,电磁场辐照可显著促进糖尿病患者足部溃疡的愈合[11]。此外,经颅电磁场刺激已被应用于脑损伤后康复、失眠及其他精神疾病的治疗中,我国科学家利用PEMF刺激对平均吸毒十多年的海洛因成瘾者进行研究,成功降低了其机体对药物的渴求度[12]。目前电磁场产生生物学效应的作用机制主要通过活化细胞膜相关受体或激活钙离子通道两种途径,但具体机制还不甚明确。
MSC是一种具有自我更新和多向分化能力的成体干细胞,已成功用于再生医学中促进组织修复。此外,大量研究报道MSC通过与免疫细胞直接接触或分泌可溶性免疫调节因子调节机体固有免疫或适应性免疫能力,从而促进慢性炎症性疾病(如克罗恩病、系统性红斑狼疮等)的有效缓解[3]。
近来,有研究着眼于探讨电磁场辐照对MSC生物学效应的影响。大量研究结果表明,电磁场辐照能够促进MSC向骨细胞、软骨细胞及神经细胞等方向分化[6, 13-14],为电磁场疗法在再生医学方面的应用提供了理论依据。MSC分泌多种免疫调节因子,具有强大的免疫调节能力,体外实验证实其免疫抑制能力呈数量依赖性[15],而回输大剂量的MSC可能会诱发急性肺栓塞、肝栓塞、肾栓塞、发热和皮疹等严重不良反应。因此,提高单个MSC的免疫抑制能力对于提高细胞治疗效力、减少不良反应、降低治疗成本等临床应用具有重要意义。本研究发现,对于IFN-γ激活的脐带MSC,PEMF辐照可显著上调COX2、HGF、IDO和TGF-β等免疫调节因子mRNA表达水平;IFN-γ激活的脐带MSC经PEMF辐照后的上清液可显著抑制炎性细胞NF-κB炎性通路的激活。
电磁场的窗效应是指只有特定频率与特定强度组合的电磁波才能产生相应的生物学效应。目前,在科学研究和临床应用中所采用的电磁场参数仍没有统一规定,并且关于电磁场生物学效应的大量前期研究结论不一。有研究证实,频率低于100 Hz、磁通量小于3 mT的低频PEMF的生物学效应更为显著[8]。也有学者认为最有效的电磁场频率范围应接近机体正常功能活动频率,并且许多研究报道已证实50 Hz 1 mT PEMF的有效性[3]。因此,本研究参考上述文献报道采用了50 Hz 1 mT PEMF,研究结果表明,脐带MSC接受不同时间电磁场辐照后细胞活性均有所升高,其中每天辐照4 h组变化最为明显。
MSC通过分泌IL-10、前列腺素E2(prostagla-ndin E2,PGE2)、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、IDO、HGF和人类白细胞抗原G5(human leucocyte antigen-G5,HLA-G5)等细胞因子调节免疫细胞功能进而改变组织的炎性环境[16]。除拮抗免疫细胞促炎作用外,MSC通过分泌IDO、iNOS和HLA-G5抑制效应T细胞增殖;分泌PGE2、IL-10、HGF、TGF-β1等抑制树突状细胞成熟;分泌PGE2、HLA-G5、TGF-β1和IDO抑制自然杀伤细胞介导的细胞毒作用并抑制自然杀伤细胞的增殖[18-21]。此外,MSC分泌的HLA-G5和PGE2可促进调节性T细胞增殖[22-23]。近来,有文献报道MSC分泌的PGE2和TGF-β1可抑制肥大细胞活化[24-25]。本研究结果表明,对于静止状态的脐带MSC,PEMF辐照对COX2、HGF、IDO和TGF-β等免疫调节因子mRNA的表达没有明显影响;而对于炎性因子激活的脐带MSC,PEMF辐照可显著上调上述免疫调节因子mRNA的表达。有文献报道,对于静止状态的MSC,其上清液没有明显免疫抑制作用,而对于与淋巴细胞共培养的MSC,其上清液有明显的免疫调节作用,并提出MSC免疫调节因子的表达需要炎性细胞介导的观点[8]。综合本研究结果,文献中所提及的MSC免疫调节因子表达需要炎性细胞介导可能是与炎性细胞所分泌的IFN-γ等炎性因子有关。IFN-γ激活的MSC经PEMF辐照后的上清液可显著抑制炎性细胞NF-κB炎性通路的激活,进一步证明了PEMF可增强脐带MSC的抗炎能力。
有学者发现,电磁场辐照与白血病、乳腺癌等恶性肿瘤的高发病率有关[25],并提出其致癌作用可能与ROS生成导致DNA断裂有关[17]。本研究旨在探索提高脐带MSC免疫调节能力的方法,前提需保证安全性、可行性,为此我们检测了PEMF对MSC ROS水平、DNA损伤及细胞凋亡的影响。研究结果表明,50 Hz 1 mT PEMF对脐带MSC ROS水平、DNA损伤及细胞凋亡无明显影响。50 Hz 1 mT PEMF能量相对较低,且本研究并未采用全天连续电磁场辐照的方法,这可能是与前期文献报道结果不一致的原因所在。
电磁场辐照促进骨折、溃疡、手术伤口愈合,与其促进细胞增殖作用有关,且多项研究表明其促进细胞增殖的机制可能与MAPK/ERK信号通路有关[27]。但本研究结果显示,PEMF对脐带MSC周期没有显著影响,间接表明50 Hz 1 mT PEMF对脐带MSC没有明显的促进增殖的作用。研究结果的不同说明磁场辐照对不同组织来源的细胞可能产生不同的生物学效应,因此在磁场的应用中还要考虑到细胞、组织的种类和特征。
本研究结果初步验证了50 Hz 1 mT PEMF辐照可增强脐带MSC的免疫调节能力,并且对细胞ROS水平、细胞凋亡率及DNA损伤无明显影响,为其临床应用的安全性评价提供了理论依据。本研究仅探究了脐带MSC免疫调节因子在mRNA水平的变化,后续研究还需探讨其免疫调节因子在分泌水平的变化,以及通过体内实验验证PEMF对脐带MSC免疫调节能力的影响;在安全性方面,本研究仅验证了PEMF单独辐照MSC时并未引起细胞损害,但未对INF-γ+PEMF组的安全性进行评价。此外,目前认为电磁场产生生物学效应的作用机制主要是通过活化细胞膜相关受体或激活钙离子通道两种途径,具体机制还不甚明确,后续研究还需对其作用机制进行进一步探讨。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 曹芳负责实验设计、现场实验、数据分析及论文撰写;张焕婷负责现场实验;刘强负责命题的提出、实验设计和论文审阅;杜利清负责实验设计;曹晓沧负责命题的提出和论文审阅。
| [1] | Friedenstein AJ, Gorskaja JF, Kulagina NN. Fibroblast precursors in normal and irradiated mouse hematopoietic organs[J]. Exp Hematol, 1976, 4(5): 267–274. |
| [2] | Chamberlain G, Fox J, Ashton B, et al. Concise review:mesenchymal stem cells:their phenotype, differentiation capacity, immunological features, and potential for homing[J]. Stem Cells, 2007, 25(11): 2739–2749. DOI:10.1634/stemcells.2007-0197 |
| [3] | Munir H, McGettrick HM. Mesenchymal stem cell therapy for autoimmune disease:risks and rewards[J]. Stem Cells Dev, 2015, 24(18): 2091–2100. DOI:10.1089/scd.2015.0008 |
| [4] | Cras A, Farge D, Carmoi T, et al.Update on mesenchymal stem cell-based therapy in lupus and scleroderma[J/OL].Arthritis Res Ther, 2015, 17:301[2017-01-09].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4631077.DOI:10.1186/s13075-015-0819-7. |
| [5] | Furlani D, Ugurlucan M, Ong L, et al. Is the intravascular administration of mesenchymal stem cells safe? Mesenchymal stem cells and intravital microscopy[J]. Microvasc Res, 2009, 77(3): 370–376. DOI:10.1016/j.mvr.2009.02.001 |
| [6] | Ferroni L, Tocco I, De Pieri A, et al.Pulsed magnetic therapy increases osteogenic differentiation of mesenchymal stem cells only if they are pre-committed[J/OL].Life Sci, 2016, 152:44-51[2017-01-09].http://www.sciencedirect.com/science/article/pii/S0024320516301709.DOI:10.1016/j.lfs.2016.03.020. |
| [7] | Boyette MY, Herrera-Soto JA.Treatment of delayed and nonunited fractures and osteotomies with pulsed electromagnetic field in children and adolescents[J/OL].Orthopedics, 2012, 35(7):e1051-e1055[2017-01-09].http://m2.wyanokecdn.com/868f60c9e861-91479086696703af8552.pdf.DOI:10.3928/01477447-20120621-20. |
| [8] | Saliev T, Mustapova Z, Kulsharova G, et al. Therapeutic potential of electromagnetic fields for tissue engineering and wound healing[J]. Cell Prolif, 2014, 47(6): 485–493. DOI:10.1111/cpr.12142 |
| [9] | Fu YC, Lin CC, Chang JK, et al.A novel single pulsed electromagnetic field stimulates osteogenesis of bone marrow mesenchymal stem cells and bone repair[J/OL].PLoS One, 2014, 9(3):e91581[2017-01-09].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0091581.DOI:10.1371/journal.pone.0091581. |
| [10] | Negm A, Lorbergs A, Macintyre NJ. Efficacy of low frequency pulsed subsensory threshold electrical stimulation vs placebo on pain and physical function in People with knee osteoarthritis:systematic review with meta-analysis[J]. Osteoarthritis Cartilage, 2013, 21(9): 1281–1289. DOI:10.1016/j.joca.2013.06.015 |
| [11] | Abbruzzese L, Iacopi E, Coppelli A, et al. Safety and effectiveness of therapeutic magnetic resonance in the management of postsurgical lesion of the diabetic foot[J]. Int J Low Extrem Wounds, 2015, 14(1): 4–10. DOI:10.1177/1534734614568374 |
| [12] | Shen Y, Cao X, Tan T, et al.10-Hz repetitive transcranial magnetic stimulation of the left dorsolateral prefrontal cortex reduces heroin cue craving in long-term addicts[J/OL].Biol Psychiatry, 2016, 80(3):e13-e14[2017-01-09].https://linkinghub.elsevier.com/retrieve/pii/S0006-3223(16)00093-7.DOI:10.1016/j.biopsych.2016.02.006. |
| [13] | Wang J, Tang N, Xiao Q, et al. Pulsed electromagnetic field May accelerate in vitro endochondral ossification[J]. Bioelectromagnetics, 2015, 36(1): 35–44. DOI:10.1002/bem.21882 |
| [14] | Kim HJ, Jung J, Park JH, et al. Extremely low-frequency electromagnetic fields induce neural differentiation in bone marrow derived mesenchymal stem cells[J]. Exp Biol Med, 2013, 238(8): 923–931. DOI:10.1177/1535370213497173 |
| [15] | Shu J, He X, Zhang L, et al.Human amnion mesenchymal cells inhibit lipopolysaccharide-induced TNF-α and IL-1β production in THP-1 cells[J/OL].Biol Res, 2015, 48:69[2017-01-09].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4690291.DOI:10.1186/s40659-015-0062-3. |
| [16] | Wolf FI, Torsello A, Tedesco B, et al. 50-Hz extremely low frequency electromagnetic fields enhance cell proliferation and DNA damage:possible involvement of a redox mechanism[J]. Biochim Biophys Acta, 2005, 1743(1-2): 120–129. DOI:10.1016/j.bbamcr.2004.09.005 |
| [17] | Yagi H, Soto-Gutierrez A, Parekkadan B, et al. Mesenchymal stem cells:Mechanisms of immunomodulation and homing[J]. Cell Transplant, 2010, 19(6): 667–679. DOI:10.3727/096368910X508762 |
| [18] | Spaggiari GM, Abdelrazik H, Becchetti F, et al. MSCs inhibit monocyte-derived DC maturation and function by selectively interfering with the generation of immature DCs:central role of MSC-derived prostaglandin E2[J]. Blood, 2009, 113(26): 6576–6583. DOI:10.1182/blood-2009-02-203943 |
| [19] | Spaggiari GM, Capobianco A, Abdelrazik H, et al. Mesenchymal stem cells inhibit natural killer-cell proliferation, cytotoxicity, and cytokine production:role of indoleamine 2, 3-dioxygenase and prostaglandin E2[J]. Blood, 2008, 111(3): 1327–1333. DOI:10.1182/blood-2007-02-074997 |
| [20] | Meisel R, Brockers S, Heseler K, et al. Human but not murine multipotent mesenchymal stromal cells exhibit broad-spectrum antimicrobial effector function mediated by indoleamine 2, 3-dioxygenase[J]. Leukemia, 2011, 25(4): 648–654. DOI:10.1038/leu.2010.310 |
| [21] | Nauta AJ, Fibbe WE. Immunomodulatory properties of mesenchymal stromal cells[J]. Blood, 2007, 110(10): 3499–3506. DOI:10.1182/blood-2007-02-069716 |
| [22] | Hsu WT, Lin CH, Chiang BL, et al. Prostaglandin E2 potentiates mesenchymal stem cell-induced IL-10+IFN-γ+CD4+ regulatory T cells to control transplant arteriosclerosis[J]. J Immunol, 2013, 190(5): 2372–2380. DOI:10.4049/jimmunol.1202996 |
| [23] | Selmani Z, Naji A, Zidi I, et al. Human leukocyte antigen-G5 secretion by human mesenchymal stem cells is required to suppress T lymphocyte and natural killer function and to induce CD4+CD25highFOXP3+ regulatory T cells[J]. Stem Cells, 2008, 26(1): 212–222. DOI:10.1634/stemcells.2007-0554 |
| [24] | Brown JM, Nemeth K, Kushnir-Sukhov NM, et al. Bone marrow stromal cells inhibit mast cell function via a COX2-dependent mechanism[J]. Clin Exp Allergy, 2011, 41(4): 526–534. DOI:10.1111/j.1365-2222.2010.03685.x |
| [25] | Kim HS, Yun JW, Shin TH, et al. Human umbilical cord blood mesenchymal stem cell-derived PGE2 and TGF-β1 alleviate atopic dermatitis by reducing mast cell degranulation[J]. Stem Cells, 2015, 33(4): 1254–1266. DOI:10.1002/stem.1913 |
| [26] | Jian W, Wei Z, Zhiqiang C, et al. X-ray-induced apoptosis of BEL-7402 cell line enhanced by extremely low frequency electromagnetic field in vitro[J]. Bioelectromagnetics, 2009, 30(2): 163–165. DOI:10.1002/bem.20461 |
| [27] | Song MY, Yu JZ, Zhao DM, et al. The time-dependent manner of sinusoidal electromagnetic fields on rat bone marrow mesenchymal stem cells proliferation, differentiation, and mineralization[J]. Cell Biochem Biophys, 2014, 69(1): 47–54. DOI:10.1007/s12013-013-9764-8 |
 2017, Vol. 41
2017, Vol. 41


