2. 421001 衡阳, 南华大学公共卫生学院放射医学教研室;
3. 421002 衡阳, 衡阳市第一人民医院
2. Department of Radiation Medicine, School of Public Health, University of South China, Hengyang 421001, China;
3. the First People's Hospital of Hengyang, Hengyang 421002, China
核技术、核医学、航空航天技术的迅猛发展给人类带来巨大福利的同时,也给人们带来不同程度的放射损伤甚至死亡。如何有效地预防和治疗放射损伤受到研究者的广泛关注,目前临床上治疗放射损伤多以化学合成小分子药物[1]、天然植物化合物[2]及对症支持治疗(成分输血、补液、补充电解质、应用抗生素等)为主,但疗效并不理想,人们迫切想找到高效、可行、低毒的辐射防护新方法。随着生物技术的不断发展,使辐射防护基因治疗成为可能,人们可以通过特定载体将辐射抗性基因定点整合到靶组织,提供额外的辐射防护以减少细胞损伤,提高细胞的增殖能力和生存率[3]。耐辐射奇球菌(Deinococcus radiodurans,DR)是目前地球上发现的最具辐射抗性的生物之一[4],可耐受超过12 kGy的电离辐射,是大多数脊椎动物的3000多倍[5]。pprM是DR特有的与辐射抗性密切相关的基因,缺陷菌株对电离辐射有较高的敏感性,其表达蛋白PprM可作为pprI介导DNA损伤响应的调节子[6-7],发挥着辐射抗性的作用。本研究构建重组绿色荧光真核表达载体pEGFP-C1-pprM,将DR高抗辐射基因pprM转入离体人肾上皮293T细胞中,并成功表达PprM蛋白,为后续实验研究pprM是否提高真核细胞的辐射抗性及其可能存在的作用机制奠定实验基础,为辐射防护与辐射损伤治疗开拓新途径。
1 材料与方法 1.1 材料胎牛血清购自杭州四季青生物有限公司,DMEM细胞培养基购自美国Gibco公司,Lipofectamine 2000转染试剂盒购自美国Invitrogen公司,无内毒素质粒提取试剂盒、DNA marker、2x Taq Master Mix购自北京康为世纪生物科技有限公司,青霉素-链霉素混合溶液购自北京索莱宝公司,胰酶消化液购自杭州吉诺生物医药公司,质粒小量抽提试剂盒购自上海碧云天生物技术研究所,引物合成及测序购自苏州金唯智生物科技有限公司,BamH Ⅰ、EcoR Ⅰ限制性内切酶购自美国Fermentas公司,琼脂糖凝胶DNA回收试剂盒购自美国OMEGA公司,293T细胞、pEGFP-C1载体、pGEX-6p-1-pprM重组质粒由南华大学生物化学与分子生物学DNA损伤与修复实验室保存。
1.2 方法 1.2.1 pEGFP-C1-pprM绿色荧光真核表达载体的构建依据美国国立生物技术信息中心已公布的pprM基因序列,利用primer5.0软件设计引物,分别在上、下游引物中加入EcoR Ⅰ、BamH Ⅰ酶切位点,上游引物pprM-F序列为:5′-GGAATTCTGTGTGCCGAGTTTCG-3′,下划线为EcoR Ⅰ酶切位点;下游引物pprM-R序列为:5′-GCGGATCCTTACCAGCGGTCGTCG-3′,下划线为BamH Ⅰ酶切位点。
利用本实验室前期构建的无任何突变的载体pGEX-6p-1-pprM为模板,加入上下游引物PCR扩增pprM基因。具体反应条件为:94℃预变性5 min;94℃变性45 s、56℃退火45 s、72℃延伸1 min,35个循环;72℃终延伸8 min;4℃保存。利用限制性内切酶EcoR Ⅰ、BamH Ⅰ双酶切回收的pprM片段及pEGFP-C1空质粒,37℃酶切1.5 h,将酶切后的空质粒及pprM片段用T4 DNA连接酶进行连接,16℃连接过夜。连接产物转化至大肠杆菌JM109感受态细胞后涂布于含卡那霉素(Kan)抗性的Luria Bertani(LB)固体培养基上进行筛选,挑取转化子溶于4 μL灭菌的ddH2O中,99℃高温灭活菌体,再加入配置好的PCR混合液进行PCR扩增。注意挑取单克隆时不要全部挑尽,且要做好相应的位置标记。所筛转化子进一步用菌落PCR,双酶切及提取质粒送往苏州金唯智生物科技有限公司进行测序鉴定。
1.2.2 细胞培养及转染293T细胞培养于含10%胎牛血清、1%双抗的DMEM培养液中,置于37℃,5% CO2细胞培养箱中培养,待细胞长至70%~80%密度时,铺板进行后续试验。用无内毒素质粒提取试剂盒抽提质粒,转染293T细胞,转染按Invitrogen公司Lipofectamine 2000转染试剂盒说明书进行操作,转染时换成无抗无血清培养基。转染后37℃ 5%CO2培养箱中培养5 h,将无抗无血清培养基换成完全培养基继续培养。转染后48 h时在倒置荧光显微镜下观察绿色荧光融合蛋白表达情况及裂解细胞抽提蛋白,Western blot验证融合蛋白的表达。
2 结果 2.1 pEGFP-C1-pprM重组质粒的构建 2.1.1 pprM目的基因琼脂糖凝胶电泳鉴定结果利用pprM基因上下游引物PCR扩增目的基因,1%的琼脂糖凝胶电泳鉴定,在400 bp左右处可见一条特异性目的条带,与预期基因片段的实际大小(402 bp)一致(图 1)。
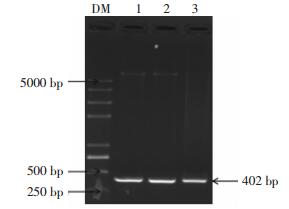
|
图 1 pprM目的基因PCR产物电泳图 Figure 1 PCR amplification products of pprM 图中,DM:DNA分子量标准;1~3:pprM基因PCR产物。 |
挑取转化子PCR扩增进行1%的琼脂糖凝胶电泳鉴定,如图 2所示,在1和3泳道有明显的约为400 bp的目的条带,结果表明1和3菌落可能为含有目的基因的阳性克隆,需进一步双酶切验证。
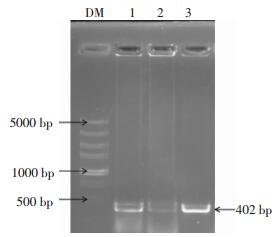
|
图 2 pEGFP-C1-pprM重组质粒菌落PCR电泳图 Figure 2 Bacterial colony PCR amplification of pEGFP-C1-pprM recombinant plasmid 图中,DM:DNA分子量标准;1,3:pEGFP-C1-pprM菌落PCR产物。 |
将图 2的1、3泳道位置对应的菌落过夜摇菌,提取质粒,利用EcoR Ⅰ、BamH Ⅰ双酶切重组质粒,1%的琼脂糖凝胶电泳鉴定,如图 3所示,在约为400 bp处有一条明显的目的条带。结果进一步表明这两个位置的菌落可能是含有目的基因的阳性克隆。
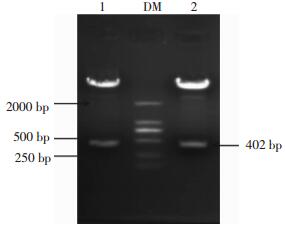
|
图 3 pEGFP-C1-pprM重组质粒双酶切产物电泳图 Figure 3 Double digestion identification results of pEGFP-C1-pprM recombinant plasmid 图中,DM:DNA分子量标准;1~2:pEGFP-C1-pprM重组质粒双酶切产物。 |
将pEGFP-C1-pprM重组质粒双酶切结果阳性菌提取质粒进行测序鉴定,部分测序结果见图 4。
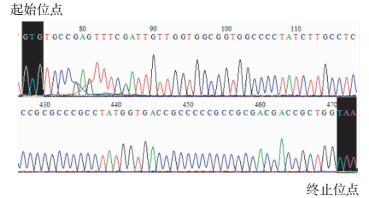
|
图 4 pEGFP-C1-pprM重组载体的部分测序结果 Figure 4 Partial sequencing results of pEGFP-C1-pprM |
将测序结果在美国国立生物技术信息中心中进行序列比对分析,结果显示构建载体序列与模板基因碱基序列相同,这说明载体构建成功。
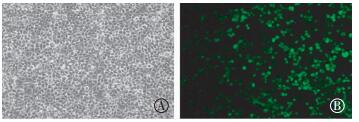
2.2 pprM基因融合蛋白的表达 2.2.1 GFP-PprM融合蛋白在293T细胞中的表达将pEGFP-C1-pprM重组质粒转入293T细胞,转染后48 h时在倒置荧光显微镜下观察绿色荧光融合蛋白的表达情况,如图 5中B所示,在绿色荧光蛋白GFP激发光下,视野中绿色荧光明显,说明pEGFP-C1-pprM重组质粒成功转染293T细胞并表达GFP-PprM融合蛋白。
|
图 5 pEGFP-C1-pprM转染的293T细胞倒置荧光显微镜观察结果(×200) Figure 5 Observation of 293T cells transfected with pEGFP-C1-pprM by Fluorescence microscopy(×200) 图中,A:pEGFP-C1-pprM转染明场图;B:绿色荧光图。 |
分别用pEGFP-C1空质粒、pEGFP-C1-pprM重组质粒转染293T细胞,48 h后裂解细胞抽提蛋白,Western blot验证融合蛋白的表达。如图 6所示,在1泳道和2泳道处有明显的目的条带,分别为GFP蛋白(相对分子质量为27×103)及GFP-PprM融合蛋白(相对分子质量为40×103),与预期的蛋白大小一致。该结果进一步表明,GFP-PprM融合蛋白能够在真核细胞中得到表达。

|
图 6 Western blot检测293T细胞中GFP蛋白和GFP-PprM融合蛋白的表达 Figure 6 Expression of GFP, GFP-PprM proteins in 293T cells analyzed by Western blot 图中,1:pEGFP-C1空质粒转染;2:pEGFP-C1-pprM重组质粒转染。 |
随着核医学技术的广泛应用及核能的不断开发,人们所受到放射污染及世界发生核辐射事故概率在逐渐增加,而人体和大多数脊椎动物耐受辐射的能力极为有限。超过1 Gy的电离辐射可引起确定性效应,如:皮肤烧伤和骨髓抑制;超过10 Gy电离辐射可导致联合脏器损伤,最终导致死亡[8]。DR对电离辐射、紫外线、干燥及一些DNA氧化损伤剂具有超强抗性[9-11],能够在15 000 Gy的辐照后存活[9],其强大的DNA修复能力能准确无误地修复由辐射引起的将近200个DNA双链断裂碎片而不发生任何突变及活力的丧失[12],因此,DR一直备受生物医学以及核医学界的重视。pprM基因是DR中特有的基因,通过对其表达的PprM蛋白进行生物信息学分析,结果发现该蛋白既含有RNA结合结构域,又拥有冷休克DNA结合结构域,能够同时结合RNA与DNA,这种结构特点在已知的DR蛋白中是非常少见的,提示该蛋白可能与DR的辐射抗性有着密切的关系。Ohba等[6]通过实验证实,pprM基因缺失菌株对γ辐照的敏感性增加,且pprM与pprA双缺失突变株比两基因单缺失突变株具有更高的辐射敏感性,研究表明pprM调节包含PprA在内的其他重要的辐射抗性蛋白。
但是,能否利用DR中辐射抗性基因pprM的表达以提高人体细胞的辐射抗性仍然未知。我们通过构建pEGFP-C1-pprM重组质粒并将其转入293T细胞,表达相应蛋白,为后续实验研究pprM基因及其产物对293T细胞辐射抗性的影响奠定了实验基础。选择pEGFP-C1绿色荧光蛋白真核表达载体可以很好地观察基因的转染情况,通过观察到的绿色荧光情况优化质粒DNA与脂质体之间的比例以达到最佳的转染效率及掌握蛋白表达的最佳时间。六孔板转染时细胞融合度约为70%,质粒DNA的量为4.0 μg,脂质体的量为10 μL时,质粒DNA的转染效率最佳,在转染后24~72 h倒置荧光显微镜下观察发现,在转染后48 h荧光强度达到最大,蛋白表达量达到高峰,因此选择转染后48 h抽提蛋白,Western blot检测pprM基因蛋白的表达。细胞转染时所用质粒纯度要求较高,光密度值260/280在1.8左右,既没有蛋白也没有RNA污染。用无内毒素试剂盒提取质粒可以很好地去除质粒中残存的内毒素,以防转染后对细胞造成损害。本研究成功构建绿色荧光蛋白真核表达载体pEGFP-C1-pprM,且将此重组载体成功转染293T细胞并通过间接荧光法检测pprM基因融合蛋白的表达,Western blot进一步验证融合蛋白的表达,为后续研究原核生物抗性基因对真核细胞辐射抗性的影响及其作用机制奠定了实验基础。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 何淑雅、杨奇负责研究命题的提出与设计、实验的实施、论文的撰写及修订;王茹静、肖方竹、王五洲负责数据的分析及整理;唐艳、蒋雨薇负责论文的修订;马云负责研究命题的提出与设计、论文的撰写及修订。
| [1] | Citrin D, Cotrim AP, Hyodo F, et al. Radioprotectors and mitigators of radiation-induced normal tissue injury[J]. Oncologist, 2010, 15(4): 360–371. DOI:10.1634/theoncologist.2009-S104 |
| [2] | Szejk M, Kołodziejczyk-Czepas J, Żbikowska HM. Radioprotectors in radiotherapy-advances in the potential application of phytochemicals[J/OL]. Postepy Hig Med Dosw(Online), 2016, 30, 70(0):722-734[2016-12-20]. https://www.ncbi.nlm.nih.gov/pubmed/27356603. DOI:10.5604/17322693.1208039. |
| [3] | Everett WH, Curiet DT. Curiel gene therapy for radioprotection[J]. Cancer Gene Ther, 2015, 22(4): 172–180. DOI:10.1667/RR14186.1 |
| [4] | Krisko A, Radman M. Biology of extreme radiation resistance:the way of Deinococcus radiodurans[J/OL]. Cold Spring Harb Perspect Biol, 2013, 5(7):a012765[2016-12-20]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3685888/.DOI:10.1101/cshperspect.a012765. |
| [5] | Sai CH, Liao R, Chou B, et al. Transcriptional analysis of Deinococcus radiodurans reveals novel small RNAs that are differentially expressed under ionizing radiation[J]. Appl Environ Microbiol, 2015, 81(5): 1754–1764. DOI:10.1128/AEM.03709-14 |
| [6] | Ohba H, Satoh K, Sghaier H, et al. Identification of pprM:a modulator of the pprI-dependent DNA damage response in Deinococcus radiodurans[J]. Extremophiles, 2009, 13(3): 471–479. DOI:10.1007/s00792-009-0232-8 |
| [7] | Jeong SW, Seo HS, Kim MK, et al. pprM is necessary for up-regulation of katE1, encoding the major catalase of Deinococcus radiodurans, under unstressed culture conditions[J]. J Microbiol, 2016, 54(6): 426–431. DOI:10.1007/s12275-016-6175-8 |
| [8] | Mettler FA. Medical effects and risks of exposure to ionising radiation[J/OL]. J Radiol Prot, 2012, 32(1):N9-13[2016-12-20]. http://sci-hub.cc/10.1088/0952-4746/32/1/N9. DOI:10.1088/0952-4746/32/1/N9. |
| [9] | Li J, Li Q, Ma X, et al. Biosynthesis of gold nanoparticles by the extreme bacterium Deinococcus radiodurans and an evaluation of their antibacterial properties[J]. Int J Nanomedicine, 2016, 11: 5931–5944. DOI:10.2147/IJN.S119618 |
| [10] | Passot FM, Nguyen HH, Dard-Dascot C, et al. Nucleoid organization in the radioresistant bacterium Deinococcus radiodurans[J]. Mol Microbiol, 2015, 97(4): 759–774. DOI:10.1111/mmi.13064 |
| [11] | Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans[J]. Microbiol Mol Biol Rev, 2011, 75(1): 133–191. DOI:10.1128/MMBR.00015-10 |
| [12] | Battista JR. Radiation resistance:The fragments that remain[J/OL]. Curr Biol, 2000, 10(5):R204-205[2016-12-20]. http://www.cell.com/current-biology/pdf/S0960-9822(00)00353-5.pdf. |
 2017, Vol. 41
2017, Vol. 41


