2. 200032 上海, 复旦大学附属中山医院神经内科
患者男性,62岁,因无明显诱因出现反应迟钝、情感淡漠、嗜睡伴动作迟缓并进行性加重2个月后,于2013年10月30号入院。患者曾于外院接受活血化瘀及脱水治疗,症状未见缓解。既往无特殊疾病史。体格检查:右手不自主运动,四肢肌张力正常,腱反射(+++),双侧霍夫曼征(+)。简易智力状态检查量表(MMSE)评分为27。实验室检查:自身免疫抗体、甲状腺功能、肿瘤标志物、肝肾功能、血糖、血同型半胱氨酸、血尿便常规检查均正常;脑脊液细菌、结核菌、真菌均为阴性;脑电图示中度异常,未见三相波;腰穿抽取脑脊液检测结果示葡萄糖、氯化物含量正常,14-3-3蛋白为阳性,朊蛋白基因(prion protein gene,PRNP)检测结果129位氨基酸多态性为M/M型,219位氨基酸多态性为E/E型,未发现与遗传型克雅病相关的突变,依照《全国克雅氏病监测方案》,建议诊断为散发型克雅病(sporadic Creutzfeldt-Jakob disease,sCJD)。
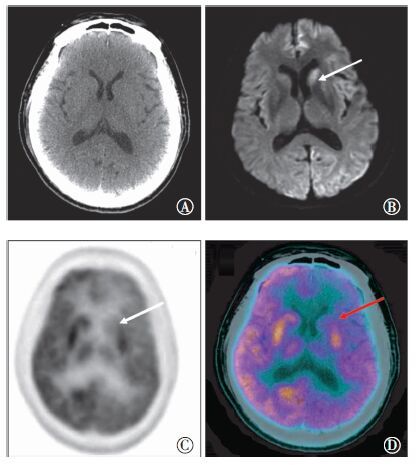
影像学检查:行CT平扫未见明显异常病灶(图 1中A),MRI示左侧尾状核头部可见一长T1长T2信号灶,弥散加权成像(diffusion weighted imaging,DWI)呈高信号(图 1中B)。颅内动脉、颈动脉、椎动脉的动脉血管造影未见异常。随即行18F-FDG(上海原子科兴药业有限公司提供)PET/CT(GE discovery VCT型PET/CT仪,其中CT为64排螺旋CT)筛查肿瘤性病变。脑部PET/CT图像显示左侧大脑半球弥漫性糖代谢减低,左侧额顶、颞叶和基底节、丘脑更为显著(图 1中C~D),脑实质密度未见明显异常,脑室未见明显扩大和推移,体部显像未见明显糖代谢异常。
|
图 1 患者男性,62岁,散发型克雅病,脑部CT、MRI、PET/CT图像图中,A:CT平扫图像,脑实质未见明显异常;B:MRI弥散加权图像,图中示左侧尾状核头部呈高信号;C~D:分别为同一层面的PET图像和PET/CT融合图像,图中示左侧额顶、颞叶和基底节、丘脑弥漫性糖代谢减低,脑CT平扫未见明显异常。 |
克雅病又称皮质-纹状体-脊髓变性或亚急性海绵状脑病,是一种高致死性、强传染性,与异常朊蛋白相关的中枢神经系统海绵样退行性疾病,以迅速进行性痴呆、肌阵挛和脑电图特征性周期性同步放电为特征[1]。克雅病平均发病年龄为65岁,可分为遗传型、散发型、医源型以及与疯牛病密切相关的变异型克雅病。研究报道,sCJD发病率约占84%,遗传型约10%,医源型约3%~4%,变异型约3%[2]。
sCJD的病理学改变局限在中枢神经系统,组织病理学特征包括脑组织海绵样变性、星形胶质细胞增生和神经元丢失;病变弥漫分布于大脑灰质、纹状体、丘脑、脑干的灰质结构和小脑皮质的分子层,也可分布在海马体[3]。脑组织活检病理学检查是确诊该病的金标准。但在临床应用中,脑组织活检的可行性非常小,因此sCJD的诊断必须结合临床表现和辅助检查。脑脊液中的Tau蛋白和13-4-4蛋白具有特征性,两者含量升高时高度提示sCJD,但也有部分患者检测结果为阴性。脑电图检查在sCJD的诊断中有重要意义,周期性同步放电是sCJD又一特征性表现,诊断特异度为67%,灵敏度为86%[4]。但是,本例患者脑电图检查结果并无周期性同步放电引起的典型双相或三相周期性复合波。另外,头颅MRI DWI和液体衰减反转恢复序列也可为sCJD诊断提供重要信息,其中MRI DWI的灵敏度及特异度均较高,分别为93.8%和92.3%~100%[5]。MRI典型表现为DWI和液体衰减反转恢复序列上大脑皮质、基底节(尤其是尾状核头和壳)、丘脑对称性信号增高,而T1WI序列未见异常;MRI增强扫描未见病灶强化[6-9]。
目前国内有关该病的报道较少,PET/CT分子影像诊断更鲜有报道。本例患者同机脑CT图像并未见明显异常,脑MRI检查仅显示左侧尾状核头部信号增高。18F-FDG PET/CT显像表现为左侧额顶、颞叶和基底节、丘脑广泛性糖代谢明显减低,且与其临床表现高度一致。在疾病进展早期,灰质的海绵样变性并不明显,但朊蛋白沉积引起神经元功能损伤时即可发现其所致的糖代谢减低,表明18F-FDG PET/CT显像在早期诊断中表现出明显的优越性。近期一项研究对17例sCJD患者进行18F-FDG PET显像,结果显示其灵敏度为94.1%,较MRI检查可以更早、更多地发现脑部病变[10]。Eun-Joo等[11]应用统计参数图(SPM)软件对11例sCJD患者的18F-FDG PET图像进行分析,结果显示患者双侧额顶、枕叶糖代谢减低,而基底节、丘脑、海马体、杏仁体等糖代谢并无明显异常,与Engler等[12]的结果基本一致。Henkel等[13]研究报道sCJD患者除了颞叶或顶叶存在糖代谢减低灶外,还发现枕叶、小脑、基底节、丘脑处糖代谢减低的病灶。
sCJD最需要与阿尔茨海默病相鉴别,两者临床均表现为迅速进展性痴呆。但是,阿尔茨海默病18F-FDG PET/CT显像早期典型表现为双侧颞顶叶皮质对称性糖代谢减低,晚期表现为整个大脑皮质代谢减低;而sCJD早期一般表现为单侧性病变[6],可能更早累及基底节、丘脑等深部核团。因此,18F-FDG PET/CT显像可精准地诊断出克雅病。随着对sCJD认知程度的提高,临床治疗上可更早进行干预,延缓病情进展,从而提高患者的生活质量。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 肖杰负责文章的撰写;修雁负责命题设计的最初指导;张洁负责数据分析;金莉蓉负责患者的随访工作;石洪成负责文章的审阅。
| [1] |
李靖, 苏净, 赵贺玲, 等.
克雅脑病三例[J]. 中华全科医师杂志, 2012, 11(3): 234–235.
Li J, Su J, Zhao HL, et al. Three cases of Creutzfeldt-Jakob disease[J]. Chin J Gen Pract, 2012, 11(3): 234–235. DOI:10.3760/cma.j.issn.1671-7368.2012.03.033 |
| [2] | Wieser HG, Schindler K, Zumsteg D, et al. EEG in Creutzfeldt-Jakob disease[J]. Clin Neurophysiol, 2006, 117(5): 935–951. DOI:10.1016/j.clinph.2005.12.007 |
| [3] | Ukisu R, Kushihashi T, Tanaka E, et al. Diffusion-weighted MR imaging of early-stage Creutzfeldt-Jakob disease:typical and atypical manifestations[J]. Radiographics, 2006, 26(Suppl 1): S191–S204. DOI:10.1148/rg.26si065503 |
| [4] | Irani N. The classic and variant forms of Creutzfeldt-Jakob disease[J]. Semin Clin Neuropsychiatry, 2003, 8(1): 71–79. DOI:10.1053/scnp.2003.50001 |
| [5] | Shiga Y, Miyazawa K, Sato S, et al. Diffusion-weighted MRI abnormalities as an early diagnostic marker for Creutzfeldt-Jakob disease[J]. Neurology, 2004, 63(3): 443–449. DOI:10.1212/01.WNL.0000134555.59460.5D |
| [6] | Vitali P, Maccagnano E, Caverzasi E, et al. Diffusion-weighted MRI hyperintensity patterns differentiate CJD from other rapid dementias[J]. Neurology, 2011, 76(20): 1711–1719. DOI:10.1212/WNL.0b013e31821a4439 |
| [7] | Young GS, Geschwind MD, Fischbein NJ, et al. Diffusion-weighted and fluid-attenuated inversion recovery imaging in Creutzfeldt-Jakob disease:high sensitivity and specificity for diagnosis[J]. AJNR Am J Neuroradiol, 2005, 26(6): 1551–1562. |
| [8] | Tschampa HJ, Kallenberg K, Kretzschmar HA, et al. Pattern of cortical changes in sporadic Creutzfeldt-Jakob disease[J]. AJNR Am J Neuroradiol, 2007, 28(6): 1114–1118. DOI:10.3174/ajnr.A0496 |
| [9] | Zerr I, Kallenberg K, Summers DM, et al. Updated clinical diagnostic criteria for sporadic Creutzfeldt-Jakob disease[J]. Brain, 2009, 132(Pt 10): 2659–2668. DOI:10.1093/brain/awp191 |
| [10] | Zhao W, Zhang JT, Xing XW, et al.Chinese specific characteristics of sporadic Creutzfeldt-Jakob disease:a retrospective analysis of 57 cases[J/OL].PLoS One, 2013, 8(3):e58442[2016-01-01].http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0058442.DOI:10.1371/journal.pone.0058442. |
| [11] | Eun-Joo K, Sang-Soo C, Byung-Hoon J, et al. Glucose metabolism in sporadic Creutzfeldt-Jakob disease:an SPM analysis of 18F-FDG PET[J]. Eur J Neurol, 2012(19): 488–493. DOI:10.1111/j.1468-1331.2011.03570.x |
| [12] | Engler H, Lundberg PO, Ekbom K, et al. Multitracer study with positron emission tomography in Creutzfeldt-Jakob disease[J]. Eur J Nucl Med Mol Imaging, 2003, 30(1): 85–95. DOI:10.1007/s00259-002-1008-x |
| [13] | Henkel K, Zerr I, Hertel A, et al. Positron emission tomography with [18F] FDG in the diagnosis of Creutzfeldt-Jakob disease (CJD)[J]. J Neurol, 2002, 249(6): 699–705. DOI:10.1007/s00415-002-0695-3 |
 2017, Vol. 41
2017, Vol. 41


