2 中国科学院大学, 北京 100049)
湿地是水陆相互作用形成的独特生态系统,具有季节或常年积水、生长或栖息喜湿动植物以及土壤发育潜育化3个基本特征[1]。全球湿地面积约占世界陆地表面的5 % ~8 % [2],但由于厌氧环境对其有机质降解的抑制作用,导致湿地积累了大量的土壤碳[3],其储量约占全球土壤碳储量的30 % [2]。因此,湿地生态系统在过去一直被认为是大气二氧化碳(CO2)的重要碳汇。同时,湿地也是重要温室气体甲烷(CH4)的主要排放源,其排放量占大气CH4自然源的70 %,占全球CH4排放量的15 % ~30 % [4]。因此,CH4排放一直是湿地生态系统碳循环研究关注的重点。
湿地CO2和CH4排放受到土壤中复杂的物理和生物化学过程的调控[5~6]。CO2是有机碳有氧分解的主要产物;在缺氧条件下,厌氧微生物将有机碳分解为CH4和CO2,二者的比例取决于产CH4过程中CH4和CO2的产量以及其他厌氧过程(如反硝化、铁还原、硫酸盐还原等)的CO2产量[7]。由此可见,CO2 : CH4的排放比例受到氧化还原反应的调控。与CO2相比,CH4在大气中停留时间更长[8],具有更强的红外光吸收能力,其百年尺度的全球增温潜势是CO2的45倍[5]。因此,深入研究湿地CO2 : CH4的排放比例及其影响因素对准确理解和预测湿地碳循环过程及其对未来环境变化的响应和影响具有重要意义。
近年来,国内外学者已经在湿地生态系统CO2和CH4的排放规律和影响因素及其对全球变化的响应等方面开展了比较深入的研究[9~13],为量化湿地在全球气候变化中的作用奠定了基础。如近期研究发现,增温导致北方泥炭地CO2 : CH4排放比例显著降低,原因是随着温度的增加,CH4排放量呈指数增加趋势[14]。该研究认为增温会导致泥炭地碳排放以CH4为主,可能进一步促进全球变暖,形成正反馈效应。此外,也有研究表明,受到气候变化和人为活动影响,湿地水位下降后,CO2的排放量大大增加,而CH4的排放量减少,进而导致CO2 : CH4排放比例升高[15];湿地CO2 : CH4的排放比例受到水位、温度、pH、植被等因素的综合影响[15~17]。本文整合了近30年发表的82篇文献数据,阐明了不同类型湿地CO2 : CH4的排放比例的特征和关键影响因素,并进一步讨论了影响湿地CO2 : CH4排放比例的其他因素,有助于深入认识影响湿地CO2和CH4排放的关键过程和机制,以期为准确预测湿地对全球变化的响应提供理论依据。
1 研究方法湿地类型多种多样,自然湿地包括沼泽湿地、湖泊湿地、河流湿地、滨海湿地等,人工湿地主要有稻田、水库、池塘等[18]。其中沼泽湿地由于具有高度多样性和结构复杂性,为了更全面反映沼泽湿地生态环境差异,又将其细分为藓类泥炭沼泽(又称为“雨养泥炭沼泽”(bog))、草本泥炭沼泽(又称为“矿养泥炭沼泽”(fen))、木本沼泽(swamp,包括森林沼泽和灌丛沼泽)和草本沼泽(marsh)[19]。为了探讨不同类型湿地CO2 : CH4的排放比例及其影响因素,本文利用Web of Science和CNKI中国知网数据库,分别以“wetland”、“peatland”、“mire”、“bog”、“fen”、“marsh”、“swamp”、“carbon dioxide”、“methane”、“CO2”、“CH4”或“湿地”、“泥炭地”、“二氧化碳”、“甲烷”等为关键词,检索了1990~2020年间发表的相关文献。数据筛选标准如下: 1)文献中必须同时包含CO2和CH4的通量或浓度数据;2)室内培养实验需剔除添加有机质的数据。将收集到的文献归为野外观测和室内培养两类,野外观测相关的文献69篇,包括藓类泥炭沼泽、草本泥炭沼泽、木本沼泽、草本沼泽、滨海湿地、河流湿地、湖泊湿地和稻田8种湿地类型。室内培养的相关文献13篇,包括藓类泥炭沼泽、草本泥炭沼泽、木本沼泽、河流湿地、湖泊湿地和稻田6种湿地类型。通过文献报道的CO2、CH4浓度或通量数据计算CO2 : CH4的排放比例。为了研究影响湿地CO2 : CH4排放比例的因素,同时收集了相应的影响因子信息,受到可获取的影响因子数据量的限制,本文相关性分析中仅分析了pH、年均降水量、水位、土壤含水率、大气年均温度、土壤温度和盐度与CO2 : CH4排放比例的关系。数据分析时,首先对原始数据进行对数转化使其满足正态分布,然后利用单因素方差分析(Analysis of Variance, 简称ANOVA)进行差异性比较,利用Pearson线性相关进行一元相关性分析。统计分析使用SPSS 19.0(SPSS,Chicago,USA)完成,本文所有检验的显著性水平为p < 0.05。
2 结果分析 2.1 不同类型湿地CO2 : CH4排放比例不同类型湿地CO2 : CH4的排放比例见图 1。结果显示,与野外观测结果相比,室内培养实验得到的CO2 : CH4排放比例较低(图 1)。例如,野外观测和室内培养实验得到的CO2 : CH4排放比例在藓类泥炭沼泽分别是2830±1185(平均值±标准误差;n=49)和1146±574(n=21),在稻田分别是372±95(n=13)和36±18(n=8)。野外观测实验得到的CO2 : CH4排放比例较高可能与野外观测中植物根系呼吸(自养呼吸)对CO2的贡献较高(可高达30 %)有关[20]。此外,室内培养实验中完全厌氧条件以及较短的培养周期也可能是导致CH4排放量较高,而CO2 : CH4排放比例较低的重要原因。
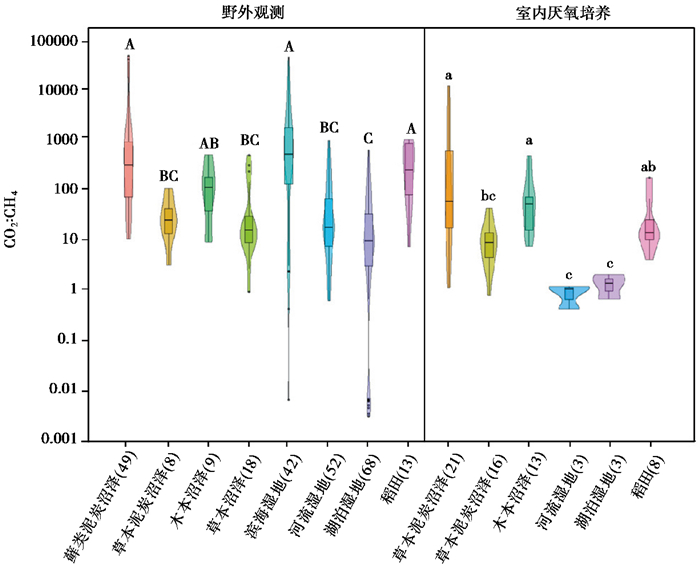
|
图 1 不同类型湿地CO2 : CH4的排放比例 小提琴图的形状表示数据的密度分布;箱式图上方和下方的线段分别表示上四分位数和下四分位数,箱式图内部的横线表示数据的中位数;横坐标括号内数字代表文献收集的数据量;不同字母分别表示野外观测(A、B、C)和室内培养(a、b、c)得到的不同类型湿地CO2 : CH4排放比例的差异性比较(p < 0.05) Fig. 1 The CO2 : CH4 ratios in various types of wetlands. The shape of violin plot is kernel density estimation to show the distribution shape of the data. The upper and lower end of boxes denote the 0.25 and 0.75 percentiles, respectively. The solid lines in the box mark the median of each dataset. Numbers in brackets of the abscissa indicate data numbers of literature collection. Different letters indicate significant differences of CO2 : CH4 ratios in various wetland types(A~C for field observation and a~c for laboratory incubation; p < 0.05) |
此外,不同类型湿地CO2 : CH4的排放比例差异较大(图 1)。在野外观测数据中,藓类泥炭沼泽、滨海湿地和稻田中CO2 : CH4排放比例最高(平均值>100),与木本沼泽无显著差异,而草本泥炭沼泽、草本沼泽、河流湿地和湖泊湿地中CO2 : CH4排放比例较低(平均值< 100)。与野外观测结果相似,室内培养实验数据也呈现出藓类泥炭沼泽、木本沼泽和稻田中CO2 : CH4排放比例显著高于草本泥炭沼泽、河流湿地和湖泊湿地的规律(p < 0.05)。
2.2 不同类型湿地CO2 : CH4排放比例的影响因素利用一元相关性分析探讨湿地CO2 : CH4排放比例与影响因子之间的关系,研究发现,湿地CO2 : CH4的排放比例与pH和水位呈显著负相关关系(p < 0.05;图 2a和2c),与盐度呈显著正相关关系(p < 0.05;图 2g)。但是,其他环境因子,包括年均降水量、土壤含水率、大气年均温度和土壤温度均与湿地CO2 : CH4的排放比例无显著性相关关系(p < 0.05;图 2b和2d~2f)。
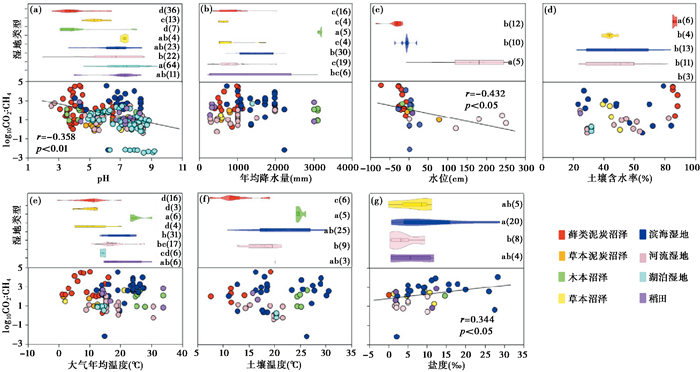
|
图 2 不同类型湿地pH值(a)、年均降水量(b)、水位(c)、土壤含水率(d)、大气年均温度(e)、土壤温度(f)、盐度(g)及其与CO2 : CH4排放比例的一元相关关系 不同小写字母表示图例中8种不同类型湿地pH值、年均降水量、水位、土壤含水率、大气年均温度、土壤温度、盐度的差异性比较(p < 0.05) 括号内数字代表文献收集的数据量;实线为一元相关趋势线,显著性水平为p < 0.05 Fig. 2 The pH (a), mean annual precipitation (b), water table (c), soil water content (d), mean annual air temperature (e), soil temperature (f) and salinity (g) in various wetland types and their correlation with CO2 : CH4 ratios. Different lowercase letters indicate significant differences of pH, mean annual precipitation, water table, soil water content, mean annual temperature, soil temperature and salinity in eight wetland types(p < 0.05). Numbers in brackets indicate data numbers of literature collection and solid lines indicate significant linear correlations at the level of p < 0.05 |
本研究中,藓类泥炭沼泽CO2 : CH4排放比例显著高于其他类型湿地(图 1),可能与其较低的pH有关,这一结果可以从CO2 : CH4排放比例与pH的显著负相关关系验证(图 2a)。藓类泥炭沼泽也称“酸沼”,相比于其他湿地类型,具有低pH和低水位的特点[1](图 2a和2c)。已有研究表明,土壤pH通过调控微生物(包括产CH4菌以及CH4氧化菌)的数量和活性从而影响CO2和CH4的排放[21~23]。在美国西弗吉尼亚州泥炭藓为主的泥炭地中,CO2 : CH4的排放比例随土壤pH值的增加(从3.1增加到6.8)而降低,因为CH4的产生量随pH值的增加而增加[21~22];同样,Zalman等[23]的培养实验结果表明,CO2 : CH4的排放比例随泥炭地土壤pH的增加而降低。上述结果说明产CH4菌的活性随土壤pH值的增加而增强,这与文献中报道的产CH4菌的最适pH范围为6~8的结果一致[11, 22]。此外,在较高的土壤pH值条件下,生物体维持其与周围环境之间质子梯度平衡所需能量较少,因此CO2的产生速率较低,从而导致CO2 : CH4的排放比例较低[12];但也有研究发现,CO2 : CH4的排放比例与土壤pH呈弱相关或没有重要的相关关系[24],认为其他因子(如水位、有机质质量等)对CO2 : CH4排放比例的影响可能更大[12, 23]。
3.2 水分对湿地CO2 : CH4排放比例的影响本研究中,藓类泥炭沼泽较低的水位也是造成其CO2 : CH4排放比例较高(图 1)的重要原因,这一结果可以从CO2 : CH4排放比例与水位的显著负相关关系验证(图 2c)。大量研究表明,湿地水位是影响CO2和CH4排放最重要的因素之一[15]。湿地水位通过调控土壤含水率和氧化还原条件影响产CH4菌及CH4氧化菌的活性[11],长期淹水和厌氧状况下的湿地是大气CH4的重要排放源。在淹水土壤中,CH4产生量可在较短时间内达到峰值;而在干燥的土壤中,产CH4菌的数量和活性远小于淹水土壤[17],因此CH4的产生量小,且存在时间滞后性[25~26]。受气候变化和人为活动干扰(如泥炭开采、挖沟)的影响,湿地水位显著下降[27~30],土壤氧气含量显著增加,从而使CH4氧化菌活性增强,CH4被大量氧化,排放量减少,而CO2排放量增加,进而导致CO2 : CH4的排放比例升高[11]。
降水可以通过改变湿地水位、含水率以及微生物活性等,从而影响CO2和CH4的产生与排放[31]。一般认为,随着降水量的增加,土壤含水率会增加,CO2的排放通量会减少,而CH4的排放会增加[32],由此可以推测CO2 : CH4的排放比例应该与降水量和土壤含水率负相关,即随降水量和土壤含水率的增加,CO2 : CH4的排放比例降低。然而,本研究中相关分析结果显示,湿地CO2 : CH4排放比例与年均降水量和土壤含水率均无显著相关性(图 2b和2d),这可能是由于其他因子比降水量和土壤含水率对CO2 : CH4排放比例的影响更大。另外,文献相关数据量较少也可能是导致CO2 : CH4排放比例与降水量和土壤含水率无一致性规律的重要原因。
3.3 温度对湿地CO2 : CH4排放比例的影响土壤温度主要通过影响微生物活性间接影响CO2和CH4的排放,在一定温度范围内,CO2和CH4的排放量均随温度的上升而增加[33~34]。土壤温度还是厌氧条件下控制CH4排放的重要因子[14, 35];随着土壤温度的增加,产CH4菌活性增强,湿地CH4的产生和排放量大大增加,因此湿地CO2 : CH4排放比例会随土壤温度的升高而降低[14, 21~22, 36]。研究认为土壤温度与CO2 : CH4排放比例之间的负相关关系,是因为CH4对温度的敏感性更高[37~38],即随土壤温度的增加,CH4释放量的增加量大于CO2增加量[12]。
气温通过对土壤(或水体)温度的调节作用引起CO2和CH4的排放通量呈现明显的季节变化,一般CO2和CH4排放量在气温最高的夏季最高,其他季节明显降低[33~34, 39]。但也有研究发现,CO2和CH4的排放与气温或土壤温度呈弱相关或没有显著的相关关系[40~42]。这与本研究中CO2 : CH4排放比例与大气平均温度和土壤温度无显著相关的结果(图 2e~2f)是一致的。这是因为温度对CO2 : CH4排放比例的影响还受水分、土壤性质(pH、质地、有机质质量等)等因素的影响,如温度升高,可能导致蒸发作用增强,湿地水位降低,进而反向调控CO2 : CH4排放比例[41~43]。Roulet等[43]的研究发现,当土壤处于水分过饱和时,CH4排放随温度增加而增加,则CO2 : CH4的排放比例降低;但当水位低于土壤表层时,CO2和CH4的排放以及比例由水位决定,因此,温度的相对重要性取决于湿地的淹水状况。
3.4 盐度对湿地CO2 : CH4排放比例的影响本研究中,相比于其他类型湿地,滨海湿地中CO2 : CH4的排放比例高可能主要与其盐分高有关[44],这一结果也可以从其CO2 : CH4排放比例与盐度显著正相关得以验证(图 2g)。一方面,高盐分的环境中硫酸根(SO42-)的浓度较高,抑制了产CH4菌的数量和活性,从而减少CH4的产生[7, 45~46];另一方面,高盐分的环境增强了CH4氧化菌和硫酸盐还原细菌的丰度,促进了CH4的氧化,减少CH4的产生[47]。同样,王纯等[48]利用室内培养试验模拟海水入侵的影响,证实盐分对CH4的产生潜力具有显著的抑制作用;此外,也有研究认为[49],滨海湿生植物(如碱蓬)也可能通过根系泌氧消耗大量的CH4,从而减少CH4排放,使其CO2 : CH4排放比例较高。
3.5 其他因子对湿地CO2 : CH4排放比例的影响湿地CO2 : CH4排放比例还受到多种其他因素的影响,例如内部因素土壤有机质组成以及外部环境因素植被类型、冻土融化、湖泊面积等都是影响湿地生态系统CO2 : CH4排放比例的重要因子[15, 49~53]。下面将依次对影响CO2 : CH4排放比例的其他内部因素和外部因素分别进行阐述。
湿地中CO2和CH4的产生和排放还依赖于土壤有机质的数量、质量以及电子受体的有效性和性质[50~51]。如厌氧培养实验表明,葡萄糖添加可促进CH4的产生和排放,导致CO2 : CH4的排放比例降低[22],而添加大分子的腐殖酸则会导致CO2 : CH4排放比例升高[54]。与此类似,泥炭沼泽的野外监测研究发现,CO2 : CH4的排放比例与易矿化有机碳和水溶性有机碳含量呈负相关[54~56]。在泥炭藓为主的藓类泥炭沼泽中,泥炭藓分泌大量的芳香性有机酸,可抑制CH4的产生,相对提高CO2 : CH4的排放比例[55~56]。相比之下,草本泥炭沼泽中有机质的平均分子量较低,含有更多的蛋白类和微生物脂类[6],更有利于CH4的产生,因此CO2 : CH4排放比例较低。
湿地植物可以通过有机质供给和根系结构影响CO2和CH4的产生、氧化和传输过程,从而影响CO2 : CH4的排放比例[15, 57]。禾草植物为主的湿地CO2 : CH4的排放比例显著低于灌木和木本植物为主的湿地生态系统[15, 58],一方面是因为禾草植物为产CH4菌提供的底物(或易分解物质)更丰富,因此产生CH4的速率最高[15];另一方面,禾草植物具有通气组织,可直接将土壤或根系附近产生的CH4通过植物传输至大气,避免其被嗜CH4菌氧化,从而提高CH4的通量[57]。不过,植物通气组织也会向根系提供氧气,提高根际的氧化还原电位,从而降低CH4的产生[11]。植物生长周期也会对CO2 : CH4排放比例产生影响,由于秋冬季节植物衰老导致根系呼吸释放的CO2量相对于CH4的量更少,因此CO2 : CH4的排放比例相对于春夏季较低[59]。
北方多年冻土区分布了大量的泥炭沼泽,存储了大量土壤碳[58]。在全球变暖的背景下,多年冻土的覆盖面积减小[60~63],近期研究表明,当富含冰的永久冻土融化时,随着冰融化,融化的区域相对于周围的区域会下沉,土壤变得淹水,形成沼泽或热融湖塘,从而促进微生物厌氧呼吸,增加CH4的产生速率,因此冰融化后的永久冻土区往往成为CH4排放的热点区域[58]。例如,在永久冻土区,活动层CH4的产生速率是冻土层的4倍,CO2产生速率是冻土层的2倍,因此活动层CO2 : CH4的产生比例显著低于冻土层[15]。此外,随着冻土融化,CO2和CH4的释放量和比例还取决于土壤水分、温度、氧化还原状态、有机质质量等环境因素,以及植被和微生物群落组成的变化[64]。因此,冻土融化对CO2 : CH4排放比例的影响非常复杂,研究结果仍存在很大的不确定性。
湖泊(特别是水深小于3m的湖泊)也常被归为一类特殊的湿地[18]。近期表明,湖泊表面积与CO2和CH4的浓度呈负相关关系,即CO2和CH4的浓度随着湖泊面积的增大而降低[52~53]。然而,湖泊面积与CO2 : CH4排放比例呈正相关关系,即CO2 : CH4排放比例随湖泊面积增大而增加,如在小湖泊(<0.001km2)中CO2 : CH4排放比例约为10,而在大湖(10~100km2)中则高达150[65]。CH4在湖泊厌氧沉积物和水体中产生,而在向上逸出的过程中被水体中的嗜CH4菌氧化[65~66]。湖泊面积小,通常意味着水深较浅,小湖泊较浅的水深和频繁的混合意味着与大气的交换更快,使得通过氧化去除CH4的时间较少,CH4的氧化潜力较低;而在较深的大湖泊中CH4的停留时间更长,CH4氧化的潜力较高[67]。此外,相比于面积较大的湖泊,面积较小的湖泊的周长和面积比值较高,加之水深较浅,因此陆源碳的载荷量较高,大量陆源碳为微生物呼吸提供了丰度的底物,从而增加CO2的浓度,提高CO2 : CH4排放比例[68]。由此可见,湖泊面积引起的CO2 : CH4排放比例变化受到湖泊水深的影响,但不全是水深导致的结果。
本研究发现,与自然湿地相比,人工湿地稻田具有较高的CO2 : CH4排放比例(图 1),其原因除了与水稻根系泌氧加大CH4的氧化、减少CH4的排放有关外,还可能与稻田施肥增加SO42-的含量,进而对产CH4菌产生毒害作用有关[69]。另外,稻草表施还田也会增加CO2 : CH4的排放比例,这是因为稻草表施还田减少了稻草与土壤的接触,增加了稻草在土壤表层的有氧降解,因此,产物主要以CO2的形式释放,同时降低了稻田CH4的排放[70]。
影响湿地CO2 : CH4排放比例的其他因子还包括土壤质地、氧化还原电位、微生物生物量和多样性等[71~74],但由于相关文献(1~3篇)和数据条目(3~7条)较少,且涉及的湿地类型单一,为了避免得出片面性的结论,因此本文不做重点分析和讨论。事实上,不同类型湿地CO2 : CH4排放比例的差异是土壤pH、水分、温度、盐度、植被等影响因子综合作用的结果,并且控制因子的相对重要性因不同湿地类型而异。
4 结论湿地是温室气体CH4和CO2的重要排放区域,在全球碳循环中起着重要作用。本文整合分析了不同类型湿地CO2 : CH4排放比例及其影响因素。结果表明,藓类泥炭沼泽、滨海湿地和稻田中CO2 : CH4排放比例显著高于草本沼泽、河流湿地和湖泊湿地等。低水位和低pH抑制CH4排放是导致藓类泥炭沼泽CO2 : CH4排放比例高的重要原因,而高盐分环境抑制CH4排放是导致滨海湿地CO2 : CH4排放比例高的重要原因。与自然湿地相比,稻田人为施肥和稻草还田措施对抑制CH4排放起着重要作用。事实上,不同类型湿地CO2 : CH4排放比例的差异是土壤pH、水分、温度、盐度、植被等影响因子综合作用的结果,并且控制因子的相对重要性因不同湿地类型而异。
通过整合分析,我们认为目前有关湿地CO2 : CH4排放比例的研究还存在以下几个问题: 1)关于不同类型湿地中CO2 : CH4排放比例的文献较少,基于有限的数据,湿地CO2 : CH4排放比例的特征和影响因素仍存在很大的不确定性,未来应该加强不同湿地类型(包括天然湿地和人工湿地)、不同植被类型以及不同退化程度湿地中CO2 : CH4排放比例研究。2)湿地生态系统中CO2和CH4通量的观测方法(包括静态箱法、涡度相关法等)不统一,导致不同类型甚至同一类型湿地中CO2 : CH4排放比例存在较大差异,不同研究结果的可比性较差。特别是,静态箱法获取的通量数据大多仅包括生长季,但不同季节湿地水位、温度、微生物数量和活性等因素均不同,必然导致CO2 : CH4排放比例存在较大季节差异。因此未来应加强湿地生态系统中CO2和CH4通量的观测方法和观测时间的统一。3)目前影响CO2 : CH4排放比例的环境因素研究还不够深入,仅有少数文献分析了CO2 : CH4排放比例与温度、植被等环境因子以及与微生物等生物因子的相关关系,且大多数文献多是基于与环境因子的单因素相关关系,缺乏多因素耦合作用分析,未来亟待加强湿地CO2 : CH4排放比例的分布特征及其主要驱动机制研究,以期为全球变化对湿地CO2和CH4排放反馈作用的预测提供理论依据。
| [1] |
吕宪国, 王起超, 刘吉平. 湿地生态环境影响评价初步探讨[J]. 生态学杂志, 2004, 23(1): 83-85. Lü Xianguo, Wang Qichao, Liu Jiping. Primary study on impact assessment of wetland ecological environment[J]. Chinese Journal of Ecology, 2004, 23(1): 83-85. DOI:10.3321/j.issn:1000-4890.2004.01.018 |
| [2] |
Mitsch W J, Bernal B, Nahlik A M, et al. Wetlands, carbon, and climate change[J]. Landscape Ecology, 2013, 28(4): 583-597. DOI:10.1007/s10980-012-9758-8 |
| [3] |
Bridgham S D, Megonigal J P, Keller J K, et al. The carbon balance of North American wetlands[J]. Wetlands, 2006, 26(4): 889-916. DOI:10.1672/0277-5212(2006)26[889:TCBONA]2.0.CO;2 |
| [4] |
宋长春. 湿地生态系统甲烷排放研究进展[J]. 生态环境学报, 2004, 13(1): 69-73. Song Changchun. Advance in the studies on methane emission from wetlands[J]. Ecology and Environment, 2004, 13(1): 69-73. DOI:10.3969/j.issn.1674-5906.2004.01.021 |
| [5] |
Neubauer S C, Megonigal J P. Moving beyond global warming potentials to quantify the climatic role of ecosystems[J]. Ecosystems, 2015, 18(6): 1000-1013. DOI:10.1007/s10021-015-9879-4 |
| [6] |
Hodgkins S B, Tfaily M M, Mccalley C K, et al. Changes in peat chemistry associated with permafrost thaw increase greenhouse gas production[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(16): 5819-5824. DOI:10.1073/pnas.1314641111 |
| [7] |
Keller J K, Weisenhorn P B, Megonigal J P. Humic acids as electron acceptors in wetland decomposition[J]. Soil Biology & Biochemistry, 2009, 41(7): 1518-1522. |
| [8] |
袁晓敏, 杨继松, 刘凯, 等. 辽河口滨海湿地CH4排放特征及其影响因素[J]. 生态学报, 2019, 39(5): 1829-1837. Yuan Xiaomin, Yang Jisong, Liu Kai, et al. Characteristics and impact factors of methane emission in coastal wetland of the Liaohe estuary[J]. Acta Ecologica Sinica, 2019, 39(5): 1829-1837. |
| [9] |
高传宇, 邢伟, 刘汉向, 等. 全新世东北地区沼泽湿地演化对全球变化的响应[J]. 第四纪研究, 2018, 38(4): 854-863. Gao Chuanyu, Xing Wei, Liu Hanxiang, et al. Holocene wetland evolution in Northeast China and its responses to global change[J]. Quaternary Sciences, 2018, 38(4): 854-863. |
| [10] |
鲍锟山, 邢伟, 宋理洪, 等. 黑龙江流域湿地过去百年水位变化历史及驱动机制[J]. 第四纪研究, 2018, 38(4): 981-995. Bao Kunshan, Xing Wei, Song Lihong, et al. A 100-year history of water level change and driving mechanism in Heilongjiang River basin wetlands[J]. Quaternary Sciences, 2018, 38(4): 981-995. |
| [11] |
陈槐, 周舜, 吴宁, 等. 湿地甲烷的产生、氧化及排放通量研究进展[J]. 应用与环境生物学报, 2006, 12(5): 726-733. Chen Huai, Zhou Shun, Wu Ning, et al. Advance in studies on production, oxidation and emission flux of methane from wetlands[J]. Chinese Journal of Applied and Environmental Biology, 2006, 12(5): 726-733. DOI:10.3321/j.issn:1006-687X.2006.05.029 |
| [12] |
Nilsson M, Oquist M. Partitioning litter mass loss into carbon dioxide and methane in peatland ecosystems[J]. Geophysical Monograph, 2009, 184: 131-144. DOI:10.1029/2008GM000819 |
| [13] |
Mccalley C K, Woodcroft B J, Hodgkins S B, et al. Methane dynamics regulated by microbial community response to permafrost thaw[J]. Nature, 2014, 514(7523): 478-81. DOI:10.1038/nature13798 |
| [14] |
Hopple A M, Wilson R M, Kolton M, et al. Massive peatland carbon banks vulnerable to rising temperatures[J]. Nature Communications, 2020, 11(1): 2373. DOI:10.1038/s41467-020-16311-8 |
| [15] |
Treat C C, Natali S M, Ernakovich J, et al. A pan-Arctic synthesis of CH4 and CO2 production from anoxic soil incubations[J]. Global Change Biology, 2015, 21(7): 2787-2803. DOI:10.1111/gcb.12875 |
| [16] |
Segers R. Methane production and methane consumption: A review of processes underlying wetland methane fluxes[J]. Biogeochemistry, 1998, 41(1): 23-51. DOI:10.1023/A:1005929032764 |
| [17] |
Tveit A, Schwacke R, Svenning M M, et al. Organic carbon transformations in high-Arctic peat soils: Key functions and microorganisms[J]. The ISME Journal, 2013, 7(2): 299-311. DOI:10.1038/ismej.2012.99 |
| [18] |
唐小平, 黄桂林. 中国湿地分类系统的研究[J]. 林业科学研究, 2003, 16(5): 531-539. Tang Xiaoping, Huang Guilin. Study on classification system for wetland types in China[J]. Forest Research, 2003, 16(5): 531-539. DOI:10.3321/j.issn:1001-1498.2003.05.003 |
| [19] |
罗玲, 王宗明, 毛德华, 等. 沼泽湿地主要类型英文词汇内涵及辨析[J]. 生态学杂志, 2016, 35(3): 834-842. Luo Ling, Wang Zongming, Mao Dehua, et al. Connotation and differentiation of terminology on main kinds of wetlands in English[J]. Chinese Journal of Ecology, 2016, 35(3): 834-842. |
| [20] |
Raich J W, Schlesinger W H. The global carbon dioxide flux in soil respiration and its relationship to vegetation and climate[J]. Tellus B: Chemical and Physical Meteorology, 1992, 44(2): 81-99. DOI:10.3402/tellusb.v44i2.15428 |
| [21] |
Updegraff K, Pastor J, Bridgham S D, et al. Environmental and substrate controls over carbon and nitrogen mineralization in northern wetlands[J]. Ecological Applications, 1995, 5(1): 151-163. DOI:10.2307/1942060 |
| [22] |
Yavitt J B, Lang G E, Wieder R K. Control of carbon mineralization to CH4 and CO2 in anaerobic, Sphagnum-derived peat from Big Run Bog, West Virginia[J]. Biogeochemistry, 1987, 4(2): 141-157. DOI:10.1007/BF02180152 |
| [23] |
Zalman C, Keller J K, Tfaily M, et al. Small differences in ombrotrophy control regional-scale variation in methane cycling among Sphagnum-dominated peatlands[J]. Biogeochemistry, 2018, 139(2): 155-177. DOI:10.1007/s10533-018-0460-z |
| [24] |
Dettling M D, Yavitt J B, Zinder S H. Control of organic carbon mineralization by alternative electron acceptors in four peatlands, Central New York State, USA[J]. Wetlands, 2006, 26(4): 917-927. DOI:10.1672/0277-5212(2006)26[917:COOCMB]2.0.CO;2 |
| [25] |
Dise N B, Verry E S. Suppression of peatland methane emission by cumulative sulfate deposition in simulated acid rain[J]. Biogeochemistry, 2001, 53(2): 143-160. DOI:10.1023/A:1010774610050 |
| [26] |
Knorr K H, Blodau C. Impact of experimental drought and rewetting on redox transformations and methanogenesis in mesocosms of a northern fen soil[J]. Soil Biology & Biochemistry, 2009, 41(6): 1187-1198. |
| [27] |
Gorham E. Northern peatlands: Role in the carbon cycle and probable responses to climatic warming[J]. Ecological Applications, 1991, 1(2): 182-195. DOI:10.2307/1941811 |
| [28] |
Roulet N, Moore T, Bubier J, et al. Northern fens: Methane flux and climatic change[J]. Tellus B: Chemical and Physical Meteorology, 1992, 44(2): 100-105. DOI:10.3402/tellusb.v44i2.15429 |
| [29] |
Laiho R. Decomposition in peatlands: Reconciling seemingly contrasting results on the impacts of lowered water levels[J]. Soil Biology & Biochemistry, 2006, 38(8): 2011-2024. |
| [30] |
Dise N B. Peatland response to global change[J]. Science, 2009, 326(5954): 810-811. DOI:10.1126/science.1174268 |
| [31] |
Yang G, Chen H, Wu N, et al. Effects of soil warming, rainfall reduction and water table level on CH4 emissions from the Zoigê peatland in China[J]. Soil Biology & Biochemistry, 2014, 78: 83-89. DOI:10.1016/j.soilbio.2014.07.013 |
| [32] |
李彦沛, 黄俊翔, 岳泓宇, 等. 降水和冻融循环对大兴安岭沼泽湿地温室气体交换的影响[J]. 农业环境科学学报, 2019, 38(10): 2420-2428. Li Yanpei, Huang Junxiang, Yue Hongyu, et al. Effects of precipitation and soil freeze-thaw cycles on greenhouse gas exchanges in a permafrost swamp of the Great Hing'an Mountains, China[J]. Journal of Agro-Environment Science, 2019, 38(10): 2420-2428. DOI:10.11654/jaes.2019-0455 |
| [33] |
陈槐, 高永恒, 姚守平, 等. 若尔盖高原湿地甲烷排放的时空异质性[J]. 生态学报, 2008, 28(7): 3425-3437. Chen Huai, Gao Yongheng, Yao Shouping, et al. Spatiotemporal variation of methane emissions from alpine wetlands in Zoigê Plateau[J]. Acta Ecologica Sinica, 2008, 28(7): 3425-3437. |
| [34] |
Xing Y P, Xie P, Yang H, et al. Methane and carbon dioxide fluxes from a shallow hypereutrophic subtropical lake in China[J]. Atmospheric Environment, 2005, 39(30): 5532-5540. DOI:10.1016/j.atmosenv.2005.06.010 |
| [35] |
Bartlett K B, Harriss R C. Review and assessment of methane emissions from wetlands[J]. Chemosphere, 1993, 26(1-4): 261-320. DOI:10.1016/0045-6535(93)90427-7 |
| [36] |
Bergman I, Lundberg P, Nilsson M. Microbial carbon mineralisation in an acid surface peat: Effects of environmental factors in laboratory incubations[J]. Soil Biology & Biochemistry, 1999, 31(13): 1867-1877. |
| [37] |
Bergman I, Klarqvist M, Nilsson M. Seasonal variation in rates of methane production from peat of various botanical origins: Effects of temperature and substrate quality[J]. Fems Microbiology Ecology, 2000, 33(3): 181-189. DOI:10.1111/j.1574-6941.2000.tb00740.x |
| [38] |
Svensson B H. Different temperature optima for methane formation when enrichments from acid peat are supplemented with acetate or hydrogen[J]. Applied & Environmental Microbiology, 1984, 48(2): 389-394. |
| [39] |
Baggs E M, Blum H. CH4 oxidation and emissions of CH4 and N2O from Lolium perenne swards under elevated atmospheric CO2[J]. Soil Biology & Biochemistry, 2004, 36(4): 713-723. |
| [40] |
Ding W X, Cai Z C, Wang D X. Preliminary budget of methane emissions from natural wetlands in China[J]. Atmospheric Environment, 2004, 38(5): 751-759. DOI:10.1016/j.atmosenv.2003.10.016 |
| [41] |
Van der Nat F J W A, Middelburg J J, Van Meteren D, et al. Diel methane emission patterns from Scirpus lacustris and Phragmites australis[J]. Biogeochemistry, 1998, 41(1): 1-22. DOI:10.1023/A:1005933100905 |
| [42] |
Schrier-Uijl A P, Veraart A J, Leffeaar P A, et al. Release of CO2 and CH4 from lakes and drainage ditches in temperate wetlands[J]. Biogeochemistry, 2011, 102(1-3): 265-279. DOI:10.1007/s10533-010-9440-7 |
| [43] |
Roulet N T, Ash R, Moore T R. Low boreal wetlands as a source of atmospheric methane[J]. Journal of Geophysical Research, 1992, 97(D4): 3739-3749. DOI:10.1029/91JD03109 |
| [44] |
Wilson B J, Mortazavi B, Kiene R P. Spatial and temporal variability in carbon dioxide and methane exchange at three coastal marshes along a salinity gradient in a northern Gulf of Mexico estuary[J]. Biogeochemistry, 2015, 123(3): 329-347. DOI:10.1007/s10533-015-0085-4 |
| [45] |
仝川, 黄佳芳, 王维奇, 等. 闽江口半咸水芦苇潮汐沼泽湿地甲烷动态[J]. 地理学报, 2012, 67(9): 1165-1180. Tong Chuan, Huang Jiafang, Wang Weiqi, et al. Methane dynamics of a brackish-water tidal Phragmites australis marsh in the Minjiang River Estuary[J]. Acta Geographica Sinica, 2012, 67(9): 1165-1180. |
| [46] |
Vallero M V G, Pol L W H, Lettinga G, et al. Effect of NaCl on thermophilic(55℃)methanol degradation in sulfate reducing granular sludge reactors[J]. Water Research, 2003, 37(10): 2269-2280. DOI:10.1016/S0043-1354(03)00024-1 |
| [47] |
席婧茹, 刘素琴, 李琳, 等. 硫酸盐还原型甲烷厌氧氧化菌群驯化及其群落特征[J]. 环境科学, 2014, 35(12): 4602-4609. Xi Jingru, Liu Suqin, Li Lin, et al. Acclimatization and characteristics of microbial community in sulphate-dependent anaerobic methane oxidation[J]. Environmental Science, 2014, 35(12): 4602-4609. |
| [48] |
王纯, 张璟钰, 黄佳芳, 等. 盐度对感潮区淡水沼泽土壤甲烷产生潜力的影响[J]. 湿地科学, 2015, 13(5): 593-601. Wang Chun, Zhang Jingyu, Huang Jiafang, et al. Effects of salinity on methane production potential from soil in a tidal freshwater marsh[J]. Wetland Science, 2015, 13(5): 593-601. |
| [49] |
王文林, 韩睿明, 王国祥, 等. 湿地植物根系泌氧及其在自然基质中的扩散效应研究进展[J]. 生态学报, 2015, 35(22): 7286-7297. Wang Wenlin, Han Ruiming, Wang Guoxiang, et al. Research advancements on the radial oxygen loss in wetland plants and its diffusion effect in natural sediments[J]. Acta Ecologica Sinica, 2015, 35(22): 7286-7297. |
| [50] |
Juottonen H, Eiler A, Biasi C, et al. Distinct anaerobic bacterial consumers of cellobiose-derived carbon in boreal fens with different CO2/CH4 production ratios[J]. Applied & Environmental Microbiology, 2017, 83(4): e02533-16. DOI:10.1128/AEM.02533-16 |
| [51] |
Wilson R M, Tfaily M M, Rich V I, et al. Hydrogenation of organic matter as a terminal electron sink sustains high CO2 : CH4 production ratios during anaerobic decomposition[J]. Organic Geochemistry, 2017, 112: 22-32. DOI:10.1016/j.orggeochem.2017.06.011 |
| [52] |
Raymond P A, Hartmann J, Lauerwald R, et al. Global carbon dioxide emissions from inland waters[J]. Nature, 2013, 503(7476): 355-359. DOI:10.1038/nature12760 |
| [53] |
Kankaala P, Huotari J, Tulonen T, et al. Lake-size dependent physical forcing drives carbon dioxide and methane effluxes from lakes in a boreal landscape[J]. Limnology & Oceanography, 2013, 58(6): 1915-1930. |
| [54] |
Blodau C, Deppe M. Humic acid addition lowers methane release in peats of the Mer Bleue bog, Canada[J]. Soil Biology & Biochemistry, 2012, 52: 96-98. DOI:10.1016/j.soilbio.2012.04.023 |
| [55] |
Conrad R. Contribution of hydrogen to methane production and control of hydrogen concentrations in methanogenic soils and sediments[J]. Fems Microbiology Ecology, 1999, 28(3): 193-202. DOI:10.1111/j.1574-6941.1999.tb00575.x |
| [56] |
Corbett J E, Tfaily M M, Burdige D J, et al. Partitioning pathways of CO2 production in peatlands with stable carbon isotopes[J]. Biogeochemistry, 2013, 114(1-3): 327-340. DOI:10.1007/s10533-012-9813-1 |
| [57] |
King J Y, Reeburgh W S, Regli S K. Methane emission and transport by arctic sedges in Alaska: Results of a vegetation removal experiment[J]. Journal of Geophysical Research, 1998, 103(D22): 29083-29092. DOI:10.1029/98JD00052 |
| [58] |
Olefeldt D, Turetsky M R, Crill P M, et al. Environmental and physical controls on northern terrestrial methane emissions across permafrost zones[J]. Global Change Biology, 2013, 19(2): 589-603. DOI:10.1111/gcb.12071 |
| [59] |
Whiting G J, Chanton J P. Greenhouse carbon balance of wetlands: Methane emission versus carbon sequestration[J]. Tellus B: Chemical and Physical Meteorology, 2001, 53(5): 521-528. |
| [60] |
Zhang Y, Chen W J, Riseborough D W. Transient projections of permafrost distribution in Canada during the 21st century under scenarios of climate change[J]. Global and Planetary Change, 2008, 60(3-4): 443-456. DOI:10.1016/j.gloplacha.2007.05.003 |
| [61] |
Koven C D, Riley W J, Stern A. Analysis of permafrost thermal dynamics and response to climate change in the CMIP5 Earth System Models[J]. Journal of Climate, 2013, 26(6): 1877-1900. DOI:10.1175/JCLI-D-12-00228.1 |
| [62] |
Lawrence D M, Slater A G, Swenson S C. Simulation of present-day and future permafrost and seasonally frozen ground conditions in CCSM4[J]. Journal of Climate, 2012, 25(7): 2207-2225. DOI:10.1175/JCLI-D-11-00334.1 |
| [63] |
尚建国, 张廷军, 高坛光, 等. 基于遥感影像的祁连山区俄博岭热融滑塌发育特征[J]. 第四纪研究, 2019, 39(5): 1203-1210. Shang Jianguo, Zhang Tingjun, Gao Tanguang, et al. Characteristics of thaw slumps over Eboling areas in Qilian Mountains using remote sensing data[J]. Quaternary Sciences, 2019, 39(5): 1203-1210. |
| [64] |
Elberling B, Michelsen A, Schadel C, et al. Long-term CO2 production following permafrost thaw[J]. Nature Climate Change, 2013, 3(10): 890-894. DOI:10.1038/nclimate1955 |
| [65] |
Holgerson M A, Raymond P A. Large contribution to inland water CO2 and CH4 emissions from very small ponds[J]. Nature Geoscience, 2016, 9(3): 222-226. DOI:10.1038/ngeo2654 |
| [66] |
Kortelainen P, Rantakari M, Huttunen J T, et al. Sediment respiration and lake trophic state are important predictors of large CO2 evasion from small boreal lakes[J]. Global Change Biology, 2006, 12(8): 1554-1567. DOI:10.1111/j.1365-2486.2006.01167.x |
| [67] |
Bastviken D, Cole J J, Pace M L, et al. Fates of methane from different lake habitats: Connecting whole-lake budgets and CH4 emissions[J]. Journal of Geophysical Research: Biogeosciences, 2008, 113(G2): G02024. DOI:10.1029/2007JG000608 |
| [68] |
Sobek S, Tranvik L J, Cole J J. Temperature independence of carbon dioxide supersaturation in global lakes[J]. Global Biogeochemical Cycles, 2005, 19(2): GB2003. DOI:10.1029/2004GB002264 |
| [69] |
Chin K J, Conrad R. Intermediary metabolism in methanogenic paddy soil and the influence of temperature[J]. Fems Microbiology Ecology, 1995, 18(2): 85-102. DOI:10.1111/j.1574-6941.1995.tb00166.x |
| [70] |
韦仁川. 免耕和稻草还田对水稻生长及土壤性状的影响[D]. 南宁: 广西大学硕士学位论文, 2017: 29-38. Wei Renchuan. Effects of No Tillage and Straw Returning on Rice Growth and Soil Properties[D]. Nanning: The Master's Thesis of Guangxi University, 2017: 29-38. |
| [71] |
Canterle E B, Marques D D, Rodrigues L R. Development of temporary subtropical wetlands induces higher gas production[J]. Frontiers in Microbiology, 2013, 4: 56. DOI:10.3389/fmicb.2013.00056 |
| [72] |
Sepulveda-Jauregui A, Anthony K M W, Martinez-Cruz K, et al. Methane and carbon dioxide emissions from 40 lakes along a north-south latitudinal transect in Alaska[J]. Biogeosciences, 2015, 12(11): 3197-3223. DOI:10.5194/bg-12-3197-2015 |
| [73] |
Gao G F, Li P F, Shen Z J, et al. Exotic Spartina alterniflora invasion increases CH4 while reduces CO2 emissions from mangrove wetland soils in Southeastern China[J]. Scientific Reports, 2018, 8: 9243. DOI:10.1038/s41598-018-27625-5 |
| [74] |
Liu Y, Liu G H, Xiong Z Q, et al. Response of greenhouse gas emissions from three types of wetland soils to simulated temperature change on the Qinghai-Tibetan Plateau[J]. Atmospheric Environment, 2017, 171: 17-24. DOI:10.1016/j.atmosenv.2017.10.005 |
2 University of Chinese Academy of Sciences, Beijing 100049)
Abstract
Wetlands as one of the major sources of greenhouse gases carbon dioxide(CO2) and methane(CH4) to the atmosphere, play an important role in the global carbon cycle. As CH4 has a global warming potential more than 45 times higher than CO2 on a 100-year time scale, it is essential to investigate wetland CO2:CH4 emission ratios and their impact factors for accurately understanding and predicting wetland carbon cycle and its response to global changes. In this study, a meta-analysis was conducted to compare the CO2:CH4 emission ratios among various wetland types and their impact factors. We find that the CO2:CH4 emission ratios were significantly higher in bogs, coastal wetlands and paddy fields than in other wetlands(e.g., marsh, riparian wetlands and lakes), and CO2:CH4 emission ratios were significantly and negatively correlated to pH and water table, and positively correlated to salinity. These results imply that lower water table and lower pH inhibit CH4 emissions may be the main reason for the higher CO2:CH4 ratio in bogs, while the higher salinity plays an important role in coastal wetlands. Compared to natural wetlands, fertilization and returning straw to paddy soil have a considerable contribution to the higher CO2:CH4 ratio by reducing CH4 emission in paddy fields. Meanwhile, the CO2:CH4 ratios are also influenced by other factors including air temperature, soil temperature, precipitation and soil water content, although they do not show any significant correlations in this study. At present, there are still large uncertainties about wetland CO2:CH4 emission ratios and their impact factors, therefore, future research on CO2:CH4 emission ratios and their main controlling factors in different wetland types needs to be strengthened urgently. 2020, Vol.41
2020, Vol.41

