2 南京大学地球科学与工程学院, 表生地球化学教育部重点实验室, 江苏 南京 210023;
3 江苏省气候变化协同创新中心, 江苏 南京 210046)
蜗牛属于软体动物门腹足纲,在自然界中种属丰富且分布广泛,是陆地生态系统中最为普遍和多样化的动物之一[1]。在古气候研究领域,陆生蜗牛通常被看作是反映气候环境信息的指示性动物[2]。相对其他非生物地质材料,其优势主要在于:第一,作为变温动物,蜗牛响应环境变化极其敏感,能够记录精细的气候波动信息。第二,蜗牛壳体为当地环境条件下形成的次生碳酸盐,不受黄土源区信息的影响;此外,蜗牛死后就地埋藏,埋藏过程中壳体在土壤剖面中不易发生上下迁移,且较少受后期沉积改造和重结晶等作用的影响,因此蜗牛化石能很好保留原始原位的气候环境信息。第三,蜗牛不同生长发育阶段的环境气候信息被适时地记录在壳体碳酸盐中,因此,基于壳体生长纹的高分辨率取样分析可用来反映环境的季节性变化特征。
目前,针对蜗牛的古环境重建研究多是根据蜗牛化石种属组合的生物学适应性特征去建立与气候环境变化之间的联系,并取得一系列重要成果[3~8]。例如,吴乃琴等[5, 7]将黄土高原地层中收集到的蜗牛化石划分为适应干冷性气候蜗牛组合和适应暖湿性气候蜗牛组合,并认为它们可以分别作为记录东亚冬季风和夏季风变化的指标,从而推断出东亚地区的古季风演化历史。该方法主要优势在于充分发挥蜗牛响应气候变化敏感这一特性,可以直接而有效的记录蜗牛生活时期的气候环境变化。然而,目前对特定蜗牛种属生态类型的精确划分仍存在一定难度,这使得蜗牛种属组合与气候环境因子之间的定量关系存在较大不确定性,而基于蜗牛壳体碳酸盐地球化学特征的方法可能是定量重建古环境古气候变化的一种有效途径。自1979年Yapp[9]首次分析地层中蜗牛壳体化石碳氧同位素组成(δ13C和δ18O)以来,越来越多的研究尝试利用这一方法重建陆地系统的气候环境变化[10~15]。例如,在美国新墨西哥州地区,Balakrishnan等[10]发现Vallonia壳体化石δ18O值在距今约10500年时明显偏正,可能指示新仙女木事件的发生,随后壳体δ18O值的逐渐降低表明气候朝着相对湿度增加、温度降低及降水δ18O值降低的方向转变;而壳体化石δ13C值相比现代壳体偏正则指示当时环境中存在更多比例的C4植物。Prendergast等[13]基于蜗牛(Melanostoma)化石碳氧同位素组成反演出的气候变化特征和考古记录中呈现的生物居住密度特征指出,在旧石器晚期至新石器时代,当周边环境极为干旱时,利比亚Haua Fteah地区可以作为区域尺度上的生物避难所。
以上这些研究多集中在地中海和美洲的一些地区,且用到的化石材料几乎全部来自于晚更新世至全新世地层,重建较长时间尺度的气候变化仍具有局限性。受东亚季风气候系统影响,中国黄土高原地区具有世界上最为完整连续且时间跨度最长的黄土-古土壤沉积序列,且其中含有大量保存较为完好的蜗牛化石[2, 16]。然而,目前利用该沉积物中蜗牛化石稳定同位素组成重建古气候变化的相关研究仍严重匮乏。其根源在于对陆生蜗牛壳体δ13C和δ18O指标气候意义的解释存在较多不确定性,对蜗牛壳体碳酸盐同位素的分馏过程及形成机理也并不完全清楚。因此,解决这些问题的有效办法是通过蜗牛稳定同位素组成的现代过程研究(包括室内饲养实验和野外不同区域采样),去限定影响蜗牛壳体δ13C和δ18O值的环境因子,明确气候环境变量控制壳体同位素组成的过程机制,最终构建壳体δ13C和δ18O值与气候环境参数之间的现代校正方程,从而达到利用壳体稳定同位素组成定量重建古气候的目的。
本文以现代过程研究着手,综述了目前有关蜗牛壳体δ13C和δ18O指标气候环境意义和应用价值的研究,并指出各自指标存在的问题;介绍了目前利用中国黄土沉积物中蜗牛化石稳定同位素重建季风研究的最新进展以及蜗牛壳体团簇同位素组成在反映环境气候信息上的潜力,并对以后蜗牛碳氧同位素组成的研究方向提出展望。
1 蜗牛壳体δ13C指标 1.1 壳体δ13C响应植被和气候变化多数基于控制变量法原则的室内蜗牛饲养实验结果表明,蜗牛所吃植物的δ13C组成是控制其壳体δ13C值的最主要因素[17~20]。例如,Stott[19]发现不论用莴苣叶(C3植物)还是玉米粉(C4植物)去喂养蜗牛Helix aspersa,壳体碳酸盐中的碳几乎完全来自于食物,而外加的碳酸钙对壳体δ13C值的影响可以忽略。从碳酸钙结晶过程的生理学角度来看,蜗牛可以通过代谢食物产生的CO2去构建壳体碳酸盐,且壳体δ13C值能够忠实记录蜗牛所食C3和C4植物的混合比例[21]。大量的自然环境下野外蜗牛研究结果也证实壳体δ13C主要受植物性食物的δ13C组成影响[22~36]。在北美南部大平原地区,Balakrishnan等[22]发现纯C3植被类型下的蜗牛(Vallonia和Gastrocopta)壳体δ13C值明显偏负于纯C4植被下的蜗牛,而C3、C4混合环境中的壳体δ13C值则介于二者之间,这表明壳体δ13C值与具有不同光合作用类型植被的分布比例密切相关,类似现象也发现于低纬度的岛屿环境中[23];在中国黄土高原地区,多属种现生蜗牛壳体δ13C值和相应软体δ13C值呈现极好相关性,且相关关系的斜率接近1,指示壳体δ13C值几乎完全反映食物的碳同位素组成,从而记录了环境中生态植被信息的变化[35]。此外,Goodfriend和Ellis[26]还发现北美地区蜗牛(Rabdotus dealbatus和Rabdotus alternatus)壳体δ13C可以用来响应CAM或C4植物的出现与否。除了指示具有不同光合作用类型的植被(C3、C4和CAM)组成以外,蜗牛壳体δ13C还可以用来指示具有不同水利用效率的C3植物的比例[30]。这是因为不同C3植物之间也会因对环境中水分的利用效率存在差异而使得碳同位素组成存在明显差异[30, 37]。这种C3植物间δ13C值差异同样可以被蜗牛壳体δ13C值所记录,即更正的壳体δ13C值指示水利用效率高的C3植物占比更高[30]。在中国中纬度地区,Bao等[36]发现沿着降雨梯度带蜗牛壳体、软体及C3植物的δ13C值呈现同步且一致的变化特征,有力地说明了C3植物δ13C值对蜗牛δ13C值的控制作用。
综上所述,蜗牛壳体δ13C值通常可以用来记录环境中具有不同光合作用类型或不同水利用效率的植被类型组成。自然界中C3植物δ13C值的范围一般在-20 ‰至-34 ‰,且多集中在-27 ‰左右,而C4植物的δ13C值范围为-9 ‰至-19 ‰,多集中在-13 ‰左右,CAM植物仅存在于一些极端生态系统中(比如沙漠),其δ13C值介于C3和C4植物之间[37~39]。这些具有不同碳同位素组成的植被分布与气候环境条件密切相关。C3植物包括所有乔木类和灌木,主要分布在温带环境中,而C4植物主要包括分布在干旱-半干旱和热带地区的草本植物[40]。Kohn[41]通过汇编全球所有已发表的C3植物的碳同位素数据发现,C3植物的δ13C值与年均降水量呈现良好的负相关关系;在中国北方地区,Wang等[42]发现C3植物δ13C值也存在类似的变化规律,且响应降水量的变化速率为-0.40 ‰ /100mm。C4植物δ13C值受气候环境的影响较为复杂,通常温度和大气CO2浓度能够对其产生较大影响[37~38, 43]。因此,壳体δ13C值在反映不同植被类型组成的基础上被认为可以进一步反映环境干湿程度的变化[26, 30, 34, 44]。
目前,已有较多研究发现了蜗牛壳体δ13C值与气候参数之间的关系[26, 36, 45~46]。例如,在北美南部大平原地区,Rabdotus dealbatus蜗牛壳体δ13C随着降水量的增加而逐渐偏负[26],但二者之间的这种关系并不存在于地中海东部地区[30];在加那利群岛,Yanes等[34]发现壳体δ13C值在北坡与年均温度存在一定相关性。近些年,在东亚季风地区,壳体δ13C值与气候的关系也得到较为充分的研究。Bao等[45]通过对中国东部季风区的大范围现生蜗牛碳同位素组成分析发现,来自暖湿的东南部区域蜗牛壳体δ13C值偏负,而来自半干旱西北部区域蜗牛壳体δ13C值偏正,其变化规律与东亚夏季风行径路线一致,并发现壳体δ13C值与年均降水量和温度均存在显著的相关性,从而认为壳体δ13C值可以指示季风强度的变化(图 1);紧接着,通过整合东亚季风区中纬度降水梯度带的数据结果,Bao等[36]认为蜗牛壳体δ13C是一个可靠的降水量指标,并构建了其与年均降水量(MAP)的定量关系式:δ13C=-0.0030(±0.0003)MAP-8.80(±0.32)(n=74,r=-0.76,p < 0.001)。该研究认为降水量是通过综合控制环境中C3植物δ13C值、蜗牛活动时的代谢作用和环境中无机碳酸盐淋滤这3个过程控制了壳体δ13C值。同样地,Wang等[46]分析中国地区最为常见的两个种属蜗牛稳定同位素组成发现,Bradybaena蜗牛在重建古环境信息上表现出巨大潜力,其壳体δ13C值随海拔和温度的升高而变正,但随年均降水量的增多而变负,并认为该种属蜗牛壳体δ13C反映的是C3植物的信号,能够响应以C3植物为主导地区的降水量变化;而Cathaica蜗牛壳体δ13C值通常记录的是C3/C4植物的混合信号,其与气候参数的关系并不明显。
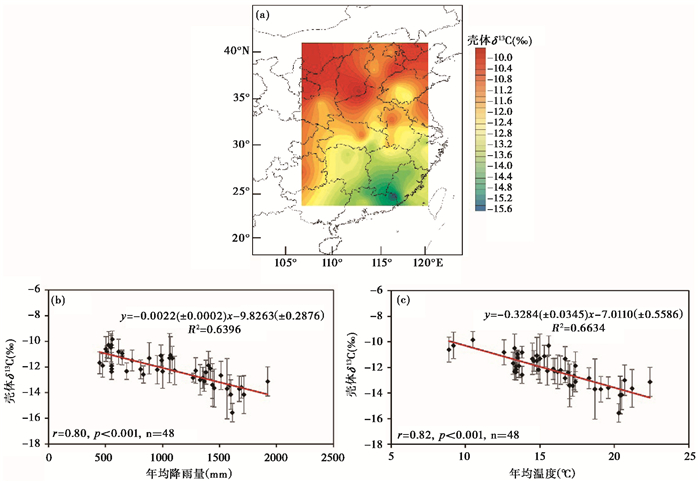
|
图 1 东亚季风区蜗牛壳体δ13C值的空间变化特征及其与气候参数(年均降水量和年均温度)之间的关系数据引自Bao等[45] Fig. 1 Spatial variation of δ13C of snail shells in the East Asian monsoon regions of China and their relations with climate parameters(mean annual precipitation and mean annual temperature)(data from Bao et al.[45]) |
上述研究进展说明蜗牛壳体δ13C值在记录环境植被和气候信息上具有重要意义。然而,除植物δ13C组成之外的其他因素对壳体δ13C值也会造成一定的影响,这使得利用壳体化石碳同位素组成进行古生态古气候重建时存在较大不确定性。影响壳体δ13C值的因子大体可以分为两类[19],其一为与蜗牛壳体碳酸盐碳源有关的环境因子(例如植物有机碳和土壤碳酸盐等),其二为影响蜗牛由食物代谢产生的CO2至壳体碳酸钙形成整个过程中的同位素分馏过程及与蜗牛生理生态特征有关的因素(如蜗牛的代谢速率和摄食行为特征等)。
理论上,蜗牛壳体碳酸盐形成于体液中的重碳酸根离子(HCO3-),而后者碳的来源除了蜗牛新陈代谢植物性食物产生的CO2,还可能有来自蜗牛摄入的环境中碳酸盐经酸解而产生的CO2以及蜗牛通过表皮交换过程而进入体内的大气CO2[47]。Goodfriend和Stipp[48]通过对蜗牛体内进行放射性碳标定发现,非石灰岩地区环境碳酸盐对壳体δ13C值的影响可以忽略,但在石灰岩地区,环境碳酸盐对壳体δ13C值变化的贡献可达7 % ~33 %。最近,室内饲养实验表明Acusta despecta sieboldiana蜗牛壳体δ13C值会受到食物、大气CO2和外加碳酸钙的共同影响;具体来说,对于喂食C3植物的蜗牛,三者贡献的比例分别为66 % ~80 %,16 % ~24 % 和0~13 %,而喂食C4植物蜗牛组分别为56 % ~64 %,18 % ~20 % 和16 % ~26 % [49]。蜗牛对环境中碳酸盐的摄入效应通常会促使壳体更加富集13C[49~50],但壳体δ13C值和摄入碳酸盐含量之间的关系并不稳定[51],这使得量化碳酸盐效应对壳体δ13C值的影响变得困难。沿蜗牛生长带序列的高分辨率同位素分析以及蜗牛饲养实验均表明,某些种属壳体受不同因子的影响会随时间而发生变化,同时取决于蜗牛的食物品质[49]。例如有研究认为单个壳体内δ13C值的波动可以由不同生长阶段蜗牛对植物和外界碳酸盐的差异性摄入而引起[23, 26, 29]。另外,种属因素也会影响到蜗牛对环境碳酸盐的摄入。对于某些种属,外界碳酸盐对壳体的贡献比例可多至40 % [50],且这种效应在碳酸盐地区尤甚[48, 51~53];而对于一些小型蜗牛(<10mm),这种影响却可以忽略[54~55]。
另有研究表明大气CO2可通过蜗牛呼吸作用进入蜗牛体内的重碳酸盐池而最终影响壳体δ13C值[21, 47, 49, 51]。DeNiro和Epstein[17]通过蜗牛饲养实验指出,壳体δ13C值不仅受食物δ13C值影响,很大程度上还受大气CO2的控制;而Magaritz等[56]则将陆生蜗牛与海洋软体动物进行对比,认为控制壳体δ13C组成的体液重碳酸盐与大气CO2存在平衡状态下的气体交换;进一步的模型计算表明,大气CO2对壳体碳酸盐的贡献在一定范围内会发生变化[47, 49]。Zhang等[49]认为蜗牛呼吸速率的变化会引起其代谢植物而生成的CO2分压的变化,从而导致摄入大气CO2通量的变化,最终引起壳体δ13C值的变化。来自东亚季风边缘区的现代蜗牛碳同位素结果也强调了大气CO2对壳体δ13C值的可能贡献,比如,在贺兰山山麓环境下,Bao等[57]发现壳体δ13C值与海拔呈显著正相关,并将这种正海拔效应解释为由环境中综合植被δ13C呈垂直梯度变化而致;但该研究还强调,在不同海拔地区,蜗牛因生活环境条件存在差异,其代谢速率发生变化,故而引起吸收的大气CO2通量发生变化,最终贡献了壳体δ13C值的正海拔效应。
以上研究多从壳体碳酸盐的碳来源角度强调壳体δ13C值的受控因子。实际上,蜗牛生物本身的生理生态因素,包括蜗牛摄食的倾向性、行为学特征、活动阶段和时长、体内新陈代谢的变化、栖息地微环境和生态特征等,均可能在一定程度上引起壳体δ13C值的变化[18, 44~46],在此不一一赘述。因此,在以蜗牛壳体δ13C为指标重建古环境前,需对这些生理生态因素进行限定。例如,需假定蜗牛无差别的食用环境中的各种植物;需假定蜗牛以植物在环境中的分布特征去等比例地食用这些植物,并且同一类型植物在环境中需具有相似的δ13C值;需假定同一种蜗牛种群内或者共存的蜗牛种属间不存在食物倾向性等[19]。
最后,从分馏过程角度来看,蜗牛由外界环境摄入碳至最终形成壳体或软体时,其体内会发生一系列代谢、溶解和结晶沉淀等过程,在这些过程中发生的任何条件(如蜗牛活动代谢速率的变化、温度等)变化都可能对碳同位素分馏产生影响,最终影响壳体碳酸盐的δ13C值[19, 49]。一般认为蜗牛形成壳体碳酸盐涉及到的分馏过程主要包括两个部分,分别为蜗牛代谢食物产生的气体CO2和体液中HCO3-之间的平衡分馏过程以及重碳酸盐沉淀形成壳体时发生的平衡分馏过程,且在温度为25℃时,这两项过程的碳同位素分馏值分别为10 ‰和2.7 ‰ [19]。多数室内饲养实验和野外研究表明,在C3植物主导下,蜗牛壳体和食物间碳同位素分馏值接近14 ‰ [17~18, 35]。DeNiro和Epstein[17]发现蜗牛代谢食物产生的CO2和蜗牛软体部分均与食物δ13C值接近(相比食物富集13C仅1 ‰),而壳体相比食物则明显且稳定富集13C约13.2 ‰;同样,刘宗秀等[35]在黄土高原地区发现现生蜗牛壳体δ13C值比对应软体平均偏正约14.2 ‰,且壳体和软体δ13C值呈显著相关。另外,一些饲养实验则强调不同食物喂养条件下蜗牛壳体和食物间碳同位素分馏值存在着差异[18~20]。例如,Metref等[18]发现纯C3植物喂食的蜗牛(Helix aspersa)壳体δ13C值相对于纯C4植物喂食的蜗牛明显偏负,且壳体和食物间的分馏值稳定在13.75 ‰左右,而这种分馏值在喂食C4植物组则波动较大(平均为4.89 ‰),但总体小于C3植物组;同样地,朱莉莉等[20]也发现在分别给蜗牛Achatina fulica喂食莴苣叶(C3)和玉米粉(C4)时,壳体与食物之间碳同位素的分馏值分别为16.7 ‰和10.6 ‰。这种差异可能是由于不同食物的品质存在差异,从而引起蜗牛体内代谢和碳同位素分馏过程的不同。此外,通量平衡模型结果显示,文石壳体和食物之间碳同位素分馏值范围在0~17.3 ‰区间内都是合理的[58]。
以上种种影响因子和分馏过程的差异使得蜗牛壳体δ13C值与气候的关系存在明显的区域和种属性差异。在东亚季风区域,Bao等[45]发现中南部种蜗牛Acusta ravida和南部种Bradybaena similaris壳体δ13C值与年均降水量及年均温度均呈现显著的相关关系,从而证实这两个种属作为东亚季风强度指标的可靠性;而北方种蜗牛Cathaica fasciola仅与温度呈现较弱的相关性,与降水量和纬度均无相关关系,说明该种属作为气候指标存在局限性(图 2)。由壳体δ13C-软体δ13C关系式的斜率差异可知北方种Cathaica fasciola受环境碳酸盐影响较显著,而Acusta ravida和Bradybaena similaris的碳酸盐效应并不明显;同时借助通量平衡模型发现,Cathaica fasciola在代谢速率上与Acusta ravida和Bradybaena similaris存在明显差异(详见Bao等[45])。因此,东亚季风区不同种属蜗牛在响应气候上的差异可以解释为种属之间存在的不同碳酸盐效应(北方种比南方种蜗牛摄入了更多的土壤碳酸盐)和不同生理生态特征(例如蜗牛活动时间长短、代谢速率上的差异)。这一发现对于以后利用季风区蜗牛化石壳体稳定同位素组成进行古气候重建具有重要借鉴意义,例如必须考虑蜗牛摄入的碳酸盐对重建结果造成的偏差。
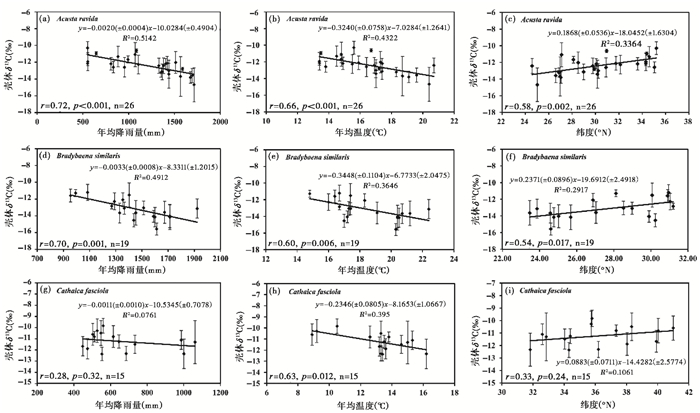
|
图 2 东亚季风区不同种属蜗牛壳体δ13C值与气候及地理因子之间的关系(数据引自Bao等[45]) Fig. 2 Bivariate plots showing the relationships between the shell δ13C with climatic and geographic factors for Acusta ravida(a, b, c), Bradybaena similaris(d, e, f)and Cathaica fasciola(g, h, i)(data from Bao et al.[45]) |
壳体文石是由体液中的重碳酸根离子在一定条件下沉淀结晶而成,因此理论上壳体氧同位素组成受控于体液δ18O值和由温度控制的碳酸盐-水体系的分馏过程[59]。当大气降水为蜗牛体液水的主要环境水来源时,壳体δ18O可以记录大气降水δ18O的变化,进而反映区域的大气水文条件[27, 60]。
室内的蜗牛饲养实验通过采用δ18O值差异较大的几种水源作为蜗牛的生活环境水,来探讨环境水δ18O值对壳体δ18O的控制作用,结果发现壳体δ18O值与环境水δ18O值呈强烈的正相关关系[60~61](图 3中的黑色实线)。自然条件下野外蜗牛壳体δ18O值与降水δ18O值的关系也在不同地区均有报道[25~27, 29, 33~34, 62~65](图 3中的虚线)。例如,Lécolle[62]通过分析西欧和北非地区共125个地点现生蜗牛壳体δ18O值发现,其与年均降水δ18O值呈现良好相关性,与温度也存在一定相关性;Yanes等[64]汇总了北美地区所有小型蜗牛氧同位素数据发现,壳体δ18O值主要记录了年均降水δ18O的变化;而Goodfriend等[27]则发现在一次降雨事件过后的几天内,蜗牛体液先后经历了18O的贫化、富集和相对稳定3个阶段,且这种变化形式与当地大气降水(包括降雨、水蒸气和露水)δ18O值变化同步;而在下次降雨开始之前,蜗牛体液与大气水蒸气或露水始终保持氧同位素平衡状态。对于中国东亚季风区域,整体来看蜗牛壳体δ18O值与气候因子并无相关关系,指示在大区域尺度上壳体δ18O受控因子的多样性和受控过程的复杂性(本课题组未发表数据);但在中国中纬度特定降雨梯度带上,壳体δ18O值与当地降水δ18O值存在着同步的变化趋势,且由于雨量效应导致壳体δ18O值和年均降水量之间存在显著相关性[36]。在黄土高原地区,刘宗秀等[66]发现夏季风降水δ18O值是导致壳体δ18O值空间变化的主要因素,且壳体δ18O与夏季降水量存在显著的负相关关系;而Wang等[46]发现中国地区主要种属Bradybaena的壳体δ18O值在印度季风和西风地区随降水量增大而变负,但在东亚季风区随温度而变正,由此认为该种属蜗牛壳体δ18O具有重建古温度的潜力。通过沿单个蜗牛壳体生长带的高分辨率取样,Leng等[29]发现壳体δ18O值具有明显的周期性变化特征,并将这种变化解释为降水δ18O值的季节性变化;同样地,孙小虹等[67]发现采集于中国镇江地区的灰尖巴蜗牛(Acusta ravida)的沿生长纹壳体δ18O值变化受控于蜗牛生长时期的降水δ18O值、温度和相对湿度。
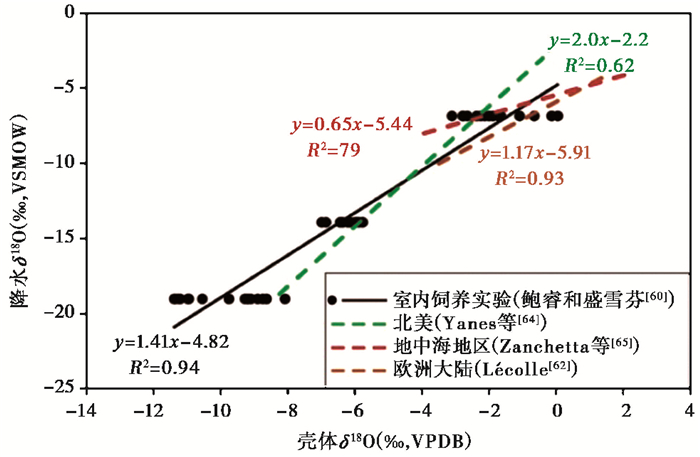
|
图 3 不同环境背景下蜗牛壳体δ18O和降水δ18O的关系 Fig. 3 shell δ18O values relative to precipitation δ18O under the different environmental background |
相比壳体δ13C,壳体δ18O的受控因子和影响机制更加复杂多变,这使得目前对于壳体δ18O气候意义的解释面临更多挑战。多数研究表明,除了降水δ18O值,一些环境过程及蜗牛本身的生理生态特征变化均能在一定程度上引起壳体δ18O的变化[27, 36, 44, 58]。首先,大气降水δ18O本身会受到温度、降雨量、海拔、雨除效应、离海岸距离的远近、气团来源及水汽运移轨迹等因素影响,且不同地区可能存在不同因素主导[68]。因此,即使在一些区域壳体δ18O值和降水δ18O值存在相关性,这些经验方程往往会因不同区域影响因子的差异而存在差异[27, 44, 46, 62, 65](图 3)。Leone等[69]曾指出雨水δ18O和蜗牛壳体δ18O之间根本不存在全球统一的关系;其次,温度和相对湿度会在一些地区对壳体δ18O值起决定作用[9, 25, 34, 44, 50, 69]。Yapp[9]指出美国不同气候类型区的蜗牛壳体δ18O值与当地雨水δ18O值并无相关性,但却与当地相对湿度的倒数呈线性相关;通量平衡模型也表明壳体δ18O值受周围环境温度、相对湿度、蜗牛摄入水及大气水蒸气δ18O值的综合影响[58];Yanes等[52]发现在降水δ18O值和温度相对稳定时,蜗牛壳体δ18O值受相对湿度的影响明显。
另外,蒸发作用对壳体δ18O值也有重要影响。一方面,蒸发效应会使得活动期蜗牛的体液水逃逸出轻氧同位素而变重,进一步导致壳体δ18O值变正[9, 27, 29, 36]。通量平衡模型也指出由湿度较低引起的蒸发作用会使得蜗牛体液明显富集18O[58];该模型已在不同环境背景下很好地解释了当地蜗牛壳体δ18O值的变化[10, 14, 22, 70~72]。另一方面,蒸发效应会通过影响蜗牛生活区域潜在的环境水(包括大气降水、植物水和土壤水等)而影响壳体δ18O值。例如,在东亚季风边缘区域的贺兰山,Bao等[57]通过分析蜗牛壳体及栖息地土壤和植物中水分的δ18O值发现,不仅蜗牛体液存在明显的蒸发效应,土壤水和植物水在被蜗牛摄入前也经历了较为显著的蒸发或蒸腾作用;当蜗牛摄入这些蒸发过的水分时,同样会引起壳体δ18O值的变化;此外,Zhang等[61]通过室内饲养实验强调,蜗牛所摄入植物中的水分对壳体δ18O值有重要贡献。
生理生态因素比如蜗牛活动方式、活动状态、生命周期的长短及小生态微环境的变化等也可能会引起壳体δ18O值出现偏差[36, 44, 61]。Goodfriend和Magaritz[44]指出:蜗牛体内新陈代谢活动的加强会使得壳体碳酸盐相对环境水富集18O;该研究认为当蜗牛不活跃时,其环境水的输入被中断,此时由于体内代谢活动会导致体液水富集18O;而当蜗牛活跃时,摄入外界环境水的通量变高,从而减弱了体内这种代谢富集作用。蜗牛活跃与否及活跃时间的长短通常取决于当地的气候条件及小生态环境[49]。另外,由于蜗牛对环境变化的响应敏感,当环境较恶劣时(例如水分获取变得困难),蜗牛会为了阻止水分丢失而进入休眠状态;又因蜗牛壳体只在活动阶段生长,故其同位素组成只反映了活动时期的环境状况。例如,在暖湿的热带地区,蜗牛最有可能反映的是整年的环境条件[23, 31],而在温带和高纬度地区,季节性变化大,壳体稳定同位素组成可能主要记录了暖湿季节的气候环境信息[31, 46]。有研究发现,沿蜗牛生长带壳体δ18O值呈现周期循环变化,并认为这反映了降水δ18O值及蜗牛生命周期内伴随的蒸发作用的季节性变化特征[29]。在种群尺度上,蜗牛的物种内同位素组成差异可能是由诸如小生态环境条件、蜗牛活动时间长度和生命周期不同而引起[22, 26, 44]。
3 黄土地层中蜗牛壳体化石碳氧同位素组成的古气候研究基于以上蜗牛同位素组成的现代过程研究,本文系统总结了陆生蜗牛壳体碳氧同位素组成的主要气候环境意义,并指出影响壳体δ13C和δ18O的各种外部环境因子和内部生理因子(图 4)。总的来说,壳体δ13C值主要通过反映植物(尤其C3)δ13C值变化来进一步响应当地降水量变化,进而指示环境的干湿程度;与此同时,需要针对性的去甄别环境碳酸盐、大气CO2及蜗牛的生理生态特征对壳体δ13C值的影响。壳体δ18O值可以在较大程度上反映大气降水δ18O值的变化,从而指示大气环境中的水文条件变化;但蒸发效应和温度等因素会对壳体δ18O值产生不可忽视的影响。这些现代过程的研究结果为地层中蜗牛化石同位素的古气候古环境重建提供了重要铺垫。目前针对中国黄土-古土壤序列中化石δ13C和δ18O的气候重建研究仍旧缺乏,但近年来已有少量研究逐渐展开,并取得了一些新的认识。下面简单介绍这些研究。
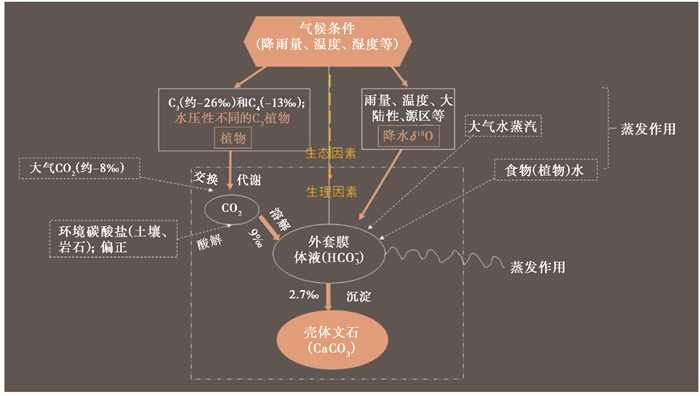
|
图 4 蜗牛壳体碳氧同位素响应气候环境变化过程的概念模型图 主要涉及影响壳体稳定同位素组成的各种潜在因子和相关分馏过程,包括外在的生态因素和内在的生理因素(黄褐色);主要影响因素和过程用橙色标出,潜在的影响因子和过程用虚线标明 Fig. 4 The conceptual model diagram of shell carbon and oxygen isotope compositions in response to climatic and environmental changes. This model mainly involves the potential factors and related fractionations affecting the stable isotopic composition of land snail shells, including the external ecological factors and internal physiological factors(yellowish-brown). Primary and potential affecting factors/processes are highlighted in orange and dotted lines, respectively |
顾兆炎等[73]通过分析邙山剖面末次冰期以来的粉华蜗牛(Cathaica pulveratrix)化石发现,壳体δ13C值与反映植被组成信息的土壤有机质δ13C值并不呈现显著相关性,说明壳体δ13C值并不能准确地记录黄土高原地区C3、C4植被类型比例的变化;而壳体化石δ18O值与黄土磁化率、粒度等指标呈显著相关,且与南京葫芦洞石笋δ18O记录的东亚夏季风强度演化具有同步且一致的变化趋势。在渭南和洛川剖面,Dong等[74]发现末次冰期阶段壳体化石δ13C值比现代蜗牛平均偏正2.7 ‰左右,这与土壤有机质δ13C值的变化正好相反。在黄土高原地区,古土壤层土壤有机质δ13C值通常偏正于黄土层[75],指示暖湿间冰期阶段存在更多比例的C4植物。因此,相比末次冰期的蜗牛化石,现代蜗牛理应摄入更多比例的C4植物而具有更正的壳体δ13C值,这显然与剖面中壳体δ13C值呈现的结果不一致。为此,Dong等[74]推断壳体δ13C值可能不是反映环境中C3、C4植物比例的指标,而是反映不同水利用效率的C3植物比例的指标,进而可以作为反映环境干湿程度的指标。得出这一结论可能主要基于以下原因:一方面,黄土高原地区现代C3植物δ13C值与年均降水量呈负相关关系[42, 76];先前笔者在中国中纬度地区沿降水梯度带的研究也指出蜗牛壳体、软体以及C3植物的δ13C值呈协同变负的变化特征[36]。因此在降水量较大的古土壤层,会出现更多比例的水利用效率较低的C3植物,从而导致间冰期阶段化石壳体δ13C值偏负。另一方面,实验室的饲养结果表明蜗牛具有明显的食物倾向性,通常更倾向于摄入环境中的C3植物[19, 20]。
最后值得注意的是,蜗牛壳体稳定同位素组成在记录气候季节性变化上具有独特优势。最近,Wang等[77]通过分析黄土地层中单个蜗牛壳体化石沿生长带的氧同位素组成变化特征,重建了中更新世以来季风气候干湿程度的季节性变化;该研究将单个壳体δ18O值的波动范围作为记录季节性干湿程度变化的指标,发现冰期蜗牛δ18O值的波动范围明显大于间冰期,指示冰期阶段的冬季更加干旱而间冰期阶段的冬季更加湿润。该项研究为以后重建东亚季风季节性变化特征开辟了新的思路。另外,黄林培等[78]认为蜗牛壳体碳氧同位素组成在反映气候季节性长度上也存在着巨大潜力,他们发现黄土高原地区喜冷干蜗牛种Pupilla aeoli与喜暖湿蜗牛种Punctum orphana的壳体δ13C值每相差1 ‰时,蜗牛生长季相差约15d;而壳体δ18O值每相差1 ‰,蜗牛生长季相差约19d,并基于此对应关系,重建了75ka以来黄土高原蜗牛生长季节长度的变化。
4 蜗牛壳体团簇同位素研究碳酸盐团簇同位素(carbonate clumped isotopes)是近些年发展起来的一种新型地质温度计,其主要原理为:碳酸盐矿物晶格中较重同位素之间(13C-18O)的成键程度(量化为Δ47值)与碳酸盐形成温度密切相关[79],因此可由碳酸盐Δ47值来指示温度。相比于传统的碳酸盐氧同位素温度计,其最主要优势在于团簇同位素是发生在单一相中的同位素平衡交换,其重建的古温度与碳酸盐形成时水体的氧同位素无关,可直接由碳酸盐Δ47值算出矿物的生长温度[80]。目前,在蜗牛壳体团簇同位素研究方面,国内外学者也取得了长足的进展,并逐渐成为壳体稳定同位素研究的新方向。Zaarur等[81]最先报道了世界范围内不同环境背景下的现代蜗牛团簇同位素组成,发现壳体Δ47值代表的碳酸盐结晶温度一般高于蜗牛栖息地的年均温度和生长季温度,并将这种现象归结于不同种属蜗牛生态-生理适应性(壳体颜色、形态、行为)上的差异;Zhang等[82]通过控制蜗牛的饲养温度,发现在20℃至30℃区间内,蜗牛壳体团簇同位素数据落在目前建立的最通用的Δ47值-温度校准线[83]的误差范围内,由此认为壳体团簇同位素形成于平衡条件且无明显的生命效应。在中国东亚季风区域,Wang等[84]分析Cathaica sp. 和Bradybaena sp. 现生蜗牛团簇同位素组成发现,两种蜗牛的Δ47值温度与环境温度均呈现强烈相关性,并且Cathaica sp. 比Bradybaena sp. 的温度普遍高3~5℃,表明两种蜗牛具有不同的生理生态适应性或生长季节,即Cathaica sp. 更倾向于生活在暖湿的夏季,而Bradybaena sp. 倾向于在相对干凉的春秋季活动;随后,Zhai等[85]进一步加大了东亚季风区Cathaica sp. 和Bradybaena sp. 蜗牛的采样范围,获得67个采样点共177个蜗牛壳体团簇同位素数据,发现两种蜗牛的Δ47温度和生长季节温度呈现良好的正相关关系,并建立蜗牛Δ47值与生长季节平均温度的转换方程。同样在东亚季风区域,Guo等[86]却发现壳体Δ47温度与蜗牛生长温度并无显著相关性;该作者进一步认为,蜗牛由于生理因素的影响可能仅倾向于记录温暖适宜期的环境温度。Eagle等[87]首次利用黄土沉积中的壳体化石团簇同位素组成重建古温度变化,发现中国中部自LGM(末次冰盛期)以来经历了6~7℃的温度变化,这一变化幅度显著高于先前气候模型得出的结果。近期,Dong等[74]通过洛川和渭南剖面的蜗牛化石分析发现,末次冰期的Δ47温度甚至可能比现代高10℃左右。由以上可知,蜗牛壳体团簇同位素可能是极具潜力的古温度计指标(尤其对东亚季风区而言),但仍存在不少问题有待深入研究,如蜗牛壳体团簇同位素是否存在生命效应以及如何评估这种效应?蜗牛壳体Δ47值与温度的精确校正方程能否建立?
5 不足与展望陆生蜗牛壳体δ13C和δ18O在古气候古环境研究上展现出巨大的应用潜力且具有独特的优势。然而需要指出的是,不同环境背景下分布着不同的蜗牛种属组合,蜗牛种群内个体间或不同种属间稳定同位素组成的波动较大,因此壳体δ13C和δ18O作为气候指标的探讨通常表现在区域性环境特征和季节性气候变化方面,而不在于大区域或全球范围的一致性探讨上。在古环境重建时,特定区域需要寻找具有明确环境指示意义的蜗牛种属展开研究,才能获得比较准确的环境信息。针对蜗牛同位素指标存在的问题,后续的研究工作可从以下几个方面加强:1)针对壳体δ13C受控因子的多解性问题,即壳体δ13C值可能受大气CO2或环境碳酸盐的额外影响,可在室内基于控制变量原则进行精准的蜗牛饲养实验,例如通过14C\}标定法或设置具有不同浓度及δ13C值的大气CO2作为平行实验组,来定量考察大气CO2对壳体碳同位素组成的贡献。针对壳体δ18O指标气候意义的不明确性,借用团簇同位素方法,根据测试Δ47值可直接获得壳体碳酸盐结晶时的温度信息,并且基于该结晶温度和壳体δ18O值,推算出蜗牛体液的δ18O值,进而对比分析体液δ18O值和大气降水δ18O值之间的关系,这对简化壳体δ18O气候意义的解释具有重要意义。2)不同种属蜗牛可能因生理生态特征差异使得其壳体δ13C和δ18O值在重建古气候时出现偏差;要弄清这一问题,后续可加强野外调查和室内饲养观察研究,从而限定特定种属蜗牛(尤其是与地层化石种相对应的现生种或亲近种属)的生长周期、活动方式和摄食行为学等特征。3)壳体δ13C值作为反映环境干湿程度(如降水量)指标虽已得到较为充分的证实,但季风气候通常具有雨热同期特点,温度和降雨对壳体同位素的影响难以区分。后续工作可尝试控制温度变化,从而更好的确定降水对壳体δ13C值的控制机理,进一步修正壳体δ13C与年均降水量之间的现代校正方程。
古环境重建方面,在对壳体碳氧同位素指标气候意义获得明确认识后,后续可加大某些特定层位或关键阶段蜗牛化石样品数量的采集,以便利用统计学方法消除因蜗牛种群内或种属间同位素波动带来的偏差,从而更好的分析千百年尺度内气候的变化特征,或是借助不同年份跨度蜗牛壳体的同位素变化特征去反映年际尺度上厄尔尼洛/拉尼娜事件的变化规律。此外,需充分发挥蜗牛壳体稳定同位素组成在反映季节性气候变化上的巨大潜力,如通过对不同地层中单个蜗牛壳体沿生长带序列的同位素分析,去探究特定阶段气候的季节性变化特征;或是通过分析具有不同生态适应性蜗牛种属间同位素值的差异,来分析季节性长度的变化[78]。
| [1] |
Barker G M. The biology of terrestrial molluscs[M]//Phylogeny G ed. Gastropods on Land: Phylogeny, Diversity and Adaptive Morphology. New York: CABI Publishing, 2001: 1-146.
|
| [2] |
刘东生. 黄土与环境[M]. 北京: 科学出版社, 1985: 251. Liu Tungsheng. Loess and the Environment[M]. Beijing: Science Press, 1985: 251. |
| [3] |
Li F J, Rousseau D-D, Wu N Q, et al. Late Neogene evolution of the East Asian monsoon revealed by terrestrial mollusk record in western Chinese Loess Plateau: From winter to summer dominated sub-regime[J]. Earth and Planetary Science Letters, 2008, 274(3-4): 439-447. DOI:10.1016/j.epsl.2008.07.038 |
| [4] |
Rousseau D D, Wu N Q. A new molluscan record of the monsoon vaiability over the past 130000 yr in the Luochuan loess sequence, China[J]. Geology, 1997, 25(3): 275-278. DOI:10.1130/0091-7613(1997)025<0275:ANMROT>2.3.CO;2 |
| [5] |
吴乃琴, 裴云鹏, 吕厚远, 等. 黄土高原35万年来冬、夏季风变化周期的差异——陆生蜗牛化石的证据[J]. 第四纪研究, 2001, 21(6): 540-550. Wu Naiqin, Pei Yunpeng, Lü Houyuan, et al. Orbital forcing of East Asian summer and winter monsoon variations in the past 350000 years[J]. Quaternary Sciences, 2001, 21(6): 540-550. DOI:10.3321/j.issn:1001-7410.2001.06.010 |
| [6] |
吴乃琴, 李丰江. 陆生蜗牛化石与中国黄土古环境研究[J]. 第四纪研究, 2008, 28(5): 831-840. Wu Naiqin, Li Fengjiang. Terrestrial mollusk fossils from Chinese loess sequence and their palaeoenvironmental significance[J]. Quaternary Sciences, 2008, 28(5): 831-840. DOI:10.3321/j.issn:1001-7410.2008.05.006 |
| [7] |
吴乃琴, 刘秀平, 顾兆炎, 等. 末次盛冰期黄土高原蜗牛化石记录的气候快速变化及其影响机制[J]. 第四纪研究, 2002, 22(3): 283-291. Wu Naiqin, Liu Xiuping, Gu Zhaoyan, et al. Rapid climate variability recorded by mollusk species on the Loess Plateau during the Last Glacial Maximum[J]. Quaternary Sciences, 2002, 22(3): 283-291. DOI:10.3321/j.issn:1001-7410.2002.03.012 |
| [8] |
李丰江, 杨意权, 吴乃琴, 等. 蜗牛卵化石在黄土高原的发现及其对季节内突变气候事件的指示[J]. 第四纪研究, 2019, 39(4): 1068-1070. Li Fengjiang, Yang Yiquan, Wu Naiqin, et al. Fossil snail eggs discovered from the Chinese Loess Plateau and their indications of seasonal abrupt climate event[J]. Quaternary Sciences, 2019, 39(4): 1068-1070. |
| [9] |
Yapp C J. Oxygen and carbon isotope measurements of land snail shell carbonate[J]. Geochimica et Cosmochimica Acta, 1979, 43(4): 629-635. DOI:10.1016/0016-7037(79)90170-4 |
| [10] |
Balakrishnan M, Yapp C J, Meltzer D J, et al. Paleoenvironment of the Folsom archeological site, New Mexico, USA, approximately 10, 500 14C yr B. P. as inferred from stable isotope composition of fossil land snail shells[J]. Quaternary Research, 2005, 63(1): 31-44. DOI:10.1016/j.yqres.2004.09.010 |
| [11] |
Colonese A C, Zanchetta G, Drysdale R N, et al. Stable isotope composition of Late Pleistocene-Holocene Eobania vermiculata (Müller, 1774) (Pulmonata, Stylommatophora) shells from the Central Mediterranean basin: Data from Grotta d'Oriente (Favignana, Sicily)[J]. Quaternary International, 2011, 244(1): 76-87. DOI:10.1016/j.quaint.2011.04.035 |
| [12] |
Colonese A C, Zanchetta G, Fallick A E, et al. Stable isotope composition of Late Glacial land snail shells from Grotta del Romito (Southern Italy): Palaeoclimatic implications[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 254(4): 550-560. |
| [13] |
Prendergast A L, Stevens R E, O'Connell T C, et al. A Late Pleistocene refugium in Mediterranean North Africa? Palaeoenvironmental reconstruction from stable isotope analyses of land snail shells (Haua Fteah, Libya)[J]. Quaternary Science Reviews, 2016, 139: 94-109. DOI:10.1016/j.quascirev.2016.02.014 |
| [14] |
Yanes Y, Riquelme J A, Cámara J A, et al. Stable isotope composition of Middle to Late Holocene land snail shells from the Marroquíes archeological site (Jaén, Southern Spain): Paleoenvironmental implications[J]. Quaternary International, 2013, 302(445): 77-87. |
| [15] |
Yanes Y, Romanek C S. Quaternary interglacial environmental stability in San Salvador Island (Bahamas): A land snail isotopic approach[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 369(Supplement C): 28-40. |
| [16] |
Wu N Q, Li F J, Rousseau D-D. Terrestrial mollusk records from Chinese loess sequences and changes in the East Asian monsoonal environment[J]. Journal of Asian Earth Sciences, 2018, 155: 35-48. DOI:10.1016/j.jseaes.2017.11.003 |
| [17] |
DeNiro M J, Epstein S. Influence of diet on the distribution of carbon isotopes in animals[J]. Geochimica et Cosmochimica Acta, 1978, 42(5): 495-506. DOI:10.1016/0016-7037(78)90199-0 |
| [18] |
Metref S, Rousseau D D, Bentaleb I, et al. Study of the diet effect on δ13C of shell carbonate of the land snail Helix aspersa in experimental conditions[J]. Earth and Planetary Science Letters, 2003, 211(3): 381-393. |
| [19] |
Stott L D. The influence of diet on the δ13C of shell carbon in the pulmonate snail Helix aspersa[J]. Earth and Planetary Science Letters, 2002, 195(3): 249-259. |
| [20] |
朱莉莉, 鲍睿, 盛雪芬. 环境因素对蜗牛Achatina fulica壳体碳酸盐δ13C组成影响的实验研究[J]. 高校地质学报, 2015, 21(2): 357-364. Zhu Lili, Bao Rui, Sheng Xuefen. Experimental study on the effect of environmental factors on the carbon stable isotope composition of the snail Achatina fulica shell carbonate[J]. Geological Journal of China Universities, 2015, 21(2): 357-364. |
| [21] |
Mcconnaughey T A, Gillikin D P. Carbon isotopes in mollusk shell carbonates[J]. Geo-Marine Letters, 2008, 28(5): 287-299. DOI:10.1007/s00367-008-0116-4 |
| [22] |
Balakrishnan M, Yapp C J, Theler J L, et al. Environmental significance of 13C/12C and 18O/16O ratios of modern land-snail shells from the southern great plains of North America[J]. Quaternary Research, 2005, 63(1): 15-30. DOI:10.1016/j.yqres.2004.09.009 |
| [23] |
Baldini L M, Walker S E, Railsback L B, et al. Isotopic ecology of the modern land snail Cerion, San Salvador, Bahamas: Preliminary advances toward establishing a low-latitude island paleoenvironmental proxy[J]. Palaios, 2007, 22(2): 174-187. DOI:10.2110/palo.2005.p05.091r |
| [24] |
Chiba S, Davison A. Associations between stable carbon isotope ratio and vegetation in modern and fossil land snails Mandarina chichijimana on Chichijima of the Ogasawara Islands[J]. Paleontological Research, 2009, 13(2): 151-157. DOI:10.2517/1342-8144-13.2.151 |
| [25] |
Colonese A C, Zanchetta G, Fallick A E, et al. Oxygen and carbon isotopic composition of modern terrestrial gastropod shells from Lipari Island, Aeolian Archipelago(Sicily)[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2014, 394(465): 119-127. |
| [26] |
Goodfriend G A, Ellis G L. Stable carbon and oxygen isotopic variations in modern Rabdotus land snail shells in the southern Great Plains, USA, and their relation to environment[J]. Geochimica et Cosmochimica Acta, 2002, 66(11): 1987-2002. DOI:10.1016/S0016-7037(02)00824-4 |
| [27] |
Goodfriend G A, Magaritz M, Gat J R. Stable isotope composition of land snail body water and its relation to environmental waters and shell carbonate[J]. Geochimica et Cosmochimica Acta, 1989, 53(12): 3215-3221. DOI:10.1016/0016-7037(89)90102-6 |
| [28] |
Hassan K M. Stable isotopic signatures of the modern land snail Eremina desertorum from a low-latitude(hot) dry desert-A study from the Petrified Forest, New Cairo, Egypt[J]. Chemie der Erde-Geochemistry, 2015, 75(1): 65-72. DOI:10.1016/j.chemer.2014.09.002 |
| [29] |
Leng M J, Heaton T H E, Lamb H F, et al. Carbon and oxygen isotope variations within the shell of an African land snail (Limicolaria kambeul chudeaui Germain): A high-resolution record of climate seasonality?[J]. The Holocene, 1998, 40(8): 407-412. |
| [30] |
Prendergast A, Stevens R E, Hill E A, et al. Carbon isotope signatures from land snail shells: Implications for palaeovegetation reconstruction in the eastern Mediterranean[J]. Quaternary International, 2017, 432: 48-57. DOI:10.1016/j.quaint.2014.12.053 |
| [31] |
Yanes Y. Stable isotope ecology of land snails from a high-latitude site near Fairbanks, interior Alaska, USA[J]. Quaternary Research, 2015, 83(3): 588-595. DOI:10.1016/j.yqres.2015.03.004 |
| [32] |
Yanes Y, Asta M P, Ibáñez M, et al. Paleoenvironmental implications of carbon stable isotope composition of land snail tissues[J]. Quaternary Research, 2013, 80(3): 596-605. DOI:10.1016/j.yqres.2013.08.010 |
| [33] |
Yanes Y, Graves G R, Romanek C S. Stable isotope ecology (δ18O, δ13C, δ15N) of modern land snails along an altitudinal gradient in southern Appalachian Mountains, USA[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2018, 492: 92-103. DOI:10.1016/j.palaeo.2017.12.015 |
| [34] |
Yanes Y, Romanek C S, Delgado A, et al. Oxygen and carbon stable isotopes of modern land snail shells as environmental indicators from a low-latitude oceanic island[J]. Geochimica et Cosmochimica Acta, 2009, 73(14): 4077-4099. DOI:10.1016/j.gca.2009.04.021 |
| [35] |
刘宗秀, 顾兆炎, 吴乃琴, 等. 食物控制的陆生蜗牛碳同位素组成[J]. 科学通报, 2006, 51(20): 2410-2416. Liu Zongxiu, Gu Zhaoyan, Wu Naiqin, et al. Diet control on carbon isotopic composition of land snail shell carbonate[J]. Chinese Science Bulletin, 2006, 51(20): 2410-2416. DOI:10.3321/j.issn:0023-074X.2006.20.013 |
| [36] |
Bao R, Sheng X F, Lu H Y, et al. Stable carbon and oxygen isotopic composition of modern land snails along a precipitation gradient in the mid-latitude East Asian monsoon region of China[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2019, 533: 109236. DOI:10.1016/j.palaeo.2019.109236 |
| [37] |
Farquhar G, Ehleringer J, Hubick K T. Carbon isotope discrimination and photosynthesis[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1989, 40(1): 503-537. DOI:10.1146/annurev.pp.40.060189.002443 |
| [38] |
O'Leary M H. Carbon isotope fractionation in plants[J]. Phytochemistry, 1981, 20(4): 553-567. DOI:10.1016/0031-9422(81)85134-5 |
| [39] |
Sage R F, Wedin D A, Li M. The biogeography of C4 photosynthesis: Patterns and controlling factors[M]//Sage R F, Monson R K. C4 Plant Biology. San Diego: Academic Press, 1999: 313.
|
| [40] |
Still C J, Berry J A, Collatz G J, et al. Global distribution of C3 and C4 vegetation: Carbon cycle implications[J]. Global Biogeochemical Cycles, 2003, 17(1): 6-1. |
| [41] |
Kohn M J. Carbon isotope compositions of terrestrial C3 plants as indicators of (paleo) ecology and (paleo) climate[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(46): 19691-19695. DOI:10.1073/pnas.1004933107 |
| [42] |
Wang G A, Feng X H, Han J M, et al. Paleovegetation reconstruction using δ13C of soil organic matter[J]. Biogeosciences, 2008, 5(5): 1325-1337. DOI:10.5194/bg-5-1325-2008 |
| [43] |
O'Leary M H. Carbon isotopes in photosynthesis: Fractionation techniques may reveal new aspects of carbon dynamics in plants[J]. Bioscience, 1988, 38(5): 328-336. DOI:10.2307/1310735 |
| [44] |
Goodfriend G A, Magaritz M. Carbon and oxygen isotope composition of shell carbonate of desert land snails[J]. Earth and Planetary Science Letters, 1987, 86(2): 377-388. |
| [45] |
Bao R, Sheng X F, Teng H H, et al. Reliability of shell carbon isotope composition of different land snail species as a climate proxy: A case study in the monsoon region of China[J]. Geochimica et Cosmochimica Acta, 2018, 228: 42-61. DOI:10.1016/j.gca.2018.02.022 |
| [46] |
Wang X, Zhai J X, Cui L L, et al. Stable carbon and oxygen isotopes in shell carbonates of modern land snails in China and their relation to environment variables[J]. Journal of Geophysical Research: Biogeosciences, 2019, 124(11): 3356-3376. DOI:10.1029/2019JG005255 |
| [47] |
Goodfriend G A, Hood D J. Carbon isotope analysis of land snail shells: Implications for carbon sources and radiocarbon dating[J]. Radiocarbon, 1983, 25(3): 184-191. |
| [48] |
Goodfriend G A, Stipp J J. Limestone and the problem of radiocarbon dating of land-snail shell carbonate[J]. Geology, 1983, 11(10): 575-577. DOI:10.1130/0091-7613(1983)11<575:LATPOR>2.0.CO;2 |
| [49] |
Zhang N Z, Yamada K, Suzuki N, et al. Factors controlling shell carbon isotopic composition of land snail Acusta despecta sieboldiana estimated from laboratory culturing experiment[J]. Biogeosciences, 2014, 11(19): 5335-5348. DOI:10.5194/bg-11-5335-2014 |
| [50] |
Yanes Y, Delgado A, Castillo C, et al. Stable isotope (δ18O, δ13C, and δD) signatures of recent terrestrial communities from a low-latitude, oceanic setting: Endemic land snails, plants, rain, and carbonate sediments from the eastern Canary Islands[J]. Chemical Geology, 2008, 249(3-4): 377-392. DOI:10.1016/j.chemgeo.2008.01.008 |
| [51] |
Romaniello L, Quarta G, Mastronuzzi G. 14C age anomalies in modern land snails shell carbonate from Southern Italy[J]. Quaternary Geochronology, 2008, 3(1-2): 68-75. DOI:10.1016/j.quageo.2007.01.006 |
| [52] |
Yanes Y, Gómez-Puche M, Esquembre-Bebia M A, et al. Younger Dryas-Early Holocene transition in the south-eastern Iberian Peninsula: Insights from land snail shell middens[J]. Journal of Quaternary Science, 2013, 28(8): 777-788. DOI:10.1002/jqs.2673 |
| [53] |
Yates T, Spiro B F, Vita C. Stable isotope variability and the selection of terrestrial mollusc shell samples for 14C dating[J]. Quaternary International, 2002, 87(1): 87-100. DOI:10.1016/S1040-6182(01)00064-7 |
| [54] |
Pigati J S, Quade J, Shahanan T M, et al. Radiocarbon dating of minute gastropods and new constraints on the timing of Late Quaternary spring-discharge deposits in southern Arizona, USA[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2004, 204(1): 33-45. |
| [55] |
Pigati J S, Rech J A, Nekola J C. Radiocarbon dating of small terrestrial gastropod shells in North America[J]. Quaternary Geochronology, 2010, 5(5): 519-532. DOI:10.1016/j.quageo.2010.01.001 |
| [56] |
Magaritz M, Heller J, Volokita M. Land-air boundary environment as recorded by the 18O/16O and 13C/12C isotope ratios in the shells of land snails[J]. Earth and Planetary Science Letters, 1981, 52(1): 101-106. DOI:10.1016/0012-821X(81)90212-0 |
| [57] |
Bao R, Sheng X F, Li C L, et al. Effect of altitude on the stable carbon and oxygen isotopic compositions of land snails at the margin of the East Asian monsoon[J]. Geochimica et Cosmochimica Acta, 2020, 273: 99-115. DOI:10.1016/j.gca.2020.01.029 |
| [58] |
Balakrishnan M, Yapp C J. Flux balance models for the oxygen and carbon isotope compositions of land snail shells[J]. Geochimica et Cosmochimica Acta, 2004, 68(9): 2007-2024. DOI:10.1016/j.gca.2003.10.027 |
| [59] |
Epestein S, Buchsbaum R, Lowenstam H, et al. Carbonate-water isotopic temperature scale[J]. GSA Bulletin, 1951, 62(4): 417-426. DOI:10.1130/0016-7606(1951)62[417:CITS]2.0.CO;2 |
| [60] |
鲍睿, 盛雪芬. 蜗牛Achatina fulica壳体δ18O环境指示意义的实验[J]. 科学通报, 2015, 60(20): 1924-1931. Bao Rui, Sheng Xuefen. The δ18O study of the laboratory-cultured Achatina fulica snail shell and its environmental implications[J]. Chinese Science Bulletin, 2015, 60(20): 1924-1931. |
| [61] |
Zhang N Z, Yamada K, Yoshida N. Food water contribution to the oxygen isotope composition of land snail body water and its environmental implication[J]. Geochemistry, Geophysics, Geosystems, 2018, 19(6): 1800-1808. DOI:10.1029/2018GC007468 |
| [62] |
Lécolle P. The oxygen isotope composition of landsnail shells as a climatic indicator: Applications to hydrogeology and paleoclimatology[J]. Chemical Geology Isotope Geoscience, 1985, 58(1-2): 157-181. DOI:10.1016/0168-9622(85)90036-3 |
| [63] |
Prendergast A, Stevens R E, Barker G, et al. Oxygen isotope signatures from land snail (Helix melanostoma) shells and body fluid: Proxies for reconstructing Mediterranean and North African rainfall[J]. Chemical Geology, 2015, 409: 87-98. DOI:10.1016/j.chemgeo.2015.05.014 |
| [64] |
Yanes Y, Al-Qattan N M, Rech J A, et al. Overview of the oxygen isotope systematics of land snails from North America[J]. Quaternary Research, 2019, 91(1): 329-344. DOI:10.1017/qua.2018.79 |
| [65] |
Zanchetta G, Leone G, Fallick A, et al. Oxygen isotope composition of living land snail shells: Data from Italy[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2005, 223(1): 20-33. |
| [66] |
刘宗秀, 顾兆炎, 许冰, 等. 夏季风降水对黄土高原现生蜗牛壳体碳酸盐氧同位素组成的影响[J]. 第四纪研究, 2006, 26(4): 643-648. Liu Zongxiu, Gu Zhaoyan, Xu Bing, et al. Monsoon precipitation effect on oxygen isotope composition of land snail shell carbonate from the Loess Plateau[J]. Quaternary Sciences, 2006, 26(4): 643-648. DOI:10.3321/j.issn:1001-7410.2006.04.021 |
| [67] |
孙小虹, 顾兆炎, 王旭. 细纹灰尖巴蜗牛壳体氧同位素组成的季节性变化[J]. 第四纪研究, 2009, 29(5): 976-980. Sun Xiaohong, Gu Zhaoyan, Wang Xu. Oxygen isotopic variations in the shells collected monthly from a live species of land snails at a locale in Zhenjiang, Jiangsu provinces, China[J]. Quaternary Sciences, 2009, 29(5): 976-980. DOI:10.3969/j.issn.1001-7410.2009.05.15 |
| [68] |
Rozanski K, Araguás-Araguás L, Gonfiantini R. Isotopic patterns in modern global precipitation[M]//Swart P K, Lohmann K C, McKenzie J, et al. eds. Climate Change in Continental Isotopic Records. Geophysical Monograph Series, Volume 78. American Geophysical Union (AGU), 1993: 1-36. https://doi.org/10.1029/GM078p0001.
|
| [69] |
Leone G, Bonadonna F, Zanchetta G. Stable isotope record in mollusca and pedogenic carbonate from Late Pliocene soils of Central Italy[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2000, 163(3): 115-131. |
| [70] |
Colonese A C, Zanchetta G, Fallick A E, et al. Holocene snail shell isotopic record of millennial-scale hydrological conditions in western Mediterranean: Data from Bauma del Serrat del Pont(NE Iberian Peninsula)[J]. Quaternary International, 2013, 303(14): 43-53. |
| [71] |
Colonese A C, Zanchetta G, Perlès C, et al. Deciphering Late Quaternary land snail shell δ18O and δ13C from Franchthi Cave (Argolid, Greece)[J]. Quaternary Research, 2013, 80(1): 66-75. DOI:10.1016/j.yqres.2013.03.006 |
| [72] |
Yanes Y, Gutiérrez-Zugasti I, Delgado A. Late-glacial to Holocene transition in Northern Spain deduced from land-snail shelly accumulations[J]. Quaternary Research, 2012, 78(2): 373-385. DOI:10.1016/j.yqres.2012.06.008 |
| [73] |
顾兆炎, 刘宗秀, 许冰, 等. 末次冰期黄土中蜗牛壳体碳酸盐同位素组成与其环境指示意义[J]. 第四纪研究, 2009, 29(1): 13-22. Gu Zhaoyan, Liu Zongxiu, Xu Bing, et al. Stable carbon and oxygen isotopes in land snail carbonate shells from a last glacial loess sequence and their implications of environmental changes[J]. Quaternary Sciences, 2009, 29(1): 13-22. |
| [74] |
Dong J B, Eiler J, An Z S, et al. Clumped and stable isotopes of land snail shells on the Chinese Loess Plateau and their climatic implications[J]. Chemical Geology, 2020, 533: 119414. DOI:10.1016/j.chemgeo.2019.119414 |
| [75] |
Ning Y F, Liu W G, An Z S. A 130-ka reconstruction of precipitation on the Chinese Loess Plateau from organic carbon isotopes[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2008, 270(1): 59-63. |
| [76] |
Liu W G, Feng X H, Ning Y F, et al. δ13C variation of C3 and C4 plants across an Asian monsoon rainfall gradient in arid Northwestern China[J]. Global Change Biology, 2005, 11(7): 1094-1100. DOI:10.1111/j.1365-2486.2005.00969.x |
| [77] |
Wang X, Dettman D, Wang M, et al. Seasonal wet-dry variability of the Asian monsoon since the Middle Pleistocene[J]. Quaternary Science Reviews, 2020, 247(106568). DOI:10.1016/j.quascirev.2020.106568 |
| [78] |
黄林培, 吴乃琴, 顾兆炎, 等. 75 ka以来黄土高原蜗牛生长季节长度的变化[J]. 科学通报, 2012, 57(9): 732-742. Huang Linpei, Wu Naiqin, Gu Zhaoyan, et al. Variability of snail growing season at the Chinese Loess Plateau during the last 75 ka[J]. Chinese Science Bulletin, 2012, 57(9): 732-742. |
| [79] |
Ghosh P, Adkins J, Affek H, et al. 13C-18O bonds in carbonate minerals: A new kind of paleothermometer[J]. Geochimica et Cosmochimica Acta, 2006, 70(6): 1439-1456. DOI:10.1016/j.gca.2005.11.014 |
| [80] |
Schauble E A, Ghosh P, Eiler J M. Preferential formation of 13 C-18O bonds in carbonate minerals, estimated using first-principles lattice dynamics[J]. Geochimica et Cosmochimica Acta, 2006, 70(10): 2510-2529. DOI:10.1016/j.gca.2006.02.011 |
| [81] |
Zaarur S, Olack G, Affek H P. Paleo-environmental implication of clumped isotopes in land snail shells[J]. Geochimica et Cosmochimica Acta, 2011, 75(22): 6859-6869. DOI:10.1016/j.gca.2011.08.044 |
| [82] |
Zhang N Z, Yamada K, Kano A, et al. Equilibrated clumped isotope signatures of land-snail shells observed from laboratory culturing experiments and its environmental implications[J]. Chemical Geology, 2018, 488: 189-199. DOI:10.1016/j.chemgeo.2018.05.001 |
| [83] |
Kelson J R, Huntington K W, Schauer A J, et al. Toward a universal carbonate clumped isotope calibration: Diverse synthesis and preparatory methods suggest a single temperature relationship[J]. Geochimica et Cosmochimica Acta, 2017, 197: 104-131. DOI:10.1016/j.gca.2016.10.010 |
| [84] |
Wang X, Cui L L, Zhai J X, et al. Stable and clumped isotopes in shell carbonates of land snails Cathaica sp. and Bradybaena sp. in North China and implications for ecophysiological characteristics and paleoclimate studies[J]. Geochemistry, Geophysics, Geosystems, 2016, 17(1): 219-231. DOI:10.1002/2015GC006182 |
| [85] |
Zhai J X, Wang X, Qin B, et al. Clumped isotopes in land snail shells over China: Towards establishing a biogenic carbonate paleothermometer[J]. Geochimica et Cosmochimica Acta, 2019, 257: 68-79. DOI:10.1016/j.gca.2019.04.028 |
| [86] |
Guo Y R, Deng W F, Wei G J, et al. Clumped isotopic signatures in land-snail shells revisited: Possible palaeoenvironmental implications[J]. Chemical Geology, 2019, 519: 83-94. DOI:10.1016/j.chemgeo.2019.04.030 |
| [87] |
Eagle R A, Risi C, Mitchell J L, et al. High regional climate sensitivity over continental China constrained by glacial-recent changes in temperature and the hydrological cycle[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22): 8813-8818. DOI:10.1073/pnas.1213366110 |
2 Key Laboratory of Surficial Geochemistry, Ministry of Education, School of Earth Sciences and Engineering, Nanjing University, Nanjing 210023, Jiangsu;
3 Jiangsu Collaborative Innovation Center for Climate Change, Nanjing 210046, Jiangsu)
Abstract
The carbon and oxygen isotopic composition(δ13C and δ18O) of the fossil shells of land snails, which are sensitive to climatic and environmental changes, has great potential to reconstruct the palaeoecology and palaeohydrology conditions. However, the research on δ13C and δ18O of snail fossils from Chinese loess-palaeosol sequences is still badly lacking, because the climatic significance of shell δ13C and δ18O proxies is still unclear. In this paper, we review the research progress on the climatic and environmental significance of δ13C andδ18O in land snail shells from the perspective of modern process, and point out the complexity and multiplicity of controlled factors for each proxy. In conclusion, land snail shell δ13C values respond to the change of local precipitation by reflecting the change of δ13C value of ingested plants(especially for C3 plants), and then indicate the humidity or aridity of an environment. However, the influence of additional factors such as environmental carbonate and atmospheric CO2 on the shell δ13C value should be considered. To a certain degree, the shell δ18O can record the variation of theδ18O of meteoric water, but the influence of evaporation effect and temperature on the shell δ18O values could not be ignored. Moreover, shell δ13C and δ18O as climatic indicators are often region-dependent and species-dependent. In addition, this paper introduces the recent advances about the palaeomonsoon reconstructions using stable isotope compositions of snail fossils from the Quaternary loess sequences in Northern China, and the advances about the clumped isotope of snail shells during the past decade. Finally, possible solutions for solving the controversy in shell δ13C or δ18O climate proxy, and the main future application directions of paleoenvironment reconstruction based on stable isotope compositions of land snails, are proposed. 2021, Vol.41
2021, Vol.41

