2 School of Biological Sciences, University Sains Malaysia, Malaysia Penang 11960)
迄今为止,末次冰盛期时在南海南部广泛暴露的巽他大陆架上生长何种植被,仍然存在着热带稀树草原和热带森林之争[1~5],这一问题的明确对于正确理解冰期时植被与碳循环之间的关系具有重要的意义。然而,热带地区的植物多为虫媒授粉,花粉产量低,地层中的花粉化石组合不能够全面反映当时的植被面貌[6]。因此,我们需要发展另外的古植被替代性指标来弥补热带花粉表现力低的缺陷。
植硅体(Phytolith)是植物从土壤中吸收可溶性二氧化硅并沉淀于植物细胞内或细胞壁之间而形成的具有不同形态的固体二氧化硅颗粒[7]。一些植物含有的植硅体具有可辨识的形态差异,这使得植硅体分析可以广泛应用在古气候与古植被重建方面[8~15]。已有的研究表明,热带雨林中的植硅体组合与热带稀树草原等植被类型中的组合有所不同。例如,非洲中部149个表土植硅体样品中,球形植硅体的含量与热带森林盖度存在极大的相关性[16]。平滑和粗糙球型在热带雨林植硅体组合中的含量比其他地区更高[17]。球形植硅体在南美亚马逊雨林表土组合中占据统治地位[18]。然而,在东南亚热带地区,此类的植硅体研究是缺乏的,这阻碍了我们将植硅体分析应用于该地区的古植被重建工作中。现有的研究主要集中于植物个体的植硅体形态观察,例如Kealhofer和Piperno[19]对东南亚377个种的热带植物进行了植硅体形态分析,其中的9科单子叶植物和26科双子叶植物含有具有形态鉴定意义的植硅体。例如,具有折叠状纹饰的球型植硅体出现在姜科(Zingiberaceae)植物中,表皮光滑的球型植硅体则出现在厚壳树科(Ehretiaceae)植物中,外表有刺的球型植硅体出现在棕榈科(Palmae)植物中[19]。
在本研究中,我们收集了马来半岛西部Jerai山不同海拔高度的表土样品,分析热带雨林气候区山地表土植硅体的形态类型及组合特征,探讨不同海拔高度的植硅体组合与周边植被的关系;试图找到能够明确指示热带森林的植硅体组合。由于当地以龙脑香科(Dipterocarpaceae)植物为主的热带森林植被也普遍出现在东南亚地区,本研究对于区域性的古植被替代性指标研究具有重要的意义。
1 区域环境Jerai山(5°47′N,101°26′E)坐落于马来半岛西北部的吉打州境内(5°44′~5°50′N,100°22′~100°29′E),濒临印度洋,最高海拔高度是1217 m(图 1a)。该地区受控于热带雨林气候,特点是终年高温多雨。基于文献资料[20]和实地调查(表 1),Jerai山自下至上可被分为4个不同的植被带(图 1c)。

|
图 1 Jerai山地理位置(a)、表土采样点的水平(b)和垂直分布图(c) Fig. 1 The location of Jerai Hill (a), horizon (b) and vertical (c) distributions of sampling sites |
| 表 1 Jerai山表土采样点周边植物调查表 Table 1 Plants investigation around surface soil samples on Jerai Hill |
本带的海拔介于0~500 m范围内,对应于J10、J11、J12、J13和J14号这5个表土样品。自然植被以龙脑香科植物为主。
1.2 丘陵龙脑香林带本带为过渡带,海拔在500~850 m范围内,对应于J4、J5、J6、J7、J8和J9号这6个表土样品。与低地龙脑香林带相比,龙脑香科植物的丰度下降,其中婆罗双属(Shorea)数量呈增加趋势,许多棕榈科植物在本带上部逐渐消失,樟科(Lauraceae)、壳斗科(Fagaceae)植物开始出现并增多。
1.3 石楠林带本带的海拔介于850~950 m范围内,对应于J2和J3号这两个表土样品。自然植被以灌木、小乔木为主。本带出现的桃金娘科植物包括薄子木属(Leptospermum)、Baechia、红胶木(Tristania)、番樱桃属(Eugenia)等。此外,本带还发育有石楠(Styphelia)、泥炭藓(Sphagnum)等。
1.4 山地林带本带的海拔介于950~1217 m范围内,对应于表土样品J1号。主要以热带山地植物和温带植物成分为主,主要包括陆均松属(Dacrydium)、栎属(Quercus)、石栎属(Lithocarpus)、杜鹃属(Rhododendron)、越桔属(Vaccinium)、樟科(Lauraceae)以及蔷薇科(Rosaceae)等。
2 研究材料与方法样品采样地点位于马来西亚Jerai山海拔220~1000 m范围内,自下而上共采集了14个表土样品(J1~J14)(图 1b)。与此同时,由于较高海拔区域植物科、属的丰富度较高,本研究还记录了J1、J2、J3和J5号表土样品周边的植物种类(图 1c和表 1)。在J4号样品以下的低海拔地区,植被类型为龙脑香林,主要的建群种为不同种、属的龙脑香科植物。表土样品在宁波大学地理系实验室进行处理,实验采用了湿式灰化法[21],具体步骤如下:1)取烘干样品10 g于500 ml大烧杯中;2)加入10 %稀盐酸,加热,脱钙去铁质;3)加入30 %双氧水,加热,去除有机质;4)用沉降法去除样品中的粘土颗粒;5)用比重为2.385的重液(HI+KI+Zn)浮选,离心后收集上浮的液体;6)制片于显微镜下观察,每个样品统计鉴定植硅体500粒以上。文中采用ICPN 1.0[22]、王永吉和吕厚远[23]的分类标准描述植硅体的形态。我们使用Tilia软件和SPSS软件对统计到的植硅体进行数量统计。植硅体形态观察是在Motic BA410型光学显微镜的400倍和1000倍镜头下进行的。
3 研究结果在本研究中,共12261粒植硅体被鉴定和统计,它们的形态可被划分为17种特征明显的类型以及更多的亚型和少数未有命名的类型。主要类型为鞍型、棒型、多裂梯型、木本不规则形态、矩形、板型、维管组织、方型、块状、塔型、双裂片型、十字型、硅化气孔、球型、椭球型、楔型、楔型泡状细胞等。在此基础上,基于表面纹饰的差异,球形植硅体还可进一步被划分为4个亚型,包括刺状纹饰、颗粒状纹饰、孔状纹饰、坑状纹饰;椭球形还可被划分为刺状和孔状亚型;棒型植硅体还可被分为7种亚型,它们分别是扁棒型、短棒型、刺状棒型、平滑棒型、尖棒型、隆凸棒型、长方体棒型;其他的亚型还包括板型的3个亚型、块状的3个亚型。
3.1 形态描述 3.1.1 鞍型马鞍状,两头较厚,中部略凹,表面光滑。鞍型长在5.8~31.1 μm之间,宽在3.9~21.9 μm之间,高在3.9~13.9 μm之间(图 2-1)。

|
图 2 Jerai山表土植硅体形态(Ⅰ) 1.鞍型(saddle);2.扁棒型(elongate platelike);3.短棒型(elongate short);4~7.刺状棒型(elongate echinate);8~9.平滑棒型(elongate smooth);10.尖棒型(elongate point);11.隆凸棒型(elongate process);12.长方体棒型(elongate cuboid);13.三棱柱型(prism sinuate);14.多裂梯型(trapeziform sinuate);15~20.木本不规则形态(irregular shapes from woody plants);21.矩形(rectangular)粗的比例尺棒(thick scale bars)=50 μm;细的比例尺棒(thin scale bars)=20 μm Fig. 2 Morphological images and line drawings of phytoliths from the surface soil layer on Jerai Hill(Ⅰ) |
棒型包含7种亚型。扁棒型侧视图呈扁平状,俯视图呈长方形,一般长在40.2~103.3 μm之间,宽在15.5~29.3 μm之间,长宽比约为3.5(图 2-2);短棒型一般长在18.8~47.2 μm之间,宽在4.6~21.7 μm,长宽比约为2.5(图 2-3);刺棒型两侧或者一侧有规律排列着小刺,一般长在13.7~94.5 μm之间,宽在1.49~19.4 μm之间(图 2-4~7);平滑棒型边缘呈平直状,表面光滑无纹饰,一般长在25.6~122.7 μm之间,宽在1.8~25.1 μm之间,长宽比约为5(图 2-8~9);尖棒型长在40.9~189.7 μm之间,宽在4.8~33.5 μm之间(图 2-10);隆凸棒型边缘蜿蜒曲折,一般长在42.7~71.1 μm之间,宽在11.0~31.8 μm(图 2-11);长方体棒型形态规则,呈长方体状,表面光滑无纹饰,一般长在26.6~84.9 μm之间,宽在4.5~15.6 μm之间(图 2-12)。短棒型、尖棒型以及长方体棒型的命名根据形态和长、宽比数据定义,刺棒型和隆凸棒型命名分别根据ICPN 1.0中的Elongate Echinate和Gibbous形态描述[22]。
3.1.3 多裂梯形长条薄板状,两侧具圆形凸齿或圆滑内凹,本研究仅发现一例多裂梯型,长20 μm,宽9.9 μm(图 2-14)。
3.1.4 木本不规则形态表面纹饰呈突起状或锯齿状,纹饰多样,一般长在38.7~71.1 μm之间,宽在4.8~31.8 μm之间(图 2-15~20)。
3.1.5 矩形矩形呈薄片状,四周平滑,无弯曲,一般长边/短边的比值大于4/3。本研究观察的矩形植硅体长在19.4~57.0 μm之间,宽在12.7~36.6 μm之间(图 2-21)。
3.1.6 板型呈薄板状,长在9.9~93.3 μm之间,宽在8.1~41.5 μm之间。基于边缘纹饰,板型可分为乳突状(图 3-1)、不规则弯曲(图 3-2)以及平直(图 3-3)状边缘这3种亚形态。
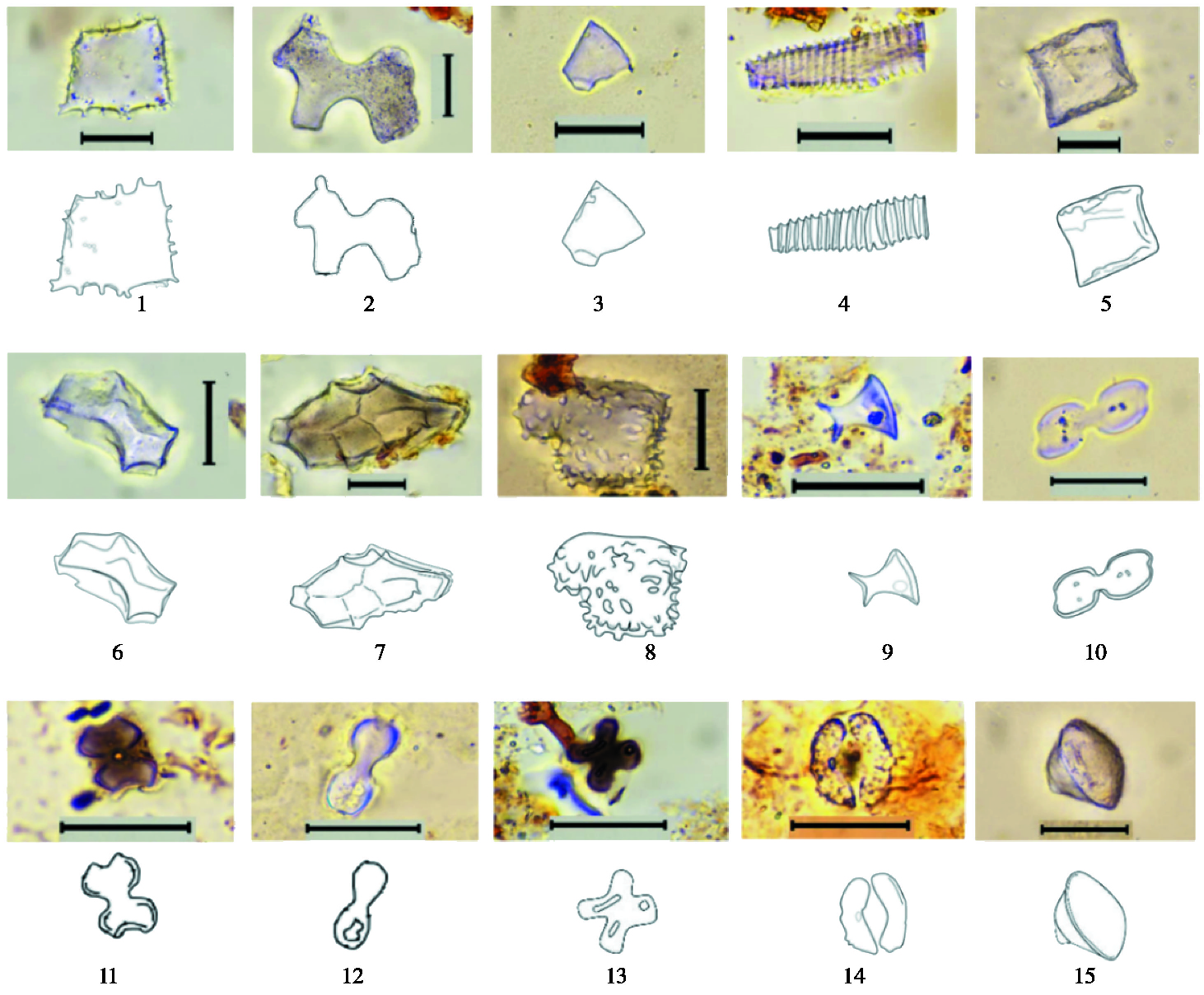
|
图 3 Jerai山表土植硅体形态(Ⅱ) 1~3.板型(tabular);4.维管组织型(vascular tissues);5.方型(square);6~8.块状(blocky bodies);9.塔型(tower);10~12.双裂片型(bilobates);13.十字型(cross);14.硅化气孔(silicified stomate);15.其他类型(other types)比例尺(scale bars)=20 μm Fig. 3 Morphological images and line drawings of phytoliths from the surface soil layer on Jerai Hill(Ⅱ) |
维管组织型植硅体表面有环状结构,一般长在14.8~117.9 μm之间,直径在5~16 μm之间(图 3-4)。
3.1.8 方型俯视呈正方形,侧视为矩形,较薄,一般长边/短边的比值在4/3范围内。本研究的方型边长在14.9~33.8 μm之间(图 3-5)。
3.1.9 块状呈不规则的多面体形态,表面纹饰多样,具有凹坑和突起等纹饰。块的大小不一,一般长在7.5~116.4 μm之间,宽在4.7~71.2 μm之间(图 3-6~8)。
3.1.10 塔型塔型属于植物短细胞。本研究发现的塔型植硅体高在3.2~15.2 μm之间,底面直径在2.2~17.5 μm之间,除产自于禾本科植物的典型的塔型植硅体外(图 3-9),我们还发现了另外两种非典型的塔型植硅体。它们的一端较宽,而另一端为尖形,体积也小于典型的塔型。两者还存在略微的区别,第一种的形状类似于子弹头(图 4-18),第二种类似于锥形(图 4-19)。已有的研究没有证明这两种非典型的塔型植硅体来自于禾本科,具体的来源还不明确。
3.1.11 双裂片型双裂片型顶面、底面以及侧面对称,均为双裂片状,当出现两个以上的铃状发育时,则称为多铃型。亚型Ⅰ外端轮廓薄弱,不封闭,呈平截状(图 3-10);亚型Ⅱ外端明显内凹,内凹轮廓呈圆滑弧线(图 3-11);亚型Ⅲ外端轮廓封闭圆滑(图 3-12)。双裂片型一般长在7.6~31.7 μm之间,宽在2.9~14.0 μm之间,柄长在1.2~8.5 μm之间。
3.1.12 十字型底面和顶面具有大小相当的四裂瓣轮廓,侧面完全对称。十字型一般对角线长在12.3~16.2 μm之间,同侧端距在12.8~14.5 μm之间(图 3-13)。
3.1.13 硅化气孔大多呈肾型,近气孔间隙的壁厚,背气孔间隙的壁薄。气孔一般长在19.2~62.5 μm之间,宽在12.5~50.0 μm之间(图 3-14)。
3.1.14 球型球型可分为4种不同的亚形态,分别是凹坑球型、刺球型、多孔球型、球粒型,其中刺球型又分为多刺型和少刺型两种。
凹坑球型植硅体大小一般在4.8~36.6 μm之间,球体表面分散着直径2~3 μm左右的不均匀凹坑(图 4-1~2)(由球型的表面纹饰特征定义)。
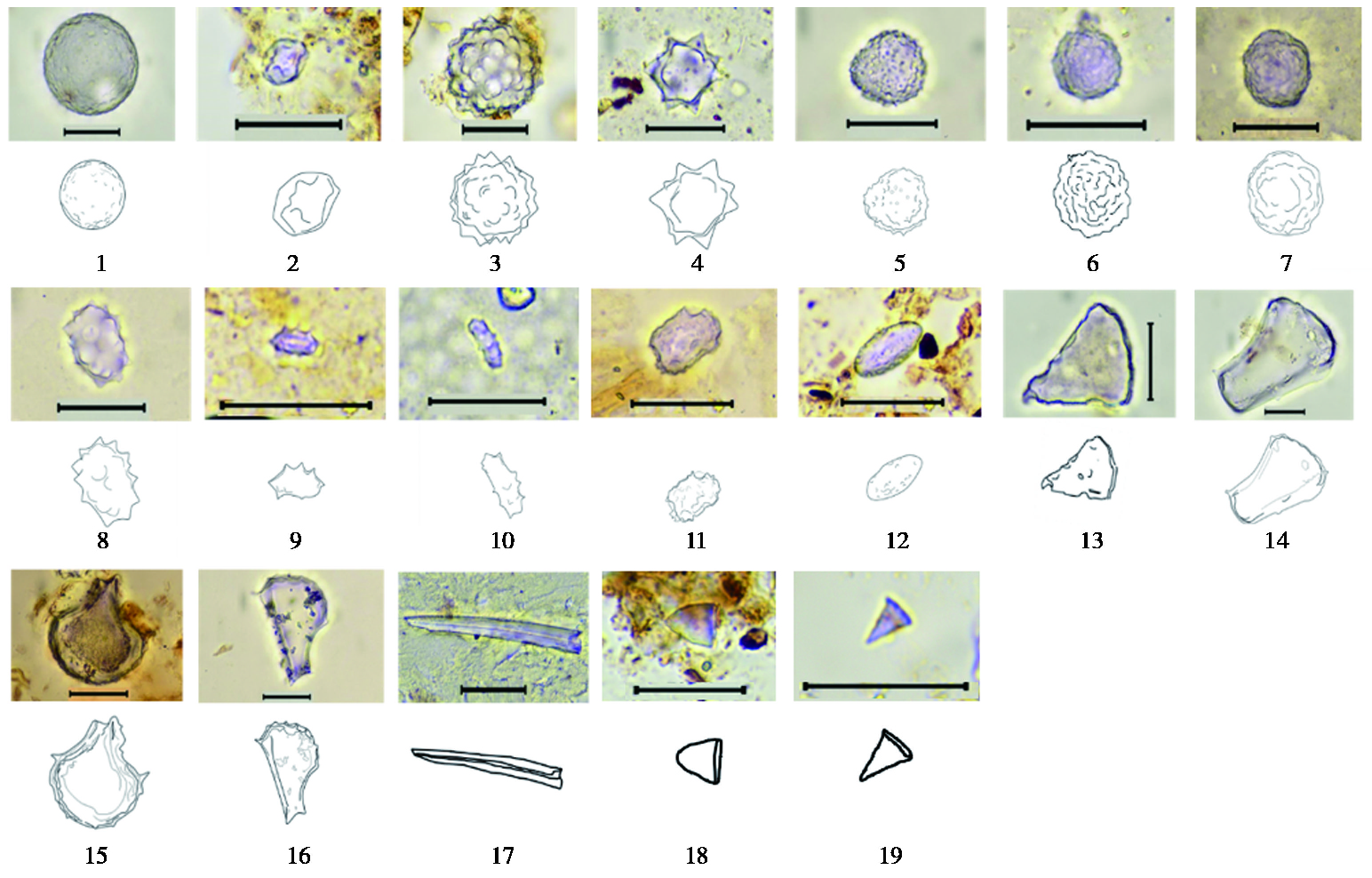
|
图 4 Jerai山表土植硅体形态(Ⅲ) 1~2.凹坑球型(globular cavate);3.多刺球型(globular more-echinate);4.少刺球型(globular less-echinate);5.多孔球型(globular multiaperture);6~7.球粒型(globular granulate);8~10.刺状椭球型(ellipsoidal echinate);11~12.孔状椭球型(ellipsoidal multiaperture);13.楔型(cuneiform);14~16.楔型泡状细胞(cuneiform bulliform cells);17.海绵骨针(sponge spicule);18~19.塔型(tower)比例尺(scale bars)=20 μm Fig. 4 Morphological images and line drawings of phytoliths from the surface soil layer on Jerai Hill(Ⅲ) |
刺球型植硅体大小一般在3.8~31.6 μm之间,表面分散着高度为2~4 μm的刺状凸起。根据球体赤道面刺的多少可将刺球型分为多刺球型和少刺球型,赤道面凸起刺个数大于12的为多刺球型(图 4-3),个数小于12的为少刺球型(图 4-4)。
多孔球型植硅体大小一般在4.6~48.6 μm之间,球体表面分散着直径1~2 μm左右的小孔(图 4-5)。
球粒型植硅体大小一般在4.4~30.2 μm之间,表面分散着高度为1 μm左右的疣状凸起,球表面的疣状凸起大小不一,分布不均(图 4-6~7)。
3.1.15 椭球型本研究中椭球型植硅体分为两种,分别为刺状椭球和孔状椭球。
刺状椭球形态呈椭球状,椭球两侧圆滑,长在9.4~14.6 μm之间,直径在3.8~9.0 μm之间,表面具有2 μm左右的刺状凸起(图 4-8~10)。
孔状椭球表面呈孔状形态,长在13.5~42.5 μm之间,直径在7.6~22.3 μm之间,孔的直径在1 μm左右,分布比较均匀(图 4-11~12)。
3.1.16 楔型呈楔状,表平较薄。楔型一般长在35~51.1 μm之间,底宽在1.7~2.1 μm之间,腰宽(中间最宽处)在27.9~39.4 μm之间,底和腰的距离在27.1~34 μm之间(图 4-13)。
3.1.17 楔型泡状细胞呈扇状或楔形。一般长在3.5~63.1 μm之间,底宽在0.6~21.3 μm之间,腰宽在3.1~53.6 μm之间,底和腰的距离在1.7~44.1 μm之间(图 4-14~16)。
除了上述形态,我们还发现了少量的蕨类三棱柱型(图 2-13)、其他未知的形态(图 3-15)及海绵骨针(图 4-17)。
3.2 各植被带的表土植硅体组合 3.2.1 低地龙脑香林带该植被带的植硅体组合为球型-木本不规则形态-块状组合带,包括5个样品(图 1c)。球型植硅体含量最高,平均含量达到82.00 %,其中的球粒型平均含量为31.97 %,其次是多孔球型,平均为22.96 %。刺球型含量为15.60 %,凹坑球型含量为11.71 %,木本不规则形态含量低于球型,为7.60 %。块状平均含量为7.17 %,鞍型平均含量为0.19 %,塔型平均含量为0.35 %。楔型泡状细胞平均含量为0.07 %,双裂片型平均含量为0.44 % (图 5和6)。

|
图 5 Jerai山不同海拔高度表土植硅体百分含量(%) Fig. 5 Percentage (%) of topsoil phytolith at different elevations on Jerai Hill |
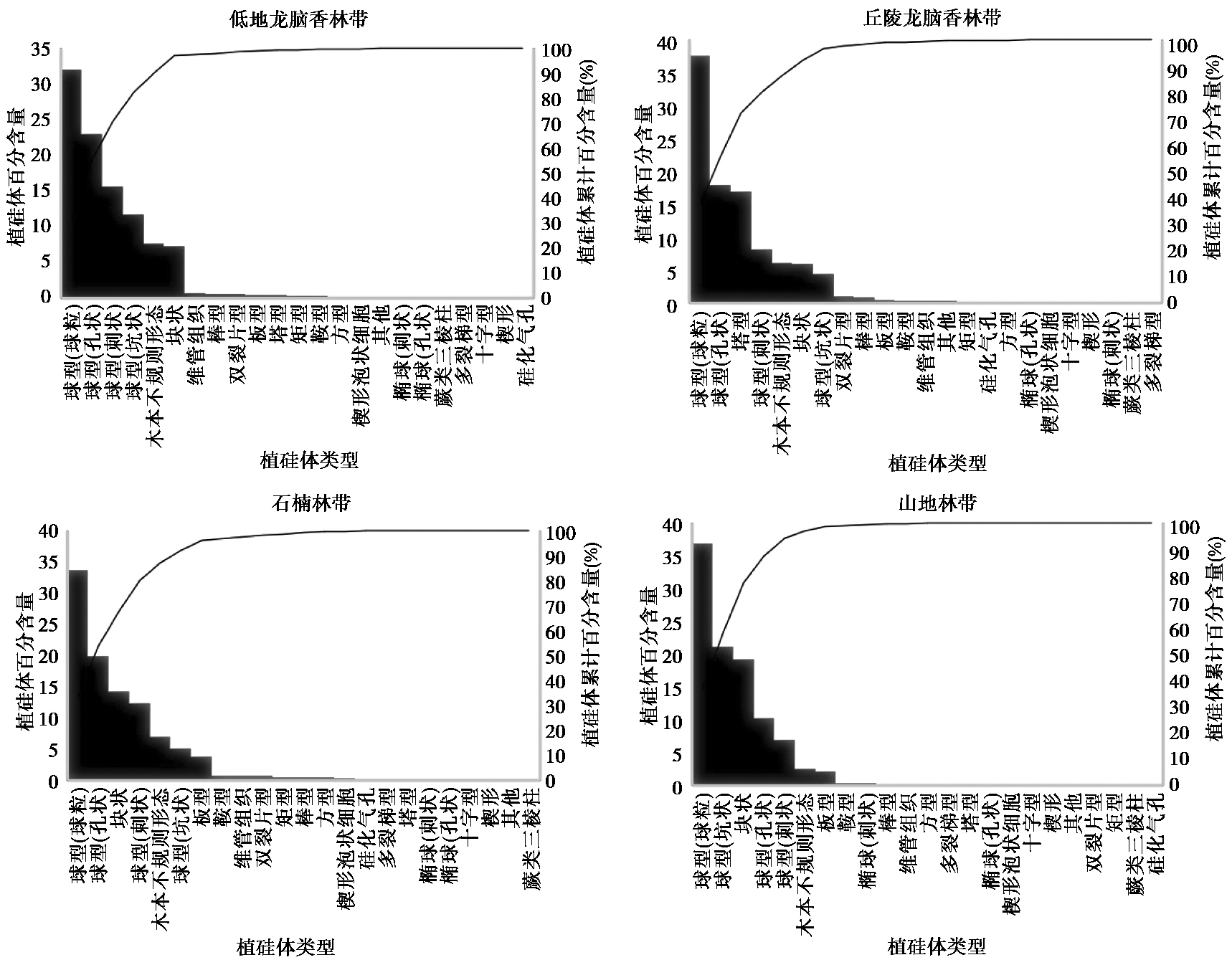
|
图 6 植硅体百分含量降序排列及累计百分含量(%) Fig. 6 Descending order and cumulative chart of phytolith percentage(%) |
该植被带的植硅体组合为球型-塔型-木本不规则形态组合带,包括6个样品。球型植硅体含量最高,平均含量达到67.80 %,其中的球粒型平均含量为37.50 %,多孔球型平均含量为17.83 %。刺球型含量为8.05 %,凹坑球型含量为4.43 %。塔型主要出现在J6和J8号样品,在本带中含量达到最高,平均为16.90 %。木本不规则形态含量为6.10 %,鞍型含量为0.28 %,楔型泡状细胞平均为0.03 %。双裂片型含量为0.90 %,块状含量为5.91 % (图 5和6)。
3.2.3 石楠林带该植被带的植硅体组合为球型-块状-木本不规则形态组合带,包括2个样品。球型植硅体含量最高,平均含量达到71.10 %,其中的球粒型平均含量为33.60 %,多孔球型平均含量为19.91 %,刺球型含量为12.39 %,块状含量为14.18 %,木本不规则形态含量为7.46 %。凹坑球型含量为5.10 %,鞍型含量为0.80 %,楔型泡状细胞含量为0.25 %,双裂片型含量为0.68 % (图 5和6)。
3.2.4 山地林带该植被带的植硅体组合为球型-块状-木本不规则形态组合带,包括1个样品。球型植硅体含量最高,平均含量达到75.10 %,其中的球粒型平均含量为36.80 %,凹坑球型平均含量为21.20 %,多孔球型含量为10.30 %,刺球型含量为6.90 %。块状含量为19.20 %,木本不规则形态含量为2.50 %,鞍型含量为0.30 %,板型含量为2.00 % (图 5和6)。
4 讨论 4.1 表土植硅体组合对热带森林植被的指示表土植硅体组合在不同的植被类型中可能表现出不同的特点,从而指示当地的植被与气候条件[24~25]。在高纬度的温带地区,硅质突起和哑铃型分别为森林区和草原区草本植物群落植硅体组合中的优势类型[26];在长白山北坡,扇型、棒型、方型等为针阔混交林带土壤的主要植硅体类型,而针叶林带土壤的主要植硅体类型为尖型、扇型、棒型[27];此外,表土植硅体组合特征随降水量的改变而变化,如棒型、哑铃型、扁平状、三棱柱型和硅质突起的百分比含量在大兴安岭、松嫩平原和长白山区之间存在显著差异[28]。在美国温带大陆性气候区,蒿属植物和松柏林地的表土植硅体以毛发状、毛基细胞以及多面体表皮细胞较为常见[29]。在中国的亚热带常绿阔叶林中,表土植硅体以短鞍-扇型-矩形-尖型组合为主[8];而在中国西南亚热带的贡嘎山,表土植硅体以“Y”型-哑铃型-十字型-短鞍型植硅体组合为主[30]。在南美亚热带气候区,表土以球型及多面体等组合为主[31]。在低纬度的热带森林区,表土植硅体组合与上述中、高纬度不同。例如,在热带亚马逊森林区,球粒型植硅体占比达到30 % ~60 % [32]。在非洲中部热带雨林,表土植硅体中不规则的平滑和粗糙球型植硅体占比达55 % ~80 %,而草本植硅体百分比非常低[16]。与之相对应,热带干旱、半干旱地带的表土植硅体组合与热带森林区存在着较大的差异。例如,在非洲中部热带草原气候区,草本植物植硅体类型较为丰富。其中,砂土层中楔型泡状细胞占比达36 % ~70 %,棕榈科的刺球型植硅体占比很小[17]。同样位于热带草原气候区的塞内加尔,表土中以双裂片型、鞍型、十字型为主,莎草科植硅体百分含量低于2 %,棕榈科的植硅体百分比低于7 %,粗糙的球型百分比低于6 % [33]。综上所述,热带森林表土植硅体组合主要的特点是球形植硅体占主导,区别于其他植被类型。在本研究中,球型占主导的植硅体组合显著不同于上述总结的温带、亚热带气候区的表土植硅体组合,而与前人对热带雨林气候区的研究结果[16, 32]吻合度较高。因此,我们认为Jerai山以球形植硅体占主导的表土植硅体组合对应于当地的热带森林环境。
在包括Jerai山在内的东南亚热带低地和山地雨林中,建群种主要来自于龙脑香科(共157个种)的Shorea、Hopea、Dipterocarpus和Vatica[34]。我们分别搜集并分析了上述4个属中各一个种植物的叶子,它们的植硅体形态均为没有鉴定意义的形态,例如表皮细胞、硅化气孔等,并不产生球形植硅体(待发表数据)。Kealhofer和Piperno[19]对龙脑香科植物的叶子和果实进行了分析,结果显示它们也不含有丰富的球形植硅体。因此,我们认为Jerai山的表土植硅体组合并不反映主要的森林植物成分。在另外的研究中,我们发现桃金娘科和棕榈科植物分别产生大量的球粒和刺球型植硅体(待发表数据)。前人研究表明,刺球型植硅体多产自于棕榈植物[7, 35],其在热带及亚热带表土及沉积物中均有发现,有棕榈植物分布的区域,表土中会伴随着刺球型植硅体的出现[36~39]。Watling和Iriarte[18]对湿润性常绿林、棕榈林、竹林等区域的植硅体研究发现,湿润性森林和棕榈植物比重很高的区域,球型植硅体在表土中含量最高;Alexandre等[40]对澳大利亚昆士兰表土植硅体的研究同样发现球型为湿热雨林区植硅体组合中的主导形态。
综上所述,Jerai山的表土植硅体组合可能反映了某些非建群种植物;与温带、亚热带以及热带干旱、半干旱地区的植硅体组合相比,这些源自于非建群种植物的植硅体仍然具有独特的组合特征,具有强烈的热带雨林气候代表性。
4.2 表土植硅体组合与海拔的关系Jerai山的植被分布具有明显的垂直分异规律[20](表 1)。在本研究过程中,我们曾经利用主成分分析的方法,以图 5中所展示的植硅体类型百分比作为参数,对14个表土样品进行排序。结果显示,主成分1和2的累积贡献率不足60 %,这说明Jerai山的植硅体组合百分比与海拔高度不存在明显的相关性,温度因子并不强烈的影响植硅体组合变化。细微的变化仅仅体现在:低地龙脑香林带为球型-木本不规则形态-块状组合;丘陵龙脑香林带为球型-塔型-木本不规则形态组合;石楠林带和山地林带为球型-块状-木本不规则形态组合(图 5)。植硅体组合与植被带具有不明显的对应关系,这进一步表明表土植硅体的来源并非各植被带的建群种。
4.3 禾本科植硅体在热带植被群落中的环境意义在本研究中,禾本科植硅体包括了鞍型、塔型、双裂片型、十字形、多裂梯型和楔形泡状细胞(图 5)。在Jerai山的热带森林中,禾本科植物是零星出现的,多分布在采样点周边,因为这里是光照相对充足的林窗位置。相对于较少的禾本科植物数量,其植硅体百分比具有较好的表现力(图 5)。已有文献表明塔型植硅体可能产自于禾本科中的稻亚科、竹亚科以及芦竹亚科[41]。在Jerai山,我们收集了竹亚科的Bambusa植物样品,其植硅体不属于塔型(待发表数据)。因此,丘陵龙脑香林带一定数量的塔型植硅体可能反映了局部开放环境中存在的某些禾本科植物。双裂片型在各植被带植硅体组合中的百分比排序随着海拔的升高而降低,从低地龙脑香林的第8位降至山地林带的第20位(图 6)。大量的研究显示,双裂片型植硅体源自禾本科[41]。以塔型和双裂片型为代表的禾本科植硅体多出现在山体的中部,这指示了它们的分布与温度变化间的复杂关系。鞍型植硅体多出现在山体的中部和上部,表现了与温度的正相关关系。
在Jerai山的热带森林中,禾本科植硅体在表土植硅体组合中具有较好的表现力,可以较为敏感的指示其母本植物的零星出现(图 5)。在东南亚的古环境重建工作中,对于末次冰盛期时暴露的巽他大陆架上生长何种植被,现在还存在热带稀树草原与热带森林的之争[1~5]。考虑到热带稀树草原中存在大量的禾本科植物以及植硅体可以较好的保存在沉积物中,我们认为禾本科植物与森林植物的植硅体数量之比可以作为有用的指标来指示末次冰盛期时暴露的巽他大陆架上是否广泛存在稀树草原群落。然而,禾本科植硅体与植被群落组成的数量关系还需在未来的工作中进一步被明确,以提供更为精确的古植被重建指标。
5 结论本研究分析了马来西亚Jerai山14个海拔高度的表土植硅体,总体的组合特征具有明显的地域性,与禾本科占优势的热带稀树草原、亚热带和温带植被类型中的植硅体组合存在显著的差别。本研究将对基于植硅体化石的古环境重建提供了重要的解释依据,具体的结论如下:
(1) Jerai山表土植硅体包括17种特征明显的形态:鞍型、棒型、多裂梯型、木本不规则形态、矩形、板型、维管组织、方型、块状、塔型、双裂片型、十字型、硅化气孔、球型、椭球型、楔型、楔型泡状细胞。其中,球型植硅体还可进一步被细分为刺球型、球粒型、多孔球型和凹坑球型。
(2) 从低海拔至高海拔,低地龙脑香林带以球型-木本不规则形态-块状为主,平均百分含量分别为82.00 %、7.60 %和7.17 %;丘陵龙脑香林以球型-塔型-木本不规则形态为主,平均百分含量分别为67.80 %、16.90 %和6.10 %;石楠林带和山地林带均以球型-块状-木本不规则形态为主,其中石楠林带中各形态占比分别为71.10 %、14.18 %和7.46 %,而山地林带中的占比为75.10 %、19.20 %和2.50 %。
(3) 球型占主导的植硅体组合显著不同于其他气候区,研究区以龙脑香科为主的建群种植物可能并不大量产生球型植硅体,因此,Jerai山的表土植硅体组合可能反映了某些非建群种植物,例如棕榈科和桃金娘科植物等;与温带、亚热带以及热带干旱、半干旱地区的植硅体组合相比,这些源自于非建群种植物的植硅体仍然具有独特的组合特征,具有强烈的热带雨林气候代表性。
(4) Jerai山热带森林中的禾本科植硅体较为敏感的指示其母本植物的存在,这使得植硅体成为区分热带森林与热带稀树草原植被类型的有用指标。本研究证明了植硅体分析在东南亚古植被重建工作中具有重要的应用价值。
致谢: 中国科学院地质与地球物理研究所吕厚远教授、中国地质大学(武汉)环境学院顾延生教授、福建师范大学左昕昕副教授、东北师范大学地理科学学院李德晖博士给予了宝贵的建议。
| [1] |
Wang X M, Sun X J, Wang P X, et al. Vegetation on the Sunda Shelf, South China Sea, during the Last Glacial Maximum[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2009, 278(1-4): 88-97. DOI:10.1016/j.palaeo.2009.04.008 |
| [2] |
Heaney L R. A synopsis of climatic and vegetational change in Southeast Asian[J]. Climatic Change, 1991, 19(1/2): 53-61. |
| [3] |
Sun X, Li X, Luo Y, et al. The vegetation and climate at the last glaciation on the emerged continental shelf of the South China Sea[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2000, 160(3): 301-316. |
| [4] |
Sun X, Li X, Luo Y. Vegetation and climate on the Sunda shelf of the South China Sea during the Last Glaciation-Pollen results from station 17962[J]. Acta Botanica Sinica, 2002, 44(6): 746-752. |
| [5] |
戴璐, Yeok F S. 末次冰期时暴露的巽他大陆架可能被热带稀树草原覆盖吗?[J]. 地球科学进展, 2017, 32(11): 1147-1156. Dai Lu, Yeok F S. Was there savanna corridor on the exposed sunder shelf during the last glacial period?[J]. Advances in Earth Science, 2017, 32(11): 1147-1156. |
| [6] |
Hunt C, Gilbertson D, Rushworth G. A 50, 000-year record of Late Pleistocene tropical vegetation and human impact in lowland Borneo[J]. Quaternary Science Reviews, 2012, 37: 61-80. DOI:10.1016/j.quascirev.2012.01.014 |
| [7] |
Piperno D R. Phytolith Analysis:An Archaeological and Geological Perspective[M]. London: Academic Press, 1988: 1-176.
|
| [8] |
刘红叶, 顾延生, 唐倩倩, 等. 浙江青浜岛现代植物群落和表土植硅体研究及环境意义[J]. 微体古生物学报, 2017, 34(1): 77-83. Liu Hongye, Gu Yansheng, Tang Qianqian, et al. Phytolith records of modern plant communities and surface soils on the Qingbang Island, Zhejiang Province, East China[J]. Acta Micropalaeontologica Sinica, 2017, 34(1): 77-83. |
| [9] |
Lu H Y, Wu N Q, Yang X D, et al. Phytoliths as quantitative indicators for the reconstruction of past environmental conditions in China Ⅰ:Phytolith-based transfer functions[J]. Quaternary Science Reviews, 2006, 25(9-10): 945-959. DOI:10.1016/j.quascirev.2005.07.014 |
| [10] |
Lu H Y, Wu N Q, Liu K B, et al. Phytoliths as quantitative indicators for the reconstruction of past environmental conditions in China Ⅱ:Palaeoenvironmental reconstruction in the Loess Plateau[J]. Quaternary Science Reviews, 2007, 26(5-6): 759-772. DOI:10.1016/j.quascirev.2006.10.006 |
| [11] |
Gu Y S, Pearsall D M, Xie S C, et al. Vegetation and fire history of a Chinese site in southern tropical Xishuangbanna derived from phytolith and charcoal records from Holocene sediments[J]. Journal of Biogeography, 2008, 35(2): 325-342. |
| [12] |
Gu Y S, Wang H L, Huang X Y, et al. Phytolith records of the climate change since the past 15000 years in the middle reach of the Yangtze River in China[J]. Frontiers of Earth Science, 2012, 6(1): 10-17. |
| [13] |
Chen S T, Smith S Y. Phytolith variability in Zingiberales:A tool for the reconstruction of past tropical vegetation[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 370: 1-12. DOI:10.1016/j.palaeo.2012.10.026 |
| [14] |
Erra G, Osterrieth M, Zurita A E, et al. Paleoenvironment of the Toropí Formation(Upper Pleistocene), Corrientes Province(Mesopotamian region, Argentina):A phytolith approach[J]. Quaternary International, 2013, 287: 73-82. DOI:10.1016/j.quaint.2012.08.2110 |
| [15] |
顾延生, 季雅斌, 管硕, 等. 植硅体形态测量学研究与应用概述[J]. 第四纪研究, 2019, 39(1): 12-23. Gu Yansheng, Ji Yabin, Guan Shuo, et al. An introduction to the research and application of phytolith morphometrics[J]. Quaternary Sciences, 2019, 39(1): 12-23. |
| [16] |
Barboni D, Bremond L. Comparative study of modern phytolith assemblages from inter-tropical Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 246(2-4): 454-470. DOI:10.1016/j.palaeo.2006.10.012 |
| [17] |
Runge F. The opal phytolith inventory of soils in Central Africa-quantities, shapes, classification, and spectra[J]. Review of Palaeobotany and Palynology, 1999, 107(1-2): 23-53. DOI:10.1016/S0034-6667(99)00018-4 |
| [18] |
Watling J, Iriarte J. Differentiation of neotropical ecosystems by modern soil phytolith assemblages and its implications for palaeoenvironmental and archaeological reconstructions Ⅱ:Southwestern Amazonian forests[J]. Review of Palaeobotany and Palynology, 2016, 226: 30-43. DOI:10.1016/j.revpalbo.2015.12.002 |
| [19] |
Kealhofer L, Piperno D R. Opal Phytoliths in Southeast Asian Flora[M]. Washington D. C.: Smithsonian Institution Press, 1998: 1-39.
|
| [20] |
A Scientific Team. Gunung Jerai State Park, Kedah: Its natural resources and its future role[R]. The World Wildlife Fund Malaysia, 1977: 1-34.
|
| [21] |
王永吉, 吕厚远, 衡平. 植物硅酸体的分析方法[J]. 植物学报, 1994, 36(10): 797-804. Wang Yongji, Lü Houyuan, Heng Ping. Methods for analysis of pytolith[J]. Acta Botanica Sinica, 1994, 36(10): 797-804. |
| [22] |
Madella M, Alexander A, Ball T. International Code for Phytolith Nomenclature 1.0[J]. Annals of Botany, 2005, 96: 253-260. DOI:10.1093/aob/mci172 |
| [23] |
王永吉, 吕厚远. 植物硅酸体的研究与应用[M]. 北京: 海洋出版社, 1993: 1-228. Wang Yongji, Lü Houyuan. Phytolith Study and Its Application[M]. Beijing: China Ocean Press, 1993: 1-228. |
| [24] |
史吉晨, 介冬梅, 刘利丹, 等. 东北地区芦苇植硅体分形特征初步研究[J]. 第四纪研究, 2017, 37(6): 1444-1455. Shi Jichen, Jie Dongmei, Liu Lidan, et al. The preliminary research on the fractal characteristics of Phragmites communis phytolith in Northeast China[J]. Quaternary Sciences, 2017, 37(6): 1444-1455. |
| [25] |
李德晖, 介冬梅, 高桂在, 等. 松嫩草原典型群落对应表土植硅体组合特征[J]. 第四纪研究, 2018, 38(4): 1035-1049. Li Dehui, Jie Dongmei, Gao Guizai, et al. Characteristics of phytolith assemblages of topsoil in typical communities of Songnen Grassland[J]. Quaternary Sciences, 2018, 38(4): 1035-1049. |
| [26] |
夏璎凡, 介冬梅, 李德晖, 等. 东北森林区与草原区草本植物群落植硅体组合特征的对比研究[J]. 草业学报, 2018, 27(3): 44-56. Xia Yingfan, Jie Dongmei, Li Dehui, et al. Comparison of phytolith assemblages in the herbaceous communities of forest and grassland regions in Northeast China[J]. Acta Prataculturae Sinica, 2018, 27(3): 44-56. |
| [27] |
张新荣, 胡克, 介冬梅. 长白山北坡垂直植被带表土植硅体组合研究[J]. 地球学报, 2006, 27(2): 169-173. Zhang Xinrong, Hu Ke, Jie Dongmei. Morphological characteristics of phytolith of woody plants from the vertical vegetation zones on the north slope in Changbai Mountain and its environmental significance[J]. Acta Geoscientica Sinica, 2006, 27(2): 169-173. |
| [28] |
刘洪妍, 王海南, 介冬梅, 等. 东北地区湿度梯度下的表土植硅体的空间分布规律[J]. 第四纪研究, 2019, 39(1): 76-88. Liu Hongyan, Wang Hainan, Jie Dongmei, et al. The distribution of phytolith in topsoil samples under the humidity gradient in Northeast China[J]. Quaternary Sciences, 2019, 39(1): 76-88. |
| [29] |
Morris L R, Baker F A, Morris C, et al. Phytolith types and type-frequencies in native and introduced species of the sagebrush steppe and pinyon-juniper woodlands of the Great Basin, USA[J]. Review of Palaeobotany and Palynology, 2009, 57(3-4): 339-357. |
| [30] |
安晓红, 吕厚远. 贡嘎山东坡表土植硅体组合的海拔分布及其与植被的关系[J]. 第四纪研究, 2010, 30(5): 934-945. An Xiaohong, Lü Houyuan. Altitudinal distribution of phytolith assemblages in topsoil from the east slope of Gongga Mountain, southeastern Qinghai-Tibetan Plateau and their relationship with vegetation composition[J]. Quaternary Sciences, 2010, 30(5): 934-945. |
| [31] |
Dickau R, Whitney B S. Differentiation of neotropical ecosystems by modern soil phytolith assemblages and its implications for palaeoenvironmental and archaeological reconstructions[J]. Review of Palaeobotany and Palynology, 2013, 193: 15-37. DOI:10.1016/j.revpalbo.2013.01.004 |
| [32] |
Watling J, Saunaluoma S, Pärssinen M, et al. Subsistence practices among earthwork builders:Phytolith evidence from archaeological sites in the southwest Amazonian interfluves[J]. Journal of Archaeological Science:Reports, 2015, 4: 541-551. DOI:10.1016/j.jasrep.2015.10.014 |
| [33] |
Bremond L, Alexandre A, Peyron O, et al. Grass water stress estimated from phytoliths in West Africa[J]. Journal of Biogeography, 2005, 32(2): 311-327. |
| [34] |
Saw Leng Guan, Sam Yen Yen. Conservation of dipterocarpaceae in peninsular Malaysia[J]. Journal of Tropical Forest Science, 1999, 12(3): 593-615. |
| [35] |
徐德克, 李泉, 吕厚远. 棕榈科植硅体形态分析及其环境意义[J]. 第四纪研究, 2005, 25(6): 785-792. Xu Deke, Li Quan, Lü Houyuan. Morphological analysis of phytoliths in palmae and its environmental significance[J]. Quaternary Sciences, 2005, 25(6): 785-792. |
| [36] |
Thorn V C. Data report:Phytoliths in drill core sediments from sites 1165 and 1166, Leg 188, Prydz Bay, East Antarctica[J]. Proceedings of the Ocean Drilling Program, Scientific Results, 2004, 188: 1-12. DOI:10.2973/odp.proc.sr.188.002.2004 |
| [37] |
Kondo R, Childs C, Atkinson L. Opal Phytoliths of New Zealand[M]. Canterbury: Manaaki Whenua Press, 1994: 1-85.
|
| [38] |
Barboni D, Bonnefille R, Alexandre A, et al. Phytoliths as paleoenvironmental indicators, West Side Middle Awash Valley, Ethiopia[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1999, 152(1-2): 87-100. DOI:10.1016/S0031-0182(99)00045-0 |
| [39] |
Wallis L. An overview of leaf phytolith production patterns inselected Northwest Australian flora[J]. Review of Palaeobotany and Palynology, 2003, 125: 201-248. DOI:10.1016/S0034-6667(03)00003-4 |
| [40] |
Alexandre A, Crespin J, Sylvestre F, et al. The oxygen isotopic composition of phytolith assemblages from tropical rainforest soil tops(Queensland, Australia):Validation of a new paleoenvironmental tool[J]. Climate of the Past Discussions, 2011, 7: 1693-1735. DOI:10.5194/cpd-7-1693-2011 |
| [41] |
高桂在, 介冬梅, 刘利丹, 等. 植硅体形态的研究进展[J]. 微体古生物学报, 2016, 33(2): 180-189. Gao Guizai, Jie Dongmei, Liu Lidan, et al. Advance in phytolith morphology research[J]. Acta Micropalaeontologica Sinica, 2016, 33(2): 180-189. |
2 School of Biological Sciences, University Sains Malaysia, Malaysia Penang 11960)
Abstract
This study analyzed 14 topsoil phytolith samples collected from 200 m to 1000 m a.s.l. on Jerai Hill of tropical Malaysia to evaluate the potential of phytolith assemblages as proxies for implying various paleovegetation types.Jerai Hill is located in Kedah State (5°44'~5°50'N, 100°22'~100°29'E) of Peninsular Malaysia. The summit of the highest mountain is at 5°47'N, 101°26'E, and the maximum elevation reaches to 1217 m. In this area, the typical vegetation type is the rainforest rich in Dipterocarpaceae species. With the increase in elevation, plant communities evidently change, particularly the richness of dipterocarp species which starts to decrease sharply above 400~500 m a.s.l., upland species frequently occur above 900 m a.s.l., and they are mainly composed of Myrtaceae, Fagaceae, and Dacrydium species. Phytoliths were extracted from the residues using the heavy liquid extraction technique. The heavy liquid was composed of Zn grains, potassium iodide, and hydroiodic acid, and specific gravity was set to 2.385. In each sample, at least 500 phytolith grains were counted.The results showed that there were a large number of phytoliths with various morphotypes in the 14 topsoil samples on Jerai Hill. 17 morphotypes can be identified in phytolith assambalges, included saddle, elongate, trapeziform, irregularly woody shapes, rectangle, tabular, vascular tissue, square, blocky, rondel, bilobate, cross, silicified stomate, globular, ellipsoidal, cuneiform and cuneiform bulliform cells. Phytoliths derived from Poaceae were significantly sensitive, even over-representative to indicate distribution of Poaceae plants. With the increasing elevations, the major phytolith components slightly varied, which were globular-irregularly woody shape-blocky assemblage in lowland dipterocarp forest, globular-roundel-irregularly woody shape assemblage in hill dipterocarp forest, and globular-block-irregularly woody shape assemblage in heath forest and montane forests. Globular phytolith was very abundant, it's percentages were 82.00%, 67.80%, 71.10% and 75.10% in lowland dipterocarp forest, hill dipterocarp forest, heath forest and montane forest, respectively. The result showed that phyolith assemblages did not well correspond to various vegetation belts, and most of diagnostic phyoltiths may not be originated from predominated vegetation species. However, phytolith assemblages predominated by globular shapes can be considered as indicators of tropical forests, as this character corresponds with those in African and South American tropical forests. This study confirmed that phytolith assemblages are useful for distinguishing between tropical forests and steppes or savannahs in Southeast Asia. 2020, Vol.40
2020, Vol.40

