2 长白山地理过程与生态安全教育部重点实验室, 吉林 长春 130024;
3 东北师范大学泥炭沼泽研究所和环境保护湿地生态与植被恢复重点实验室, 吉林 长春 130024;
4 植被生态科学教育部重点实验室, 吉林 长春 130024;
5 东北师范大学地理科学学院, 吉林 长春 130024;
6 安阳师范学院资源环境与旅游学院, 河南 安阳 455000)
过去植被是现代植被变化的先导和基础,重建长时期的古植被演替则需借助于古植被代用指标,如孢粉、植硅体、稳定碳同位素等[1~3]。其中,植硅体是植物与其生存环境间生物地球化学过程的产物,是恢复古植被的直接和可靠代用指标之一[4~6]。随着研究的深入,由于受植硅体指标本身的产量、溶解和迁移等诸多因素的影响,表土中植硅体的特征与现生植被之间的关系可能存在偏差。据研究,大量的植物植硅体类型中,大约仅有8 %的植硅体类型在土壤中具有较强的抗分解能力,90 %的植硅体类型会受到不同程度的溶解[7]。而且由于受剧烈风力、地表径流以及人类生产活动等的影响,土壤中的植硅体也会产生不同程度的水平、垂向迁移,研究表明土壤中约有20 % ~30 %的植硅体产生了垂向迁移[8~9]。因此,明确表土中生物代用指标的分布特征与地上现生植被数量特征的定量关系是准确恢复历史时期古气候和古植被面貌的关键,科学校正二者之间的偏差,直接影响着历史时期古气候和古植被恢复的准确性。
目前针对表土植硅体与其地上植物群落对应关系的研究工作已在少数地区开展[10~13],但其主要集中于探讨大区域背景下不同生态系统或局部地区典型生境中不同植物群落下表土植硅体组合及指数的差别,间接推断表土植硅体与植物群落间的联系,并认为表土植硅体组合特征与地上植物群落间是存在一定联系的。为进一步定量表征表土植硅体对植物群落的代表性,学者们在温带地区利用代表性指数定量区分了森林区和草原区表土中不同植硅体类型的植被指示性[14]。还有学者在热带地区初步探索了刺球状植硅体或植硅体指数(D/P)与植物群落数量特征即叶面积指数、归一化植被指数和生物量的关系[10, 15],发现表土植硅体组合可反映不同植物群落的物种组成及数量特征。但目前关于表土植硅体对植被的代表性及基于其校正沉积物剖面植硅体的研究工作尚少见。且在以上研究中,学者们直接以不同植物群落下的表土为研究对象,仅关注不同群落下表土植硅体组合的异同,忽略了不同植物群落植硅体与相应表土植硅体转化机制的探讨,导致表土植硅体对群落的代表性不甚清楚。更为重要的是目前限制表土植硅体对植被代表性研究的关键在于,植硅体并不像孢粉那样,与地上植物间存在一一对应的关系,多数类型植硅体其实与其母体植物之间并不是一一对应的关系[16~17],直接建立两者的关系显得尤为困难。因此,寻找既能够反映地上现生植物群落的信息,又可与表土中不同类型植硅体间存在一一对应关系的变量已成为解决该难题的重要环节。已有研究显示,植物群落植硅体组合不仅能够反映群落的植物组成,且与地上植物群落的生物量、叶面积指数等数量特征间存在关联[18],植物群落植硅体组合在一定程度上能够反映表土植硅体来源的地上植物群落的信息。因此,本文为弥补植硅体指标本身的缺陷,尝试以植物群落植硅体为媒介,通过植物群落植硅体和表土植硅体关系的研究,间接讨论表土植硅体对地上植物群落的代表性,并基于此实现对表土中不同类型植硅体的校正,以更准确地恢复历史时期的古气候和古植被。
鉴于此,本文分别提取了东北地区东部森林区木本植物群落和西部草原区草本植物群落及对应表土中的植硅体,通过相关系数C、相似系数CC和代表性指数R值的界定研究了森林区和草原区表土中不同植硅体类型的植被代表性,并尝试利用代表性指数R值校正表土植硅体与植被的数量关系。相信这一研究能够为有效提高历史时期古植被和古气候的重建精度提供依据和数据参考。
1 研究区概况东北地区位于39°40′~53°30′N,115°05′~135°02′E[19],属温带湿润、半湿润大陆性季风气候,四季鲜明,夏季较短而温暖多雨,冬季寒冷而漫长。年气温一般在-5~10℃,冬季受极地大陆气团控制,气候严寒,1月为全年最冷月,7月为全年气温最高月[20]。年降水量一般在400~1000mm,主要集中在夏秋季节,地域间差别大,基本由东南向西北减少。该区土壤类型比较复杂,分布广泛的地带性土壤有温带的暗棕壤、黑土和黑钙土,寒温带的棕色针叶林土。隐域性土壤有白浆土、草甸土、沼泽土等,常和地带性土壤呈微域交错分布。该区植被带的分布形成了东北-西南方向的偏转。西部大兴安岭山地为寒温带落叶针叶林分布区,以耐寒的兴安落叶松(Larix gmelinii)为典型树种;东部长白山地为温带针阔叶混交林分布区,以喜湿的红松(Pinnus koraiensis)与枫桦(Betula costata)为典型树种;东北平原为温带森林草原、草甸草原和干草原分布区,以耐旱的羊草(Leymus chinensis)、贝加尔针茅(Stipa baicalensis)等植物为典型植物种;西南部还有面积广阔的科尔沁沙地[21]。
本文样点采集区主要集中于长白山区和松嫩平原。依据《中国植被》[22](1980)分类标准,长白山区地带性植被为温带针阔混交林,并可根据植物组成的差别进一步划分为红松针阔混交林和落叶阔叶林,其中,“红松针阔混交林”的典型树种以红松、紫椴、枫桦为主[23];地带性土壤为暗棕壤,另采集有白浆土、沼泽土、草甸土等。松嫩平原地带性植被类型为草甸草原,以羊草、针茅等植物为主;地带性土壤为黑钙土、栗钙土,另采集有草甸土、沼泽土、冲积土等类型土壤。
2 材料与方法 2.1 样品采集在东北地区东部森林区和西部草原区依据年均4℃等温线共设置41个植物群落样方(图 1),其中森林区木本群落样点13个,草原区草本群落样点28个。按照群落调查要求,草本群落设置1m×1m样方,收割1m×1m内所有的地上植物,采集地表 2cm以上表土;木本群落设置10m×10m样方,按照梅花采样法,选取样方的四角及中心共5个1m×1m的小样方,分别收集样方内林下所有的草本植物及木本植物的枯枝落叶,采集地表 2cm以上表土。同时,分别调查对应群落内的植物组成及植物盖度等信息,共采集植物群落样品93个(草本群落样品28个,木本群落样品65个),表土93块(暗棕壤50块、黑钙土14块、栗钙土1块、草甸土12块、风沙土4块、冲积土1块、白浆土5块和沼泽土6块)(图 1和表 1)。
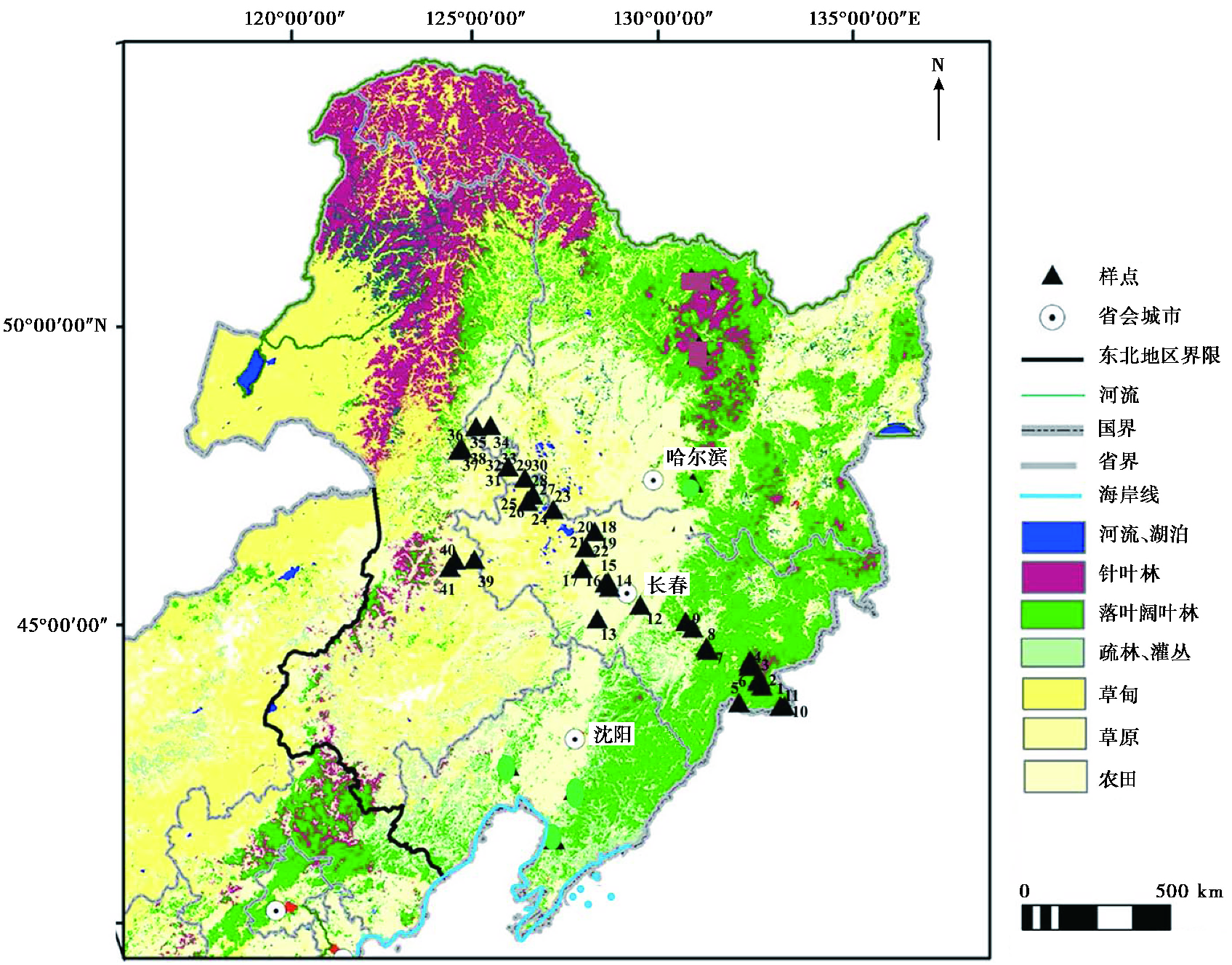
|
图 1 样点分布图 底图基础数据来源于网络:http://www.gvm.jrc.it/glc2000,经重绘 Fig. 1 Distribution of sampling sites. The basic data of the base map comes from the website (http://www.gvm.jrc.it/glc2000) and it is redrawn |
| 表 1 采样点土壤类型及群落信息 Table 1 Soil type and plant community information for the sampling sites |
土壤植硅体的提取采用湿式灰化法[24]。首先,取烘干并碾碎的表土样品5g,加入过量的10 %稀盐酸,反应完全后加入蒸馏水离心清洗3次;其次,在溶液中加入浓硝酸,水浴加热,并取另一离心管放入一粒孢子片,加入浓盐酸反应;第三,在清洗后的上述溶液中加入比重为2.35的重液并用蒸馏水清洗3次,之后加入孢子片溶液,离心清洗3次(最后一次用无水乙醇);最后,取均匀样滴一滴于载玻片上,加热,再滴一滴中性树胶并加盖玻片。之后将该玻片在MOTIC生物显微镜下放大600倍观察,每个样品统计植硅体300粒以上。
2.3 数据处理考虑到表土和地上植物群落植硅体类型间存在着3种基本关系:①某一植硅体类型既存在于植物群落中,也分布在相应表土中;②某一植硅体类型仅在植物群落中出现;③某一植硅体类型仅分布在表土中。故为进一步定量表征表土植硅体和群落植硅体组合间的相似程度,在植硅体分析中引入孢粉分析中常用的相关系数C和相似系数CC[14, 25]。其中,相关系数描述了表土与相应群落中某一植硅体类型的线性相关程度,其绝对值越接近于1,两变量间的线性相关程度越强;相似系数描述了表土与相应群落中植硅体组合间的相似程度,相似系数越大,二者之间的相似程度越强,表土植硅体对地上植物群落的代表性也就越强。
相关系数C和相似系数CC的具体计算公式如下:

|
(1) |
公式(1)中:xik为i点表土中植硅体类型k的百分含量;yik为i点对应地上植物群落中同类植硅体k的含量;x为所有点表土中植硅体类型k的平均含量;y为所有点对应群落中植硅体类型k的平均含量。
为明确表土植硅体和地上植物群落植硅体间相关性的强弱,本文根据相关系数的均值和标准差定义:当相关系数为0~11 %时,表土和相应群落植硅体间的相关性较差;当其为12 % ~36 %时,二者间的相关性一般;当其为36 % ~61 %时,二者间的相关性较强[14]。

|
(2) |
公式(2)中:a为样方中表土-植物群落间存在关系③的植硅体类型数;b为样方中群落-表土间存在关系②的植硅体类型数;c为样方中群落-表土间存在关系①的植硅体类型数。
本文根据相似系数的均值和标准差定义:当相似系数为0~33 %时,表土和相应群落中植硅体类型组合间的相似性较低;当其为34 % ~56 %时,二者间的相似性一般;当其为56 % ~100 %时,二者间的相似性较强[14]。
同时,为准确揭示表土植硅体对地上植物群落的指示性及其在土壤中的保存程度,引入孢粉分析中常用的R值。其中,植硅体类型t在i样点的Rit值[26],即i点表土中植硅体类型t的含量(Sit)和相应地上植物群落中同类植硅体t的含量(Cit)之比,Rit的计算公式如下:

|
(3) |
一般R值越大,表土植硅体对地上植物群落的代表性越好,表土中该类植硅体的保存越好。本文根据R值的均值和标准差定义:当R值为0~1时,表土中该类植硅体对地上植物群落的代表性较差,低估了对应植物群落植硅体的含量,在土壤中保存较差;当R值为1~4时,表土中该类植硅体能够准确指示其地上植物群落的信息,在土壤中保存较好;当R值大于4时,表土中该类植硅体对地上植物群落的代表性过高,高估了对应植物群落植硅体的含量[14, 27]。
3 结果 3.1 森林区和草原区表土植硅体与地上植物群落植硅体组合的对应关系东北地区森林区和草原区表土及其地上植物群落中植硅体类型丰富,参考王永吉和吕厚远[28]对植硅体形态的划分及International Code for Phytolith Nomenclature(ICPN)2.0的划分方案[29],植物群落中共鉴定出40类植硅体,大体可分为短细胞植硅体、棒型、尖型、块状、扇型、扁平状、表皮植硅体、硅化气孔、导管型及其他类型(图 2-Ⅰ)[12, 23]。且森林区木本群落和草原区草本群落中植硅体类型差异不大,绝大多数植硅体类型均同时出现于木本群落和草本群落。具体包括7类。

|
图 2-Ⅰ 东北地区森林区和草原区植物群落中的植硅体形态[23] a,鞍型(saddle);b,帽型(rondel);c,哑铃型(bilobate);d,十字型(cross);e,多铃型(cylindrical polylobate);f,齿型(trapeziform sinuate);g,硅质突起型(conical phytolith);h,多边帽型(achene phytolith);i,小毛发状(hair);j,盾尖型(scutiform);k,细长尖型(lanceolate attenuate);l,尖型(lanceolate);m,大毛发状(macrohair);n,平滑棒型(elongate psilate);o,扁棒型(elongate tabular);p,刺状棒型(elongate echinate);q,牛角棒型(elongate cavate terminal);r,波状棒型(elongate sinuate);s,突起棒型(elongate granulate);t,倾斜扁棒型(elongate tabular and gradient);u,细长棒型(elongate attenuate);v,凹口棒型(elongate cavate);w,单侧波棒(elongate unilateral sinuate);x,三棱柱(pteridophyte-type);y,边缘弯曲扁平状(tabular sinuate);z,多边形(tabular polygon);aa,刺扁平状(tabular prickle);ab,不规则块状(小)(blocky irregular(small));ac,纹孔块状(blocky scrobiculate);ad,表皮植硅体(epidermal phytolith);ae,不规则块状(大)(blocky irregular(big));af,脊线块状(blocky ridged);ag,导管型(tracheid);ah,椎骨状(carinate);ai,弓型(sclereid);aj/ak,硅化气孔(stomata);al,毛发底座(hair base);am,多面表皮植硅体(polyhedral epidermal);an/ao,扇型(bulliform);ap,芦苇扇型(bulliform-Phragmites) Fig. 2-Ⅰ Phytolith morphotypes identified in the plant and community samples in Northeast China[23] |
第Ⅰ类,短细胞植硅体。包括鞍型(图 2-Ⅰ,a)、帽型(图 2-Ⅰ,b)、哑铃型(图 2-Ⅰ,c、d、e)、齿型(图 2-Ⅰ,f)。
第Ⅱ类,长细胞植硅体。长细胞产生的植硅体类型是多种多样的棒型,根据纹饰特征可细分为多种类型,其中,刺状棒型(图 2-Ⅰ,p)、牛角棒型(图 2-Ⅰ,q)和突起棒型(图 2-Ⅰ,s)多见于草本植物中;扁棒型(图 2-Ⅰ,o)、倾斜扁棒型(图 2-Ⅰ,t)和凹口棒型(图 2-Ⅰ,v)是木本植物的特征植硅体类型;平滑棒型(图 2-Ⅰ,n)、波状棒型(图 2-Ⅰ,r、w)和细长棒型(图 2-Ⅰ,u)普遍存在于草本植物和木本植物中。
第Ⅲ类,毛状细胞植硅体。本文鉴定出小毛发植硅体(图 2-Ⅰ,i)、尖型(图 2-Ⅰ,j、k、l)、大毛发植硅体(图 2-Ⅰ,m)和毛发底座(图 2-Ⅰ,al)4类。除大毛发状(毛发底座)多见于双子叶植物外,其他尖型主要来自禾本科和莎草科。
第Ⅳ类:泡状细胞植硅体。其植硅体形态在镜下观察主要表现为扇型(图 2-Ⅰ,an、ao、ap)和方型(或者长方型)。
第Ⅴ类:气孔保卫细胞及副卫细胞。硅化的气孔保卫细胞、副卫细胞和气孔腔组成了一个完整的硅化气孔器,习惯简称为硅化气孔(图 2-Ⅰ,aj、ak)。
第Ⅵ类:表皮细胞植硅体。表皮细胞具有多种形态,故硅化后形成的植硅体也具有多种形态。本文观察到的为边缘弯曲扁平状(图 2-Ⅰ,y)、多边形(图 2-Ⅰ,z)、刺扁平状(图 2-Ⅰ,aa)和表皮植硅体(图 2-Ⅰ,ad、am),其中多面表皮植硅体(图 2-Ⅰ,am)主要源自草本植物。
第Ⅶ类:未知细胞来源的植硅体类型。例如硅质突起型(图 2-Ⅰ,g)、多边帽型(图 2-Ⅰ,h)、三棱柱(图 2-Ⅰ,x)、块状(图 2-Ⅰ,ab、ac、ae、af)、弓/Y型(图 2-Ⅰ,ai)、导管型(图 2-Ⅰ,ag)、椎骨状(图 2-Ⅰ,ah)等。块状中纹孔块状、脊线块状是裸子植物或松科植物的特征类型;莎草科植物中含有形态独特的硅质突起型和多边帽型;蕨类植物以三棱柱为典型特征;阔叶树尤其是暖温带树种产生弓/Y型[23]。
东北地区表土样品中共鉴定出39类植硅体,主要包括短细胞植硅体、长细胞植硅体、毛状细胞植硅体、泡状细胞植硅体、气孔保卫细胞及副卫细胞、表皮细胞植硅体、未知细胞来源的植硅体类型,具体可分为短细胞植硅体(包括鞍型、帽型、十字型、哑铃型、多铃型和齿型)、棒型、尖型、块状、扇型、扁平状、表皮植硅体、硅化气孔、导管型及其他类型(图 2-Ⅱ)[12, 23],其中硅质突起型和硅化气孔仅见于个别表土样点。东北地区表土中鉴定出的形态多样的植硅体类型与地上植物群落中产生的植硅体类型大体一致。同时,森林区和草原区表土中植硅体类型差异不大,除不均匀厚壁组织、纹孔块状、脊线块状仅见于森林区表土外,其他类型均存在于草原区和森林区表土中。

|
图 2-Ⅱ 东北地区森林区和草原区表土中的植硅体形态[23] a,帽型(rondel);b,鞍型(saddle);c,哑铃型(bilobate);d,十字型(cross);e,多铃型(cylindrical polylobate);f,齿型(trapezifor m sinuate);g,尖型(lanceolate);h,盾尖型(scutiform);i,刺毛发状(prickle);j,平滑棒型(elongate psilate);k,刺状棒型(elongate echinate);l,细长棒型(elongate attenuate);m,树突棒型(elongate dendritic);n,牛角棒型(elongate cavate terminal);o,扁棒型(elongate tabular);p,突起棒型(elongate granulate);q,凹口棒型(elongate cavate);r,波状棒型(elongate sinuate);s,三棱柱(pteridophyte-type);t/u,不规则扁平状(tabular irregular);v,扇型(bulliform);w,芦苇扇型(bulliform-phragmites);x,长方型(rectangle);y,不规则块状(blocky irregular);z,表皮植硅体(epidermal phytolith);aa,大毛发状(macrohair);ab,弓型(sclereid);ac,不均匀厚壁组织(margin scuniform);ad,多面表皮植硅体(polyhedral epidermal);ae,导管型(tracheid);af,硅质突起型(conical epidermal);ag,椎骨状(carinate);ah,硅化气孔(stomata) Fig. 2-Ⅱ Phytolith morphotypes identified in the modern soil samples in Northeast China[23] |
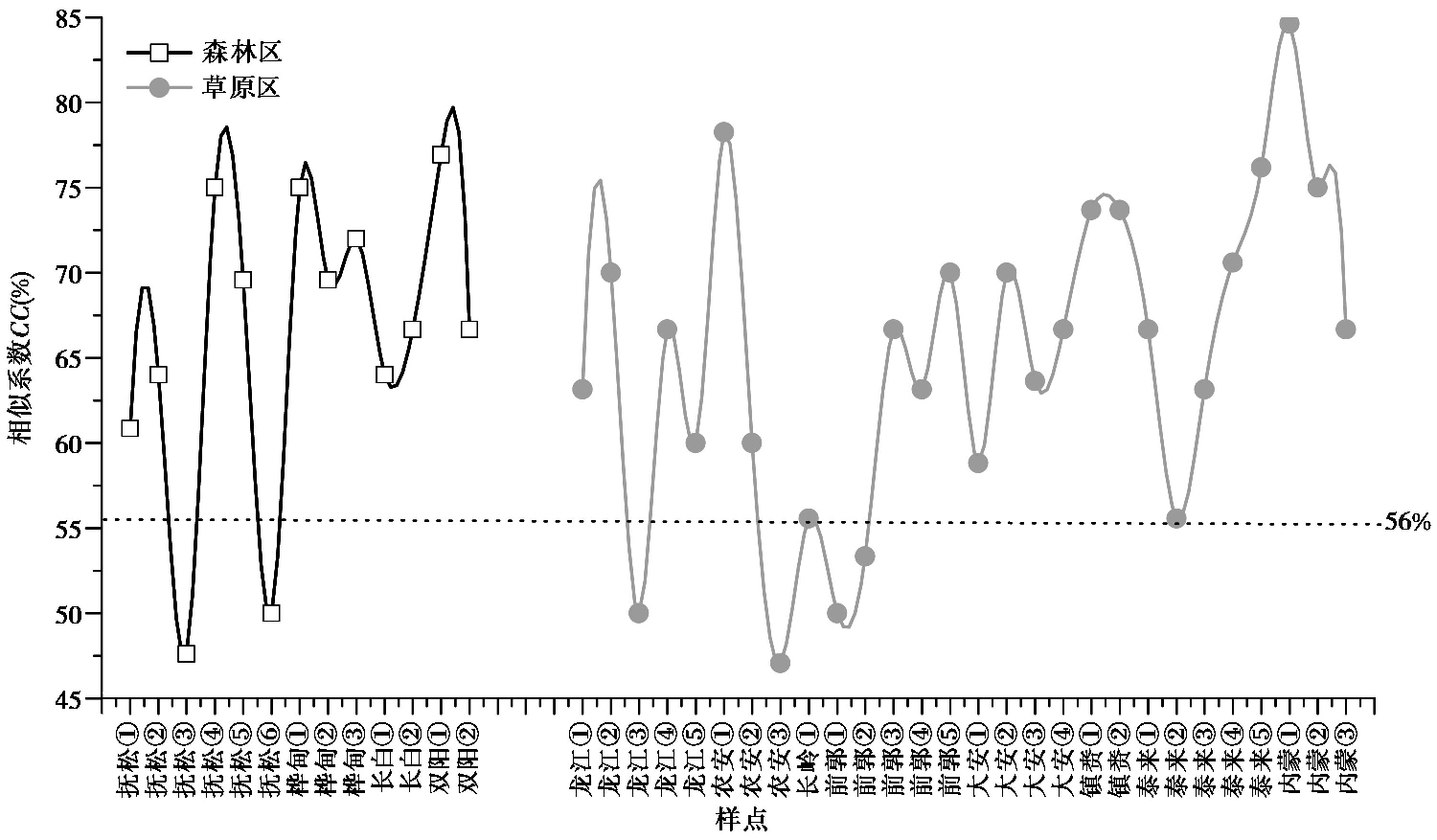
据图 3可知,除抚松③和抚松⑥外,东部森林区各样点植物群落和表土植硅体的相似系数均在56 %以上;同样,除龙江③、农安③、前郭①和前郭②外,西部草原区其他样点两者间的相似系数也均大于56 %或在50 %左右。故不管是在东部森林区还是西部草原区,表土植硅体类型组合基本上反映了其地上植物群落的植物组成。其中,抚松③和抚松⑥地上植物有人工砍伐痕迹,初步推测受人为扰动明显。龙江③、农安③、前郭①和前郭②土壤盐化特征明显,经测定其土壤表层pH值分别为7.8、7.8、7.8和8.7,据研究当土壤pH高于8时,土壤中植硅体的溶解量将会上升[30],不利于土壤中植硅体的保存,故推测较高的土壤pH可能导致了上述样点表土与群落间植硅体的相似系数偏低。
|
图 3 森林区和草原区表土及相应群落中植硅体的相似系数变化 Fig. 3 Coefficient of similarity of phytoliths in the typical soils and the corresponding communities in the forested and grassland regions |
同时,为进一步观察东部森林区和西部草原区表土和群落间不同植硅体类型间的相似性,由图 4可知,东部森林区和西部草原区分别约有24 %和12 %的植硅体类型在表土和群落间的相关系数达到了36 %以上,表明表土植硅体类型与植物群落组成间确实存在联系。且不同地理区域同一类型植硅体在表土和群落间的相关程度略有不同,其中,短细胞植硅体、扁平状、块状和导管型在西部草原区的相关系数要大于东部森林区,也即西部草原区该四类植硅体在表土和群落间的相关程度较大;其余植硅体类型则表现为东部森林区大于西部草原区。

|
图 4 森林区和草原区表土及相应群落中主要类型植硅体的相关系数变化 Fig. 4 Correlation coefficient of the main phytolith morphotypes in the soils and the corresponding plant communities in the forested and grassland regions |
为进一步验证表土和群落植硅体组合特征的相似性,利用植硅体组合的百分含量数据对草原区植物群落和森林区植物群落进行了判别分析。根据分类结果正确率(表 2)可知,基于群落植硅体的百分含量能够对初始分组案例的100 %的样点进行正确分类。故群落植硅体特征与其地上植物群落间是有密切联系的。且可得出森林区木本植物群落和草原区草本植物群落的典型判别方程:森林区木本植物群落Y1=1.627x1+1.512x2+1.517x3+1.348x4+1.659x5+1.591x6-4.236x7+4.953x8+2.263x9+2.039x10+1.698x11+12.379x12+11.030x13+12.542x14+0.909x15+0.037x16-102.082;草原区草本植物群落Y1=1.744x1+1.668x2+1.621x3+1.807x4+1.050x5+1.471x6-3.615x7+2.305x8+2.489x9+1.456x10+1.701x11+14.922x12+10.374x13+5.112x14+0.180x15+0.995x16-80.939,其中x1,x2,…,x16分别为鞍型(x1)、帽型(x2)、哑铃型(x3)、齿型(x4)、棒型(x5)、尖型(x6)、扁平状(x7)、块状(x8)、毛发状(x9)、硅质突起型(x10)、硅化气孔(x11)、表皮植硅体(x12)、弓型(x13)、特殊型(x14)、导管型(x15)和三棱柱(x16)。另外,利用部分群落样品进行了不重复交叉验证,在交互验证中,其正确率有所下降,但其仍能够对交叉验证分组中87.8 %的样点进行正确分类,其中森林区木本植物群落和草原区草本植物群落的判别正确率分别为69.2 %和96.4 % (表 2)。可见,依据群落植硅体组合的百分含量可将森林区木本植物群落和草原区草本植物群落成功判别出来,一定程度上再次表明了不同植物群落间植硅体组合特征的差别。
| 表 2 基于植硅体百分含量的木本群落和草本群落的判别分析结果 Table 2 DA of phytolith percentages in the woody and herbaceous communities |
为验证表土和群落植硅体组合特征的相似性,利用上述判别函数对不同类型土壤样点进行判别,判别结果如表 3所示。由表 3可知,基于典型植物群落的判别函数能够对东北地区不同群落下表土中54.17 %的样点进行正确分类,其中,森林区木本植物群落和草原区草本植物群落下表土判断正确数分别为10个和9个,正确率分别为76.92 %和32.14 %。总的看来,依据典型植物群落的判别函数能够大体区分不同类型土壤,表征了相应群落下的表土和群落植硅体组合特征的相似性,但是其区分效果还有待于进一步验证,一定程度上也表明了不同群落下表土植硅体组合是有差别的。
| 表 3 基于典型植物群落的判别函数对不同类型土壤判别的结果* Table 3 DA result of different soil types based on the discrimination function of communities |
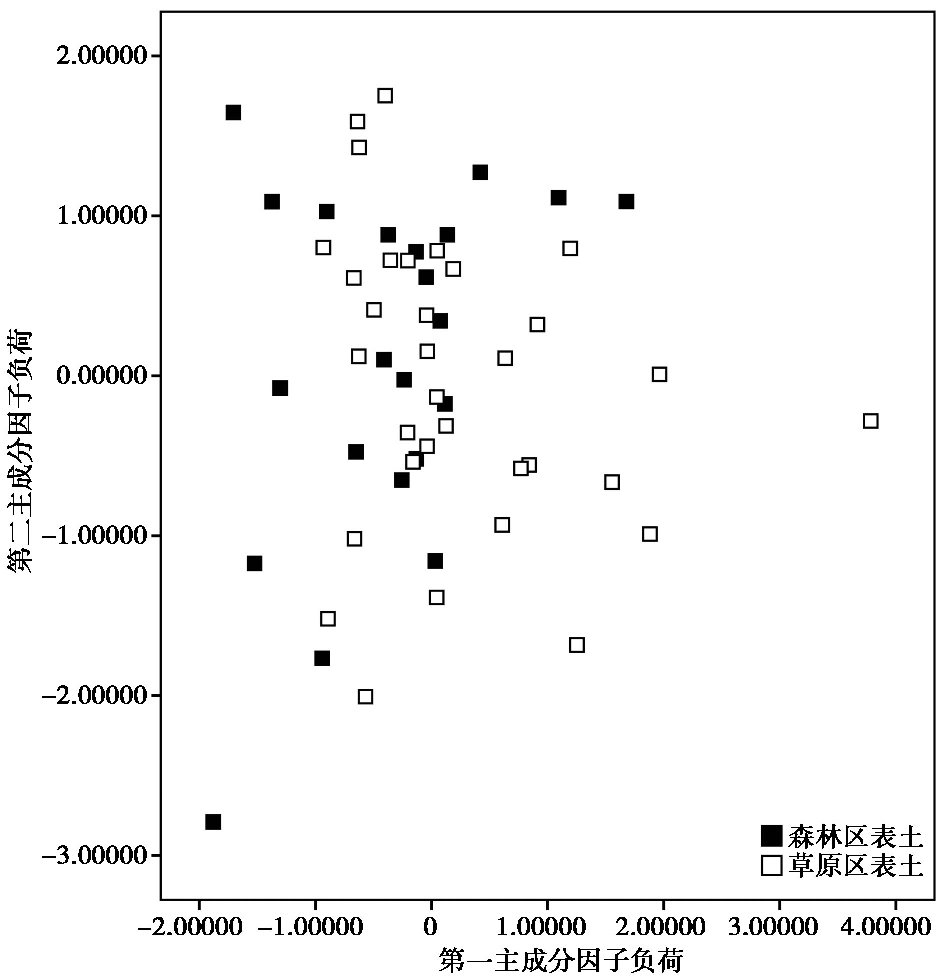
PCA分析结果显示,PCA第一、二排序轴数据解释量分别为18.59 %和31.80 %,累计贡献率为50.39 %。由图 5可知,森林区木本群落和草原区草本群落下的表土样点可以被明显区分开。草原区表土样点主要位于该图左下方,而森林区表土样点主要位于该图右上侧。草原区表土样点与森林区表土样点大体上可被区分开,反映了不同群落下表土中植硅体组合特征的差异,这与上述判别分析结果是一致的。
|
图 5 森林区和草原区表土植硅体组合百分含量的主成分分析图 Fig. 5 PCA of phytolith percentages in the soils from the forested and grassland regions |
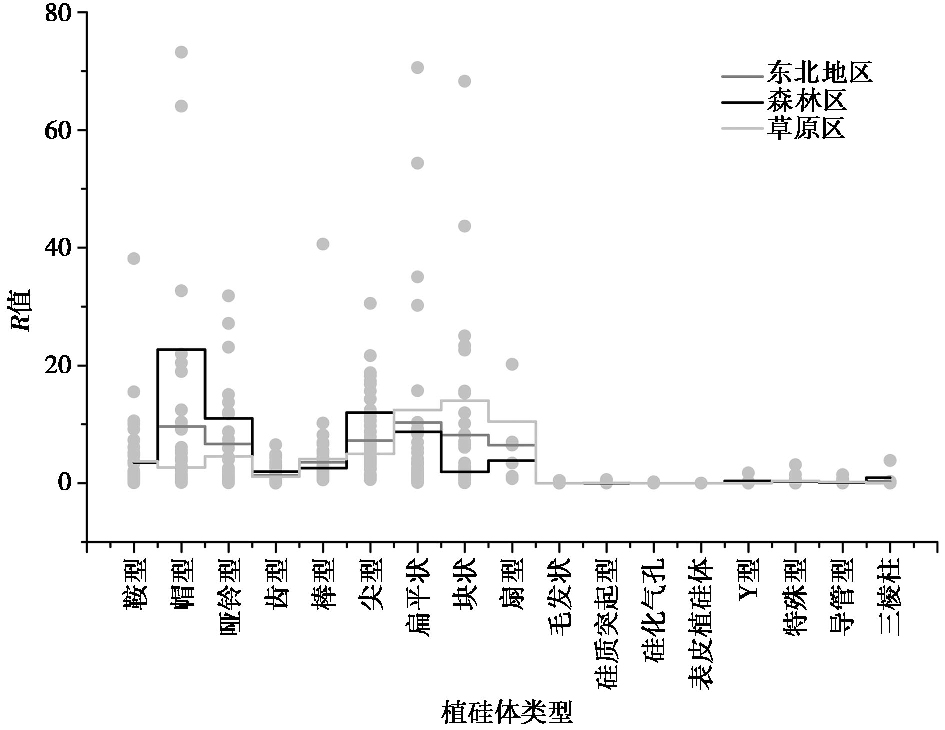
从植硅体的R值(图 6)来看,不仅不同区域土壤中植硅体的保存存在差异,而且不同类型植硅体的保存也有所不同。就整个东北地区而言,表土中含量丰富的帽型、哑铃型、尖型、扁平状、块状和扇型的R值较高,集中分布在6~10,此类表土植硅体的含量高估了对应植物群落中该类植硅体的含量,在表土中保存较好。与此相反的是,在植物群落中含量丰富而在表土中少见的毛发状、硅质突起型、硅化气孔、表皮植硅体等的R值均小于1,对地上植物群落的代表性较低,低估了群落中该类植硅体的含量,在表土中保存较差。而鞍型、齿型和棒型的R值集中在1~4,表明表土中该类植硅体对地上植物群落的代表性较为适中,能够较准确地反映地上植物信息,在表土中保存较好。不同植物群落下表土植硅体对地上植被的指示性稍有不同。其中,不管是东部森林区还是西部草原区,鞍型和齿型植硅体均可准确指示地上植物群落的信息,哑铃型、尖型和扁平状植硅体均高估了对应植物群落中该类植硅体的含量,在表土中保存较好;毛发状、硅质突起型、硅化气孔、表皮植硅体等植硅体均低估了对应物群落中该类植硅体的含量,在表土中保存较差。东部森林区表土中帽型植硅体的含量高估了其对应群落中该类植硅体的含量,棒型、块状和扇型植硅体则可准确指示地上植物群落的信息,而西部草原区则与此刚好相反。故表土中不同植硅体类型对地上植物群落的代表性是不同的,且不同植被类型下表土植硅体对于植被的指示性也各有不同,在利用植硅体重建古植被、古气候时,需按照其指示性的大小校正表土植硅体与植被的数量关系,从而提高植硅体重建古环境的精度。
|
图 6 东北地区表土中不同植硅体类型R值的变化 Fig. 6 R value of the main phytolith morphotypes in the soils in NE China |
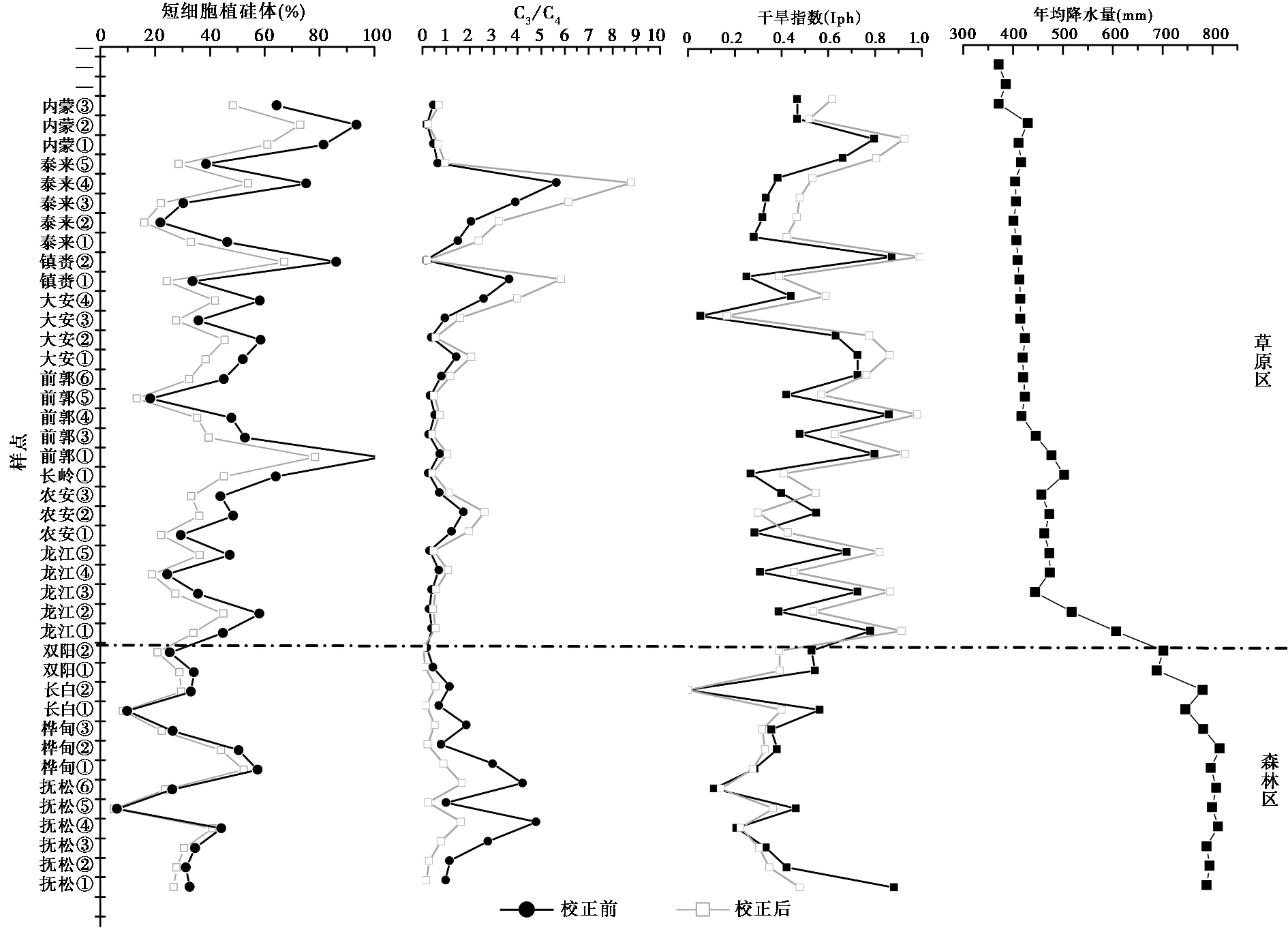
基于表土植硅体含量与地上植物群落植硅体含量之比(R值),校正各样点表土植硅体的含量(校正后的表土植硅体含量为原表土植硅体的百分含量与R值的比值),并对比校正前后森林区和草原区表土植硅体对草本植物比重、C3和C4草本植物比率和干旱指数(Iph)的指示差异。干旱指数Iph=画眉草亚科/(画眉草亚科+黍亚科)=鞍型/(鞍型+哑铃型)[31]。考虑到本文样点主要基于年均4℃等温线采集,样点间降水量差异明显,故仅研究了植硅体干旱指数与年均降水量间的关系。依据校正前后短细胞植硅体的含量、C3和C4草本植物比率以及校正前后的植硅体干旱指数与年均降水量的相关分析结果,发现校正前后草本短细胞植硅体的含量、C3和C4草本植物比率间均存在着显著的正相关关系,校正前后草本短细胞植硅体含量、C3和C4草本植物比率间的相关系数分别为0.846和0.800,均通过了极显著性检验(p=0.000<0.01)。同时,校正前后植硅体干旱指数与年均降水量间存在着显著的负相关关系,校正后土壤中植硅体的干旱指数与年均降水量间的相关系数为-0.466,并通过了极显著性检验(p=0.000<0.01)。可见,校正前后表土中草本短细胞植硅体含量、C3和C4草本植物比率以及植硅体干旱指数与年均降水量间均具有密切联系。
对比校正前后表土中草本短细胞植硅体含量、C3和C4植物植硅体比率的变化发现(图 7),校正前西部草原区和东部森林区草本短细胞植硅体的含量、C3和C4植物植硅体比率相当,东部森林区个别样点的含量和比率甚至超过西部草原区。显然地,校正前表土中草本植硅体含量、C3和C4植物比率与地上现生植物群落组成明显不符,表土植硅体含量的变化并不能有效地反映植物群落面貌。但校正后,西部草原区和东部森林区中草本短细胞植硅体的含量、C3和C4植物比例差别明显。具体看来,西部草原区草本短细胞植硅体含量明显多于东部森林区,多数样点其含量大于10 %,而东部森林区中该类植硅体的含量不及6 %;东部森林区C3和C4植物比率也明显大于西部草原区。由此可见,校正后,东部森林区和西部草原区表土植硅体组合特征的差别与地上现生植物群落组成更为相符,能够更好地反映地上植物群落信息。此外,从图 7可知校正后泰来④、泰来③、镇赉①等样点的C3和C4植物比率与其他样点相比较大,对该样点地上植物群落的调查发现,C3植物的生物量偏高,其分别为总生物量的86 %、74 %和78 %,故推测可能由于该样点C3植物的数量偏多,导致产生的植硅体较多,从而使C3和C4植物比率偏大,但具体原因还有待进一步调查验证。
|
图 7 校正前、后东部森林区和西部草原区表土特征植硅体比值对比图 Fig. 7 Comparison between percentage of characteristic phytoliths of the unrevised soil and these of the revised soil in the forested and grassland regions |
进一步比较校正前后表土植硅体干旱指数(Iph)的差异(图 7)发现,校正前,东部森林区和西部草原区表土中植硅体Iph值大体相当,虽然略有差异,但其差异相对较小,东部森林区个别样点表土中植硅体Iph值的大小甚至高于西部草原区。校正后,东部森林区和西部草原区间表土植硅体Iph值的差别非常明显。校正后,西部草原区表土植硅体Iph值明显高于东部森林区,多数样点表土植硅体Iph值大于0.45,而东部森林区其明显小于0.45。可见,校正后,东部森林区和西部草原区表土植硅体的干旱指数与年均降水量的变化更为相符,能够更好地反映区域降水的差异。并且当校正后的表土植硅体干旱指数为0.45时,可以将高于或低于年均降水量600mm的样点即东部森林和西部草原进行很好区分。因此,根据表土植硅体与地上植物群落的数量关系,校正沉积物剖面中不同类型植硅体的含量,可能在一定程度上可提高植硅体-古植被、古气候重建的精度。
4 讨论 4.1 表土植硅体对地上植物群落的代表性及其保存特征的探讨依据不同植物群落的植硅体组合特征,总体看来,不同植物群落间植硅体组合特征明显不同,这可能主要是因为不同植物群落中其植物组成具有明显差别,而不同种类植物的植硅体组合又各有差异[6, 32],从而导致整个植物群落的植硅体组合特征明显不同[12, 33]。其中,西部草原区草本群落中禾本科植物相对较多,所以产自该植物的短细胞植硅体、棒型、尖型等植硅体的含量也相应较多[33];森林区木本群落中植物组成主要以莎草科植物——苔草和较多的双子叶草本植物及阔叶类木本植物为主,而禾本科植物仅有少量存在,其中苔草的典型植硅体为硅质突起型,且其含量丰富[16],双子叶草本植物和阔叶类木本植物均含有丰富的硅化气孔和表皮植硅体[34],故森林区木本群落中硅质突起型、硅化气孔和表皮植硅体等的含量较高。可见,不同植物群落的植硅体组合特征与其植物群落间各自植物组成间具有密切联系,并验证了前人研究结果。与植物群落植硅体组合特征类似,相应表土的植硅体组合也有较为接近的特征,这可能主要由于表土中植硅体的直接来源是其地上植物群落,地上植物群落的不同显著影响着土壤中植硅体的组合特征。这与前人在热带、亚热带以及温带个别地区得出的不同植物群落下的表土植硅体组合是明显不同的结论也是一致的[12, 15, 35~37]。
早期相关研究认为,阔叶类木本植硅体为超代表性植硅体类型,草本植硅体为低代表性植硅体类型,且研究认为禾本科植物植硅体含量丰富且相对容易保存[34, 38];土壤中保存较好的扇型为超代表性植硅体类型,不易保存的硅化气孔、硅质突起型等为低代表性植硅体类型[39~40]。本文结果与此既有一致性,又有不同。例如,土壤中不易保存的植硅体类型如硅化气孔、硅质突起型等在本研究和前人研究中均为低代表性植硅体类型[41],在表土中不易保存。前人研究中作为超代表性植硅体类型的扇型在本研究中也为超代表性植硅体类型[40]。但在前人研究中作为低代表性植硅体类型的草本植硅体[40]在本研究中则为适中代表性植硅体类型或超代表性类型(如不管是东部森林区还是西部草原区,鞍型和齿型植硅体均可准确指示地上植物群落的信息,为适中代表性类型,而哑铃型均高估了对应植物群落中该类植硅体的含量,为超代表性类型)。但帽型在东部森林区和西部草原区对地上植物群落的代表性则有所不同,东部森林区帽型植硅体高估了其对应群落中该类植硅体的含量,而在西部草原区则为适中代表性类型。这可能是因为:一是表土植硅体是地上植物多年积累的结果,东部森林区和西部草原区表土中植硅体的组合特征差别较小[14];二则西部草原区地上早熟禾亚科等禾本科植物的种类和数量要远远多于东部森林区,而早熟禾亚科等禾本科植物中又富含帽型等短细胞植硅体[35, 42],故西部草原区地上植物群落中帽型等短细胞植硅体的含量要明显高于东部森林区,所以,在东部森林区和西部草原区,土壤中不同类型植硅体的含量特征相差不大,但是其地上植物群落中同类植硅体的含量可能有较大差异,从而导致同一植硅体类型的R值在东部森林区和西部草原区具有较大差别。总之,土壤中植硅体的保存是一个相对复杂的过程,其可能同时受到地上植物群落植硅体和土壤本身理化环境的双重影响。
4.2 基于植硅体的保存特征校正表土植硅体工作的探讨受植硅体自身产量、沉积环境等的影响,土壤-植物系统中,土壤植硅体存在不同程度的溶蚀与迁移,并且不同植硅体类型对植被的代表性也明显不同[38, 40, 43~44]。为了尽量减少解释古植被成分时因地层中不同植硅体类型的保存差异引起的偏差,明确表土中不同植硅体类型的保存特征并据其校正古环境恢复结果不失为提高古环境定量重建的有效方式[45~47]。植硅体保存的相关研究显示,与热带、亚热带地区相比,温带地区土壤植硅体组合特征与上覆植物群落特征偏差更大,该区土壤中植硅体的保存不甚理想[43, 48]。因此,学者们普遍认为温带地区植硅体-古植被重建工作必须以植硅体组合谱的校正工作为前提。
目前,温带地区已零星开展了针对表土植硅体保存的研究[10, 45],但其仅针对某些具有形态学意义的个别植硅体类型,例如D/P、草本植硅体和针叶类植硅体等[10, 49~50]。且基于植硅体代表性的表土植硅体的校正工作尚少有报道。本文尝试分别利用森林区和草原区表土植硅体的R值对表土植硅体的含量进行校正,发现校正后森林区和草原区表土植硅体含量和气候指数的变化明显。从草本植硅体含量、C3和C4植物植硅体比率来看,校正前后草原区表土中草本植硅体含量、C3和C4植物植硅体比率变化不大,而在森林区则明显下降。主要因为表土中鞍型、帽型、尖型等草本植硅体类型能够比较准确地反映草原区地上草本植物的数量特征,而森林区表土中鞍型、帽型等的含量普遍高估地上草本植物的数量,R值相对较高,经过R值校正后,草原区表土中草本植硅体含量、C3和C4植物植硅体比率明显高于森林区。总之,校正后的表土植硅体含量更能够凸显森林区和草原区植被面貌的差异,与上覆植物群落组成更为相符。温带地区表土植硅体的校正工作也将为该区林草界限的变迁以及古植被、古气候的精确重建等奠定重要基础,但针对表土植硅体校正的工作仍需继续加强。
从植硅体气候指数来看,校正后东部森林区和西部草原区表土植硅体的干旱指数与年均降水量的变化更为相符,校正后的表土植硅体干旱指数能够更好地反映区域降水的差异。同时,据研究,Diester-Haas等[51]计算了非洲西北部(热带地区)土壤植硅体的Iph指数并定量说明了当Iph>40 %时该地的植被以干草原为主;随后,Kurmann[52]、Fredlund和Tieszen[53]均证明了植硅体的Iph指数可指示环境的干湿程度,并指出当Iph值处于40 % ~45 %时可区分该区(温带地区)干旱环境和湿润环境。但也有研究表明当Iph值为30 %或20 %时就可将该区(热带地区)高草草原(湿润环境)和矮草草原(干旱环境)区分开[49, 54]。因此,整体看来,区分不同地区高草原(湿润环境)和矮草草原(干旱环境)的Iph值的大小并不相同,这可能是由于研究区的不同所致。而本研究表明当土壤植硅体的干旱指数为0.45即45 %时,可将西部草原区(干旱环境)和东部森林区(湿润环境)进行很好区分,这与上述Kurmann[52]、Fredlund和Tieszen[53]的研究结果是一致的。综合看来,在温带地区干旱指数Iph值的取值范围基本上是位于40 % ~45 %间,而热带地区干旱指数的取值范围波动较大,故推测,在温带地区,当土壤植硅体的干旱指数为40 % ~45 %时,其可将草原(干旱环境)和森林(湿润环境)进行良好区分,一定程度上明确了温带地区区分干旱环境和湿润环境的Iph值的范围,为温带地区地层中该指数的成功应用提供了参考依据。
5 结论(1) 东北地区森林区和草原区表土及其地上植物群落中植硅体类型丰富,按照细胞来源可将其划分为7组,主要包括短细胞植硅体(包括鞍型、帽型、十字型、哑铃型、多铃型和齿型)、棒型、尖型、块状、扇型、扁平状、表皮植硅体、硅化气孔、导管型及其他类型。同时,不同植物群落下表土植硅体的组合特征与其地上植物群落间存在密切关联,表土与其地上植物群落间的植硅体组合特征较为相似,两者植硅体类型组合间的相似系数CC值均在56 %以上,不同植硅体类型的相关系数C值也达到了36 %以上。主成分分析和判别分析结果进一步验证了表土和群落植硅体组合特征的相似性。此外,森林区和草原区表土中植硅体类型差异也不大,除不均匀厚壁组织、纹孔块状、脊线块状仅见于森林区表土外,其他类型均存在于草原区和森林区表土中。
(2) 东北地区表土中不同植硅体类型对地上植物群落的代表性是不同的。表土中帽型、哑铃型、尖型、扁平状、块状和扇型的含量高估了对应植物群落中该类植硅体的含量(R值集中分布在6~10),在土壤中保存较好;毛发状、硅质突起型、硅化气孔、表皮植硅体等植硅体的含量则低估了群落中该类植硅体的含量(R值均小于1),在土壤中保存较差;鞍型、齿型和棒型能够较准确地反映地上植物的信息(R值集中分布在1~4),在土壤中保存较好。同时,森林区和草原区不同植物群落下表土中同一植硅体类型对地上植物群落的代表性也是有所差别的。如东部森林区帽型植硅体高估了其对应群落中该类植硅体的含量,棒型、块状和扇型植硅体则可准确指示地上植物群落的信息,而西部草原区则与此刚好相反。故在利用植硅体重建古植被、古气候时,需按照其指示性的大小校正表土植硅体与植被的数量关系,从而提高植硅体重建古环境的精度。
(3) 西部草原区和东部森林区中校正后的草本短细胞植硅体的含量、C3和C4植物比率差别明显,其中,西部草原区校正后的草本短细胞植硅体含量明显多于东部森林区,多数样点含量大于10 %,而东部森林区中该类植硅体的含量不及6 %;东部森林区C3和C4植物比率也明显大于西部草原区。同时,西部草原区校正后的表土植硅体干旱指数Iph值明显高于东部森林区,多数样点表土植硅体干旱指数Iph值大于0.45,而东部森林区其明显小于0.45,东部森林区和西部草原区间校正后的表土植硅体干旱指数Iph值的差别非常明显。当校正后的表土植硅体干旱指数为40 % ~45 %时,可明显区分森林和草原。故基于植硅体保存性校正后的表土植硅体特征和干旱指数对地上植物群落特征和区域降水的响应更为敏感,表土植硅体组合特征能够更好地代表地上植物群落信息和气候变化。该结果证实了基于土壤-植物系统间植硅体的保存特征对表土植硅体进行校正工作的必要性,也为植硅体-古环境重建精度的提高提供了依据。
致谢: 感谢东北师范大学王海南老师、蒙萌同学和夏璎凡同学在野外工作中给予的帮助;感谢审稿专家和杨美芳老师为本文提出的宝贵修改意见。
| [1] |
Strömberg C A E. Using phytolith assemblages to reconstruct the origin and spread of grass-dominated habitats in the great plains of North America during the Late Eocene to Early Miocene[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2004, 207(3-4): 239-275. DOI:10.1016/j.palaeo.2003.09.028 |
| [2] |
Nguetsop V F, Bentaleb I, Favier C, et al. A Late Holocene palaeoenvironmental record from Lake Tizong, northern Cameroon using diatom and carbon stable isotope analyses[J]. Quaternary Science Reviews, 2013, 72: 49-62. DOI:10.1016/j.quascirev.2013.04.005 |
| [3] |
Trondman A K, Gaillard M J, Sugita S, et al. Pollen-based quantitative reconstruction of Holocene regional vegetation cover(plant-function types and land-cover types)in Europe suitabale for climate modeling[J]. Global Change Biology, 2015, 21(2): 676-697. DOI:10.1111/gcb.12737 |
| [4] |
冷程程, 汤卓炜, 张伟, 等. 嫩江流域新石器时代以来的环境考古(初步)研究[J]. 第四纪研究, 2019, 39(1): 48-58. Leng Chengcheng, Tang Zhuowei, Zhang Wei, et al. Research of environmental archaeology(preliminary)in Nenjiang River Basin since Neolithic age[J]. Quaternary Sciences, 2019, 39(1): 48-58. |
| [5] |
刘洪妍, 王海南, 介冬梅, 等. 东北地区湿度梯度下的表土植硅体的空间分布规律[J]. 第四纪研究, 2019, 39(1): 76-88. Liu Hongyan, Wang Hainan, Jie Dongmei, et al. The distribution of phytolith in topsoil samples under the humidity gradient in Northeast China[J]. Quaternary Sciences, 2019, 39(1): 76-88. |
| [6] |
顾延生, 季雅斌, 管硕, 等. 植硅体形态测量学研究与应用概述[J]. 第四纪研究, 2019, 39(1): 12-23. Gu Yansheng, Ji Yabin, Guan Shuo, et al. An introduction to the research and application of phytolith morphometrics[J]. Quaternary Sciences, 2019, 39(1): 12-23. |
| [7] |
Alexandre A, Meunier J D, Mariotti A, et al. Late Holocene phytoliths and carbon-isotope record from a latosol at Salitre, South-Central Brazil[J]. Quarternary Research, 1999, 51(2): 187-194. DOI:10.1006/qres.1998.2027 |
| [8] |
Fishkis O, Ingwersen J, Streck T. Phytolith transport in sandy sediment:Experiments and modeling[J]. Geoderma, 2009, 151(3-4): 168-178. DOI:10.1016/j.geoderma.2009.04.003 |
| [9] |
Liu L D, Li D H, Jie D M, et al. Translocation of phytoliths within natural soil profiles in Northeast China[J]. Frontiers in Plant Science, 2019, 10: 1-15. DOI:10.3389/fpls.2019.01254 |
| [10] |
Hyland E, Smith S Y, Sheldon N D. Representational bias in phytoliths from modern soils of central North America:Implications for paleovegetation reconstructions[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 374: 338-348. DOI:10.1016/j.palaeo.2013.01.026 |
| [11] |
Biswas O, Ghosh R, Paruya D K, et al. Can grass phytoliths and indices be relied on during vegetation and climate interpretations in the eastern Himalayas?Studies from Darjeeling and Arunachal Pradesh, India[J]. Quaternary Science Reviews, 2016, 134: 114-132. DOI:10.1016/j.quascirev.2016.01.003 |
| [12] |
李德晖, 介冬梅, 高桂在, 等. 松嫩草原典型群落对应表土植硅体组合特征[J]. 第四纪研究, 2018, 38(4): 1035-1049. Li Dehui, Jie Dongmei, Gao Guizai, et al. Characteristics of phytolith assemblages of topsoil in typical communities of Songnen Grassland[J]. Quaternary Sciences, 2018, 38(4): 1035-1049. |
| [13] |
米慧珊, 高会, 翟水晶, 等. 闽江河口湿地典型植物群落及交错带植硅体碳分布特征研究[J]. 第四纪研究, 2019, 39(1): 99-107. Mi Huishan, Gao Hui, Zhai Shuijing, et al. Distribution characteristics of phytolith-occluded carbon in typical plant communities and ecotones in the Min River Estuary[J]. Quaternary Sciences, 2019, 39(1): 99-107. |
| [14] |
Gao G Z, Jie D M, Liu L D, et al. Assessment and calibration of representational bias in soil phytolith assemblages in Northeast China and its implications for paleovegetation reconstruction[J]. Quaternary Research, 2018, 90(1): 38-49. DOI:10.1017/qua.2018.5 |
| [15] |
Barboni D, Bremond L, Bonnefille R. Comparative study of modern phytolith assemblages from inter-tropical Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 246(2-4): 454-470. DOI:10.1016/j.palaeo.2006.10.012 |
| [16] |
Wallis L. An overview of leaf phytolith production patterns in selected Northwest Australian flora[J]. Review of Palaeobotany and Palynology, 2003, 125(3-4): 201-248. DOI:10.1016/S0034-6667(03)00003-4 |
| [17] |
Das S, Ghosh R, Bera S. Application of non-grass phytoliths in reconstructing deltaic environments:A study from the Indian Sunderbans[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2013, 376: 48-65. DOI:10.1016/j.palaeo.2013.02.017 |
| [18] |
Honaine M F, Osterrieth M L. Silicification of the adaxial epidermis of leaves of a panicoid grass in relation to leaf position and section and environmental conditions[J]. Plant Biology, 2012, 14(4): 596-604. |
| [19] |
马占云, 林而达, 吴正方, 等. 东北地区湿地生态系统的气候特征[J]. 资源科学, 2007, 29(6): 16-24. Ma Zhanyun, Lin Erda, Wu Zhengfang, et al. Eco-climate characteristics of the wetlands in Northeast China[J]. Resources Science, 2007, 29(6): 16-24. |
| [20] |
赵国帅, 王军邦, 范文义, 等. 2000-2008年中国东北地区植被净初级生产力的模拟及季节变化[J]. 应用生态学报, 2011, 22(3): 621-630. Zhao Guoshuai, Wang Junbang, Fan Wenyi, et al. Vegetation net primary productivity in Northeast China in 2000-2008:Simulation and seasonal change[J]. Chinese Journal of Applied Ecology, 2011, 22(3): 621-630. |
| [21] |
国志兴, 王宗明, 张柏. 2000-2006年东北地区植被NPP的时空特征及影响因素分析[J]. 资源科学, 2008, 30(8): 1226-1235. Guo Zhixing, Wang Zongming, Zhang Bai, et al. Analysis of temporal-spatial characteristics and factors influencing vegetation NPP in Northeast China from 2000 to 2006[J]. Resources Science, 2008, 30(8): 1226-1235. |
| [22] |
吴征镒, 侯学煜, 朱彦丞, 等. 中国植被[M]. 北京: 科学出版社, 1980: 1-1028. Wu Zhengyi, Hou Xueyu, Zhu Yancheng, et al. Chinese Vegetation[M]. Beijing: Science Press, 1980: 1-1028. |
| [23] |
高桂在.东北地区典型植物群落的表土植硅体记录及晚冰期以来古植被定量重建[D].长春: 东北师范大学博士学位论文, 2019: 1-169. Gao Guizai. Phytolith Reference for Identifying Typical Plant Communities in Northeastern China and Its Implication in Paleo-vegetation Reconstruction since the Late-glacial Period[D]. Changchun: The Master's Dissertation of Northeast Normal University, 2019: 1-169. |
| [24] |
Li N N, Chambers F M, Yang J X, et al. Records of East Asian monsoon activities in Northeastern China since 15.6 ka, based on grain size analysis of peaty sediments in the Changbai Mountains[J]. Quaternary International, 2017, 447: 158-169. DOI:10.1016/j.quaint.2017.03.064 |
| [25] |
李宜垠, 张新时, 周广胜. 中国东北样带(NECT)东北森林区的植被与表土花粉的定量关系[J]. 植物学报, 2000, 42(1): 81-88. Li Yiyin, Zhang Xinshi, Zhou Guangsheng. Study of quantitative relationships between vegetation and pollen in surface samples in the eastern forest area of Northeast China transect[J]. Acta Botanica Sinica, 2000, 42(1): 81-88. |
| [26] |
Davis M B. On the theory of pollen analysis[J]. American Journal of Science, 1963, 261: 897-912. DOI:10.2475/ajs.261.10.897 |
| [27] |
郭梅娥.长白山区植硅体-气候因子模型的研究[D].长春: 东北师范大学硕士学位论文, 2013: 24. Guo Mei'e. Research on the Model between Phytoliths and Climate Factors[D]. Changchun: The Master's Dissertation of Northeast Normal University, 2013: 24. |
| [28] |
王永吉, 吕厚远. 植物硅酸体研究及应用[M]. 北京: 海洋出版社, 1992: 1-228. Wang Yongji, Lü Houyuan. Phytolith Study and Its Application[M]. Beijing: China Ocean Press, 1992: 1-228. |
| [29] |
Neumann K, Strömberg C A E, Ball T, et al. International code for phytolith nomenclature(ICPN)2.0 international[J]. Annals of Botany, 2019, 124(2): 189-199. |
| [30] |
Fraysse F, Pokrovsky O S, Schott J, et al. Surface chemistry and reactivity of plant phytoliths in aqueous solutions[J]. Chemical Geology, 2009, 258(3-4): 197-206. DOI:10.1016/j.chemgeo.2008.10.003 |
| [31] |
Barboni D, Bremond L. Phytoliths of East African grasses:An assessment of their environmental and taxonomic significance based on floristic data[J]. Review of Palaeobotany and Palynology, 2009, 158(1-2): 29-41. DOI:10.1016/j.revpalbo.2009.07.002 |
| [32] |
Morris L R, Baker F A, Morris C, et al. Phytolith types and type-frequencies in native and introduced species of the sagebrush steppe and pinyon-juniper woodlands of the Great Basin, USA[J]. Review of Palaeobotany and Palynology, 2009, 157(3-4): 339-357. DOI:10.1016/j.revpalbo.2009.06.007 |
| [33] |
Piperno D R, Pearsall D M. The silica bodies of tropical American grasses:Morphology, taxonomy, and implications for grass systematics and fossil phytolith identification[J]. Smithsonian Contributions to Botany, 1998, 85: 1-40. |
| [34] |
Mercader J, Bennett T, Esselmont C, et al. Soil phytoliths from Miombo woodlands in Mozambique[J]. Quaternary Research, 2011, 75(1): 138-150. DOI:10.1016/j.yqres.2010.09.008 |
| [35] |
Barboni D, Bremond L, Bonnefille R. Comparative study of modern phytolith assemblages from inter-tropical Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 246(2-4): 454-470. DOI:10.1016/j.palaeo.2006.10.012 |
| [36] |
Blinnikov M S, Bagent C M, Reyerson P E. Phytolith assemblages and opal concentrations from modern soils differentiate temperate grasslands of controlled composition on experimental plots at Cedar Creek, Minnesota[J]. Quaternary International, 2013, 287: 101-113. DOI:10.1016/j.quaint.2011.12.023 |
| [37] |
Dickau R, Whitney B S, Iriarte J, et al. Differentiation of neotropical ecosystems by modern soil phytolith assemblages and its implications for palaeoenvironmental and archaeological reconstructions[J]. Review of Palaeobotany and Palynology, 2013, 193: 15-37. DOI:10.1016/j.revpalbo.2013.01.004 |
| [38] |
李仁成, 温梦丹, 陶欣悦, 等. 植硅体化学组成研究进展[J]. 第四纪研究, 2020, 40(1): 283-293. Li Rencheng, Wen Mengdan, Tao Xinyue, et al. Advance of study on chemical composition of phytolith[J]. Quaternary Sciences, 2020, 40(1): 283-293. |
| [39] |
Albert R M, Bamford M K, Esteban I. Reconstruction of ancient palm vegetation landscapes using a phytolith approach[J]. Quaternary International, 2015, 369: 51-66. DOI:10.1016/j.quaint.2014.06.067 |
| [40] |
Cabanes D, Weiner S, Shahack-Gross R. Stability of phytoliths in the archaeological record:A dissolution study of modern and fossil phytoliths[J]. Journal of Archaeological Science, 2011, 38(9): 2480-2490. DOI:10.1016/j.jas.2011.05.020 |
| [41] |
Cabanes D, Shahack-Gross R. Understanding fossil phytolith preservation:The role of partial dissolution in paleoecology and archaeology[J]. PLoS One, 2015, 10(5): 1-16. |
| [42] |
刘洪妍, 介冬梅, 刘利丹, 等. 长白山区典型禾本科植物植硅体形状系数[J]. 第四纪研究, 2013, 33(6): 1234-1244. Liu Hongyan, Jie Dongmei, Liu Lidan, et al. The shape factors of phytolith in selected plants from Changbai Mountains and their implications[J]. Quaternary Sciences, 2013, 33(6): 1234-1244. |
| [43] |
Strömberg C A E, Werdelin L, Friis E M, et al. The spread of grass dominated habitats in Turkey and surrounding areas during the Cenozoic:Phytolith evidence[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2007, 250(1-4): 18-49. DOI:10.1016/j.palaeo.2007.02.012 |
| [44] |
杨石磊, 宋照亮, 郝倩, 等. 草地退化对植物硅分布和植硅体碳汇的影响:以北方农牧交错带草地为例[J]. 第四纪研究, 2019, 39(1): 89-98. Yang Shilei, Song Zhaoliang, Hao Qian, et al. Impact of grassland degradation on plant silicon distribution and phytolith carbon sequestration[J]. Quaternary Sciences, 2019, 39(1): 89-98. |
| [45] |
Delhon C, Alexandre A, Berger J F, et al. Phytolith assemblages as a promising tool for reconstructing Mediterranean Holocene vegetation[J]. Quaternary Research, 2003, 59(1): 48-60. DOI:10.1016/S0033-5894(02)00013-3 |
| [46] |
Carnelli A L, Theurilla J P, Madella M. Phytolith types and type-frequencies in subalpine-alpine plant species of the European Alps[J]. Review of Palaeobotany and Palynology, 2004, 129(1-2): 39-65. DOI:10.1016/j.revpalbo.2003.11.002 |
| [47] |
Blinnikov M. Phytoliths in plants and soils of the interior Pacific Northwest, USA[J]. Review of Palaeobotany and Palynology, 2005, 135(1-2): 71-98. DOI:10.1016/j.revpalbo.2005.02.006 |
| [48] |
Hodson M J, White P J, Mead A, et al. Phylogenetic variation in the silicon composition of plants[J]. Annals of Botany, 2005, 96(6): 1027-1046. DOI:10.1093/aob/mci255 |
| [49] |
Bremond L, Alexandre A, Hély C, et al. A phytolith index as a proxy of tree cover density in tropical areas:Calibration with leaf area index along a forest-savanna transect in Southeastern Cameroon[J]. Global and Planetary Change, 2005, 45(4): 277-293. DOI:10.1016/j.gloplacha.2004.09.002 |
| [50] |
Dunn R E, StrÖmberg C A E, Madden R H, et al. Linked canopy, climate, and faunal change in the Cenozoic of Patagonia[J]. Science, 2015, 347(6219): 258-261. DOI:10.1126/science.1260947 |
| [51] |
Diester-Haas L, Schrader H J, Thiede J. Sedimento-logical and paleoclimatological investigations of two pelagic ooze cores off Cape Barbas, North-West Africa[J]. Meteor Forsch Ergebnisse, 1973, 16: 19-66. DOI:10.1594/PANGAEA.548418 |
| [52] |
Kurman M H. An opal phytolith and palynomorph study of extant and fossil soils in Kansas(USA)[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1985, 49(3-4): 217-235. DOI:10.1016/0031-0182(85)90055-0 |
| [53] |
Fredlund G G, Tieszen L L. Modern phytolith assemblages from the North American Great Plains[J]. Journal of Biogeography, 1994, 21(3): 321-335. DOI:10.2307/2845533 |
| [54] |
Alexandre A, Meunier J D, Lezine A M, et al. Phytoliths:Indicators of grassland dynamics during the Late Holocene in intertropical Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1997, 136(1-4): 213-229. DOI:10.1016/S0031-0182(97)00089-8 |
2 Key Laboratory of Geographical Processes and Ecological Security in Changbai Mountains, Ministry of Education, Changchun 130024, Jilin;
3 Institute for Peat and Mire Research, State Environmental Protection Key Laboratory of Wetland Ecology and Vegetation Restoration, Changchun 130024, Jilin;
4 Key Laboratory of Vegetation Ecology, Ministry of Education, Changchun 130024, Jilin;
5 School of Geographic Sciences, Northeast Normal University, Changchun 130024, Jilin;
6 School of Resources Environment & Tourism, Anyang Normal University, Anyang 455000, Henan)
Abstract
Phytolith records have provided a new perspective on the reconstruction and interpretation of palaeovegetation and paleoclimate. However, the reliability of soil phytoliths for representing phytolith assemblages from archaeological and palaeoecological contexts has not been fully determined, and it needs to be assessed and calibrated before they can be used in palaeoecological contexts.In this study, we collected plant samples and topsoil samples from a total of 41 sites in Northeast China (39°40'~53°30'N, 115°05'~135°02'E), representing 13 sites in woody communities and 28 sites in herbaceous communities. A total of 93 topsoil samples (including dark brown soil, chernozem, chestnut soil, meadow soil, eolian sandy soil, wetland soil, alluvial soil, and albic soil) and 93 community samples were sampled, respectively. The NE China is influenced by the East Asian monsoon and has four distinct seasons, with a long winter and a short summer. The annual average temperature ranges from-5℃ to 10℃. The temperature in January and July ranges from-24℃ to 9℃ and from 21~26℃, respectively. The average annual precipitation ranges from 400~1000 mm and is concentrated in summer and autumn.Phytoliths were extracted using the wet ashing method and heavy liquid flotation. At least 300 phytolith grains were counted for each sample. Correlation coefficient (C) and Similarity coefficient (CC) were calculated to assess the similarity between phytoliths from soil samples and community samples. R-values were also calculated to assess the soil phytolith preservation, using the percentage of each morphotype for all of the grassland or forested samples, respectively. Then principal components analysis (PCA) and discriminant analysis (DA), implemented with Canoco 4.5, were used to determine the morphotype associations in grassland and forested region respectively. Correlation analysis was used to assess the correlation between Iph values and the mean annual precipitation (MAP).The phytolith morphotypes extracted from community samples and corresponding topsoil samples in NE China are various and could be divided into seven categories according to anatomical items:short cell (rondel, saddle, bilobate, cross, cylindrical polylobate, trapeziform sinuate), elongate, lanceolate, blocky, bulliform, tabular, epidermal phytolith, stomata, tracheid, and others. And there is a reasonable correspondence between phytolith morphotypes from topsoils and those from the corresponding plant communities. In the grassland and forested region, the CC-values all exceeded 56%, and the C-values of different phytolith morphotypes all exceeded 36%. Principal components analysis (PCA) and discriminant analysis (DA) further confirm the correlation between phytolith morphotypes from topsoils and those from the corresponding plant communities. Topsoil phytolith assemblages could reliably differentiate samples from herbaceous and woody communities. Additionally, there is slight difference on the topsoil phytolith morphotypes between grassland and forested region. All the phytolith morphotypes, except for margin scuniform, blocky scrobiculate and blocky ridged, occur in both forested and grassland regions.Notably, different phytolith morphotypes exhibit varying degrees of representational bias in terms of the aboveground plant community. Some morphotypes (e.g. rondel, bilobate, lanceolate, blocky, tabular and bulliform) with R-values greater than six over-represent the abundance of the associated plant taxa; morphotypes such as microhair, conical epidermal, silicified stomata and epidermal phytoliths with R-values less than one under-represent the parent plant abundance; and other morphotypes (e.g. saddle, trapeziform sinuate and elongate) are in good agreement with the numbers of individual plant taxa, with R-values varying from 1 to 4. Additionally, the representational bias of some phytolith types, such as rondel, elongate, blocky and bulliform, for reflecting the aboveground plant communities differed between the woody community and herbaceous communities. Specifically, in the woody communities, rondel in topsoil over-represented the numbers of individuals of the corresponding plant taxa; whereas elongate, blocky and bulliform could well represent the aboveground communities. However, the reverse has taken place in the herbaceous communities.Based on R value, soil phytolith indices with known vegetation compositions and precipitation change was calibrated, and the corrected phytolith contents of the herbaceous plants from most sites are greater than 10% in grassland samples and but remain less than 6% in the forest samples. The corrected Iph values of grassland samples are higher than those of forest samples, and the corrected Iph values of grassland samples from most sites are greater than 0.45 in grassland samples and but remain less than 0.45 in the forest samples. And Iph values between 40% and 45% tend to correspond to grassland. Thus the frequencies of corrected soil phytolith indices are moderately consistent with actual plant richness and climatic changes. Overall, our findings provide new perspectives on the reliability of phytoliths for reconstructing climatic changes in the northern temperate region. 2020, Vol.40
2020, Vol.40

