河流作为连接陆地和海洋生态系统两大碳库的重要通道,成为全球碳循环研究的一个重要组成部分。虽然河流只占地表面积的0.58±0.06 %,但它们在全球碳循环中发挥了重要的作用[1~4]。通常,河流系统在全球碳循环中的主要作用是输送河流中总有机碳(TOC)和溶解无机碳(DIC)到海洋中,其通量高达0.9 Pg C/a[2],但近年来的研究表明河流系统存在显著的CO2脱气作用,其通量达到0.23~1.8 Pg C/a,且与大陆净碳累积(2.2 Pg C/a)相当[2~9],属于同一数量级,因此在IPCC第五次评估报告中已提出全球河流水-气界面CO2脱气是全球碳循环的重要组成部分,在全球碳收支评价中需要高度关注[10]。
自2002年关于全球和大区域河流水-气界面CO2脱气通量评估工作以来,其通量几乎都达到了Pg C/a的量级,可达1.8±0.25 Pg C/a[9]。因此,以往陆地生态系统的碳汇通量由于忽视了来自表层水体的碳流失,可能被显著地高估了[11~14],且如此大的CO2脱气通量无疑需要额外的汇来平衡,这也给目前面临的不明确“陆地剩余碳汇”带来更大的压力(在IPCC第五次气候评估报告中其值高达2.5 Pg C/a)[10],而忽视地质作用可能是已知大气CO2源汇不平衡的重要原因之一[15~18]。目前,全球碳循环模型因碳汇时间尺度问题仍然对地质作用碳汇效应(主要是岩石风化碳汇)有所忽视[19]。但研究发现碳酸盐岩风化与全球碳循环过程密切相关,其在年际、季节、昼夜以及降雨事件等时间尺度上都积极敏感地响应环境变化过程[20~23]。然而传统观点认为碳酸盐岩溶蚀过程不稳定,其消耗的大气CO2,又通过CO2脱气返回大气,存在一个源与汇的相互转化过程,最终并没有产生碳汇[24~25]。但是,Liu等[26~27]考虑水-岩-土-气-生相互作用的碳酸盐风化碳汇效应,结合水体中水生光合生物对DIC的利用,形成有机碳沉积,认为这一部分碳汇是稳定的,其碳汇量为0.233 Pg C/a。在实际碳汇评估中,这一部分碳汇我们不能忽视,且这一过程无疑与河流CO2脱气高度的动态变化相关。因此,岩溶水体水-气界面CO2脱气过程成为评估岩溶碳汇稳定性的关键。
由于岩溶区地表水体CO2交换强度和方向存在显著的时空变化特征[21, 23, 28~29],尤其是显著的昼夜变化[30~31],使其通量评估存在较大的不确定性。此外,虽然研究表明河流逸出CO2主要来自于年轻有机碳和地层沉积有机碳(干酪根)的分解[32~34]。但对美国Santa Fe岩溶河流的研究指出,河水逸出CO2上游以有机碳来源为主,下游以无机碳来源为主的空间变化特征[28],并非单一的无机碳或有机碳来源。在岩溶区,由于其“富碳”特征(无机碳),其逸出的CO2可能主要来自水体无机碳[35]。另外,由于水生光合生物的广泛参与,表层水体逸出CO2来源可能更为复杂,存在无机碳、大气碳及有机碳的共同影响[32~33, 36~37]。因此,河流逸出CO2的来源较为复杂。总之,岩溶区河流水气界面CO2交换研究存在着通量评估不准确、影响因素不确定以及来源复杂的问题,从而影响了岩溶碳汇效应的评价。目前关于岩溶地表水体水-气界面CO2交换的研究主要集中在对于表层岩溶泉水及其排泄后形成的地表溪流[23, 30]。对于决定碳酸盐岩风化产物(HCO3-,来自碳酸盐岩溶解和大气CO2)命运最终归宿(源或汇)的岩溶区大型河流,给予的关注较少。因此,准确评估岩溶区大型河流水气界面CO2交换强度和方向上的变化特征并深入探讨其控制机制,对于准确评价岩溶地质碳汇稳定性具有重要意义。
本研究以流经岩溶区的大型河流-桂江干流为研究对象,在不同地质背景区典型断面水-气界面CO2交换量高分辨率监测的基础之上,结合相应的大气环境参数、水化学参数以及碳同位素(Δ14C和δ13C)数据,分析水气界面CO2交换通量、变化过程及来源变化,进而探讨其控制机制及其对岩溶地质碳汇的影响。研究结果能够丰富西南岩溶区地表水体水气界面CO2交换的基础数据,同时也能为岩溶地质碳汇稳定性提供新的思路及数据支撑。
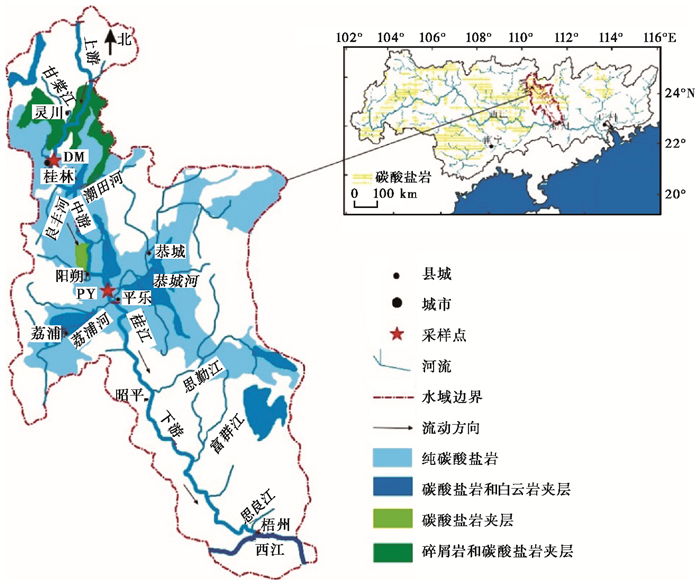
1 研究区及样品采集 1.1 研究区概况桂江流域是珠江流域西江水系支流(图 1),发源于广西壮族自治区兴安县西北部的越城岭主峰猫儿山,全长438km,流域面积18790km2,河道平均坡降0.43 ‰,多年平均径流深1033mm,多年平均径流量1.44×1010m3。桂江是自北向南流,因此上下游气候差异较大。桂江流域属于亚热带季风气候,雨热同期,下游梧州市附近年平均气温为21℃,上游桂林以上则只有18℃。流域内降水比较丰沛,多年平均降水量达1666mm。降水量年内分配极端不均,4~8月降水占全年的72.1 %,秋冬两季则较少。桂江年平均蒸发量在1100~1200mm之间,全年日照小时数从上游的1400h递增至下游的1800 h[38]。
|
图 1 研究区示意[39] Fig. 1 Location map of study site |
桂江上游河段称大溶江,主要为花岗岩、碎屑岩分布的非岩溶区;中游河段称漓江,以碳酸盐岩分布为主,其中以古生代石灰岩分布最广(表 1);平乐县以下为桂江流域下游,又称抚河,主要为砂岩分布的非岩溶区。桂江流域土壤主要有石灰土、水稻土、黄壤、红壤、赤红壤等,石灰土pH值呈微酸性至微碱性,持水能力差[38]。流域内植被类型比较复杂,有顶级乔木林、次生林、人工纯林、灌林地、灌丛、灌草丛和草丛等,岩溶分布区灌丛所占的比例最大。
| 表 1 桂江流域碳酸盐岩分布面积[38] Table 1 Carbonate distribution area in Guijiang basin |
在桂江干流选择位于岩溶区与非岩溶区交界的大面圩断面(DM,上游:25°20′59″N,110°19′21″E)和岩溶区的普益断面(PY,下游:24°40′37″N,110°35′59″E)(图 1),于2016年08月24日12:00时到2016年08月25日12:00时进行了24h连续的昼夜监测采样工作。现场使用YSI Prodass进行水温(T)、pH、电导率(Spc)、溶解氧(DO)的监测,精度分别为0.1℃、0.01 pH单位、0.5 %、0.1 %。现场利用真空泵每2h采集一次水样,并利用直径50mm的醋酸纤维脂膜(孔径为0.45μm)过滤。在现场通过0.05mmol/L的HCl标准液滴定50ml过滤水样的碱度,滴定终点为pH=4.2~4.4。取500ml过滤水样储存于高密度聚乙烯瓶中,用于阴离子测定。取过滤水样装于事先用1:1的HNO3溶液清洗过的50ml聚乙烯瓶中用于阳离子测定,并立即加入浓硝酸2~3滴,调节pH值<2。分别取30ml、100ml水样装于聚乙烯瓶中,并滴入饱和氯化汞,用于δ13CDIC和Δ14CDIC的测试。所有水样采集后立即放入便捷式冰箱保存,并于12h内运至室内4℃冷藏。同时利用之前在马弗炉450℃灼烧5h的0.7μm孔径的玻璃纤维膜过滤水样,然后保存在锡纸中用于颗粒有机碳的δ13C和Δ14C值的测试。
Cl-、NO3-、SO42-阴离子采用美国戴安公司ICS-900离子色谱仪分析,K+、Na+、Ca2+、Mg2+阳离子采用ICP-OES光谱仪分析(IRIS Intrepid Ⅱ XSP,Thermo Fisher Scientific,USA),测试精度为0.01mg/L。阴阳离子分析误差<5 %。δ13CDIC测试采用连有Gas Bench连续流进样器的MAT253同位素质谱仪,利用磷酸法测试水样溶解无机碳同位素组成(δ13CDIC以V-PDB标准给出),分析误差<0.15 ‰。颗粒有机碳(Particulate Organic Carbon,简称POC)膜采用MAT253气体同位素质谱仪双路测定(δ13CPOC以V-PDB标准给出),分析误差<0.2 ‰。以上测试工作均在中国地质科学院岩溶地质研究所自然资源部岩溶地质资源环境监督检测中心完成。相关样品的Δ14C值在中国科学院西安加速器质谱中心通过3 MV多核素分析加速器质谱仪(Xi'an-AMS)进行测量。此外,我们通过WATSPEC程序并利用水化学数据集来计算河水中的CO2分压(pCO2)和方解石饱和指数(SIc)[40]。
1.3 CO2交换通量监测方法通量箱法是目前河流水气界面CO2交换的最常用的监测方法之一,主要通过原位搜集一定空间范围内温室气体,分析其随时间的变化率(静态箱)或浓度差异(动态箱)来计算被罩界面待测气体的排放通量[41]。本文利用独立设计的浮游箱[42],通过Tygon管以闭合回路连接到美国PP Systems公司生产的EGM-5(非色散红外便携式CO2分析仪),空气通过EGM-5的内部泵进行循环,高分辨率的测试箱体内CO2浓度的变化(每分钟间隔,持续半个小时)。最后根据下述公式通过计算静态箱内气样浓度变化率来计算水-气界面的CO2交换通量,计算公式为[41]:
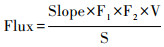
|
(1) |
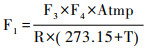
|
(2) |
公式(1)和(2)中,Flux为温室体通量mg/(m2·h),Slope为时间-浓度关系图中的斜率(10-6/min),F1为标准气压和温度下ppm转换为mg/m3的转换因子(mg/m3),F2为min和h的转换系数(60),V为浮游箱内套入的空气体积(m3),S为水上浮游箱的底面积(m2),F3是测量的CO2浓度(10-6),F4是CO2的摩尔质量(44 g/mol),Atmp是测量的大气压(KPa),R是气体常数8.314 J/(K ·mol),T是测量的气温(℃)。
2 结果与分析 2.1 河流CO2交换的昼夜变化监测期间,DM和PY断面水温的变化很小,其变异系数都<2 %,基本保持稳定。DM断面各参数包括风速、DO、pH、Spc、流速、DIC、SIc、pCO2都表现出显著的昼夜变化,其变异系数都>3.5 %。其中尤其以风速、DIC、SIc以及pCO2变化最为明显,其变异系数高达70 %以上。PY断面各参数除风速和水温外,都比DM断面变化小,但是也表现出显著的昼夜变化,例如风速、SIc以及pCO2的变异系数也达到24 %以上(表 2)。
| 表 2 DM和PY断面各参数变异系数 Table 2 Coefficients of variation at DM and PY transects |
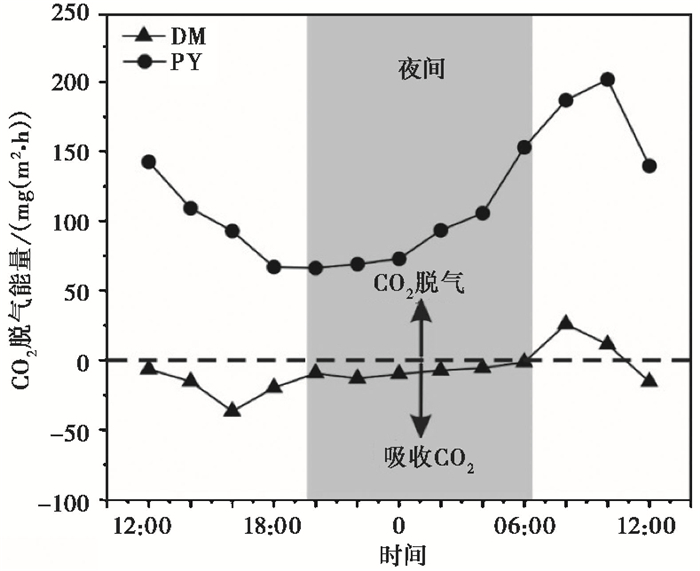
桂江干流两个断面(DM和PY)水气界面CO2交换表现出显著的昼夜变化特征(图 2)。DM断面CO2交换量范围为-36.58~25.92mg/(m2·h),其中最大值出现在上午(8:00时),而最小值出现在下午(16:00时)。而且,DM断面CO2脱气量在12:00~06:00时出现了显著的负通量现象(即吸收大气CO2)。PY断面CO2交换量范围为66.25~201.67mg/(m2·h),其中最大值出现在上午(10:00时),最小值出现在下午(18:00时)。PY断面CO2交换在监测期间都为CO2脱气,为大气CO2的源。总体而言,两个断面CO2交换量都在白天下降,到下午达到最小值,之后上升到次日上午达到最大值。结果显示,两个断面CO2交换量的昼夜变化趋势一致,可能受到相同的因素影响。计算表明,在昼夜时间尺度上,DM断面CO2交换量表现出负通量,为-205.42mg/(m2·d),为大气CO2的汇。相反,PY断面CO2交换量都表现出正通量,为3000.56mg/(m2·d),为大气CO2的源,这暗示控制两个断面CO2交换的机制可能并不一致。
|
图 2 DM和PY断面CO2交换量昼夜变化 Fig. 2 Diurnal variations of CO2 exchange flux at DM and PY transects |
河流水气界面CO2交换的强度和方向受控于水体和近水面大气中CO2的浓度梯度差[43]。研究发现水体pCO2受到气温和降雨的显著影响,并且暴雨会打断其昼夜变化的信号,从而影响CO2交换的变化[44~45]。因此,河流CO2交换的昼夜变化可能受到气温、降雨及极端暴雨等天气变化的影响。此外,由于风速影响CO2交换系数,进而可能影响CO2交换的变化[46]。研究期间,DM和PY断面并没有降雨,两个断面CO2交换量在监测期间都与气温、风速没有表现出相关性(表 3)。这些结果表明监测期间,大气环境因素对DM和PY断面水气界面CO2交换昼夜变化影响较小。
| 表 3 DM和PY断面CO2交换量与水化学参数相关性 Table 3 Correlation between CO2 exchange flux and hydrochemical parameters at DM and PY transects |
水温的昼夜变化将会改变气体的溶解度,即CO2溶解度随着水温的上升而下降[47]。因此,当水温上升时会引起过饱和水中CO2交换量上升。从表 3中可以看出DM和PY断面CO2交换量与水温表现出较好的负相关关系,与理论关系并不相符,且两个断面的水温表现出0.5~1.3℃较小的昼夜变化(表 2),因此,监测期间水温的昼夜变化对桂江水气界面CO2交换的昼夜变化影响较小。
水体中DO和CO2浓度直接受到水生植物、藻类及微生物的光合作用和呼吸作用的变化控制,并且pCO2的变化也会改变水体中的pH值[48]。两个断面的DO与pCO2都表现出强烈的负相关关系,且都与pH值表现出显著的正相关关系(表 3),反应出水生光合生物的光合作用和呼吸作用的控制。DM和PY断面的pCO2与pH表现出强烈的负相关关系(表 3),表明系统中主要酸为CO2的水合产物。呼吸作用引起的pCO2上升,增加了水体与大气之间的pCO2浓度梯度,从而增加CO2交换量,但是在白天当光合作用速率超过呼吸作用速率时,在河水中消耗足够多的CO2,使得大气CO2被河流直接吸收以补给水生光合生物的光合自养作用[30, 49]。DM和PY断面水体pCO2与CO2交换量表现出较强烈的正相关关系(表 3),说明水生光合生物的新陈代谢过程是河流CO2交换量昼夜变化的控制因素。
碳酸盐岩矿物的溶解与沉淀对水体pCO2的控制反应在水体的矿物饱和状态(SIc)[30, 50]。两个断面SIc在夜间逐渐下降,甚至在DM断面SIc逐渐小于0,但是两个断面夜间CO2交换量却表现出上升的趋势,表明碳酸盐岩的溶解对CO2交换的昼夜变化影响不大[50~51]。两个断面SIc在白天逐渐上升,在下午达到最大值,表明白天发生方解石沉淀和CO2脱气的潜力,但是CO2交换量在此阶段却表现出下降的趋势(图 2)。此外,DM和PY断面CO2交换量与SIc表现出负相关关系,也与理论关系相反,这些结果表明方解石溶解与沉淀对CO2交换量的昼夜变化影响不大。综上所述,两个断面CO2交换的昼夜变化受到水生光合生物新陈代谢过程的控制。
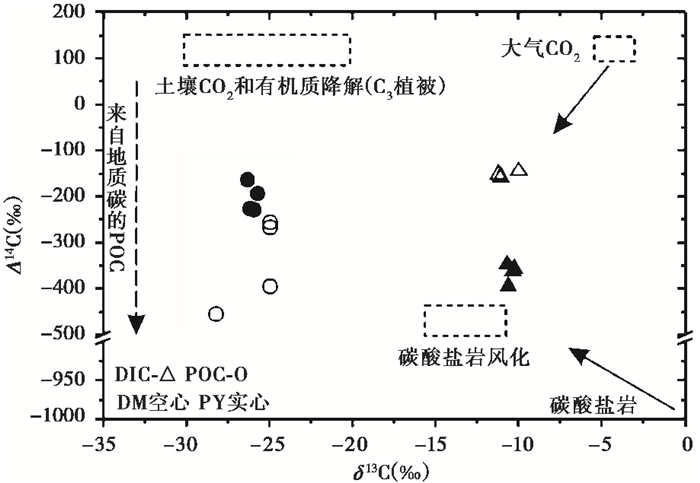
2.3 桂江干流碳同位素变化河流中CO2的主要来源有:1)大气CO2;2)有机质降解和土壤CO2;3)碳酸盐岩[37]。由于碳潜在的生物源、大气源以及地质源有着不同的碳同位素信号值[32~33],因此利用Δ14C和δ13C值来示踪河流CO2来源逐渐成为重要的手段。大气CO2与河水会发生交换,因此有可能构成河流DIC的一部分[37]。通常,大气CO2有偏正的Δ14C值(Δ14C≈80 ‰)[52],而且由于Δ14C值是经过分馏校正的,所以大气来源的水体DIC应该和大气CO2具有相同的Δ 14C值。研究区大气CO2的δ13C值为-12.98±0.89 ‰,通过对DIC(HCO3-、溶解CO2(CO2aq)及CO32-)的分馏计算[53~54],会产生7.22±0.03 ‰的分馏,因此,来自大气CO2的河流DIC的δ13C平均值为-4.60±0.91 ‰。我们将有机质降解和土壤呼吸合并为一个来源,即有机质降解来源。理论上,这个来源的年龄变化有一个范围很广的信号值,但是,目前的研究发现大多数来自有机碳库的土壤呼吸CO2有一个大于0 ‰的14C值[55~57],这可能与根系自养呼吸对土壤呼吸通量的巨大贡献有关[58]。土壤呼吸CO2的δ13C值可以反应有机质源的δ13C值,桂江流域C3植被发育,其土壤CO2的δ13C值范围为-29.35 ‰~-18.26 ‰,平均值为-24.26 ‰[59]。土壤CO2溶解于土壤水或地下水中,在10~30℃条件下会发生约-1.2 ‰的分馏,因此,其δ13C值约为-30.6 ‰~-19.5 ‰,平均值为-25.5 ‰。此外,碳酸盐岩来源的δ13C值约为0 ‰,而其放射性碳一般为“死碳”,其Δ14C约为-1000 ‰。在碳酸盐岩风化中,几乎等量的来自碳酸盐岩(Δ14C=-1000 ‰,δ13C≈0 ‰)和土壤/大气CO2贡献于河流DIC,因此,产生的DIC将会具有两者中间的δ13C和Δ14C值[37],其δ13C值约为-12.7 ‰[60],而Δ14C值通常比较偏负[36]。
如图 3所示,DM和PY断面δ13CDIC平均值分别为-11.02±0.67 ‰和-10.43±0.17 ‰,接近碳酸盐岩风化的理论值(-12.7 ‰),且两个断面Δ14CDIC值比较偏负,尤其是PY断面,约为-366.7±18.9 ‰,明显受到碳酸盐岩风化的影响。通常,大气交换会注入富集14C的大气CO2,将会驱动DIC趋向富集14C值[61]。DM断面Δ14CDIC值约为-151.6±5.9 ‰,且其δ13CDIC平均值稍稍大于碳酸盐岩风化的理论值,说明DM断面受到大气CO2端元来源的影响。这些结果也与DM断面发生了吸收大气CO2的现象相吻合。当然,硅酸盐岩风化也会使得Δ14CDIC值增大,但研究表明桂江(桂林)河段,硅酸盐岩风化仅占总HCO3-的2.8 %左右[62],因此其影响可以忽略。
|
图 3 DM和PY断面DIC和POC的δ13C和Δ14C值变化图[33] Fig. 3 Variations in δ13C and Δ14C values of DIC and POC at the DM and PY transects |
通常,河流POC偏负的14C值来自深层土壤和沉积岩侵蚀的老碳[36]。DM和PY断面Δ14CPOC值平均值分别为-342.52±97.81 ‰和-205.0±27.03 ‰,都比较偏负。DM断面Δ14CPOC值要明显偏小于PY断面,但是两者δ13CPOC值相差不大,都在桂江土壤CO2端元值范围内(-26.08 ‰和-25.80 ‰),可能是由于上游DM断面POC更多来源于偏古老的地质碳,而PY断面则受到来源于与当代大气CO2交换的植物残体和土壤腐殖质的有机质的影响[63]。但是,如果下游PY断面受到上述来源的影响,则其Δ14CPOC值无疑会受到当代大气CO2端元的影响显著偏正,也与其实际结果不符。Raymond等[36]表明在碳酸盐岩风化为主的流域,如果有机碳(OC)主要从通过河流自养作用的DIC转化,那么应该以DIC和OC偏负的Δ14C值主导。PY断面Δ14CPOC值和Δ14CDIC值相对于大气CO2端元都显著偏负,且PY断面δ13CDIC稍稍大于碳酸盐岩风化的理论值,但PY断面以CO2脱气为主,大气CO2端元的影响较小[64]。此外,河流系统中的有机质自身也会降解为DIC,并因此取代河流中DIC的Δ14C值和δ13C值信号[65]。如图 3所示,虽然PY断面Δ14CPOC值要大于Δ14CDIC值,但河流有机质降解明显会降低δ13CDIC值,明显与其δ13CDIC值增大不符,因此这个因素也可以忽略。桂江流域土壤CO2主要参与了碳酸盐岩风化过程[62],因此其直接溶解与硅酸盐岩风化的影响较小,可以忽略不计。因此,很可能是由于水生植物的光合作用利用DIC,使得δ13CDIC值相对于碳酸盐岩风化的δ13CDIC值偏重,同时使得其Δ14CPOC值偏轻。水生植物利用了来自岩溶作用的DIC而形成了偏负的Δ14CPOC值,这与之前的研究发现碳酸盐岩主导的河流输送的POC和DIC的Δ14C值偏负的结果一致[66],说是明岩溶水的汇入控制了PY断面的碳循环过程。此外,也有研究表明桂江河水中的DIC明显被浮游植物的光合作用所利用,浮游植物初级生产力对POC的贡献达22.3 %~30.9 %,平均值为25.1 % [60]。总之,从DM断面向下游PY断面的过程中,碳酸盐岩风化的影响显著增强,同时,进入下游后河流流速趋缓,地势平坦,加之富碳的岩溶水也为水生植物提供了丰富的碳源,影响了河流POC的变化[60],也改变了河流CO2交换的方向。
2.4 岩溶碳汇通量利用水化学-径流法来计算岩溶作用过程中的碳通量F是常用方法,其计算公式如下[67]:
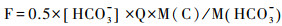
|
(3) |
公式(3)中,F为流域碳通量,[HCO3-]为监测断面HCO3-浓度(mg/L),Q为监测断面流量(m3/s),M(C)和M(HCO3-)分别是C和HCO3-的摩尔分子量。
传统观点认为碳酸盐岩风化消耗的CO2最终会由于碳酸盐岩的沉积再次释放回大气,因而并没有产生碳汇[24~25],因此,需要扣除流域范围内来自碳酸盐岩端元的CO2脱气量。研究表明,桂江岩溶区硅酸盐岩风化对于流域内HCO3-的贡献范围为2.02 %~3.68 %,平均约为2.77 %[62],因此,需要扣除硅酸盐岩风化的贡献。此外,通过上述分析表明,PY断面CO2明显受到碳酸盐岩端元的影响,因此在下文计算中,我们假设DM断面到PY断面河段CO2脱气都来源于碳酸盐岩风化,以此来计算其可能形成最少的岩溶碳汇。同时在计算一个流域的净碳汇时需要扣除输入的碳通量,具体计算为:
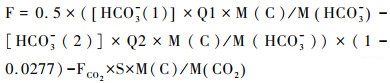
|
(4) |
公式(4)中,F为DM到PY断面的桂江干流可能形成的最低岩溶碳汇通量(t/d),[HCO3-(1)]和[HCO3-(2)]分别为PY和DM断面监测的HCO3-浓度(mg/L),Q1和Q2分别为PY和DM断面监测当天平均流量(m3/s),M(C)、M(CO2)、M(HCO3-)分别是C、CO2以及HCO3-的摩尔分子量(12、44和61),FCO2为DM到PY断面水气界面CO2脱气量(kg/d),S为DM到PY断面的河流面积(m2,DM到PY断面的河流面积约为20.3×106m2)。
经计算得到DM到PY断面桂江干流水气界面CO2脱气量为14.1tC/d,硅酸盐岩风化碳汇通量为7.1t C/d,碳酸盐岩风化碳汇通量为249.95t C/d。CO2脱气量仅占碳酸盐岩风化碳汇量的5.6 %,结果与一些碳酸盐岩河流如长江和Santa Fe河相似[28, 68],在报告的亚热带和温带河流系统中属于偏低的水平[69~70]。总之,虽然监测期间,桂江干流进入岩溶区以后发生了CO2脱气现象,但是在显著的水生生物代谢过程的控制下,限制了河流水气界面的CO2脱气,形成了可观的碳汇通量,达到249.95t C/d,约为0.089TgC/a。
3 结论河流水气界面碳循环是全球碳循环的重要组成部分之一,深入探讨其变化过程无疑对全球碳循环和气候变化具有重要意义。本文利用浮游箱法获取河流水气界面高分辨率的CO2脱气量,结合相应的水文地球化学和同位素数据探讨岩溶区河流水气界面CO2交换的昼夜变化过程。结论如下:
(1) DM断面CO2交换量范围为-36.58~25.92mg/(m2·h),全天为-205.42mg/m2,是大气CO2的汇;相反,PY断面CO2交换量范围为66.25~201.67mg/(m2·h),全天为3000.56mg/ m2,为大气CO2的源。两个断面水气界面CO2交换都发生了显著的白天下降夜间上升的昼夜变化模式,且都受到水生植物代谢过程的控制。
(2) DM断面δ13CDIC和Δ14CDIC平均值分别为-11.02±0.67 ‰和-151.6±5.9 ‰,明显处于碳酸盐岩和大气CO2端元特征值之间,受到两个来源的影响,加之水生植物代谢过程的影响,从而出现了吸收大气CO2的现象。但PY断面Δ14CDIC值(-366.7± 18.9 ‰)更偏负,而δ13CDIC则偏正(-10.43±0.17 ‰),都非常接近碳酸盐岩端元的特征值,说明碳酸盐岩是主要的来源。此外,随着下游碳酸盐岩风化作用显著增强,为水生植物的生长提供了丰富的碳源,水生植物利用岩溶作用的DIC形成偏负的Δ14CPOC值(-205.0±27.03 ‰),从而影响了河流POC的变化,出现了CO2脱气现象。总之,碳来源的变化显著影响了河流CO2交换方向的变化。
(3) 虽然进入岩溶区河段后发生了显著的CO2脱气过程,但是由于河流水生代谢过程限制了河流水气界面的CO2脱气,使得河流CO2脱气量仅占碳酸盐岩风化碳汇量的5.6 %,在亚热带和温带河流系统中属于偏低的水平,从而形成了249.95t/d可观的碳汇通量,约为0.089TgC/a。
致谢: 感谢审稿专家和编辑部杨美芳老师提出的宝贵修改意见!
| [1] |
Allen G H, Pavelsky T M. Global extent of rivers and streams[J]. Science, 2018, 361(6402): 585-588. DOI:10.1126/science.aat0636 |
| [2] |
Cole J J, Prairie Y T, Caraco N F, et al. Plumbing the global carbon cycle:Integrating inland waters into the terrestrial carbon budget[J]. Ecosystems, 2007, 10(1): 172-185. DOI:10.1007/s10021-006-9013-8 |
| [3] |
Butman D, Raymond P A. Significant efflux of carbon dioxide from streams and rivers in the United States[J]. Nature Geoscience, 2011, 4(12): 839-842. DOI:10.1038/ngeo1294 |
| [4] |
Aufdenkampe A K, Mayorga E, Raymond P A, et al. Riverine coupling of biogeochemical cycles between land, oceans, and atmosphere[J]. Frontiers in Ecology and the Environment, 2011, 9(1): 53-60. DOI:10.1890/100014 |
| [5] |
Richey J E, Melack J M, Aufdenkampe A K, et al. Outgassing from Amazonian rivers and wetlands as a large tropical source of atmospheric CO2[J]. Nature, 2002, 416(6881): 617-620. DOI:10.1038/416617a |
| [6] |
Tranvik L J, Downing J A, Cotner J B, et al. Lakes and reservoirs as regulators of carbon cycling and climate[J]. Limnology and Oceanography, 2009, 54(6): 2298-2314. |
| [7] |
Regnier P, Friedlingstein P, Ciais P, et al. Anthropogenic perturbation of the carbon fluxes from land to ocean[J]. Nature Geoscience, 2013, 6(8): 597-607. DOI:10.1038/ngeo1830 |
| [8] |
Borges A V, Darchambeau F, Teodoru C R, et al. Globally significant greenhouse-gas emissions from African inland waters[J]. Nature Geoscience, 2015, 8(8): 637-642. DOI:10.1038/ngeo2486 |
| [9] |
Raymond P A, Hartmann J, Lauerwald R, et al. Global carbon dioxide emissions from inland waters[J]. Nature, 2013, 503(7476): 355-359. DOI:10.1038/nature12760 |
| [10] |
Ciais P, Sabine C, Bala G, et al. Carbon and other biogeochemical cycles[R]//Stocker T F, Qin D, Plattner G-K, et al. eds. Climate Change 2013: The Physical Science Basis. Contribution of Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York, NY, USA: Cambridge University Press, 2013: 465-570. 10.13140/2.1.1081.8883
|
| [11] |
Kling G W, Kipphut G W, Miller M C. The flux of CO2 and CH4 from lakes and rivers in Arctic Alaska[J]. Hydrobiologia, 1992, 240(1): 23-36. |
| [12] |
Waddington J M, Roulet N T. Atmosphere-wetland carbon exchanges:Scale dependency of CO2 and CH4 exchange on the developmental topography of a peatland[J]. Global Biogeochemical Cycles, 1996, 10(2): 233-245. DOI:10.1029/95GB03871 |
| [13] |
Hope D, Palmer S M, Billett M F, et al. Carbon dioxide and methane evasion from a temperate peatland stream[J]. Limnology and Oceanography, 2001, 46(4): 847-857. DOI:10.4319/lo.2001.46.4.0847 |
| [14] |
Billett M F, Palmer S M, Hope D, et al. Linking land-atmosphere-stream carbon fluxes in a lowland peatland system[J]. Global Biogeochemical Cycles, 2004, 18(1): GB1024. DOI:10.1029/2003gb002058 |
| [15] |
Yuan D. The carbon cycle in karst[J]. Zeitschrift für Geomorphologie Neue Folge, 1997, 108(Suppl-Bd): 91-102. |
| [16] |
徐胜友, 蒋忠诚. 我国岩溶作用与大气温室气体CO2源汇关系的初步估算[J]. 科学通报, 1997, 42(9): 953-956. Xu Shengyou, Jiang Zhongcheng. Preliminary estimation of the source and sink relationship between karst and atmospheric CO2 in China[J]. Chinese Science Bulletin, 1997, 42(9): 953-956. DOI:10.3321/j.issn:0023-074X.1997.09.019 |
| [17] |
刘再华. 大气CO2两个重要的汇[J]. 科学通报, 2001, 45(21): 2348-2351. Liu Zaihua. Two important sinks of atmospheric CO2[J]. Chinese Science Bulletin, 2001, 45(21): 2348-2351. |
| [18] |
刘再华, Dreybrodt W, 王海静. 一种由全球水循环产生的可能重要的CO2汇[J]. 科学通报, 2007, 52(20): 2418-2422. Liu Zaihua, Dreybrodt W, Wang Haijing. A possible important CO2 sink by the global water cycle[J]. Chinese Science Bulletin, 2007, 52(20): 2418-2422. DOI:10.3321/j.issn:0023-074x.2007.20.013 |
| [19] |
蒲俊兵, 蒋忠诚, 袁道先, 等. 岩石风化碳汇研究进展:基于IPCC第五次气候变化评估报告的分析[J]. 地球科学进展, 2015, 30(10): 1081-1090. Pu Junbing, Jiang Zhongcheng, Yuan Daoxian, et al. Some opinions on rock-weathering-related carbon sinks from the IPCC fifth assessment report[J]. Advances in Earth Science, 2015, 30(10): 1081-1090. |
| [20] |
Liu Z, Zhao J. Contribution of carbonate rock weathering to the atmospheric CO2 sink[J]. Environmental Geology, 2000, 39(9): 1053-1058. DOI:10.1007/s002549900072 |
| [21] |
Liu Z, Li Q, Sun H, et al. Seasonal, diurnal and storm-scale hydrochemical variations of typical epikarst springs in subtropical karst areas of SW China:Soil CO2 and dilution effects[J]. Journal of Hydrology, 2007, 337(1-2): 207-223. DOI:10.1016/j.jhydrol.2007.01.034 |
| [22] |
White W B. Carbon fluxes in karst aquifers:Sources, sinks, and the effect of storm flow[J]. Acta Carsologica, 2013, 42(2-3): 177-186. DOI:10.3986/ac.v42i2-3.659 |
| [23] |
Pu J, Li J, Khadka M B, et al. In-stream metabolism and atmospheric carbon sequestration in a groundwater-fed karst stream[J]. Science of the Total Environment, 2017, 579: 1343-1355. DOI:10.1016/j.scitotenv.2016.11.132 |
| [24] |
Berner E K, Berner R A. The Global Water Cycle; Geochemistry and Environment[M]. New Jersey: Englewood Cliffs, Prentice-Hall, 1987: 1-397.
|
| [25] |
Berner R A. A model for atmospheric CO2 over phanerozoic time[J]. American Journal of Science, 1991, 291(2): 339-376. |
| [26] |
Liu Z, Dreybrodt W, Wang H. A new direction in effective accounting for the atmospheric CO2 budget:Considering the combined action of carbonate dissolution, the global water cycle and photosynthetic uptake of DIC by aquatic organisms[J]. Earth-Science Reviews, 2010, 99: 162-172. DOI:10.1016/j.earscirev.2010.03.001 |
| [27] |
刘再华. 岩石风化碳汇研究的最新进展和展望[J]. 科学通报, 2012, 57(2-3): 95-102. Liu Zaihua. New progress and prospects in the study of rock-weathering-related carbon sinks[J]. Chinese Science Bulletin, 2012, 57(2-3): 95-102. |
| [28] |
Khadka M B, Martin J B, Jin J. Transport of dissolved carbon and CO2 degassing from a river system in a mixed silicate and carbonate catchment[J]. Journal of Hydrology, 2014, 513: 391-402. DOI:10.1016/j.jhydrol.2014.03.070 |
| [29] |
Liu Z, Dreybrodt W. Significance of the carbon sink produced by H2O-carbonate-CO2-aquatic phototroph interaction on land[J]. Science Bulletin, 2015, 60(2): 182-191. DOI:10.1007/s11434-014-0682-y |
| [30] |
Liu H, Liu Z, Macpherson G L, et al. Diurnal hydrochemical variations in a karst spring and two ponds, Maolan Karst Experimental Site, China:Biological pump effects[J]. Journal of Hydrology, 2015, 522(1): 407-417. DOI:10.1016/j.jhydrol.2015.01.011 |
| [31] |
Zhang T, Li J, Pu J, et al. River sequesters atmospheric carbon and limits the CO2 degassing in karst area, Southwest China[J]. Science of the Total Environment, 2017, 609: 92-101. DOI:10.1016/j.scitotenv.2017.07.143 |
| [32] |
Raymond P. The age of the Amazon's breath[J]. Nature, 2005, 436(7050): 469-470. DOI:10.1038/436469a |
| [33] |
Mayorga E, Aufdenkampe A K, Masiello C A, et al. Young organic matter as a source of carbon dioxide outgassing from Amazonian rivers[J]. Nature, 2005, 436(7050): 538-541. DOI:10.1038/nature03880 |
| [34] |
Masiello C A, Druffel E R M. Carbon isotope geochemistry of the Santa Clara River[J]. Global Biogeochemical Cycles, 2001, 15(2): 407-416. DOI:10.1029/2000GB001290 |
| [35] |
Wang S, Yeager K M, Wan G. Carbon export and HCO3- fate in carbonate catchments:A case study in the karst plateau of Southwestern China[J]. Applied Geochemistry, 2012, 27(1): 64-72. |
| [36] |
Raymond P A, Bauer J E, Caraco N F, et al. Controls on the variability of organic matter and dissolved inorganic carbon ages in northeast US rivers[J]. Marine Chemistry, 2004, 92(1): 353-366. |
| [37] |
Zeng F W, Masiello C A. Sources of CO2 evasion from two subtropical rivers in North America[J]. Biogeochemistry, 2010, 100(1): 211-225. |
| [38] |
张红波.桂江流域水化学与岩溶碳汇动态变化特征[D].重庆: 西南大学硕士学位论文, 2013: 13. Zhang Hongbo. Water Chemistry and Characteristics of Dynamic Changes of Carbon Sinks in Guijiang Basin[D]. Chongqing: The Maeter's Dissertation of Graduate School of Southwest University, 2013: 13. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201302&filename=1013265450.nh&v=MDY2MjBlWDFMdXhZUzdEaDFUM3FUcldNMUZyQ1VSN3FmWU9WdkZ5amtWNy9PVkYyNkhiRytHOVhKcjVFYlBJUjg= |
| [39] |
Sun H, Han J, Zhang S, et al. Carbon isotopic evidence for transformation of DIC to POC in the lower Xijiang River, SE China[J]. Quaternary International, 2015, 380: 288-296. DOI:10.1016/j.quaint.2015.01.018 |
| [40] |
Wigley T M L. WATSPEC:A Computer Program for Determining Equilibrium Speciation of Aqueous Solutions[M]. Norwich, England: Geo-Abstracts for the British Geomorphological Research Group, 1977: 1-49.
|
| [41] |
UNESCO/IHAGHG. Greenhouse Gas Emissions Related to Freshwater Reservoirs[R]. World Bank Report, 2010: 64-127.
|
| [42] |
刘文, 蒲俊兵, 章程.一种便携式水陆两用温室气体采集设备[P].中国专利, ZL 201420363633.4. Liu Wen, Pu Junbing, Zhang Cheng. A Portable Greenhouse Gas Collection Equipment in Water and Land Dual-use[P]. China Patent, 2014. ZL 201420363633.4. http://cprs.patentstar.com.cn/Search/Detail?ANE=8BFA4CCA9AIA9DEC6DCA9HCA9CIE5EAA9EDF9BDD9BCC9GDF |
| [43] |
Hoffer-French K J, Herman J S. Evaluation of hydrological and biological influences on CO2 fluxes from a karst stream[J]. Journal of Hydrology, 1989, 108(1): 189-212. |
| [44] |
Yao G R, Gao Q Z, Wang Z G, et al. Dynamics of CO2 partial pressure and CO2 outgassing in the lower reaches of the Xijiang River, a subtropical monsoon river in China[J]. Science of the Total Environment, 2007, 376(1-3): 255-266. DOI:10.1016/j.scitotenv.2007.01.080 |
| [45] |
Peter H, Singer G A, Preiler C, et al. Scales and drivers of temporal pCO2 dynamics in an Alpine stream[J]. Journal of Geophysical Research, 2014, 119(6): 1078-1091. DOI:10.1002/2013JG002552 |
| [46] |
Li S Y, Lu X X, Bush R T. CO2 partial pressure and CO2 emission in the lower Mekong River[J]. Journal of Hydrology, 2013, 504: 40-56. DOI:10.1016/j.jhydrol.2013.09.024 |
| [47] |
Drysdale R, Lucas S, Carthew K. The influence of diurnal temperatures on the hydrochemistry of a tufa-depositing stream[J]. Hydrological Processes, 2003, 17(17): 3421-3441. DOI:10.1002/hyp.1301 |
| [48] |
Doctor D H, Kendall C, Sebestyen S D, et al. Carbon isotope fractionation of dissolved inorganic carbon(DIC)due to outgassing of carbon dioxide from a headwater stream[J]. Hydrological Processes, 2008, 22(14): 2410-2423. DOI:10.1002/hyp.6833 |
| [49] |
Carpenter S R, Cole J J, Hodgson J R, et al. Trophic cascades, nutrients, and lake productivity:Whole-lake experiments[J]. Ecological Monographs, 2001, 71(2): 163-186. DOI:10.1890/0012-9615(2001)071[0163:TCNALP]2.0.CO;2 |
| [50] |
de Montety V, Martin J B, Cohen M J, et al. Influence of diel biogeochemical cycles on carbonate equilibrium in a karst river[J]. Chemical Geology, 2011, 283(1): 31-43. |
| [51] |
Kurz M J, de Montety V, Martin J B, et al. Controls on diel metal cycles in a biologically productive carbonate-dominated river[J]. Chemical Geology, 2011, 358: 61-74. DOI:10.1016/j.chemgeo.2013.08.042 |
| [52] |
Mook W G, Bommerso J, Staverma W. Carbon isotope fractionation between dissolved bicarbonate and gaseous carbon dioxide[J]. Earth and Planetary Science Letters, 1974, 22(2): 169-176. |
| [53] |
Plummer L N, Busenberg E. The solubilities of calcite, aragonite and vaterite in CO2-H2O solutions between 0 and 90 ℃, and an evaluation of the aqueous model for the system CaCO3-CO2-H2O[J]. Geochimica et Cosmochimica Acta, 1982, 46(6): 1011-1040. DOI:10.1016/0016-7037(82)90056-4 |
| [54] |
Zhang J, Quay P D, Wilbur D O. Carbon isotope fractionation during gas-water exchange and dissolution of CO2[J]. Geochimica et Cosmochimica Acta, 1995, 59(1): 107-114. DOI:10.1016/0016-7037(95)91550-D |
| [55] |
Keller C K, Bacon D H. Soil respiration and georespiration distinguished by transport analyses of vadose CO2, 13CO2, and 14CO2[J]. Global Biogeochemical Cycles, 1998, 12(2): 361-372. DOI:10.1029/98GB00742 |
| [56] |
Trumbore S. Age of soil organic matter and soil respiration:Radiocarbon constraints on belowground C dynamics[J]. Ecological Applications, 2000, 10(2): 399-411. DOI:10.1890/1051-0761(2000)010[0399:AOSOMA]2.0.CO;2 |
| [57] |
Torn M S, Lapenis A G, Timofeev A, et al. Organic carbon and carbon isotopes in modern and 100-year-old-soil archives of the Russian steppe[J]. Global Change Biology, 2002, 8(10): 941-953. DOI:10.1046/j.1365-2486.2002.00477.x |
| [58] |
Schlesinger W H, Andrews J A. Soil respiration and the global carbon cycle[J]. Biogeochemistry, 2000, 48(1): 7-20. DOI:10.1023/A:1006247623877 |
| [59] |
曹建华, 周莉, 杨慧, 等. 桂林毛村岩溶区与碎屑岩区林下土壤碳迁移对比及岩溶碳汇效应研究[J]. 第四纪研究, 2011, 31(3): 431-437. Cao Jianhua, Zhou Li, Yang Hui, et al. Comparison of carbon transfer between forest soils in karst and clasolite areas and the karst carbon sink effect in Maocun village of Guilin[J]. Quaternary Sciences, 2011, 31(3): 431-437. |
| [60] |
唐文魁, 陶贞, 高全洲, 等. 桂江主要离子及溶解无机碳的生物地球化学过程[J]. 环境科学, 2014, 35(6): 2099-2107. Tang WenKui, Tao Zhen, Gao Quanzhou, et al. Biogeochemical processes of the major ions and dissolved inorganic carbon in the Guijiang River[J]. Environmental Science, 2014, 35(6): 2099-2107. |
| [61] |
Raymond P A, Hopkinson C S. Ecosystem modulation of dissolved carbon age in a temperate marsh-dominated estuary[J]. Ecosystems, 2003, 6(7): 694-705. DOI:10.1007/s10021-002-0213-6 |
| [62] |
Sun P A, He S Y, Yuan Y Q, et al. Effects of aquatic phototrophs on seasonal hydrochemical, inorganic, and organic carbon variations in a typical karst basin, Southwest China[J]. Environmental Science and Pollution Research, 2019, 26(32): 1-16. DOI:10.1007/s11356-019-06374-6 |
| [63] |
Kao S J, Liu K K. Particulate organic carbon export from a subtropical mountainous river(Langyang Hsi)in Taiwan[J]. Limnology and Oceanography, 1996, 41(8): 1749-1757. DOI:10.4319/lo.1996.41.8.1749 |
| [64] |
Palmer S, Hope D, Billett M, et al. Sources of organic and inorganic carbon in a headwater stream:Evidence from carbon isotope studies[J]. Biogeochemistry, 2001, 52(3): 321-338. DOI:10.1023/A:1006447706565 |
| [65] |
Raymond P A, Bauer J E, Cole J J. Atmospheric CO2 evasion, dissolved inorganic carbon production, and net heterotrophy in the York River estuary[J]. Limnology and Oceanography, 2000, 45(8): 1707-1717. DOI:10.4319/lo.2000.45.8.1707 |
| [66] |
Liu Z, Zhao M, Sun H, et al. "Old" carbon entering the South China Sea from the carbonate-rich Pearl River Basin:Coupled action of carbonate weathering and aquatic photosynthesis[J]. Applied Geochemistry, 2017, 78: 96-104. DOI:10.1016/j.apgeochem.2016.12.014 |
| [67] |
张兴波, 蒋勇军, 邱述兰, 等. 农业活动对岩溶作用碳汇的影响:以重庆青木关地下河流域为例[J]. 地球科学进展, 2012, 27(4): 466-476. Zhang Xingbo, Jiang Yongjun, Qiu Shulan, et al. Agricultural activities and carbon cycling in karst areas in Southwest China:Dissolving carbonate rocks and CO2 sink[J]. Advances in Earth Science, 2012, 27(4): 466-476. |
| [68] |
Zai W, Dai M, Guo X. Carbonate system and CO2 degassing fluxes in the inner estuary of Changjiang(Yangtze)River, China[J]. Marine Chemistry, 2007, 107(3): 342-356. DOI:10.1016/j.marchem.2007.02.011 |
| [69] |
Telmer K, Veizer J. Carbon fluxes, pCO2 and substrate weathering in a large northern river basin, Canada:Carbon isotope perspectives[J]. Chemical Geology, 1999, 159(1): 61-86. |
| [70] |
Polsenaere P, Savoye N, Etcheber H, et al. Export and degassing of terrestrial carbon through watercourses draining a temperate podzolized catchment[J]. Aquatic Sciences, 2012, 75(2): 299-319. |
Abstract
The Guijiang River (GJR) is the first order tributary of the Pearl River, which originates from Mao'ershan Mountain at an elevation of 2142 m. The river is 438 km long and drains an area of 18790 km2. The regional climate is dominated by the East Asian Monsoon, which is characterized by a cold-dry winter from late November through March and a hot-rainy summer from April through October. The annual average temperature is about 20℃ in the GJR catchment from south to north, and has significant spatial differences. Carbonate rock (mainly of limestone) outcrops account for about 51% of the GJR drainage basin, most of which occur in the upper and middle parts of the drainage basin. We chose two typical transects for carrying out high-resolution diel monitoring and sampling during August 24 and 25, 2016, which represents two rock types in the GJR catchment:The upstream site, DM (25°20'59″N, 110°19'21″E) is located at the upstream edge of the middle reach and underlain by carbonate and siliciclastic rock. The downstream site, PY (24°40'37″N, 110°35'59″E) is located at the downstream edge of the middle reach and is underlain by pure carbonate rocks. Here, we measured CO2 fluxes across the air-water interface at both DM and PY sections by floating chamber designed independently, and combined the corresponding atmospheric environmental parameters (air temperature and wind speed), hydrochemical parameters (water temperature, pH, DO and dissolved inorganic carbon (DIC)) and carbon isotopes (Δ14C and δ13C) of particulate organic carbon (POC) and DIC to assess variations, sources and controlling mechanism on intensity and direction of CO2 exchange. The results showed that the intensity of CO2 exchange across the water-air interface displayed similar diurnal pattern of decreasing in daytime and increasing at night at the two sections in the main stream of the Guijiang River, which is controlled by metabolism process of sub-aquatic community. The average δ13CDIC and Δ14CDIC value were -11.02±0.67 ‰ and -151.6±5.9 ‰ at DM, respectively, which implies that the DIC was affected by the carbonate weathering and atmospheric CO2 and resulting in absorption of atmospheric CO2. However, a more negative mean value of Δ14CDIC (-366.7±18.9 ‰) and a more positive mean value of δ13CDIC (-10.43±0.17 ‰) occurred at PY, indicating that the carbonate rocks weathering increases significantly. Additionally, aquatic plants utilized the DIC from karst processes to form a negative Δ14CPOC value indicating that the carbonate rocks weathering provided abundant carbon sources for the growth of aquatic plants to affect the sources of POC in the river, and changing the direction of CO2 exchange. Therefore, the variations of CO2 exchange intensity and direction were jointly controlled by the internal process of metabolism of sub-aquatic community and the external carbon sources. In conclusion, due to the strong aquatic metabolic processes under different geological feature in the main stream of Guijiang River, the research transections did not only directly absorb atmospheric CO2 at some time, but also further limit CO2 degassing, which resulted in a considerable carbon sink flux of 249.95 t/d, about 0.089 Tg C/a. 2020, Vol.40
2020, Vol.40

