2 中国地质大学(武汉)地理与信息工程学院, 湖北 武汉 430074)
岩溶关键带是地球各圈层相互作用的复杂交互带[1]。石笋作为岩溶关键带中多圈层相互作用的产物,保存着大量的古气候信息,是目前高分辨率古气候研究的重要载体之一。石笋具有纹层清晰、生长连续不受干扰、全球分布的特点,可以通过U/Th同位素及纹层计数方法精确定年,且石笋氧同位素组成通常继承雨水同位素变化,可在一定程度上反映区域降水的变化历史[2~4]。因此,石笋在全球季风系统的形成、演化规律及驱动机制的研究中发挥着重要作用。例如,Wang等[5]通过研究中国南京葫芦洞,发现其石笋氧同位素记录与格陵兰冰芯氧同位素记录相似;Zhang等[6]利用石笋氧同位素记录及微量元素揭示了末次冰消期东亚夏季风较弱时我国中东部变湿的内在原因;Zhu等[7]发现石笋中反映土壤来源的软磁组分通量记录了过去9000年以来的区域水文事件,尤其是暴雨事件;Xie等[8]从石笋中提取出生物标志物,发现短链/长链的正构脂肪醇的比值与亚热带表层海水温度(20~10kaB.P.)吻合。可见,无论是同位素、微量元素还是岩石磁学、生物标志化合物,石笋中多种代用指标均在古气候和古环境重建中显示出了一定的潜力。
在诸多指标中,来自于微生物的甘油二烷基甘油四醚(GDGTs)化合物近年来也开始在石笋古气候重建中被逐渐关注。GDGTs广泛存在于各种地质环境中,且结构相对稳定,不易降解,是当前古气候和古环境重建的重要工具[8~12]。对全球范围内的海洋和湖泊沉积物、土壤等载体中GDGTs研究表明,GDGTs可以灵敏的响应环境变化,基于GDGTs建立起的一系列代用指标具有应用于古气候、古环境重建的潜力[13~18]。古菌类异戊二烯型GDGTs(isoGDGTs)的四醚指数TEX86在早期的研究中被发现与表层海水温度具有较好的相关性[19],可以用于重建表层海水温度。基于细菌支链GDGTs(branched GDGTs,简称brGDGTs)的甲基化指数(Methylation of Branched Tetraethers,简称MBT)和环化指数(Cyclization of Branched Tetraethers,简称CBT)分别表征细菌brGDGTs的甲基和五元环的相对数量,其中MBT主要受控于年均温(MAT)和土壤pH,而CBT只与pH相关,从而建立了MBT/CBT与温度、CBT与pH之间的线性相关关系[20],用以重建陆地的温度和pH变化[21]。
目前,GDGTs化合物在喀斯特洞穴中也被广泛发现[22],并已经被用作气候变化重建的代用指标[23]。Yang等[22]发现和尚洞石笋古菌TEX86值与石笋碳酸盐氧同位素值δ 18O具有一定的相关性,推测TEX86在洞穴石笋中可能记录了温度的变化。之后,Blyth等[24~25]通过分析不同区域多个洞穴内部石笋GDGTs与温度之间的关系,分别提出了TEX86和MBT/CBT与温度之间的校正方程,为利用GDGTs相关指标定量重建洞穴温度变化提供了可能。目前,GDGTs相关指标已经开始逐渐被应用于石笋古环境的重建,例如,它们已经被应用于印度Mawmluh洞穴[23],提供了温度和湿度等方面的信息,解释了印度夏季风从末次冰盛期向全新世早期过渡中局部温度与印度夏季风的不耦合现象,表明石笋GDGTs对洞穴古气候的研究是一个较为有力的手段。
洞穴石笋中GDGTs分子的来源直接关系到其记录的环境信号来自上层土壤还是洞穴内部等,是利用其重建气候和环境变化需要首先解决的关键科学问题。当前,对洞穴环境中GDGTs分子的研究多聚焦在这个方面。Yang等[22]最早报道了湖北宜昌和尚洞上覆表层土壤、洞穴内部崩塌岩石风化层、滴水和石笋中GDGTs组成,发现洞顶土壤与石笋中GDGTs分布存在显著差异。洞穴石笋和风化岩石表面的GDGTs主要为古菌isoGDGTs。而在上覆土壤中细菌brGDGTs占主导地位,土壤和石笋样品间的甲基化指数MBT和环化指数CBT差异显著。Yang等[22]认为石笋中发现的古菌isoGDGTs和brGDGTs大部分可能都是在洞穴中产生的。此外,Blyth等[25]研究了英国和澳大利亚的5个洞穴和洞顶土壤,比较了不同pH值和年均温度梯度下的土壤和洞穴GDGTs组成,观察到GDGTs在石笋与土壤中的分布不同:石笋以crenarchaeol为主,土壤与石笋最大的差异出现在brGDGTs中,土壤与石笋两者的环化指数CBT之间没有相关性。Blyth等[25]认为石笋GDGTs主要来源于洞穴或包气带内生长的微生物;之后,Baker等[26]通过人工浇灌的方式尝试追踪Cathedral洞穴内部GDGTs在喀斯特关键带中的迁移和来源,发现洞穴内滴水中GDGTs的分布与石笋和土壤不同,推测石笋表面微生物可能是洞穴石笋中GDGTs信号的一个来源。
近年来,由于分析方法的改进,GDGTs分子的研究也取得了诸多进展。De Jonge等[27~28]改进GDGTs测试方法,用两根硅胶柱串联将其5-和6-甲基异构体分离,并指出6-甲基brGDGTs含量主要与土壤pH有关,5-甲基brGDGTs含量主要与温度相关,并提出基于5-甲基的MBT′5ME指标,该指标与年均温MAT的相关性相较于MBT′有显著的提高,分别基于5-甲基和6-甲基brGDGTs的环化指数CBT5ME和CBT6ME指标均与pH相关。后续对全球不同地区土壤GDGTs研究表明,MBT′5ME对温度的响应是一种普遍的现象,并且基于异构体比值提出的IRⅢ a′、IRⅡ a′指标也被证明与pH有较好的相关性[29]。Dang等[30]调查了青海湖周边土壤,提出IR6ME指标能够用于识别不同环境条件下MBT′/CBT指标响应的环境因子:当IR6ME>0.5时,MBT′/CBT指标反映的不再是温度,而主要是降水(或土壤湿度)。近期有研究表明甘油单烷基甘油四醚(GMGTs)也可以被用作为古气候指标[31],GMGTs又称H型GDGTs,是古菌和细菌产生的一类跨膜脂类[32](结构见图 1)。这类化合物目前研究较少,最早的古菌类异戊二烯型GMGTs(isoGMGTs)是在非嗜热的产甲烷古菌中被鉴定出[33],后来在低温的湖泊和海洋沉积物以及泥炭中也有发现[31, 34~36]。细菌支链型GMGTs在海洋和泥炭沉积物中被发现[31, 34];Bauersachs和Schwark[37]在侏罗纪时期的沉积物中也发现了GMGTs,这一发现表明GMGTs化合物能够长时间保存在地质体中,可以作为研究古环境、古气候的新手段。
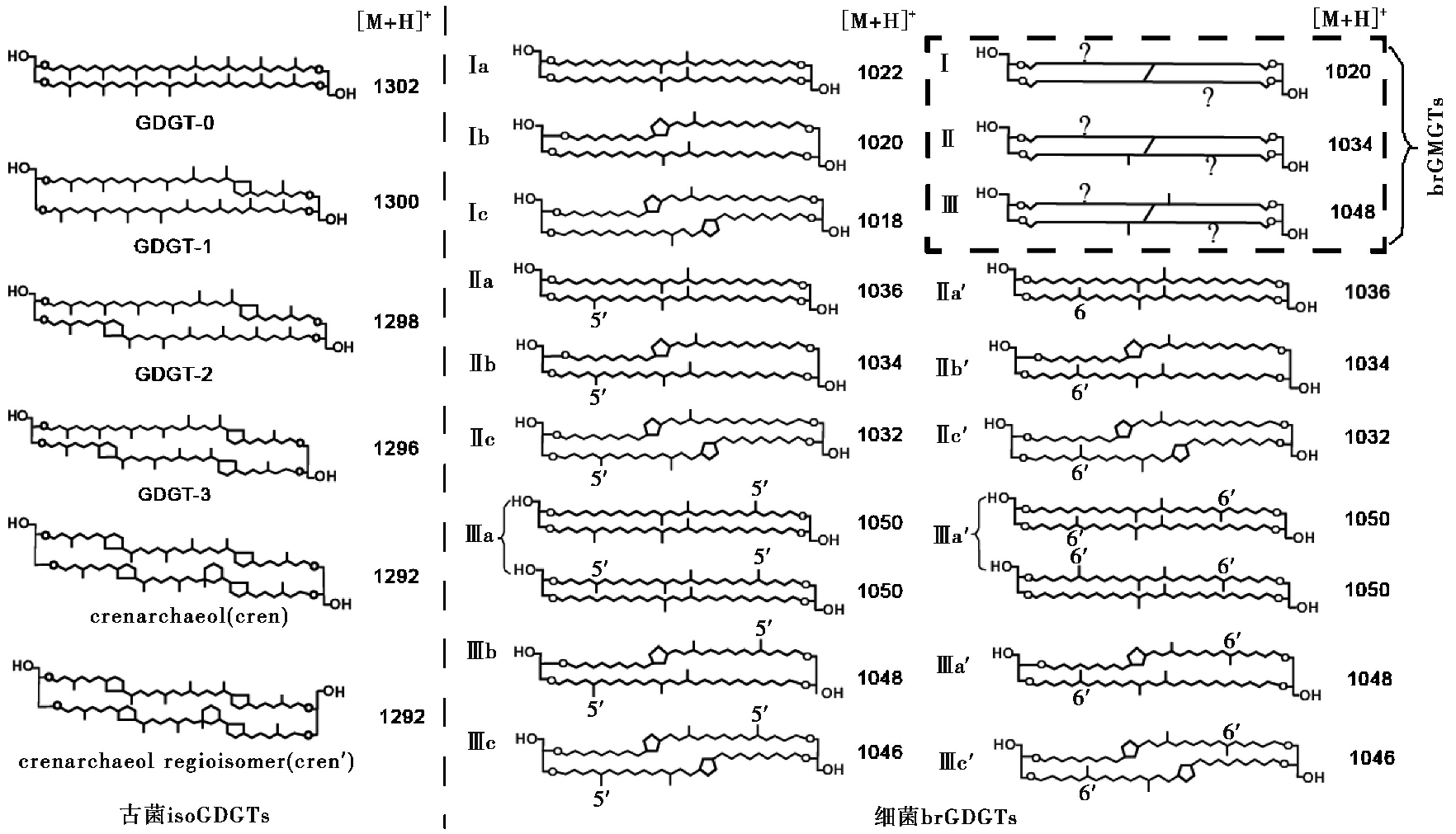
|
图 1 古菌和细菌GDGTs分子结构图及质子化后的质核比(m/z)及细菌brGMGTs分子结构图[32] Fig. 1 The structures of GDGTs and their protonated mass to charge ratio(m/z) |
尽管GDGTs相关新异构体和新化合物研究进展很多,但在喀斯特洞穴系统中还未曾有研究和报道,而这些化合物可能可以为石笋和洞穴内部GDGTs来源提供新的证据。为进一步了解洞穴沉积物中GDGTs的来源,我们对湖北清江和尚洞进行了更加系统的监测研究。本研究在Yang等[22]的基础上重新采样,对和尚洞洞穴上层土壤、洞穴内滴水以及洞穴石笋进行了比较,利用最新的色谱方法分离5-和6-甲基异构体并检测了新的化合物brGMGTs,进一步讨论石笋中GDGTs化合物的来源,为和尚洞石笋GDGTs来源辨析提供新的证据。
1 材料与方法 1.1 样品采集与处理和尚洞(30°27′N,110°25′E)位于长江中游的湖北省宜昌市清江流域(图 2),海拔530m,属亚热带季风性湿润气候,降雨主要集中在夏季,年平均降雨量为1400mm,年均气温16~17℃。洞口高205m,洞长>250m,宽10~30m,发育于寒武系三游洞群,围岩以白云岩为主[38]。和尚洞洞顶发育有亚热带常绿乔木,洞顶土壤以白云岩风化残积形成的石灰土和黄棕壤为主,质地较为粘重。本研究采集了和尚洞洞顶表层土壤样品20个,以五点采样法获取,五点上采集的土壤混合成为一个土壤样品,编号LBT-X(X为编号);同时,采集土壤剖面1个,剖面深70cm,每隔5cm取一个样,共获得不同深度土壤剖面样品14个,编号LBT-P-X(X为距表层的距离)。表层土壤样品详细信息见表 1,剖面土壤样品详细信息见表 2。所有的土壤样品采回后立即放入-20℃冰箱预冻,用冷冻干燥机进行冻干,然后研磨至60目装样品袋备用。
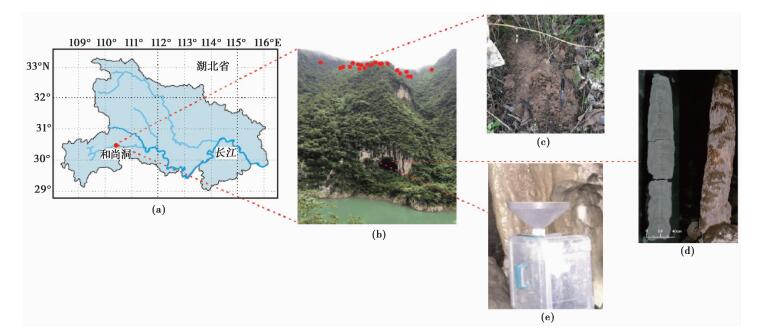
|
图 2 采样点情况示意图[39] (a)和尚洞地理位置;(b)和尚洞口,红色圆点代表表层土壤采样点位置;(c)表层土壤;(d)HS4石笋[2];(e)洞内HS4点位滴水采集 Fig. 2 Map of Hubei Province showing (a) the sampling location; (b)The entrance of Heshang Cave. The red circles represent the sampling sites of surface soils; (c)A selected surface soil sample; (d)The HS4 stalagmite[2]; (e)Dripping water at site HS4 |
| 表 1 和尚洞上覆表层土壤部分环境因子及GDGTs相关指标* Table 1 Environmental parameters and GDGT-based indices for surface soils above the Heshang Cave |
| 表 2 和尚洞上覆剖面土壤环境因子及GDGTs相关指标 Table 2 Environmental parameters and GDGT-based indices for a soil profile over the Heshang Cave |
为对比石笋中GDGTs与岩溶喀斯特关键带各处GDGTs分布异同,我们选取洞内HS4石笋作为研究对象。该石笋已经用U-Th进行过高精度的定年工作,获得了可靠的年代框架[2]。该石笋氧同位素δ 18O已经用于重建过去9000年以来长江中下游季风强度和降雨量的变化[2]。石笋样品沿着生长轴线切开后将外围石笋锯除,只留下生长纹层近水平的中间部分。将石笋切割成2cm左右的块状后,用铁研钵研磨成粉末。从顶部到底部按年代均匀选取60个样品,编号为HS4-X(X为距HS4石笋底部的距离)。
洞穴内滴水样品目前总共采集HS4、HS6两个滴水点2~10月份9个月共计18个样品,GDGTs测试有效样品14个,编号为HS4D-X和HS6D-X(X为月份)。每月固定时间收集,每次收集滴水20~25 L,在1天内迅速将滴水运回实验室。滴水样品需倒入玻璃砂芯过滤器通过0.22μm的生物纤维滤膜进行过滤,以收集水中悬浮颗粒物质(Suspended Particulate Matter,简称SPM)进行脂类抽提。
1.2 样品GDGTs化合物的提取与分离 1.2.1 土壤样品GDGTs化合物的提取与分离土壤样品采用超声萃取法,称取15g土壤粉末样品装入聚四氟乙烯离心管中,加入15ml二氯甲烷︰甲醇(9 ︰ 1,v/v)溶液,在涡旋振荡器上使样品和试剂充分混合,随后放入超声波清洗机进行超声提取,重复进行5~6次,直至提取液没有明显颜色为止。萃取液合并后用旋转蒸发仪浓缩至1~2ml,之后采用柱层析进行分离[40]。用正己烷洗脱非极性组分,二氯甲烷︰甲醇(1 ︰ 1,v/v)溶液洗脱极性组分,GDGTs存在于分离后的极性组分中。将分离后的组分放于40℃加热板上晾干。含有GDGTs化合物的极性组分细胞瓶晾干后进行皂化(1mol/ L KOH的甲醇溶液: 5 %超纯水,80℃,2 h)将醇与酸进行分离。冷却后将醇组分用正己烷进行萃取5次,之后样品通过0.45μm疏水性PTFE滤膜转移至进样瓶后用氮气吹干,然后用液相色谱-质谱联用仪(LC-MS/MS)进行检测。
1.2.2 石笋样品GDGTs化合物的提取与分离称取15g石笋粉末样品装入烧杯中,用3mol/L的盐酸溶液充分溶解石笋粉末,每次加入20ml并用玻璃棒搅拌,重复5次,随后放置12 h,充分释放碳酸盐晶格中的有机质。将溶解后的石笋溶液倒入玻璃滤器通过半径40mm,孔径0.45μm的玻璃纤维滤膜,使得不溶颗粒物质全部过滤在滤膜上。滤膜在40℃烘箱中烘干称重。随后将滤膜与滤后的酸液混合利用电加热套125℃恒温加热3 h使GDGTs化合物充分释放,并酸解带极性头基的GDGTs分子,待溶液冷却至室温后用分液漏斗进行萃取。总提取物用旋转蒸发仪浓缩至1~2ml,为减少柱层析对石笋中低含量GDGTs的影响,萃取液通过0.45μm疏水性PTFE滤膜后直接利用LC- MS/MS进行检测。
1.2.3 滴水样品GDGTs化合物的提取与分离滴水每月采集20~25 L,倒入玻璃砂芯过滤器通过半径15mm,孔径0.22μm的生物纤维滤膜,使得颗粒物质和微生物全部过滤在滤膜上。滤膜之后放于通风橱晾干。用二氯甲烷︰甲醇(9 ︰ 1,v/v)溶液对干燥的滤膜进行超声抽提。萃取液用旋转蒸发仪浓缩至1~2ml。为减少柱层析对滴水中低含量GDGTs的影响,萃取液直接通过0.45μm疏水性PTFE滤膜后利用LC-MS/MS进行检测。
1.3 样品GDGTs化合物的检测在待测样品中加入10 μL的C46GTGT内标[41],之后将样品溶解在300 μL正己烷︰异丙醇(9 ︰ 1,v/v)混合溶剂中。GDGTs化合物检测采用的是LC-MS/MS,仪器型号为Agilent 1200系列HPLC- 6460A三重四极杆质谱仪,配备大气压化学电离源(APCI)。检测GDGTs化合物的条件:A流动相为正己烷,B流动相为正己烷︰异丙醇(9 ︰ 1,v/v)。细菌brGDGTs的5-甲基和6-甲基的分离采用两根串联的色谱柱(BEH HILIC柱,2.1×150mm,1.7μm;Waters),柱温恒定30℃。洗脱梯度:0~25min为82 % A:18 % B,25~50min为A/B流动相由82 % A:18 % B线性变化至65 % A:35 % B,50~80min线性到100 % B,最后30min回归到82 % A:18 % B。流速保持0.2ml/min[42]。APCI/MS条件:雾化器压力60 psi,雾化温度400℃,干燥气(N2)流速6 L/ min,温度200℃,毛细管电压3500V,电晕电流5 μA。扫描模式:单离子扫描(SIM),扫描化合物质核比(m/z):1302、1300、1298、1296、1292、1050、1048、1046、1036、1034、1032、1022、1020、1018和744[43]。C46 GTGT化合物作为样品内标进行半定量[41],并假设每个化合物与内标之间的响应因子为1 ︰ 1。本次测样仪器状态良好,各指标重复测试误差范围在±0.02。
1.4 指标计算温度指标TEX86以及温度计算基于以下公式[27]:

|
(1) |
甲基化指数MBT′和环化指数CBT基于以下公式[20]:

|
(2) |
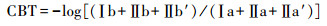
|
(3) |
分离5-、6-甲基后的MBT′5ME、MBT′6ME、CBT5ME、CBT6ME基于以下公式[28]:

|
(4) |

|
(5) |
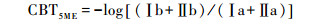
|
(6) |
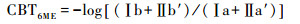
|
(7) |
陆源输入指标BIT基于以下公式[44]:
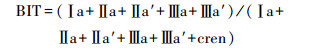
|
(8) |
根据CBT计算pH基于以下公式[45]:
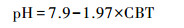
|
(9) |
根据CBT5ME计算pH基于以下公式[28]:
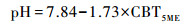
|
(10) |
IRⅡ a′和IRⅢ a′与pH有较好相关性,其计算基于以下公式[43]:
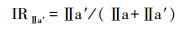
|
(11) |
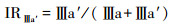
|
(12) |
细菌brGMGTs相对细菌brGDGTs中的含量基于以下公式:
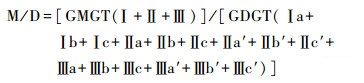
|
(13) |
上述公式中的罗马字母对应图 1中各化合物的结构。
2 结果与讨论 2.1 土壤、滴水、石笋GDGTs分布 2.1.1 表层土壤和土壤剖面无论是表层土壤还是剖面土壤,都显示出了典型的土壤GDGTs分布特征,随机选取表层土壤LBT- 2为例(图 3a),即细菌brGDGTs显著高于古菌isoGDGTs。细菌brGDGTs以Ⅰa为主,其次是5-甲基brGDGTs中的Ⅱa。以表层土壤为例,作为样品中含量最高的Ⅰa化合物,除LBT-20为苔藓外其余样品Ⅰa含量在4.96~59ng/g之间,20个样品平均绝对含量13.09 ng/g,占细菌brGDGTs总含量的13 % ~91 %。且大部分样品Ⅰa含量要远高于占次要地位的Ⅱa含量(表 3),这与Yang等[22]报道的表层土壤GDGTs分布略有不同,这是由于洞顶土壤具有一定的空间差异性造成的。表层土壤样品的古菌以cren(crenarchaeol)为主,且crenarchaeol平均占古菌isoGDGTs的46 %左右,平均含量为1.56 ng/g(表 3)。
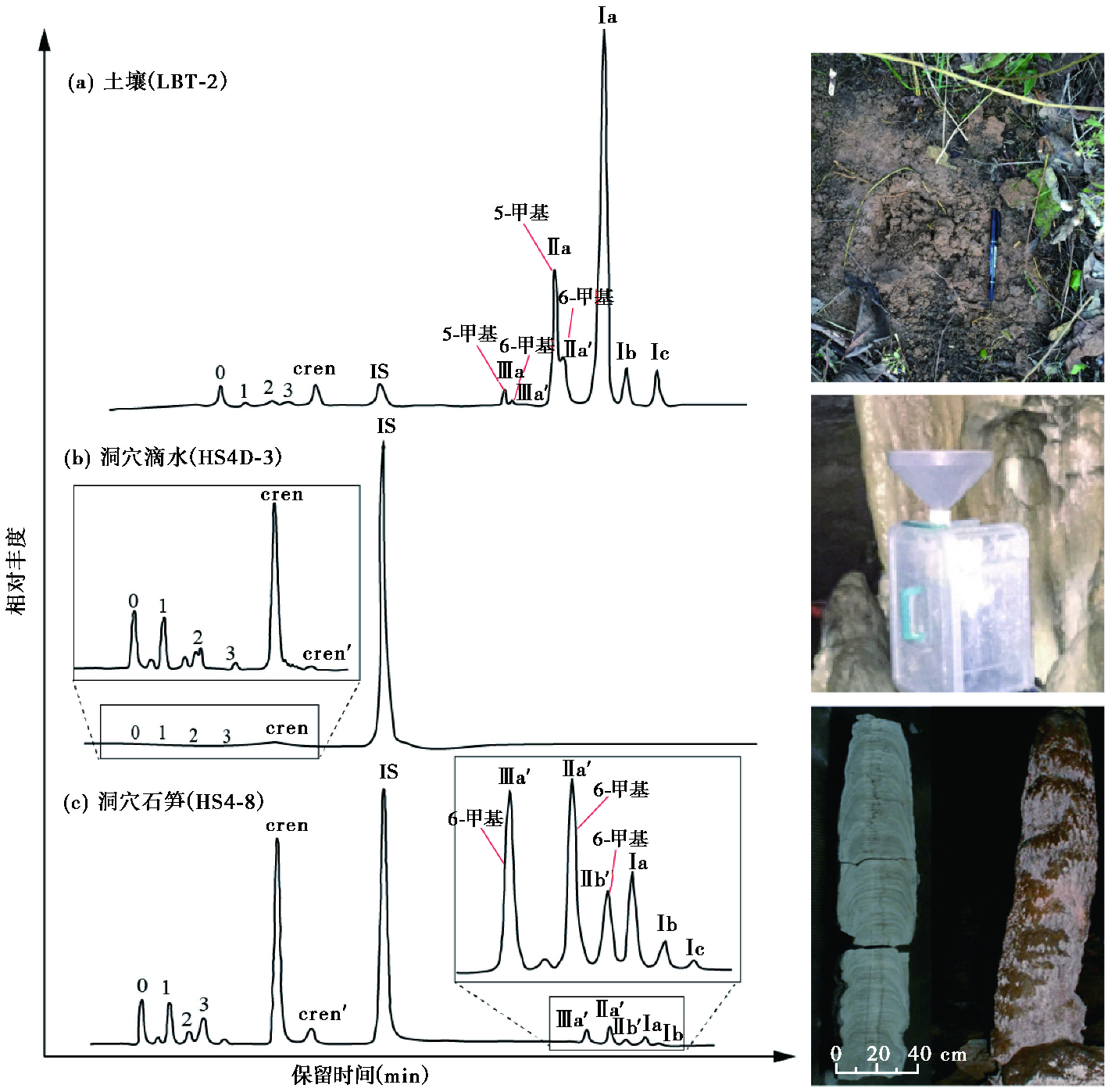
|
图 3 基峰色谱图显示古菌和细菌GDGTs在土壤(以表层土壤LBT-X系列的LBT-2为例)、洞穴滴水(以HS4D-3为例)和石笋(以HS4-8为例)的分布 IS为C46GTGT内标 Fig. 3 Partial base peak chromatograms showing the distribution of archaeal and bacterial GDGTs for a surface soil(LBT-2), a dripping water sample(HS4D-3)and a stalagmite sample(HS4-8). IS denotes internal standard, a synthesized C46GTGT |
| 表 3 和尚洞上覆表层土壤GDGTs化合物含量(ng/g) Table 3 The concentration of GDGTs in overlying surface soils above the Heshang Cave(ng/g) |
土壤剖面(LBT-P-X系列样品)中GDGTs化合物绝对含量随剖面深度的增加呈现出较为不同的变化趋势(图 4)。从表层开始至70cm,剖面样品中的古菌isoGDGTs的GDGT-0的含量从表层的0.46ng/g降至70cm处的0.04 ng/g(图 4a),下降幅度较大;GDGT-1和GDGT-2先升后降,升至25cm处开始呈下降趋势,GDGT-3和crenarchaeol的含量呈现出较为相同的趋势,从表层开始上升至40cm处开始下降,到60cm处再次出现升高趋势,且两者含量相近;cren′在0~40cm含量较低,未能检测到,自40cm处开始出现,含量为0.004 ng/g,基本接近检出限。crenarchaeol作为氨氧化奇古菌的标志物,随氧气含量减小化合物含量降低[46]。但是在该剖面中crenarchaeol含量先升后降的变化模式似乎可以说明该土壤剖面中的含氧量并非随深度呈线性下降模式。古菌含环的GDGT-1、-2、-3、crenarchaeol随土壤深度呈现先升后降,无环的GDGT-0呈下降趋势,表明产生不同化合物的古菌属种不同。细菌brGDGTs主要化合物含量呈明显递减趋势,且变化趋势较为一致(图 4g~4m),总体随深度下降呈递减趋势,含量最高的Ⅰ a化合物从表层的14.98ng/g降到70cm处的1.3 ng/g,减少11倍;Ⅰ b和Ⅰ c在40cm之上变化较为杂乱,40cm往下呈下降趋势;Ⅱ a和Ⅲ a及其异构体均成单调下降趋势。

|
图 4 土壤剖面(LBT-P-X系列样品)中古菌和细菌GDGTs化合物绝对含量随深度变化图 Fig. 4 The changes in the concentration of isoGDGTs and brGDGTs with increased depth in the soil profile(LBT-P-X) |
土壤剖面(LBT-P-X系列样品)中GDGTs化合物相对含量随剖面深度的增加呈现出不同的变化趋势(图 5)。无论是表层土壤还是剖面土壤,古菌isoGDGTs中GDGT-0的丰度始终高于GDGT- 1、- 2、- 3,这种分布与Weijers等[47]报道的全球土壤中的分布是一致的。古菌isoGDGTs中GDGT-0的相对含量在0~25cm逐渐减小,在大于30cm的深度保持在较小的水平;GDGT-1、-2、-3这3个化合物的相对含量变化趋势相近,在0~25cm相对含量增加,在大于25cm深度保持在相对较大值;crenarchaeol(cren)的相对含量在0~40cm大致呈增加趋势,在大于40cm深度其值先降后增,而crenarchaeol异构体cren′的相对含量与cren含量变化不同,在0~35cm基本为0,在40cm处又增多,40~70cm呈下降趋势。古菌isoGDGTs各化合物随深度的不同变化趋势代表了不同化合物具有不同的古菌来源,氧气可能在控制不同深度古菌类群变化中起到了主要作用[39]。由于该土壤剖面表层存在短暂积水,导致缺氧的现象,因而GDGT-0在表层含量较高。深度从表层增加到40cm时,氧气含量相对表层有所增加,GDGT-1、-2、-3、crenarchaeol及其异构体cren′比例有所增加,并在>40cm的层位保持相对较高的含量,代表奇古菌等好氧古菌在古菌中的比例增加。细菌brGDGTs的Ⅰ a、Ⅱ a、Ⅲ a的相对含量从表层到深层大致呈减少趋势,而Ⅰ b、Ⅰ c、Ⅱ a′、Ⅲ a′所占比例逐渐增加。虽然GDGTs化合物在相对含量变化有增有减,但浓度总体随深度呈下降趋势(见图 4)。因此,有机质含量降低后的深层土壤,不太适合产brGDGTs细菌的生长,再经过岩石层的层层渗滤,土壤中的GDGTs化合物不太可能出现在石笋中。

|
图 5 土壤剖面(LBT-P-X系列样品)中古菌和细菌GDGTs化合物相对含量随深度变化图 Fig. 5 The changes in the relative abundance of archaeal and bacterial GDGTs in the soil profile(LBT-P-X) |
洞穴滴水样品根据目前所采集的HS4和HS6滴水共14个有效样品综合分析,几乎所有样品中只检测到了古菌isoGDGTs,平均颗粒物重约1.5mg,详细信息见表 4。与土壤相比,滴水中的GDGTs相对浓度要小得多。古菌isoGDGTs化合物以crenarchaeol、GDGT-0、-1为主(图 3b),细菌brGDGTs含量较低,低于检出限。
| 表 4 滴水样品信息及古菌isoGDGTs相对含量* Table 4 Sample information and the relative abundance of isoGDGTs in dripping water |
洞穴石笋样品中的古菌isoGDGTs和细菌brGDGTs均有检测到(图 3c)。60个石笋样品的古菌isoGDGTs平均总浓度1.54 ng/g,细菌brGDGTs平均总浓度0.55 ng/g,古菌isoGDGTs含量总体上高于细菌brGDGTs(表 5)。古菌isoGDGTs分布模式均以crenarchaeol、GDGT-0、-1为主,与滴水分布模式(图 3b)相似。Crenarchaeol是石笋样品中含量最高的GDGT化合物,占古菌isoGDGTs的55 %左右,绝对含量平均为0.86 ng/g(表 5),也是整个石笋样品中含量最高的GDGTs化合物(图 3),贡献了石笋中总GDGTs的三分之一左右;细菌brGDGTs以IIa为主,其次是Ⅲa,Ⅰa含量相对较低。总体上,5-甲基brGDGTs化合物含量较低,甚至低于检出限。
| 表 5 石笋样品GDGTs化合物含量(ng/g) Table 5 The concentration of GDGTs in the HS4 stalagmite from Heshang Cave(ng/g) |
根据洞穴系统的垂直分布,洞顶土壤和滴水在石笋的形成过程中发挥着重要的作用,均有可能是石笋中GDGTs的来源。根据图 3c离子色谱图中GDGTs分布显示,石笋中古菌GDGT-0、-1含量相近,GDGT-2、-3含量较低。而在表层土壤样品中,古菌isoGDGTs含量最高的化合物为crenarchaeol和GDGT-0(图 3a)。Crenarchaeol作为氨氧化奇古菌的标志物在土壤样品中含量较低,在石笋中却上升至主导地位,表明奇古菌可能是石笋中古菌isoGDGTs的重要来源。
洞穴滴水中GDGTs整体上含量较低,前人研究得出的洞穴滴水中的微生物量较低(约104个细胞/ml)相吻合[46]。滴水中颗粒物GDGT-0和GDGT-1含量相近,与石笋的isoGDGTs分布一致。含量最低的是GDGT-3,从GDGT-0到GDGT-3呈现递减趋势(图 3b)。Crenarchaeol不仅在古菌isoGDGTs中含量最高,也是滴水GDGTs中的主要化合物。滴水样品中crenarchaeol的绝对优势表明,奇古菌可能在地下水-岩溶裂隙(包括地下水饱水带和滴水)中具有生长优势。
石笋古菌isoGDGTs化合物分布特征与滴水的分布较为相似,均为crenarchaeol占绝对主导地位,GDGT-0和GDGT-1含量较低(见图 3b和3c)。但与表层土壤中古菌isoGDGTs分布不同:土壤以GDGT-0和crenarchaeol为主要化合物(图 3a),而石笋最主要化合物仅为crenarchaeol,GDGT-0含量并不高。Baker等[26]通过研究发现,澳大利亚洞穴上覆土壤、洞穴滴水和石笋中古菌isoGDGTs分布差异较大。不同于和尚洞,澳大利亚洞穴上覆土壤中GDGT-3、crenarchaeol含量较多,滴水GDGT-0、-1更多。这种不同有可能是澳大利亚岩溶裂隙中存在部分的缺氧环境,使得主要细胞膜脂为GDGT-0的厌氧古菌,如产甲烷古菌等增多造成的[48]。赵晓玲等[49]对和尚洞滴水的微生物群落结构进行研究发现,在部分月份的滴水中出现有不动杆菌属的细菌。这些细菌可以生长在土壤和水中,也能够在乙酸、乙醇作为碳源,硝酸盐做唯一氮源的培养基中生长,说明滴水中的部分菌群可能也能在岩层裂隙或表面生长。综合以上两处洞穴数据,滴水和石笋古菌isoGDGTs分布最为接近,这表明石笋中至少有一部分古菌isoGDGTs是由形成滴水的地下水系统贡献。Ding等[29]首次报道地下水系统的GDGTs分布,发现在地下水系统中存在一定量的古菌isoGDGTs,表明岩溶地区地下水中存在着原位生长的古菌群落,具有提供石笋古菌isoGDGTs来源的可能性。
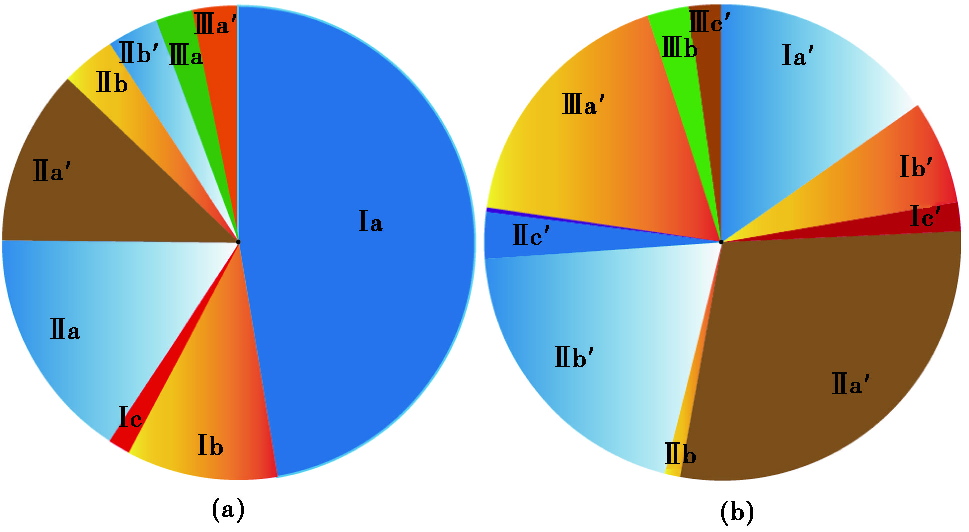
2.2.2 细菌brGDGTs所有石笋样品细菌brGDGTs的含量均小于古菌isoGDGTs。对应的,表征古菌isoGDGTs与细菌brGDGTs相对量的BIT值(Branched Isoprennoid Tetraether)范围为0.04~0.51,明显小于大部分土壤的值1(图 6c)。石笋的不同样品细菌brGDGTs分布相似,都以Ⅱ系列为主,Ⅱ a′含量最高,占细菌brGDGTs总量平均为30 %左右(图 7b)。值得注意的是,在所有石笋样品中,5-甲基brGDGTs均接近于检出限或者未检出。而无论是剖面还是表层土壤中,均以Ⅰ系列为主,Ⅰ a含量最高,5-甲基brGDGTs含量较高(图 7a)。事实上,表征6-甲基brGDGTs相对含量的IRⅡ a′和IRⅢ a′指标在土壤和石笋中也表现出较大差异。土壤的IRⅡ a′和IRⅢ a′值变化范围较大,为0~0.88,中值都为0.3左右,而石笋中的IRⅡ a′和IRⅢ a′指标较为稳定,基本为1(图 6a和6b)。土壤细菌brGDGTs与石笋brGDGTs分布的巨大差异,表明石笋中细菌brGDGTs可能并非由土壤贡献。

|
图 6 土壤和石笋中IRⅡ a′指数(a)和IRⅢ a′指数(b)以及陆源输入指数BIT (c)的不同分布 Fig. 6 Box plots showing significant difference in IRⅡ a′ (a), IRⅢ a′ (b), BIT (c) indices between stalagmites and overlying soils |
|
图 7 表层土壤(a)和石笋(b)细菌brGDGTs含量分布饼状图 Fig. 7 Pie chart showing the distribution of brGDGTs in soils over the Heshang cave (a) and stalagmite samples (b), respectively |
对比土壤和石笋的甲基化和环化程度,表层土壤甲基化指数(MBT′)在0.43~0.79之间(表 1),而石笋MBT′在0.19~0.30之间,两者差异较大;这也证实了石笋中细菌brGDGTs与土壤细菌brGDGTs存在较大差异。土壤环化指数(CBT)在-1.70~2.25之间,石笋CBT在-0.10~0.54之间。CBT指数越高,说明样品中含环化合物越少。土壤的高CBT指数与石笋的低CBT指数形成了较大的差异;石笋MBT′和CBT投点后在图中与土壤之间无明显重叠区域(图 8)。同样,土壤与石笋中MBT′5ME和MBT′6ME也投点在不同区域。根据公式(10)CBT5ME计算pH值的方法,得到的土壤pH平均值为6.4(±1.2),而实测pH值为6.8(±0.48),两者非常接近;计算出的石笋样品pH平均值为7.3(±0.31),而滴水的实测pH值平均为8.5 (±0.1),明显比石笋重建的pH值大。由于滴水样品HS4D-9中细菌brGDGTs计算出pH,得到的pH值为8,与实际值也较为接近。通过对比三者用CBT5ME计算的pH值,可以看出,石笋样品重建得到的pH明显高于土壤,也再一次证实了石笋中brGDGTs并非继承自洞顶上覆土壤。

|
图 8 土壤和石笋中甲基化指数与环化指数MBT′与CBT (a)、MBT′5ME与CBT5ME (b)、MBT′6ME与CBT6ME (c)指数的不同分布 Fig. 8 Cross plots of MBT′ vs. CBT (a), MBT′5ME vs. CBT5ME (b), MBT′6ME vs. CBT6ME (c)indices between stalagmites and overlying soils |
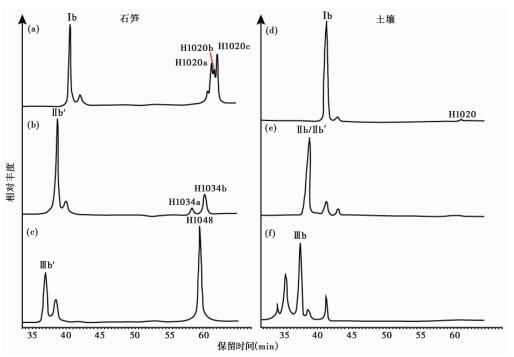
除此之外,我们还在石笋中检测到了甘油单烷基甘油四醚化合物(GMGTs,也称H型brGDGTs)[31](结构见图 1)。在本研究中所有样品均未检测到古菌isoGMGTs,只检测到细菌brGMGTs。石笋样品中细菌brGMGTs仅检测到Ⅰ、Ⅱ和Ⅲ(图 9a、9b和9c),且GMGT-Ⅰ和Ⅱ有多个同分异构体,以出现的先后顺序命名(如Ⅰ-1020a、Ⅰ-1020b和Ⅰ-1020c)。土壤样品中仅检测到brGMGT-Ⅰ但含量较低,其他GMGTs基本无法检测到(图 9d、9e和9f)。
|
图 9 基峰色谱图展示的石笋和土壤主要brGMGTs分布特征及差异 Fig. 9 Partial base peak chromatograms showing distribution of brGMGTs in stalagmite and soil samples |
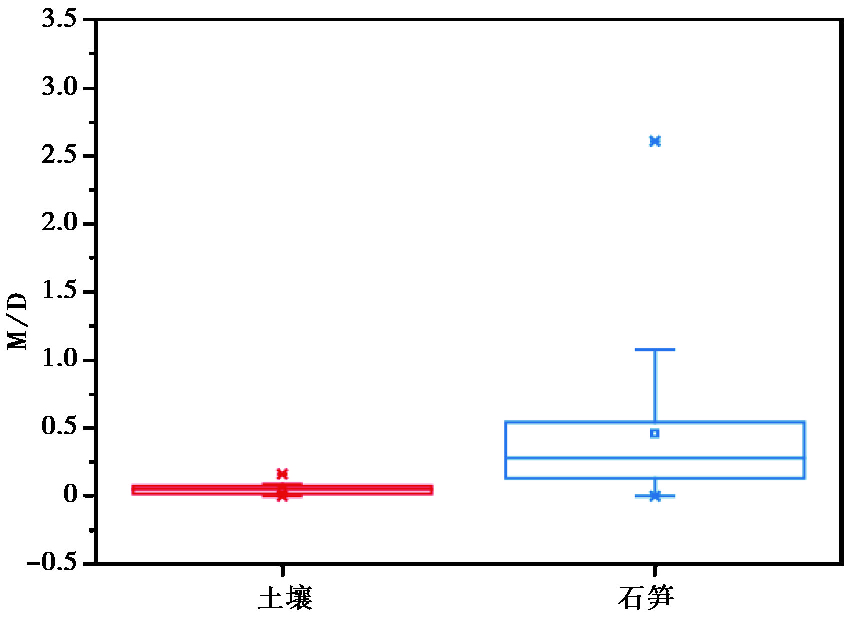
由于石笋和土壤GDGTs的绝对含量相差悬殊,故将brGMGT的丰度之和与brGDGTs的丰度之和作比值(公式13),即M/D值,发现石笋和土壤的M/D值差异较大(图 10)。土壤的M/D值基本处于0,而石笋的M/D值变化范围较大,在0~1.85之间。这也可以证明石笋和土壤中brGMGTs有明显差别,石笋中的brGMGTs有土壤之外的其他来源。基于以上证据,我们认为和尚洞洞穴石笋中细菌brGDGTs的主要贡献者并非上覆土壤,更多可能来源于洞穴内部原位生长的微生物群落。
|
图 10 石笋与土壤的M/D值的显著差异 Fig. 10 The significant difference in the M/D ratio between stalagmite and soil samples |
通过对长江中游和尚洞上覆土壤、洞内滴水和石笋中古菌和细菌GDGTs分布的详细调查,我们获得了石笋中GDGTs来源的一些新证据。
(1) 和尚洞上覆表层土壤、土壤剖面和洞穴石笋中GDGTs分布存在显著差异,表层土壤和土壤剖面中细菌brGDGTs含量高于古菌isoGDGTs,古菌isoGDGTs以GDGT-0或crenarchaeol为主,细菌brGDGTs中Ia含量最高;而石笋中古菌isoGDGTs含量总体上高于细菌brGDGTs,古菌isoGDGTs以crenarchaeol为主,细菌brGDGTs中IIa′含量最高。土壤剖面越深,GDGTs含量越低,且深部土壤(70cm)处GDGTs分布与石笋差异显著。表征古菌isoGDGTs与细菌brGDGTs相对含量的陆源输入指数BIT在石笋中范围为0.04~0.51,而在表层土壤和土壤剖面中均接近于1,两者没有交集。
(2) 表层土壤和土壤剖面中5-甲基brGDGTs均多于6-甲基brGDGTs,而石笋中6-甲基brGDGTs为主要异构体类型,5-甲基brGDGTs几乎检测不到。表征6-甲基brGDGTs相对含量的IR指标变化范围较大,表层土壤为0~0.88,中值在0.3左右,而石笋异构体指标IR较为稳定,大部分为1左右。对比土壤和石笋的甲基化指数MBT′和环化指数CBT,石笋的MBT′和CBT投点后在图中与土壤无重叠区间。
(3) 在石笋中检测到了大量的brGMGTs,而土壤中的brGMGTs相对含量远低于石笋中brGMGTs含量。
(4) 洞穴滴水颗粒物质中GDGTs分布与洞顶土壤完全不同。滴水中只检测到了古菌isoGDGTs,细菌brGDGTs接近检出限,古菌isoGDGTs在样品中占绝对优势,且以crenarchaeol为主,其次是GDGT-0、-1,其GDGTs组成分布模式与石笋古菌isoGDGTs分布模式一致。
综合研究证据可以看出,石笋中古菌isoGDGTs和细菌brGDGTs化合物均不是主要来自于洞穴上覆土壤,而可能来自于石笋表面原位生长的菌群或(和)洞穴岩溶地下水系统的贡献,其记录的信号是地下水系统和洞穴内部的环境信息,而非洞穴上层土壤记录的环境信息。
致谢: 感谢中国地质大学(武汉)胡超涌教授团 队胡尊语、汪颖钊、周浩、杨梦宇、杨鑫等同学以及 常标师兄在出野外过程中的帮助。
| [1] |
袁道先. 我国岩溶资源环境领域的创新问题[J]. 中国岩溶, 2015, 34(2): 98-100. Yuan Daoxian. Scientific innovation in karst resources and environment research field of China[J]. Carsologica Sinica, 2015, 34(2): 98-100. |
| [2] |
Hu C Y, Henderson G M, Huang J H, et al. Quantification of Holocene Asian monsoon rainfall from spatially separated cave records[J]. Earth and Planetary Science Letters, 2008, 266(3-4): 221-232. |
| [3] |
王权, 汪永进, 刘殿兵, 等. DO3事件的湖北神农架高分辨率年纹层石笋记录[J]. 第四纪研究, 2017, 37(1): 108-117. Wang Quan, Wang Yongjin, Liu Dianbing, et al. The DO3 event in Asian monsoon climates evidenced by an annually laminated stalagmite from Qingtian Cave, Mt. Shennongjia[J]. Quaternary Sciences, 2017, 37(1): 108-117. |
| [4] |
薛刚, 蔡演军, 马乐, 等. 山东半岛石笋记录的倒数第二次冰消期δ18O变化特征及其气候环境意义[J]. 第四纪研究, 2019, 39(4): 812-824. Xue Gang, Cai Yanjun, Ma Le, et al. The penultimate deglaciation characters and significance of climatic and environmental changes in Shandong Peninsula, inferred from speleothem δ18O records[J]. Quaternary Sciences, 2019, 39(4): 812-824. |
| [5] |
Wang Y J, Cheng H, Edwards R L, et al. A high-resolution absolute-dated Late Pleistocene monsoon record from Hulu Cave, China[J]. Science, 2001, 294(14): 2345-2348. |
| [6] |
Zhang H B, Griffiths M L, Chiang J C H, et al. East Asian hydroclimate modulated by the position of the westerlies during Termination Ⅰ[J]. Science, 2018, 362(6414): 580-583. |
| [7] |
Zhu Z M, Feinberg J M, Xie S C, et al. Holocene ENSO-related cyclic storms recorded by magnetic minerals in speleothems of Central China[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(5): 852-857. |
| [8] |
Xie S C, Yi Y, Huang J H, et al. Lipid distribution in a subtropical Southern China stalagmite as a record of soil ecosystem response to paleoclimate change[J]. Quaternary Research, 2003, 60(3): 340-347. |
| [9] |
Schouten S, Hopmans E C, Sinninghe Damsté J S. The organic geochemistry of glycerol dialkyl glycerol tetraether lipids:A review[J]. Organic Geochemistry, 2013, 54(1): 19-61. |
| [10] |
Sinninghe Damsté J S, Rijpstra W I C, Hopmans E C, et al. Ether-and ester-bound iso-diabolic acid and other lipids in members of acidobacteria subdivision 4[J]. Applied and Environmental Microbiology, 2014, 80(17): 5207-5218. |
| [11] |
谢树成, 梁斌, 郭建秋, 等. 生物标志化合物与相关的全球变化[J]. 第四纪研究, 2003, 2(5): 521-528. Xie Shucheng, Liang Bin, Guo Jianqiu, et al. Biomarkers and the related global change[J]. Quaternary Sciences, 2003, 2(5): 521-528. |
| [12] |
王欢业, 刘卫国, 张传伦, 等. 青海钻孔沉积物中的羟基甘油二烷基甘油四醚类化合物及其环境意义[J]. 第四纪研究, 2017, 37(5): 1151-1160. Wang Huanye, Liu Weiguo, Zhang Chuanlun, et al. Hydroxylated glycerol dialkyl glycerol tetraethers in Lake Qinghai sediments and their paleoclimate implications[J]. Quaternary Sciences, 2017, 37(5): 1151-1160. |
| [13] |
曾方明, 杨欢, 卞昊昆. 青海湖地区全新世风尘堆积的GDGTs化合物及其环境指示意义[J]. 第四纪研究, 2018, 38(5): 1233-1243. Zeng Fangming, Yang Huan, Bian Haokun. GDGTs compounds of the Holocene eolian deposits in Qinghai Lake area and their paleoenvironmental implications[J]. Quaternary Sciences, 2018, 38(5): 1233-1243. |
| [14] |
郭海超, 陈炽皓, 白艳, 等. GDGTs揭示的西宁盆地中中新世环境变化[J]. 第四纪研究, 2018, 38(1): 97-106. Guo Haichao, Chen Chihao, Bai Yan, et al. Paleoenvironmental evolution of the Xining Basin, NE Tibetan Plateau during mid-Miocene:Revealed by GDGTs[J]. Quaternary Sciences, 2018, 38(1): 97-106. |
| [15] |
Sluijs A, Schouten S, Pagani M, et al. Subtropical Arctic Ocean temperatures during the Palaeocene/Eocene Thermal Maximum[J]. Nature, 2006, 441(1): 610-613. |
| [16] |
李秀美, 朱二雷, 王明达, 等. 喜马拉雅山南坡海拔梯度表土GDGTs分布特征及其指示意义[J]. 第四纪研究, 2017, 37(6): 1226-1237. Li Xiumei, Zhu Erlei, Wang Mingda, et al. Distributions of glycerol dialkyl glycerol tetraether lips along an altitudinal transect on the southern slope of Mt. Himalaya and their indicating significanc[J]. Quaternary Sciences, 2017, 37(6): 1226-1237. |
| [17] |
Gao L, Nie J S, Clemens S, et al. The importance of solar insolation on the temperature variations for the past 110 kyr on the Chinese Loess Plateau[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2012, 317-318: 128-133. DOI:10.1016/j.palaeo.2011.12.021 |
| [18] |
李婧婧, 杨欢, 高超, 等. 羟基甘油二烷基甘油四醚脂类化合物研究进展[J]. 第四纪研究, 2018, 38(6): 1462-1470. Li Jingjing, Yang Huan, Gao Chao, et al. Application of hydroxylated glycerol dialky glycerol tetraethers:A review[J]. Quaternary Sciences, 2018, 38(6): 1462-1470. |
| [19] |
Schouten S, Hopmans E C, Schefuß E, et al. Distributional variations in marine crenarchaeotal membrane lipids:A new tool for reconstructing ancient sea water temperatures?[J]. Earth and Planetary Science Letters, 2002, 204(1): 265-274. |
| [20] |
Weijers J W H, Schouten S, van den Donker J C, et al. Environmental controls on bacterial tetraether membrane lipid distribution in soils[J]. Geochimica et Cosmochimica Acta, 2007, 71(3): 703-713. |
| [21] |
Peterse F, Prins M A, Beets C J, et al. Decoupled warming and monsoon precipitation in East Asia over the last deglaciation[J]. Earth and Planetary Science Letters, 2011, 301(1-2): 256-264. |
| [22] |
Yang H, Ding W H, Zhang C L, et al. Occurrence of tetraether lipids in stalagmites:Implications for sources and GDGT-based proxies[J]. Organic Geochemistry, 2011, 42(1): 108-115. DOI:10.1016/j.orggeochem.2010.11.006 |
| [23] |
Huguet C, Routh J, Fietz S, et al. Temperature and monsoon Tango in a tropical stalagmite:Last glacial-interglacial climate dynamics[J]. Scientific Reports, 2018, 8: 5386. |
| [24] |
Blyth A J, Schouten S. Calibrating the glycerol dialkyl glycerol tetraether temperature signal in speleothems[J]. Geochimica et Cosmochimica Acta, 2013, 109(2): 312-328. |
| [25] |
Blyth A J, Jex C N, Baker A, et al. Contrasting distributions of glycerol dialkyl glycerol tetraethers(GDGTs)in speleothems and associated soils[J]. Organic Geochemistry, 2014, 69: 1-10. DOI:10.1016/j.orggeochem.2014.01.013 |
| [26] |
Baker A, Jex C N, Rutlidge H, et al. An irrigation experiment to compare soil, water and speleothem tetraether membrane lipid distributions[J]. Organic Geochemistry, 2016, 94: 12-20. DOI:10.1016/j.orggeochem.2016.01.005 |
| [27] |
De Jonge C, Hopmans E C, Stadnitskaia A, et al. Identification of novel penta-and hexamethylated branched glycerol dialkyl glycerol tetraethers in peat using HPLC-MS2, GC-MS and GC-SMB-MS[J]. Organic Geochemistry, 2013, 54: 78-82. |
| [28] |
De Jonge C, Hopmans E C, Zell C I, et al. Occurrence and abundance of 6-methyl branched glycerol dialkyl glycerol tetraethers in soils:Implications for palaeoclimate reconstruction[J]. Geochimica et Cosmochimica Acta, 2014, 141: 97-112. DOI:10.1016/j.gca.2014.06.013 |
| [29] |
Ding S, Xu Y, Wang Y, et al. Distribution of branched glycerol dialkyl glycerol tetraethers in surface soils of the Qinghai-Tibetan Plateau:Implications of brGDGTs-based proxies in cold and dry regions[J]. Biogeosciences, 2015, 12(11): 3141-3151. |
| [30] |
Dang X Y, Yang H, Naafs B D A, et al. Evidence of moisture control on the methylation of branched glycerol dialkyl glycerol tetraethers in semi-arid and arid soils[J]. Geochimica et Cosmochimica Acta, 2016, 189: 24-36. DOI:10.1016/j.gca.2016.06.004 |
| [31] |
Naafs B D A, Mccormick D, Inglis G N, et al. Archaeal and bacterial H-GDGTs are abundant in peat and their relative abundance is positively correlated with temperature[J]. Geochimica et Cosmochimica Acta, 2018, 227: 156-170. DOI:10.1016/j.gca.2018.02.025 |
| [32] |
Baxter A J, Hopmans E C, Russell J M, et al. Bacterial GMGTs in East African lake sediments:Their potential as palaeotemperature indicators[J]. Geochimica et Cosmochimica Acta, 2019, 259: 155-169. DOI:10.1016/j.gca.2019.05.039 |
| [33] |
Morii H, Eguchi T, Nishihara M, et al. A novel ether core lipid with H-shaped C80-isoprenoid hydrocarbonchain from the hyperthermophilic methanogen methanothermus fervidus[J]. Biochimica et Biophysica Acta, 1998, 1390(3): 339-345. |
| [34] |
Liu X, Summons R E, Hinrichs K. Extending the known range of glycerol ether lipids in the environment:Structural assignments based on tandem mass spectral fragmentation patterns[J]. Rapid Communications in Mass Spectrometry, 2012, 26(19): 2295-2302. |
| [35] |
Pan A, Yang Q, Zhou H, et al. A diagnostic GDGT signature for the impact of hydrothermal activity on surface deposits at the Southwest Indian Ridge[J]. Organic Geochemistry, 2016, 99: 90-101. DOI:10.1016/j.orggeochem.2016.07.001 |
| [36] |
Schouten S, Baas M, Hopmans E C, et al. An unusual isoprenoid tetraether lipid in marine and lacustrine sediments[J]. Organic Geochemistry, 2008, 39(8): 1033-1038. |
| [37] |
Bauersachs T, Schwark L. Glycerol monoalkanediol diethers:A novel series of archaeal lipids detected in hydrothermal environments[J]. Rapid Communications in Mass Spectrometry, 2016, 30(1): 54-60. |
| [38] |
黄俊华, 胡超涌, 周群峰. 湖北清江和尚洞石笋的高分辨率碳氧同位素及古气候研究[J]. 地球科学——中国地质大学学报, 2000, 25(5): 505-509. Huang Junhua, Hu Chaoyong, Zhou Qunfeng. High-resolution carbon and oxygen isotope records from stalagmite and palaeoclimate in Heshang Cave, Qingjiang, Hubei Province[J]. Earth Science-Journal of China University of Geosciences, 2000, 25(5): 505-509. |
| [39] |
张佳皓, 裴宏业, 赵世锦, 等. 样品保存过程中降解对GDGTs环境代用指标的影响[J]. 地球科学, 2020, 45(1): 1-13. Zhang Jiahao, Pei Hongye, Zhao Shijin, et al. The impact of degradation on the tetraether-based proxies during the sample storage[J]. Earth Science, 2020, 45(1): 1-13. |
| [40] |
Yang H, Pancost R D, Dang X Y, et al. Correlations between microbial tetraether lipids and environmental variables in Chinese soils:Optimizing the paleo-reconstructions in semi-arid and arid regions[J]. Geochimica et Cosmochimica Acta, 2014, 126(2): 49-69. |
| [41] |
Huguet C, Hopmans E C, Febo-Ayala W, et al. An improved method to determine the absolute abundance of glycerol dibiphytanyl glycerol tetraether lipids[J]. Organic Geochemistry, 2006, 37(9): 1036-1041. |
| [42] |
Hopmans E C, Schouten S, Damsté J. The effect of improved chromatography on GDGT-based palaeoproxies[J]. Organic Geochemistry, 2016, 93: 1-6. DOI:10.1016/j.orggeochem.2015.12.006 |
| [43] |
Yang H, Lü X X, Ding W H, et al. The 6-methyl branched tetraethers significantly affect the performance of the methylation index(MBT')in soils from an altitudinal transect at Mount Shennongjia[J]. Organic Geochemistry, 2015, 82: 42-53. DOI:10.1016/j.orggeochem.2015.02.003 |
| [44] |
Hopmans E C, Weijers J W H, Schefuß E, et al. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids[J]. Earth and Planetary Science Letters, 2004, 224(1-2): 107-116. |
| [45] |
Peterse F, Meer J V, Schouten S, et al. Revised calibration of the MBT-CBT paleotemperature proxy based on branched tetraether membrane lipids in surface soils[J]. Geochimica et Cosmochimica Acta, 2012, 96(11): 215-229. |
| [46] |
Pitcher A, Rychlik N, Hopmans E C, et al. Crenarchaeol dominates the membrane lipids of Candidatus Nitrososphaera gargensis, a thermophilic group I.1b Archaeon[J]. ISME Journal:Multidisciplinary Journal of Microbial Ecology, 2010, 4(4): 542-552. |
| [47] |
Weijers J W H, Schouten S, Spaargaren O C, et al. Occurrence and distribution of tetraether membrane lipids in soils:Implications for the use of the TEX86 proxy and the BIT index[J]. Organic Geochemistry, 2007, 37(12): 1680-1693. |
| [48] |
Liu Q, Wang H M, Zhao R, et al. Bacteria isolated from dripping water in the oligotrophic Heshang Cave in Central China[J]. Journal of Earth Science, 2010, 21(S1): 325-328. |
| [49] |
赵晓玲.喀斯特洞穴滴水微生物群落结构的克隆文库测序研究——以湖北清江和尚洞HS-3D为例[D].武汉: 中国地质大学(武汉)硕士学位论文, 2008: 30-32. Zhao Xiaoling. Clone Library Analysis of the Microbial Communities in Dripping Waters of Karst Cave-A Case Study from Qingjiang, Hubei, P R China[D]. Wuhan: The Master' Thesis of China University of Geosciences(Wuhan), 2008: 30-32. |
2 School of Geography and Information Engineering, China University of Geosciences(Wuhan), Wuhan 430074, Hubei)
Abstract
Stalagmite is an important archive for the paleoclimate research. A number of proxies have been used in stalagmites to reconstruct the paleoenvironment. Among these proxies, glycerol dialkyl glycerol tetraethers (GDGTs) derived from microbial cell membrane have emerged as a promising tool to reconstruct paleoclimate in stalagmites. However, the sources of GDGTs in stalagmites is still unclear, hindering their wide application.In order to determine the source (s) of GDGTs in stalagmite, we investigated the distribution of isoGDGTs and brGDGTs in the karst critical zone over Heshang Cave in Qingjiang valley of Hubei Province, central China (30°27'N, 110°25'E; 530 m above sea level). This region is subject to a typical subtropical monsoon climate, and precipitation mainly falls in the summer. The mean annual precipitation is about 1400 mm and the mean annual temperature is 16~17℃. We collected 20 surface soils (sample No. LBT-X, X denotes its number), a soil profile (sample No. LBT-P-X; a total of 14 samples for all depths) with a depth of 70 cm, 18 dripping water samples spanning from February 2019 to September 2019 (labeled as HS4D-X and HS6D-X) and a stalagmite (labeled as HS4-X). GDGTs in above samples were extracted with organic solvents and analyzed using an Agilent liquid chromatography mass spectrometry (HPLC-MS). The distribution and concentrations of archaeal isoprenoid and bacterial branched GDGTs (isoGDGTs and brGDGTs) were obtained. The sources of GDGTs in Heshang cave stalagmite was then examined by means of comparison of the distributions between soils, stalagmites and dripping water.Distribution of GDGTs in surface soils and the soil profile differed markedly from that in the stalagmite. Specifically, brGDGTs dominated isoGDGTs in soils whereas the stalagmite showed the opposite. The relative abundance of brGDGTs vs. isoGDGTs, which can be reflected by BIT index, varied from 0.04~0.51 in stalagmites, much smaller than that (ca. 1) in the soils. BrGDGTs were dominated by brGDGT-Ia in soils, in contrast to the dominance of Ⅱ a' in stalagmites. The most abundant compound of isoGDGTs in soils was crenarchaeol and, in some cases, was GDGT-0. However, crenarchaeol was found to be most abundant in all stalagmite samples.In addition, 5-methyl brGDGTs were found to be more abundant than their 6-methyl isomers in the overlying soils, while 5-methyl brGDGTs in the stalagmite samples were extremely low in abundance. The IR index, expressing the relative abundance of 6-vs. 5-methyl brGDGTs, ranged from 0 to 0.88 in soils, whereas this index was close to 1 in most stalagmite samples. Cross plots of the methylation index (MBT) and the cyclisation index (CBT) exhibited significant difference between stalagmite and soils. GMGTs have been identified in the stalagmite samples, in contrast to the near absence of them from the surface soils and soil profile.GDGTs in the suspended particulate matter (SPM) of dripping water also provides clues to the provenance of GDGTs in stalagmites. GDGTs in SPM samples were composed of archaeal isoGDGTs dominated by crenarchaeol and followed by GDGT-0 and GDGT-1. The distribution of GDGTs in the SPM samples were different from that in the surface soils and the soil profile but were similar to that in the stalagmite.To sum up, the above comparisons provide several lines of evidence for the origin of GDGTs in stalagmites from the underground water (dripping water) or cave system rather than from the soils over the cave. 2020, Vol.40
2020, Vol.40

