2 广西隐伏金属矿产勘查重点实验室, 广西 桂林, 541004)
植硅体是维管束植物通过根系吸收单硅酸(Si(OH)4),在细胞壁、细胞内或细胞间硅化而淀积的非晶质二氧化硅,多形成于植物表皮角质层下面的表皮细胞,禾本科植物含量最为丰富[1]。植硅体分析广泛应用于植物分类、植硅体形成机制探讨、考古及古环境重建研究[1~9],其中,植硅体的形态、大小及组合研究较为深入[1, 5~12],植硅体化学组成研究相对薄弱。近年来,植硅体化学组成研究日益得到重视,研究者尝试了多种测试技术,促进了植硅体的化学组成认识。植硅体化学组成已成为探讨植硅体形成与植物种类及生长环境关系的重要手段,将在植物种类鉴定、测年、古环境重建研究中发挥越来越重要的作用。
为了总结植硅体化学组成的主要研究成果,明确植硅体化学组成在古环境研究的潜力,发现植硅体化学组成研究存在的问题,特对植硅体化学组成研究进行综述。
1 植硅体测试技术及化学组成植硅体的化学组成与植物种类、生长环境之间的关系研究,为认识植硅体的形成机制及生态响应与古环境研究提供了依据和基础,一直是广大研究者关注的热点问题。近30年来,随着测试技术的发展,研究者尝试了多种植硅体形态、组成、结构的显微观察及理化特性测试技术[3, 13]。植硅体化学组成测试主要涉及有机成分、水分、矿质元素及主要元素同位素组成。有机成分测试技术主要有:气相色谱(Gas Chromatography,简称GC),气相色谱-质谱联用仪(Gas Chromatography-mass Spectrometer,简称GC-MS)[14~15],气相色谱-同位素比值质谱(Gas Chromatography Isotope Ratio Mass Spectrometer,简称GC-IRMS)[14, 16],碳-13核磁共振(Nuclear Magnetic Resonance, 简称13 C-NMR)[17],拉曼(Raman Microprobe),红外光谱(Infrared Spectroscopy,简称FTIR)等分析技术[18~20];水热状况测试技术有:热重分析(thermogravimetry,简称TGA),差示扫描量热分析(Differential Scanning Calorimetry,简称DSC)等技术[21];矿质元素分析主要有X射线技术:X射线衍射(X-ray Diffractometry/Diffraction,简称XRD)[20, 22],X射线吸收(X-ray Absorption)[23],X射线能谱(Energy Dispersive X-ray Spectroscopy,简称EDX)或扫描电镜-X射线能谱(Cory-SEM-EDX)[24~27],X射线荧光光谱法(X-ray Fluorescence Spectroscopy,简称XRF)[13, 26],X射线光电子能谱(X-ray Photoelectron Spectroscopy,简称XPS)[18],X射线波谱(Wavelength Dispersive X-ray Spectroscopy),电子探针分析(Electron-probe Microanalysis,简称EPMA)等测试技术[28~29];另外,电感耦合等离子体光谱(ICP-Optical/Atomic Emission Spectroscopy)[30]及中子活化分析(Neutron Activation Analysis,简称NAA)[31]也被广泛利用。
由于石英结晶的动力学临界值较高(大约800 kJ/mol),室温和常压条件下晶体硅形式无法形成,只能形成非晶质硅[32]。然而,也有少量文献报道植硅体具有晶体性质,利用红外光谱法和X-射线衍射分析法鉴定出仙人掌锦绣玉属植物(Wigginsia tephracantha)植硅体,具有低温石英(α-石英)的特征[22],这种现象可能由污染或“形式双折射”现象导致,非晶质硅不可能形成双折射现象,不过,纤维素微纤维丝和其他糖类具有有序结构,以此为基质形成的生物硅,可形成“形式双折射”现象[3]。黄背草(Themeda triandra)植硅体纳米压痕测量发现,其硬度低于牙珐琅质,大麦(Hordeum vulgare)植硅体纳米压痕测量表现出非均匀性,由高度组织化类似晶体的硅质颗粒组成,颗粒间基质被认为是一种更晶质化的结构,也有可能是一种介于硅胶和完全结晶化的颗粒之间的过渡相物质[33]。
植硅体的化学组成与其来源植物有一定的联系,检测元素及其丰度与测试技术有关。总体看来,植硅体化学组成研究涉及主要成分SiO2和H2O,有机成分、无机矿物质及其主要元素同位素组成。
1.1 二氧化硅和水植硅体是一种单硅酸不可逆形成的非晶体硅酸盐胶体(SiO2 nH2O),是由疏水性的SiO2分子外部带有亲水性的羟基(-OH)官能团的非晶体[34]。植物切片电子探针显微分析(EPMA)发现,植硅体主要含SiO2,不同组织细胞硅含量不同[28]。植硅体中非晶体二氧化硅的通用分子式为[SiOn/2(OH)4-n]m(n=0~4,m为较大自然数)[32]。金丝雀虉草(Phalaris canariensis)大型毛状体中分离出的植硅体高分辨率透射电镜、红外光谱法和13 C-NMR波谱分析表明,在10 Å水平以下,硅的分布是没有秩序的,植硅体的组成分子式为:Si(OSi≡)nOH4-n,包括Si(OSi≡)3OH单元和一些Si(OSi≡)4类型,其大小跨越6个数量级从100 nm到200 mm。含水率高的植硅体密度一般较小,折射率较低[35]。
植硅体SiO2和水含量分别在66 % ~91 %和0~11 %之间[1, 36],电感耦合等离子体原子发射光谱(ICP-AES)分析表明,几种栽培水稻植硅体二氧化硅含量在80 % ~96 %之间,碳含量1.42 % ~3.36 %,水含量1.24 % ~17.64 % [30]。据此,可认为植硅体二氧化硅含量一般在66 % ~96 %之间,水含量一般在0~17.64 %之间。
1.2 有机成分植硅体形成通常以细胞壁、细胞腔内细胞质为基质,形成过程能够圈闭细胞壁的纤维素及细胞内的细胞质或细胞器,因而含有一定比重的有机碳,称为植硅体圈闭碳,其含量一般为0.2 % ~5.8 %;由于植硅体受硅氧结构的保护,抗氧化和降解,植硅体碳是一种重要的陆地碳库,一些土壤或沉积物有机质经过千年分解,植硅体碳的含量可占到土壤总有机碳含量的82 %,平均占陆地长期碳封存的15 % ~37 % [37~38]。植硅体由不同比例的无定型硅和有机物构成,金丝雀虉草(P.canariensis)外稃大型表皮毛细胞壁硅化形成的植硅体,含40 %的硅和60 %的有机质,其成熟毛发中的整个加厚的细胞壁被硅化,经过酸氧化提取、灰化或降解过程,有机质被除去,保留下来的植硅体结构可能是多孔的[3]。Carter[39]认为比重较小(1.5~2.0 g/cm3)植硅体圈闭有机质的含量可超过比重较大植硅体(2.0~2.3 g/cm3)的3倍。植硅体有机质含量影响其比重大小,从而影响植硅体的运移或其在土壤及沉积物中的稳定性,氧化处理可造成有机质破坏。
由于类脂物种类丰富,土壤及沉积物的类脂物具有较好的生源和环境指示意义,植硅体类脂物分析也备受学者关注。化学热分解法分析表明,植硅体含类脂物[14]。HF酸分解湿化法提取的竹叶植硅体GC-MS分析表明,类脂物主要有低碳数的正构脂肪酸三甲基硅酯,是正构脂肪酸的硅烷化的衍生物,碳数分布在C12~C16,具有明显的偶奇优势;低含量C21~C23的正构烷烃、以166 m/z 和178 m/z为特征离子峰的化合物及少量的未鉴定成分[15]。C-13核磁共振(13 C-NMR)分析表明,植硅体有机成分含少量的烷基碳,而热裂解的产物主要为正构烷烃和烯烃,碳数分布在C6~C34之间[17]。
核磁共振(13 C-NMR)分析表明植硅体有机成分主要含糖类[17],拉曼、红外光谱及射线光电子能谱分析表明竹子植硅体含纤维素、木质素[18]。
镶嵌在生物矿质(含生物硅)之间、构成有机框架的酸性蛋白质或糖蛋白,是生物矿物质的重要成分,植物非晶质硅酸解溶液中可以检测到各种氨基酸和糖类[40];射线光电子能谱分析表明酸消解提取的竹子植硅体含有蛋白质释放出的氨基氮和氨离子[18];Elbaum等[41]从植硅体中检测到碎片的糖蛋白,没有检测出DNA,认为任意植硅体中没有DNA或者不能用常规的方法提取获得DNA,植硅体的形成可能发生在细胞死亡或DNA降解之后,或者少量的DNA有可能存在于一些特定的类型中。
由此可见,植硅体形成能够封闭一定比重的有机质,主要有糖类、木质素、类脂物和蛋白质,暂时没有发现DNA,能够保留母源植物部分生源信息。
由于有机质在植硅体中赋存状态的复杂性,有机成分与硅、氢元素相互作用对植硅体结构和形成影响的复杂性[40],植硅体提取及降解方法对有机成分提取的影响、植硅体有机成分组成及存在形式有待于进一步研究。植硅体碳是碳循环的重要组成部分,不同生态系统的植硅体的碳汇潜力不同,不同植物植硅体碳的积累速率存在明显的差异,同种植物不同组织部位植硅体含碳量也不相同;另外,植硅体形态及其化学组成对其保存也有影响,从而影响其固碳[30, 42],据此可以优化生态系统植物种植结构,改良种植方式,提高植物植硅体含量及固碳积累率,发挥植硅体碳调节全球碳循环、缓解全球气候变暖等方面的重要作用。
1.3 无机成分植硅体除了圈闭有机成分外,还含有其他无机矿质元素。植硅体无机矿质元素组成研究主要涉及现代植物不同组织器官植硅体矿质元素组成与分布、植硅体圈闭元素在植物-土壤系统中迁移规律及影响因素研究(表 1)。
| 表 1 植硅体主要无机矿质元素研究 Table 1 Studies on major inorganic mineral elements occluded in phytolith |
大麦(Hordeum vulgare L.)植硅体中子活化分析(NAA)、桑树(Morus alba)叶片及水稻植硅体扫描电子显微镜和能谱仪(SEM-EDS)分析表明,植硅体由Na、Mg、Cl、K、Al、Ca、Si、Sc、Ti、V、Cr、Mn、Fe等多种常量化学和微量元素组成[26~27, 31, 43]。电感偶合等离子体质谱仪(ICP/MS)分析表明,法兰绒花(Actinotus helanthi(Apiaceae))和禾本科三齿稃草属植物(Triodia mitchelli(Poaceae))植硅体含有B、Na、Mg、Al、P、Ca、Sc、Ti、V、Cr、Mn、Fe、Ni、Cu、Zn、Ga、Ge、Se、Yb、Zr、Ba、Nd、Pb和Th等24种矿质元素[44]。栽培水稻叶片、茎植硅体含Al、Fe、Mg等元素,Al含量为0.01 % ~4.55 %,Fe含量为0~2.1 % [1, 30, 36]。K、Ca、Mg、Al、Fe、Mn等是植硅体中比较常见的矿质元素,N、P、Al、Fe、Ca、K、Na、Mn、Ti等元素含量为0.1 % ~5.6 % [30~31, 45]。植物硅淀积通常与Al、Fe、Ca、Cu淀积一起发生于水稻小圆尖型植硅体中,可能指示植物把这些毒性或多余的矿质元素固定在植硅体中,与植物“隔离”,通过这种方式来减轻这些元素对植物体的毒害或胁迫[27, 46]。多数植物植硅体中含有Ca元素,Ca通常和Si一起淀积在细胞壁中。由于原子大小的原因,Ca不可能取代到非晶体硅矿物中,可能直接或与细胞壁残留一起圈闭在植硅体中[3]。Hodson和Evans[47]发现Al和Si通常与植硅体的形成相联系,Al和Si累积在植物中是相互抑制的,高含量积Al的植物通常吸收较少的Si,而高含量积Si的植物通常吸收较少的Al。Trinh等[20]发现水稻茎植硅体含P、Si等元素,在500~700 ℃高温作用下,硅和磷溶解率较高。含植硅体丰富的生物炭可为农作物生长提供Si及K、N、P、Fe等元素,且与生物炭来源、热裂解温度及土壤特性有关[48~49]。植硅体封闭K是土壤K营养元素的重要来源之一,土壤植硅体K的利用率和有效性受土壤pH值、粘土含量及EC对植硅体溶解的影响[52]。水稻植硅体封闭的Pb是水稻土Pb库的重要组成部分,能够释放到土壤中,Pb污染水稻茎野外燃烧可造成Pb的挥发释放,可能对人类是一种健康风险[54]。
由此可见,封闭在植硅体的各种化学元素可伴随植硅体的形成和溶解在土壤-植物系统中迁移与循环,受植硅体来源植物种类、土壤特性及组成元素等多种因素影响,其循环模式同草地硅循环模式相似[36](如图 1),不同之处在于植硅体溶解后其他元素的存在形式和赋存状态与H4SiO4不同,为对应元素的可溶物、挥发物或其他矿物参与地球化学循环。不过,植硅体封闭无机矿物元素的研究植物种类偏少,大多元素淀积、迁移、转换等循环机制还不够清楚。
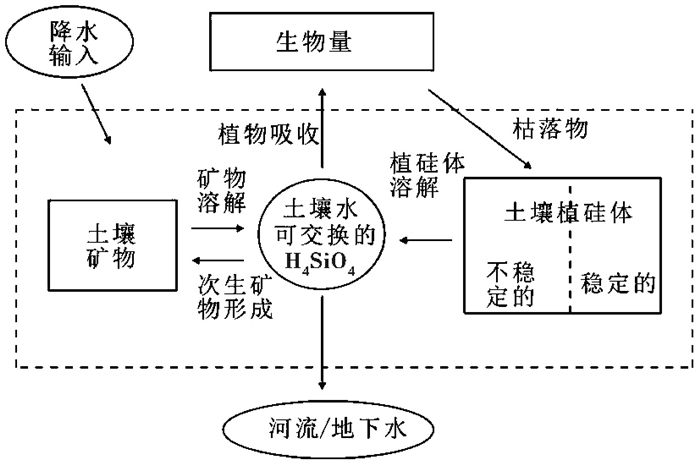
|
图 1 草地硅循环主要库及通量概念模型[36] Fig. 1 Conceptual model of major pools and fluxes associated with the terrestrial grassland Si cycle[36] |
植硅体同位素组成研究主要涉及Si、O、C元素,其中C同位素研究较为深入,植硅体碳同位素组成主要侧重其组成、分布及14 C测年研究。植硅体碳同位素组成(δ13C)及其生态环境指示意义研究已经在世界多个地区开展(如表 2),植硅体与母源植物δ13C组成一般呈正相关,但印度河流域C3、C4禾草植物植硅体δ13C与其母源植物δ13C组成有显著的相关性,而C3、C4灌木植物植硅体δ13C与其母源植物δ13C组成相关性不明显[57],不过,综合分析已发表植硅体δ13C数据表明,C3、C4植物植硅体δ13C与其母源植物δ13C组成之间总体呈显著正相关(R2=0.73)(如图 2)。植硅体δ13C组成相对于母源植物一般相对偏负,且C3草本植物植硅体δ13C组成偏负的程度小于C4植物,造成C3、C4植硅体δ13C之间差值小于其母源植物δ13C之间的差值,不过Carter[39]及Basu等[57]报道的C3植物植硅体δ13C组成与母源植物相比并没有出现明显的偏负现象(如表 2)。由于类脂物具有偏负的δ13C组成,植硅体δ13C组成偏负于母源植物可能与植硅体所含类脂物有关[14]。有机质含量较低的C4草本植物炭,其δ13C负偏于植物体,而C3类植物(乔木或灌木)不明显,可能与其植硅体所含类脂物不同有关[17]。大气CO2的δ13C与植物δ13C存在联系,可以进行不同植物与植硅体δ13C组成差值的定量和校正研究,以通过测试植硅体δ13C值来计算CO2的δ13C值,这为植硅体δ13C重建古大气CO2碳同位素组成变化提供了可能[39]。
| 表 2 不同光合作用植物及其植硅体碳同位素分布(数据来源Basu等[57]) (‰,VPDB) Table 2 The δ13C values of phytoliths and their source plant with different photosynthetic pathway (data from Basu et al. [57])(‰, VPDB) |

|
图 2 植硅体与母源植物δ13C组成呈正相关数据来源Basu等[57] Fig. 2 The δ13C values of phytoliths are positively correlated with those of the source plants(data from Basu et al. [57]) |
不同植物植硅体碳同位素组成端元值及其与母源植物碳同位素组成的关系表现出复杂性,一方面可能与植物种类有关,也可能与植硅体提取、提纯方法或植硅体碳同位素组成实验室测试条件差异相联系。增加植物种类研究数量、摸索和规范实验提取及测试方法有利于推动植硅体δ13C研究。
植硅体内14 C,可代表植物生长时期外界大气CO2的放射性碳水平,由于植硅体碳保存较好,不易被外界污染,植硅体14 C组成广泛应用于考古、地质学及生态学测年研究[59~60]。然而,植硅体14 C测年受植硅体提取方法、测试方法及植硅体接受植物吸收老碳影响,其准确性及可靠性备受争议[60],其校正研究不断深入。
2 植硅体化学组成的影响因素 2.1 植硅体化学组成与植物种类及产出部位有关不同品种的水稻植硅体,所含的碳、SiO2及矿质元素不同[30]。不同种的杜鹃科植物(Ericaeae)生长在相同土壤条件下叶片植硅体所含矿质元素不同[55]。王永吉[29]发现不同植物植硅体化学元素组成不同。C3、C4草本植物植硅体碳同位素组成不同,能够反映其来源植物C3、C4植物种类,北美、新西兰、中国及印度等地C3、C4植物植硅体碳同位素端元值分布存在显著的空间差异,主要与植物种类有关[57]。Parr等[61]分析了10种竹子的植硅体碳的含量,发现植硅体封闭碳在1.4 % ~4.0 %之间,植硅体碳含量与竹子种类有关。Carnelli等[53]对禾本科(Poaceae),莎草科(Cyperaceae),杜鹃花科(Ericaceae)和针叶树类(Coniferae)中的20种植物植硅体的铝元素进行了研究,发现杜鹃花科(Ericaceae)、针叶树类(Coniferae)比禾本科(Poaceae)、莎草科(Cyperaceae)含有较高的铝元素,并认为植硅体Al在古生态研究中可以作为木本植物出现的重要标志物。不同植物植硅体含Al、H2O等成分不同,其溶解率不同,高含水量、低含Al量的落叶阔叶树种植硅体相对低含水量、高含Al量的松科植物植硅体溶解率较高[45]。因此,植硅体化学组成与植物种类有关,相同生长条件下,植硅体的含量和化学组成可能存在潜在的植物分类指示意义,可用于古植被、古生态重建研究。
受植物生理影响,同种植物不同组织或器官植硅体的碳及矿质元素组成不同。强蒸发的水稻叶及叶鞘部位SiO2含量高,且相对于种子和茎植硅体富集Al和Fe(Si/Al和Si/Fe较低);植硅体水含量为5.4 % ~14.5 %之间,呈现的趋势为茎>叶>叶鞘=稻谷,植硅体SiO2含量稻谷(94.71 %)最高,随叶鞘(92.50 %)、叶(88.47 %)、茎(83.04 %)逐渐降低[30]。水稻壳与叶片植硅体硅、氧、钙、钾和镁的含量不同,水稻壳植硅体热稳定性高于叶片[26]。大麦茎、叶及芒植硅体中均能检测到C、Si、K、Ca、Mg、Al、Fe、Mn等元素,而水稻叶片、茎等组织器官中的植硅体没有检测到K、Ca、P、Mn等元素[30~31]。植硅体碳、氧、硅同位素组成随植物组织部位不同而变化,通常与植物光合作用方式和蒸腾作用有关[3, 62]。因此,可根据植物不同部位植硅体化学组成进行植硅体形成机制探讨、植物组织部位来源鉴定。
2.2 植硅体化学组成与植物生长环境植硅体的化学组成与其生长的气候、土壤环境有关;同种植物在不同土壤条件下,植硅体化学元素组成不同[55, 63]。伊比利亚硫化铁矿区金属污染土壤生长的杜鹃(Ericaeae)叶片植硅体,其Ca、Al等金属元素含量相对较高,非矿区蛇纹岩土壤生长的种类,Cr和Ni含量较高[55]。加拿大安大略省Muskoka的pH为4.2土壤生长的白松(Pinus strobus),其针叶顶端传输组织Al和Si一起淀积,但其Al含量明显高于采集于多伦多pH为6.7土壤生长的样品,表明植物积累Al不仅与植物种类有关,还与土壤Al的供给密切相关,酸性比中性或碱性土壤Al含量高,生长的植物对Al的吸收较多[63]。不同岩性生长的毛竹(Phyllostachys pubescens)植硅体含碳量具有明显差异,表现为花岗闪长岩﹥花岗岩﹥玄武岩﹥页岩,可能与岩石风化程度以及母岩中SiO2含量有关[64]。现代植物植硅体可分为主要受基因控制的稳定型及易受环境因子影响的环境敏感型,稳定型主要包括禾草短细胞植硅体,环境敏感型主要包括长细胞和气孔细胞植硅体。一些谷物环境敏感型植硅体形成受水分管理制度的影响,X射线分析表明,检验样品纯SiO2的Si ︰ O为1 ︰ 2,水分管理干燥状态下小麦(Triticum aestivum)环境敏感型植硅体Si ︰ O比为1 ︰ 3.3,而湿润状态下Si ︰ O比为1:4.4,说明植硅体化学结合水与植物生长期间水的供给或灌溉条件有关。湿润状态下植硅体含有较多的结合水,而野外生长的此种小麦环境敏感型植硅体Si ︰ O为1 ︰ 2.8,可能不仅与植物生长水分供给有关,同时还与生长气候影响的蒸腾率相联系(如图 3)[65]。融安黄竹(Dendrocalamus ronganensis)、玉米(Zea mays)不同生长季节的植硅体形态、组合存在明显的变化[4, 66]。现代植物植硅体的形成受温度、降水、湿度、二氧化碳浓度、土壤pH及养分的影响[10, 67~70],其碳、氧同位素的组成,不仅与植物生长土壤水和蒸腾作用有关,还与空气湿度及大气温度有关[3, 56, 71~74]。不同气候带土壤植硅体碳同位素组成能够反映C3、C4草本植物的比重[16, 58],印度恒河中、下流域不同地区C3、C4植物δ13C组成能够响应平均降雨量,C3、C4草本植物δ13C与其植硅体δ13C存在显著的相关性[57],因此,植硅体δ13C组成有可能响应平均降雨量变化。
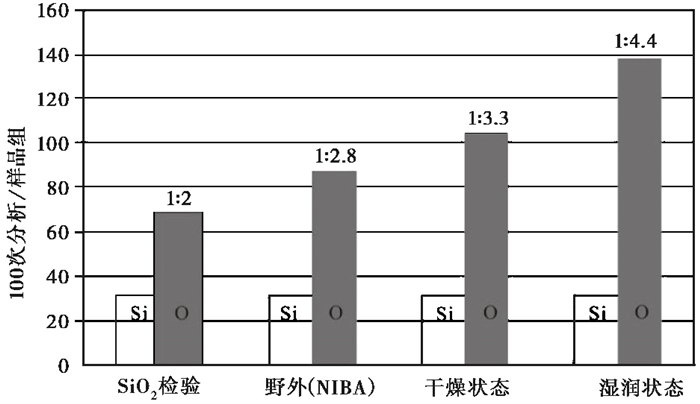
|
图 3 SiO2检验样品及人工培养室(干旱及湿润状况)及NIAB野外生长小麦X射线分析的Si ︰ O比值[65] Fig. 3 Ratios of silicon and oxygen from the X-rays micro- analyses of the SiO2 test and T.aestivum L.(bread wheat) crops from the NIAB field and the growing chamber (dry and wet regime)[65] |
因此,同种植物在不同环境下所形成的植硅体化学组成有较大差异,此研究不仅可探讨植硅体的形成机制,还可根据植硅体化学组成推断其生长环境,重建古环境、古气候。
2.3 植硅体化学组成与细胞微环境植硅体淀积与细胞部位有关[75~77]。植物可在细胞壁及细胞腔淀积硅分别形成植硅体。以细胞壁中的糖类为基质淀积形成植硅体,至今最典型的是金丝雀虉草(P.canariensis)外稃远轴面外部的大型表皮毛发植硅体的形成,成熟的大型表皮毛发长度平均为376 μm,圆锥花序没有出现之前,基本没有硅在表皮毛发中淀积,然而,在随后的两周内绝大部分植硅体在此形成[75]。Hodson等[76]对大型表皮毛发中硅淀积进行了透射电子显微镜和X-射线显微分析发现,圆锥花序出现之前,大型表皮毛发有较大的液泡和薄的细胞壁,但没有发现硅,当细胞壁的外部出现一薄层硅,随后的两周内细胞壁硅质大大加厚,细胞质破坏以后最终就剩下很小的细胞腔,最后整个细胞壁硅化。Perry等[77]分析了成熟表皮毛发的化学组成,发现其含40 %的硅,55 %的多糖(53 %己糖、45 %戊糖、少量糖醛酸)和不足5 %的蛋白质;表皮毛发中的植硅体形成经历片状、球状和纤维状的形成过程。植硅体的淀积以生物体内的细胞壁和细胞膜为组装二氧化硅的模板,这种有序的生物高分子模板表面有确定的位点成为矿质元素生长的核[78]。可溶性单硅酸进入植物体内,其亲水性羟基可与各种亲水成分通过分子间弱相互作用力形成SiO(OH)单元固定在植物体内,成为硅酸继续水解沉淀的核[79]。植物在演化过程中为了减轻Ca2+和碳酸钙对细胞的毒害作用,也能淀积钙质矿物,碳酸钙和草酸钙最常见。植物Ca2+矿化最典型的例子有含晶异细胞和钟乳体,含晶异细胞散布于植物表皮及薄壁组织中,能够在液泡中淀积钙质矿物,草酸钙在植物界最常见,多来自于液泡;钟乳体通常是植物在细胞壁中淀积的碳酸钙,有晶质和非晶质形式,通常含纤维素、果胶和其他细胞壁多聚糖[13]。钙和硅一起淀积是一种常见现象,由于钙对细胞质有毒害作用,钙淀积多发生在细胞壁中,通常和细胞壁淀积一起[3]。在某些情况,钙和硅能够形成精细的组织结构,如荨麻(Urtica dioica)刺毛细胞壁的基部和下部是钙质淀积,上部是硅质淀积[80]。
植物细胞腔内的积硅不同于细胞壁有糖类做基质,也不同于硅藻在膜束缚的硅淀积囊泡(Silica deposited vesicle,简称SDV)中进行,细胞内硅淀积一般与原生质的分解相联系[3]。Zhang等[81]推测植硅体的形成可分为两个阶段,首先是细胞壁的木质化和硅化,然后细胞腔内逐渐硅化,细胞内的硅化首先是细胞壁内层出现针状硅质结构,然后逐步填充整个细胞腔。Carter[39]提出了一种植硅体圈闭碳形成模型:具有液泡结构的植物细胞在生长过程中,其细胞液中通常会包含硅酸;在细胞与胞外环境进行液体交换的过程中,硅酸会不断浓缩,当液泡中的硅酸浓度上升到能聚合的程度后就会形成植硅体。由于细胞腔内形成的植硅体与细胞质的降解相联系,植硅体的化学组成可能多蛋白质、脂类等原生质物质[39, 41]。硅淀积的细胞环境不同可能导致植硅体折射率变化,指示着其水合作用程度及密度的变化[13]。
植硅体淀积与细胞类型有关[4, 29, 82]。不同类型细胞,产出部位存在差别,生理功能也不尽相同,形成植硅体的硅及其他元素可能不同。一些植物在生长周期内,植硅体形态、大小及组合存在显著变化,与植物生长阶段及环境因子有关。在生长季节的初期,赤竹属山白竹(Sasa veitchii(Carriére)Rehder)短细胞优先积硅,可能与植物主动积硅有关[82]。李仁成等[4]研究发现融安黄竹(D.ronganensis)竹叶植硅体形成有明显的季节变化,在生长季节的早期,短细胞优先形成,叶片成熟后很少有短细胞植硅体形成;机动细胞植硅体在蒸腾作用旺盛的夏季形成较多,而棒型和尖型植硅体在生长衰老的叶片或低温的生长季节末期比重较高。玉米生长季节内,前3片真叶植硅体种类与其后生真叶存在显著差异,前3片真叶含有大量的3叶片及3叶片以上多铃型,几乎不含十字型和椭圆-哑铃型(平面观似哑铃型、侧面观似帽型,镜下叶片圆面不针对观察者),随着生长天数增加及生长温度的升高,第4~5片真叶3叶片以上多铃型消失,哑铃型含量逐渐增加[66]。不同的细胞类型积硅时间具有一定的差异,外界环境不同,可能造成不同类型植硅体化学组成的差异。
由于植物细胞硅化发生在不同类型的细胞及细胞内环境,植物硅淀积的条件至今了解很少[13]。植硅体淀积细胞微环境不同,其化学组成应当存在差异,因此,不同形态植硅体化学组成的差异研究是揭示植硅体淀积细胞微环境的有效手段。电子探针、X-射线能谱及X-射线荧光光谱等测试技术能够原位测定微区的化学元素组成,尤其是电子探针利用X射线能谱和波谱技术,不仅可以测试植硅体微区元素的组成,还能定量测试元素的丰度。然而,由于植物组织表面不光滑、质地不均匀、硅质含量低等原因,植物切片电子探针分析定量困难[28];王永吉[29]初步尝试了磨片植硅体电子探针化学元素测试,发现不同形态植硅体化学组成不同,但部分样品测的碳含量出现高值,可能由于电子探针定量测定低碳数元素比较困难,试样喷碳影响了碳元素的准确测定,因此,植硅体电子探针元素测试技术还需进一步研究。
3 结论与展望植硅体主要成分为二氧化硅、水,化学组成研究还涉及有机物、无机矿质元素及组成元素C、Si、O同位素组成,植硅体化学组成与植物的产出部位、植物生长环境及植硅体形成的细胞微环境及类型有关。植硅体化学组成研究有利于认识植硅体的形成机制及其植物生理意义,认识植硅体碳、硅循环及其他元素的化学迁移特征及规律。植硅体化学组成结合形态分析,有利于提高植硅体来源植物种类鉴别的准确性,其化学组成分析可以为考古植物种类鉴定、植物生长环境重建提供新的认识。植硅体化学组成及同位素分析具有一定古环境重建应用潜力。
植硅体化学组成由于受提取方法、测试技术和方法影响,植硅体化学组成和丰度准确性还不够,对比困难;一些化学组成的赋存状态尚不清楚,植硅体的形成机制尚无定论;植硅体碳、硅以外其他化学元素地球化学循环研究尚少,植硅体化学组成研究有待于进一步深入。
由于不同植物植硅体化学组成不同,有可能利用其化学组成差异进行植物种类鉴定,用于古植被重建,考古领域人类种植、利用农作物种类的鉴定。可以调查不同环境条件下植物生长形成植硅体化学组成变化,以解译土壤及沉积物植硅体化学组成变化的生态、环境信息。其中,现代植物植硅体化学组成(水、Si含量)可能与岩性及气候变化有关,可能具有一定的古生态、环境研究价值;植硅体碳同位素组成与其来源植物总有机碳同位素组成有一定的联系,土壤及沉积物草本植物植硅体碳同位素组成能够反映C3/C4比重,但不同地区植硅体碳同位素组成端元值存在显著差异,植硅体碳同位素组成的环境信号至今了解不多;植硅体氧同位素组成与大气温度、降水、土壤湿度、蒸发量有关,植硅体碳、氧同位素组成与植物种类、植物生长环境因子的关系研究仍然不足。因此,现代植物植硅体化学组成调查及其与环境因子之间的关系研究仍然是考古学及古环境研究的热点内容。
尽管植硅体化学元素组成测试方法较多,但大多方法不能针对不同形态植硅体进行测试。电子探针能够进行植硅体微区元素组成及定量分析。由于植硅体化学组成受植物种类、形成细胞的部位及类型影响;生长季节的初期竹亚科部分植物短细胞优先积硅属于主动积硅过程,因此,植硅体电子探针化学元素组成研究有利于了解不同形态植硅体的化学组成,可能提供不同植物、不同细胞类型、细胞环境对植硅体化学组成的影响及植物生长过程中主动积硅的信号,为植硅体化学组成应用于植物种类鉴定及植硅体形成机制解释提供新的思路。
致谢: 非常感谢审稿专家和编辑部杨美芳老师中肯、细致的修改意见。
| [1] |
王永吉, 吕厚远. 植物硅酸体研究及应用[M]. 北京: 海洋出版社, 1993: 1-32. Wang Yongji, Lü Houyuan. Phytolith Study and Its Application[M]. Beijing: China Ocean Press, 1993: 1-32. |
| [2] |
Tao X Y, Wen M D, Li R C, et al. Phytolith sizes and assemblages differentiate genera and ecotypes of woody bamboos in subtropical Southwest China[J]. Review of Palaebotany and Palynology, 2020, 272: 104129. DOI:10.1016/j.revpalbo.2019.104129 |
| [3] |
Hodson M J. The development of phytoliths in plants and its influence on their chemistry and isotopic composition. Implications for palaeoecology and archaeology[J]. Journal of Archaeological Science, 2016, 68: 62-69. DOI:10.1016/j.jas.2015.09.002 |
| [4] |
Li R C, Fan J, John C, et al. Phytolith monthly variations in the leaves of the bamboo Dendrocalamus ronganensis(Poaceae:Bambusoideae)[J]. Review of Palaeobotany and Palynology, 2017, 246: 62-69. DOI:10.1016/j.revpalbo.2017.06.006 |
| [5] |
Ball T, Chandler-Ezell K, Dickau R, et al. Phytoliths as a tool for investigations of agricultural origins and dispersals around the world[J]. Journal of Archaeological Science, 2016, 68: 32-45. DOI:10.1016/j.jas.2015.08.010 |
| [6] |
Lu H, Zhang J, Wu N, et al. Phytoliths analysis for the discrimination of foxtail millet(Setaria italica)and common millet(Panicum miliaceum)[J]. PLoS One, 2009, 4(2): e4448. DOI:10.1371/journal.pone.0004448 |
| [7] |
Alexandre A, Meunier J D, Lezine A M, et al. Phytoliths:Indicators of grassland dynamics during the Late Holocene in intertropical Africa[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1997, 136(1-4): 213-229. DOI:10.1016/S0031-0182(97)00089-8 |
| [8] |
Barboni D, Bonnefille R, Alexandre A, et al. Phytoliths as palaeoenvironmental indicators, west side Middle Awash Valley, Ethiopia[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 1999, 152(1-2): 87-100. DOI:10.1016/S0031-0182(99)00045-0 |
| [9] |
Li R C, Cater J A, Xie S C, et al. Phytoliths and microcharcoal at Jinluojia archeological site in middle reaches of Yangtze River indicative of paleoclimate and human activity during the last 3000 years[J]. Journal of Archaeological Science, 2010, 37(1): 124-132. DOI:10.1016/j.jas.2009.09.022 |
| [10] |
Lu H Y, Liu K B. Morphological variations of lobate phytoliths from grasses in China and the Southeastern USA[J]. Diversity and Distributions, 2003, 9(1): 73-87. |
| [11] |
张健平, 吕厚远, 葛勇, 等. 粟类作物稃片植硅体形态研究回顾与展望[J]. 第四纪研究, 2019, 39(1): 1-11. Zhang Jianping, Lü Houyuan, Ge Yong, et al. Review and prospect of phytolith morphology on millets identification[J]. Quaternary Sciences, 2019, 39(1): 1-11. |
| [12] |
顾延生, 季雅斌, 管硕, 等. 植硅体形态测量学研究与应用概述[J]. 第四纪研究, 2019, 39(1): 12-23. Gu Yansheng, Ji Yabin, Guan Shuo, et al. An introduction to the research and application of phytolith morphometrics[J]. Quaternary Sciences, 2019, 39(1): 12-23. |
| [13] |
Bauer P, Elbaum R, Weiss I M. Calcium and silicon mineralization in land plants:Transport, structure and function[J]. Plant Science, 2011, 180(6): 746-756. DOI:10.1016/j.plantsci.2011.01.019 |
| [14] |
Smith F A, White J W C. Modern calibration of phytolith carbon signatures for C3/C4 paleograss land reconstruction[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2004, 207(3-4): 277-304. DOI:10.1016/j.palaeo.2003.09.029 |
| [15] |
李仁成.竹叶及其植硅体类脂物的分类学意义及其季节性变化[D].武汉: 中国地质大学(武汉)博士学位论文, 2010: 85-89. Li Rencheng. Taxonomic Significance and Seasonal Variations of Lipid from Bamboo Leaf and Its Phytolith[D]. Wuhan: The Doctoral Thesis of China University of Geosciences(Wuhan), 2010: 85-89. http://cdmd.cnki.com.cn/article/cdmd-10491-2010250459.htm |
| [16] |
Kelly E, Amundson R G, Marino B D, et al. Stable isotope ratios of carbon in phytoliths as a quantitative method of monitoring vegetation and climate change[J]. Quaternary Research, 1991, 35(2): 222-233. |
| [17] |
Krull E S, Skjemstada J O, Graetzb D, et al. 13C-depleted charcoal from C4 grasses and the role of occluded carbon in phytoliths[J]. Organic Geochemistry, 2003, 34(9): 1337-1352. DOI:10.1016/S0146-6380(03)00100-1 |
| [18] |
Watling K M, Parr J F, Rintoul L, et al. Raman, infrared and XPS study of bamboo phytoliths after chemical digestion[J]. Pectrochimica Acta-Part A:Molecular and Biomolecular Spectroscopy, 2011, 80(1): 106-111. DOI:10.1016/j.saa.2011.03.002 |
| [19] |
Espíndola-Gonzalez A, Martínez-Hernández A L, Angeles-Chávez C, et al. Novel crystalline SiO2 nanoparticles via annelids bioprocessing of agro-industrial wastes[J]. Nanoscale Research Letters, 2010, 5(9): 1408-1417. DOI:10.1007/s11671-010-9654-6 |
| [20] |
Trinh T K, Nguyen T T H, Tu N N, et al. Characterization and dissolution properties of phytolith occluded phosphorus in rice straw[J]. Soil & Tillage Research, 2017, 171: 19-24. DOI:10.1016/j.still.2017.04.002 |
| [21] |
Gal A, Weiner S, Addadi L. The stabilizing effect of silicate on biogenic and synthetic amorphous calcium carbonate[J]. Journal of the American Chemical Society, 2010, 132(38): 13208-13211. DOI:10.1021/ja106883c |
| [22] |
Monje P V, Baran E J. First evidences of the bioaccumulation of α-quartz in Cactaceae[J]. Journal of Plant Physiology, 2000, 157(4): 457-460. DOI:10.1016/S0176-1617(00)80032-2 |
| [23] |
Taylor M G, Simkiss K, Greaves G N, et al. An X-ray absorption spectroscopy study of the structure and transformation of amorphous calcium carbonate from plant cystoliths[J]. Proceedings of the Royal Society B:Biological Sciences, 1993, 252(1333): 75-80. DOI:10.1098/rspb.1993.0048 |
| [24] |
Jakes K, Mitchell J. Cold plasma ashing preparation of plant phytoliths and their examination with Scanning Electron Microscopy and Energy Dispersive Analysis of X-rays[J]. Journal of Archaeological Science, 1996, 23(1): 149-156. DOI:10.1006/jasc.1996.0012 |
| [25] |
Shillito L M, Almond M J, Nicholson J, et al. Rapid characterisation of archaeological midden components using FT-IR spectroscopy, SEM-EDX and micro-XRD[J]. Spectrochimica Acta-Part A:Molecular and Biomolecular Spectroscopy, 2009, 73(1): 133-139. DOI:10.1016/j.saa.2009.02.004 |
| [26] |
Wu Y, Yang Y M, Wang H, et al. The effects of chemical composition and distribution on the preservation of phytolith morphology[J]. Applied Physics A, 2014, 114(2): 503-507. DOI:10.1007/s00339-013-7616-4 |
| [27] |
Anala R, Nambisan P. Study of morphology and chemical composition of phytoliths on the surface of paddy straw[J]. Paddy and Water Environment, 2015, 13(4): 521-527. DOI:10.1007/s10333-014-0468-5 |
| [28] |
Hayward D M, Parry D W. Electron-probe microanalysis studies of silica distribution in Barley(Hordeum sativum L.)[J]. Aannals of Bontany, 1973, 37(3): 579-591. |
| [29] |
王永吉. 植物硅酸体化学成分的研究[J]. 黄渤海海洋, 1998, 16(3): 33-37. Wang Yongji. A study on the chemical composition of phytolith[J]. Journal of Oceanography of Huanghai & Bohai Sea, 1998, 16(3): 33-37. |
| [30] |
Li Z M, Song Z L, Cornelis J. Impact of rice cultivar and organ on elemental composition of phytoliths and the release of bio-available silicon[J]. Frontier of Plant Science, 2014, 5: 1-8. DOI:10.3389/fpls.2014.00529 |
| [31] |
Kameník J, Mizera J, Řanda Z. Chemical composition of plant silica phytoliths[J]. Environmental Chemistry Letters, 2013, 11(2): 189-195. DOI:10.1007/s10311-012-0396-9 |
| [32] |
Mann S, Perry C C. Structural aspects of biogenic silica[J]. Ciba Foundation Symposium, 1986, 121: 40-58. DOI:10.1002/9780470513323.ch4 |
| [33] |
Schulz-Kornas E, Braune C, Winkler D E, et al. Does silica concentration and phytolith ultrastructure relate to phytolith hardness?[J]. Biosurface and Biotribology, 2018, 3(4): 135-143. |
| [34] |
Kaufman P B, Petering L B, Smith J G. Ultrastructural development of cork-silica cell pairs in avena internodal epidermis[J]. Botanical Gazette, 1970, 131(3): 173-185. DOI:10.1086/336529 |
| [35] |
Mann S, Perry C C, Williams R J P, et al. The characterization of the nature of silica in biological systems[J]. Journal of the Chemical Society Chemical Communications, 1983, 4(4): 168-170. |
| [36] |
Blecker S W, Mcculley R L, Chadwick O A, et al. Biologic cycling of silica across a grassland bioclimosequence[J]. Global Biogeochemical Cycles, 2006, 20(3): GB3023. DOI:10.1029/2006GB002690,2006 |
| [37] |
Parr J F, Sullivan L A. Soil carbon sequestration in phytoliths[J]. Soil Biology Biochemistry, 2005, 37(1): 117-124. DOI:10.1016/j.soilbio.2004.06.013 |
| [38] |
Song Z L, McGrouther K, Wang H L. Occurrence, turnover and carbon sequestration potential of phytoliths in terrestrial ecosystems[J]. Earth-Science Reviews, 2016, 158: 19-30. DOI:10.1016/j.earscirev.2016.04.007 |
| [39] |
Carter J A. Atmospheric carbon isotope signatures in phytolith-occluded carbon[J]. Quaternary International, 2009, 193(1): 20-29. |
| [40] |
Harrison C C. Evidence for intramineral macromolecules containing protein from plant silicas[J]. Phytochemistry, 1996, 41(1): 37-42. |
| [41] |
Elbaum R, Melamed-Bessudo C, Tuross N. New methods to isolate organic materials from silicified phytoliths reveal fragmented glycoproteins but no DNA[J]. Quaternary International, 2009, 193(1-2): 11-19. DOI:10.1016/j.quaint.2007.07.006 |
| [42] |
Li Z M, Song Z L, Parr J F, et al. Occluded C in rice phytoliths:Implications to biogeochemical carbon sequestration[J]. Plant Soil, 2013, 370(1-2): 615-623. DOI:10.1007/s11104-013-1661-9 |
| [43] |
Tsutsui O, Sakamoto R, Obayashi M, et al. Light and SEM observation of opal phytoliths in the mulberry leaf[J]. Flora, 2016, 218: 44-50. DOI:10.1016/j.flora.2015.11.006 |
| [44] |
Hart D M. Elements occluded within phytoliths[M]//Meunier J D, Colin F eds. Phytoliths-Applications in Earth Science and Human History. The Netherlands, Lisse: A. A. Balkema, 2001: 313-316.
|
| [45] |
Bartoli F, Wilding L P. Dissolution of biogenic opal as a function of its physical and chemical properties[J]. Soil Science Society of America Journal, 1980, 44: 873-878. DOI:10.2136/sssaj1980.03615995004400040043x |
| [46] |
Raven J A. The transport and function of silica in plants[J]. Biological Reviews, 2010, 58(2): 179-207. |
| [47] |
Hodson M J, Evans D E. Aluminium/silicon interactions in higher plants[J]. Journal of Experimental Botany, 1995, 46(2): 161-171. |
| [48] |
Li Z, Song Z, Singh B P, et al. The impact of crop residue biochars on silicon and nutrient cycles in croplands[J]. Science of the Total Environment, 2019, 659: 673-680. DOI:10.1016/j.scitotenv.2018.12.381 |
| [49] |
Li Z, Unzué-Belmonte D, Cornelis J T, et al. Effects of phytolithic rice-straw biochar, soil buffering capacity and pH on silicon bioavailability[J]. Plant and Soil, 2019, 438(1-2): 187-203. DOI:10.1007/s11104-019-04013-0 |
| [50] |
Hodson M J, Sangster A G. Aluminium/silicon interactions in conifers[J]. Journal of Inorganic Biochemistry, 1999, 76(2): 89-98. |
| [51] |
Gal A, Hirsch A, Siegel S, et al. Plant cystoliths:A complex functional biocomposite of four distinct silica and amorphous calcium carbonate phases[J]. Chemistry, 2012, 18(3): 10262-10270. |
| [52] |
Nguyen H X, Nguyen V T, Tran C T, et al. Characterization and implication of phytolith-associated potassium in rice straw and paddy soils[J]. Archives of Agronomy and Soil Science, 2019, 65(10): 1354-1369. DOI:10.1080/03650340.2018.1564908 |
| [53] |
Carnelli A L, Madella M, Theurillat J P, et al. Aluminum in the opal silica reticule of phytoliths:A new tool in palaeoecological studies[J]. America Journal of Botany, 2002, 89(2): 346-351. DOI:10.3732/ajb.89.2.346 |
| [54] |
Nguyen T N, Nguyen M N, McNamara M, et al. Encapsulation of lead in rice phytoliths as a possible pollutant source in paddy soils[J]. Environmental and Experimental Botany, 2019, 162: 58-66. DOI:10.1016/j.envexpbot.2019.02.009 |
| [55] |
Buján Eva. Elemental composition of phytoliths in modern plants(Ericaceae)[J]. Quaternary International, 2013, 287: 114-120. DOI:10.1016/j.quaint.2012.02.046 |
| [56] |
Webb E A, Longstaffe F J. Limitations on the climatic and ecological signals provided by the δ13C values of phytoliths from a C4 North American prairie grass[J]. Geochimica et Cosmochimica Acta, 2010(74): 3041-3050. DOI:10.1016/j.gca.2010.03.006 |
| [57] |
Basu S, Agrawal S, Sanyal P, et al. Carbon isotopic ratios of modern C3-C4 plants from the Gangetic Plain, India and its implications to paleovegetational reconstruction[J]. Palaeogeography, Palaeoclimatology, Palaeoecology, 2015, 440: 22-32. DOI:10.1016/j.palaeo.2015.08.012 |
| [58] |
Lu H, Wang Y, Wang G, et al. Analysis of carbon isotope in phytoliths from C3 and C4 plants and modern soils[J]. Chinese Science Bulletin, 2000, 45(19): 1804-1808. DOI:10.1007/BF02886272 |
| [59] |
Piperno D R, Stothert K E. Phytolith evidence for Early Holocene Cucurbita domestication in Southwest Ecuador[J]. Science, 2003, 299(5069): 1054-1057. |
| [60] |
左昕昕, 吴乃琴. 植硅体14C测年研究:过去、现在与未来[J]. 第四纪研究, 2019, 39(1): 59-66. Zuo Xinxin, Wu Naiqin. Phytolith radiocarbon dating:Past, present and future[J]. Quaternary Sciences, 2019, 39(1): 59-66. |
| [61] |
Parr J F, Sullivan L A, Chen B, et al. Carbon bio-sequestration within the phytoliths of economic bamboo species[J]. Global Change Biology, 2010, 16(10): 2661-2667. DOI:10.1111/j.1365-2486.2009.02118.x |
| [62] |
Ding T P, Zhou J X, Wan D F, et al. Silicon isotope fractionation in bamboo and its significance to the biogeochemical cycle of silicon[J]. Geochimica et Cosmochimica Acta, 2008, 72(5): 1381-1395. DOI:10.1016/j.gca.2008.01.008 |
| [63] |
Hodson M J, Sangster A G. X-ray microanalytical studies of mineral localization in the needles of white pine (Pinus strobus L.)[J]. Annals of Botany, 2002, 89: 367-374. DOI:10.1093/aob/mcf052 |
| [64] |
Li B, Song Z, Wang H, et al. Lithological control on phytolith carbon sequestration in moso bamboo forests[J]. Scientific Reports, 2014, 4(7504): 5262. |
| [65] |
Madella M, Jones M K, Echlin P, et al. Plant water availability and analytical microscopy of phytoliths:Implications for ancient irrigation in arid zones[J]. Quaternary International, 2009, 193(1): 32-40. DOI:10.1016/j.revpalbo.2017.06.006 |
| [66] |
李仁成, 谭淑慧, 覃翔, 等. 玉米生长周期内植硅体的变化研究[J]. 微体古生物学报, 2016, 33(2): 170-179. Li Rencheng, Tan Shuihui, Qin Xiang, et al. Studies on the phytolith variation in maize during growing season significance[J]. Acta Micropalaeontologica Sinica, 2016, 33(2): 170-179. |
| [67] |
介冬梅, 葛勇, 郭继勋, 等. 中国松嫩草原羊草植硅体对全球变暖和氮沉降模拟的响应研究[J]. 环境科学, 2010, 31(8): 1708-1715. Jie Dongmei, Ge Yong, Guo Jixun, et al. Response of phytolith in Leymus chinensis to the simulation of global warming and nitrogen deposition on Songnen Grassland, China[J]. Environmental Science, 2010, 31(8): 1708-1715. |
| [68] |
Ge Yong, Jie Dongmei, Guo Jixun, et al. Response of phytoliths in Leymus chinensis to the simulation of elevated global CO2 concentrations in Songnen Grassland, China[J]. Chinese Science Bulletin, 2010, 55(32): 3703-3708. DOI:10.1007/s11434-010-4123-2 |
| [69] |
Liu L, Jie D, Liu H, et al. , Response of phytoliths in Phragmites communis to humidity in NE China[J]. Quaternary International, 2013, 304: 193-199. DOI:10.1016/j.quaint.2013.03.020 |
| [70] |
李仁成, 樊俊, 高崇辉. 植硅体现代过程研究进展[J]. 地球科学进展, 2013, 28(12): 1287-1295. Li Rencheng, Fan Jun, Gao Chonghui. Advances in modern phytolith research[J]. Advances in Earth Science, 2013, 28(12): 1287-1295. |
| [71] |
Webb E, Longstaffef F J. Climatic influences on the oxygen isotopic composition of biogenic silica in prairie grass[J]. Geochimica et Cosmochimica Acta, 2002, 66(11): 1891-1904. DOI:10.1016/S0016-7037(02)00822-0 |
| [72] |
Webb E A, Longstaffe F J. The relationship between phytolith and plant-water 18O values in grasses[J]. Geochimica et Cosmochimica Acta, 2003, 67(8): 1437-1449. DOI:10.1016/S0016-7037(02)01300-5 |
| [73] |
Shahack-Gross R, Shemesh A, Yakir D, et al. Oxygen isotopic composition of opaline phytoliths:Potential for terrestrial climatic reconstruction[J]. Geochimica et Cosmochimica Acta, 1996, 60(20): 3949-3953. DOI:10.1016/0016-7037(96)00237-2 |
| [74] |
李仁成, 谢树成, 顾延生. 植硅体稳定同位素地球生物化学研究进展[J]. 地球科学研究进展, 2010, 25(8): 812-819. Li Rencheng, Xie Shucheng, Gu Yansheng. Advance in the biogeochemical study of phytolith stable isotope[J]. Advances in Earth Science, 2010, 25(8): 812-819. |
| [75] |
Sangster A G, Hodson M J, Parry D W, et al. A developmental study of silicification in the trichomes and associated epidermal structures of the grass Phalaris canariensis L[J]. Annals of Botany, 1983, 52(2): 171-187. |
| [76] |
Hodson M J, Sangster A G, Parry D W. An ultrastructural study on the development of silicified tissues in the lemma of Phalaris canariensis L.[J]. Proceedings of Royal Society B:Biological Science, 1984, 222(1229): 413-425. |
| [77] |
Perry C C, Williams R J P, Fry S C. Cell wall biosynthesis during silicification of grass hairs[J]. Journal of Plant Physiology, 1987, 126(4): 437-448. |
| [78] |
Bommel K J C V, Friggeri A, Shinkai S. Organic templates for the generation of inorganic materials[J]. Angewandte Chemie International Edition, 2003, 42(9): 980-999. DOI:10.1002/anie.200390284 |
| [79] |
白淑琴, 阿木日沙那, 那仁高娃, 等. 水稻中硅元素的分布及存在状态[J]. 应用与环境生物学报, 2012, 18(3): 444-449. Bai Shuqin, Amurishana, Gaowanaren, et al. Distribution and status of silicon in rice plant[J]. Chinese Journal of Applied & Environmental Biology, 2012, 18(3): 444-449. |
| [80] |
Hughes N P, Perry C C, Williams R J P, et al. A scanning proton microprobe study of stinging emergences from the leaf of the common stinging nettle Urtica dioica L.[J]. Nuclear Instruments & Methods in Physics Research B, 1988, 30(3): 383-387. |
| [81] |
Zhang C, Wang L, Zhang W, et al. Do lignification and silicification of the cell wall precede silicon deposition in the silica cell of the rice(Oryza sativa L.)leaf epidermis?[J]. Plant Soil, 2013, 372(1-2): 137-149. DOI:10.1007/s11104-013-1723-z |
| [82] |
Motomura H, Fujii T, Suzuki M. Silica deposition in relation to ageing of leaf tissues in Sasa veitchii(Carrière)Rehder(Poaceae:Bambusoideae)[J]. Annals of Botany, 2004, 93(3): 235-248. |
2 Guangxi Key Laboratory of Hidden Metallic Ore Deposits Exploration, Guilin 541004, Guangxi)
Abstract
The study on chemical compositions of modern plant phytoliths is helpful to reveal the relationships between the chemical composition of phytoliths and cell morphology, plant species and plant growth environment, and to understand the mechanism of phytolith formation, plant classification and ecological significance. The measurement technologies and methods of phytolith chemical composition are various and involved in major chemical elements and isotopic compositions of Si, O and C. The test results showed SiO2 and H2O form the basis of phytolith, few organic components and various inorganic mineral elements are occluded in phytolith. Some achievements were got on the existing form of organic components, the cycle (deposition, migration) mechanism of some elements occluded in phytolith, the compositions and distributions of carbon isotope in phytolith and their ecological indicative significance, and 14C age of phytolith. The chemical compositions of phytoliths are influenced by plant species and plant tissue parts, the cellular micro-environment which phytoliths are deposited, and by plant growing conditions. The study of phytolith chemical composition is significant to understand the mechanisms of phytolith, and the natural cycle of Si, C and other elements related to phytolith. Some chemical elements, stable isotope compositions of phytoliths, and 14C age of phytolith are potential stools for paleoenvironmental reconstruction and archaeological research. The investigation of chemical compositions of phytoliths from modern plants and their relationship with environmental conditions which phytoliths formed, and the electron probe microanalysis (EPMA) of phytoliths are necessary to be further developed. 2020, Vol.40
2020, Vol.40
