2 福建师范大学湿润亚热带生态地理过程教育部重点实验室, 福建 福州 350007;
3 福建师范大学地理研究所, 福建 福州 350007)
温室气体过量排放引起全球气候持续变暖已成为国际社会公认的全球性环境问题[1~2],湿地作为陆地生态碳“汇”的重要组成部分,在全球碳循环中占据着不可忽略的重要作用,据估计全球湿地有机碳储量约为120~260 Pg,相当于陆地生态圈总碳储量的20 % [3]。但是湿地中的有机碳受多种因素影响很快被分解并再次释放进入大气圈,其中湿地甲烷的排放量约占全球的40 % [4],湿地从碳“汇”地变成碳“源”地,因此,现在亟需找出一种长期稳定的固碳方式。
植硅体是植物从土壤中吸收可溶性单硅酸,在体内形成的含水非晶态二氧化硅颗粒,在形成过程中会包裹一定的有机碳,这部分碳被称作植硅体碳(Phytolith-Occluded Carbon,简称PhytOC)[5~6]。植硅体耐高温,耐腐蚀,具有很强的抗分解能力,可在土壤中存留几千到上万年[5, 7],甚至百万年[8],植硅体封存的有机碳在植物凋落归还土壤后,能够被较长时间的保存下来,在土壤中形成巨大的碳库,近年来被普遍认为是一种稳定的碳汇方式[9]。不同植物植硅体固碳潜力存在明显差异,其中湿地植物平均植硅体固碳速率为0.04 t/(hm2·a)[10],全球湿地植物植硅体每年可以封存1.14×107 t CO2[11],中国草本植物占主导地位的湿地植物植硅体每年可以封存0.04×106~1.05×106 t CO2[10],世界水稻植硅体固碳量约占全球2007年CO2排放量的0.02~0.05 % [12]。此外,森林[13~14]、草地[15~16]、农田[17~18]等生态系统植物植硅体固碳均做过研究,而作为全球气候变化最为敏感的生态系统之一的河口湿地[19],在植硅体固碳方面的研究鲜有报道。
闽江河口湿地是我国东南沿海地区面积最大的河口潮汐湿地,本地种芦苇、短叶茳芏和入侵种互花米草碳储量均占生态系统30 %以上[20],据统计,这3种植物湿地年均甲烷排放通量分别为0.436 t/(hm2·a)、0.053 t/(hm2·a)和0.965 t/(hm2·a)[21~22],通过植物固定下来的大量的碳又再次被释放到大气中,那么这些植物通过植硅体能够固定多少碳?同种植物在相互交错的地带其植硅体固碳能力是否会受到影响,目前尚不清楚。因此,以闽江口鳝鱼滩湿地为研究对象,对植物的植硅体固碳能力方面展开相关研究,这样不但可以帮助人类找到新的碳汇方式,能更客观地认识碳的生物地球化学循环过程,还可以为研究硅素循环和互花米草入侵机制提供新的思路。
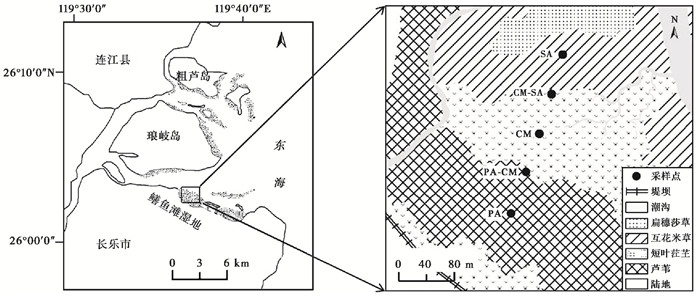
1 材料与方法 1.1 研究区域概况闽江河口鳝鱼滩湿地(26°00′36″~26°03′42″N,119°34′12″~119°40′40″E)是闽江河口面积最大(约3120 hm2)的天然潮滩湿地,呈东西向弯曲长条状分布,气候暖热潮湿,雨热同期,年平均气温19 ℃,降水量可达1300 mm。潮汐属正规半日潮,土壤类型属滨海盐土和沙土,偏酸性。研究区位于鳝鱼滩湿地中西部的高潮滩地段,以芦苇(Phragmites australis)和短叶江芏(Cyperus malaccensis)植被占优势,2002年互花米草(Spartina alterniflora)开始入侵该湿地,这3种植物群落由陆向海方向整体呈带状分布,宽度分别可达100~200 m、50~200 m、50~100 m,植物之间形成明显的交错带,宽度可达30~100 m[23~24]。
1.2 样品采集与处理2016年10月,于植物生长成熟时期,在闽江入海口鳝鱼滩湿地的中西部,由陆向海选取5个样地,分别是:芦苇群落(记为PA)、芦苇与短叶茳芏的交错带群落(记为PA-CM;PA′-CM和PA-CM′分别表示交错带中的芦苇和短叶茳芏)、短叶茳芏群落(记为CM)、短叶茳芏与互花米草的交错带群落(记为CM-SA;CM′-SA和CM-SA′分别表示交错带中的短叶茳芏和互花米草)以及互花米草群落(记为SA)(如图 1所示)。
|
图 1 湿地位置及采样点示意图 Fig. 1 Sketch of the marsh position and sampling sites |
在每个样地内随机选取3个50 cm×50 cm的样方,用剪刀沿地面割下植物地上部分,用挖掘法将样方内根系全部挖出装袋;用卷尺测量出植物株高,计算密度,并做好记录;将植物样品在实验室内分根、茎、叶、鞘和枯体,清洗干净并放入烘箱中杀青烘至恒重,称重做记录;将植物样品研磨后均过80目筛,装袋待测。
1.3 样品测定植物SiO2采用碱溶-钼蓝比色法测定[25],方法如下:1)取10 ml 4N的NaOH溶液于镍坩埚中,在电热板上蒸干;2)称取植株样品0.1 g均匀撒在坩埚中,加盖放在马弗炉里低温灰化,再升高温度至650 ℃熔融15 min;3)用热蒸馏水冲洗坩埚并装入有10 ml 4N盐酸的l00 ml容量瓶中,然后定容,此液为硅待测液;4)吸硅待测液2 ml于50 ml比色管中,稀释至15 ml左右,摇匀,室温下放置20 min;5)加5 ml 0.6N H2SO4溶液和5 ml 5 %钼酸铵溶液,摇匀,放置20 min;6)依次加5 ml 5 %草酸溶液和5 ml 5 %硫酸亚铁铵溶液,用蒸馏水定容;7)20 min后,在紫外分光光度计上用700 nm波长和1 cm比色槽比色,同时作0~2.4 μg的校准曲线。
1.4 指标计算

|
(1) |
公式(1)中,M为测得的硅的质量浓度(μg/ml);V为测定时显色体积(ml);ts为分取倍数,即定容体积(ml)与分取体积(ml)之比;m为风干土质量(g)。
植硅体含量均由植硅体- SiO2转化公式[26]所得:

|
(2) |
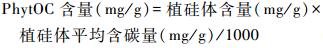
|
(3) |
植物各器官PhytOC储量(Ri)为各器官PhytOC含量与生物量的乘积,单位为mg/m2,即:

|
(4) |
PhytOC储量分配比(allocation proportion)为各器官PhytOC储量与PhytOC总储量之比,用Ai表示,采用以下公式计算:
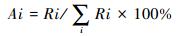
|
(5) |
公式(4)中,i表示植物根系、茎、叶、鞘与枯体;Ci表示第i种器官的PhytOC含量,单位为mg/g;Bi表示第i种器官生物量,单位为g/m2;Ai的单位为%。
2 结果与分析 2.1 植物空间扩展过程中植被生态特征闽江河口鳝鱼滩湿地不同植物在空间扩展过程中植被生态特征均发生了明显变化(如表 1所示)。短叶茳芏分别与芦苇、互花米草扩展过程中形成的两个交错带中的短叶茳芏株高较短叶茳芏纯群落的株高均显著增加(差异性水平分别为P=0.023,P=0.014),而密度(差异性水平分别为P=0.002,P=0.008)与生物量均降低,交错带中的芦苇株高(P=0.02)和生物量较芦苇纯群落均降低,而密度则增加,交错带中的互花米草株高较互花米草纯群落增加,而密度(P=0.039)与生物量均有所下降。3种植物的交错带群落根冠比较各自纯群落均有所增加,尤其是交错带互花米草增加显著(P=0.012)。
| 表 1 闽江河口湿地不同植物扩展过程中植被生态特征* Table 1 Ecological traits of different plants in the process of their spatial expansion in the Min River Estuary |
闽江河口湿地典型植物群落及交错带PhytOC含量整体上表现为芦苇纯群落(4.14 mg/g)>交错带芦苇(3.67 mg/g)>与芦苇交错的短叶茳芏(3.08 mg/g)>互花米草纯群落(2.70 mg/g)>与互花米草交错的短叶茳芏(1.96 mg/g)>交错带互花米草(1.86 mg/g)>短叶茳芏纯群落(1.75 mg/g),短叶茳芏纯群落与两个交错带中的短叶茳芏在3个群落之间存在显著性差异(P=0.02),且交错带短叶茳芏(PA-CM′)分别与短叶茳芏纯群落、交错带短叶茳芏(CM′-SA)之间均存在显著性差异(P < 0.05),互花米草的纯群落与交错带之间也存在显著性差异(P=0.024)。
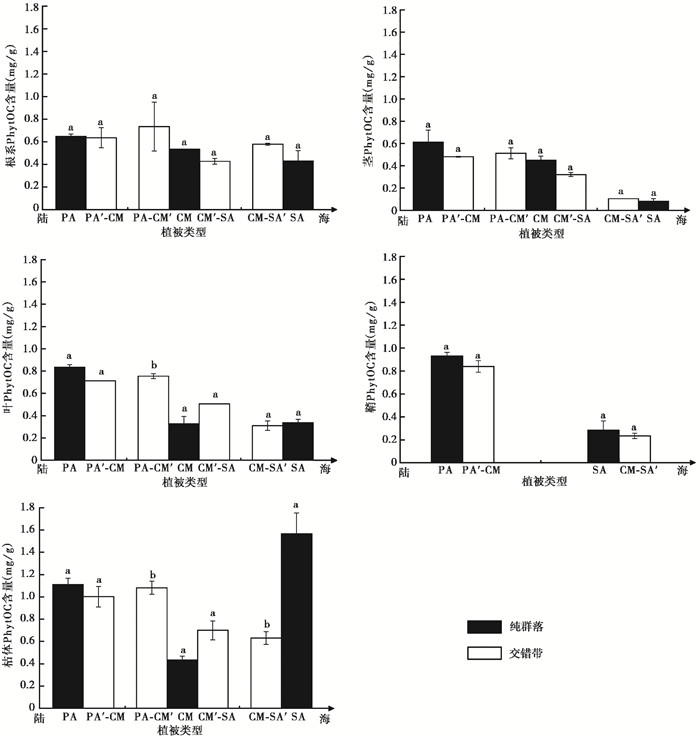
植物的空间扩展使植物PhytOC含量的分布特征发生改变,且不同器官PhytOC含量不同(如图 2所示)。芦苇与短叶茳芏在空间扩展过程中,交错带芦苇各器官较芦苇纯群落PhytOC含量均降低,而交错带短叶茳芏(PA-CM′)各器官PhytOC含量较短叶茳芏纯群落均升高,且在叶(P=0.047)和枯体(P=0.011)中存在显著差异。短叶茳芏与互花米草空间扩展过程中,交错带短叶茳芏(CM′-SA)根系和茎PhytOC含量较短叶茳芏纯群落均降低,在叶和枯体中均高于纯群落,而互花米草则相反。除了根部,其他器官PhytOC含量在各植物群落之间均存在显著性差异(P < 0.05)。
|
图 2 闽江河口湿地植物不同器官植硅体碳含量 Fig. 2 PhytOC contents in different organs of marsh plants in the Min River Estuary |
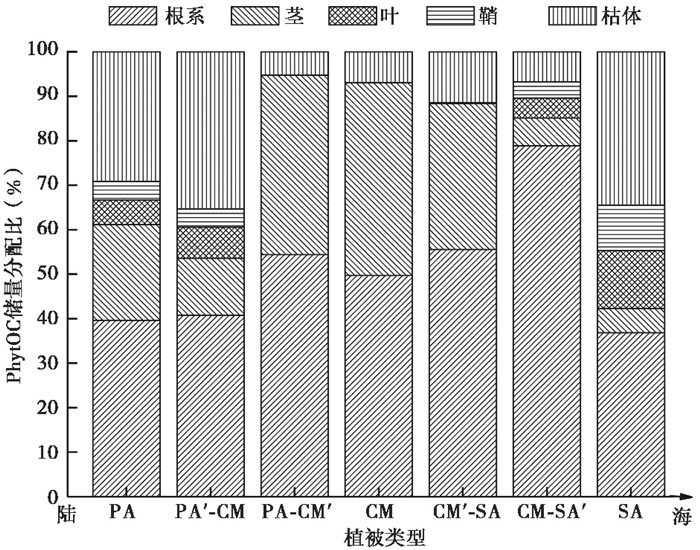
与短叶茳芏的相互扩展中,芦苇的根系、叶和枯体中的PhytOC储量分配比较纯群落分别提高了2.68 %、28.76 %和21.26 % (如图 3所示),而茎、鞘则下降,降幅分别为40.7 %、3.33 %;短叶茳芏在根系、叶中的PhytOC储量分配比较纯群落分别提高了9.40 %、73.39 %,而在茎和枯体中下降,降幅分别为6.92 %、25.20 %。与互花米草的相互扩展中,短叶茳芏PhytOC储量分配比较纯群落在除了茎(降幅为24.37 %)以外的器官均升高,根系、叶和枯体增幅分别为11.82 %、140.22 %和65.29 %;互花米草PhytOC储量分配比较纯群落在除了根系、茎(增幅为114.16 %、14.07 %)以外的器官均降低,叶、鞘、枯体的降幅分别为65.60 %、64.41 %、80.38 %。
|
图 3 闽江河口湿地植物不同器官PhytOC储量分配比 Fig. 3 Allocation ratios of PhytOC stocks in different organs of marsh plants in the Min River Estuary |
闽江河口湿地不同植物群落之间PhytOC储量存在显著差异(P=0.026),尤其是芦苇在纯群落与交错带之间(P=0.037),而短叶茳芏和互花米草的纯群落与交错带之间不存在显著差异(如表 2所示)。PhytOC储量在纯群落中表现为芦苇(2623.16 mg/m2)>短叶茳芏(1028.41 mg/m2)>互花米草(854.02 mg/m2),交错带中的各植物群落PhytOC储量较各自纯群落均显著下降,芦苇下降了1200.00 mg/m2、短叶茳芏下降了378.34 mg/m2(PA-CM′)、578.89 mg/m2(CM′-SA)以及互花米草下降了223.33 mg/m2,下降幅度分别为45.75 %、36.79 %、56.29 %和26.15 %;短叶茳芏与芦苇、互花米草的空间扩展过程中,尽管交错带中的两个短叶茳芏群落较交错带中的芦苇与互花米草的储量均下降,但后者下降幅度较前者大。
| 表 2 闽江河口湿地不同植物单位面积PhytOC储量* Table 2 PhytOC stocks in different plants on unit area in the Min River Estuary |
PhytOC含量在植物类别、分布区域以及植物不同器官的分布差异较大,综合对比我国各区域不同植物类型的平均PhytOC含量发现:竹林(4.86 mg/g)[28~29]>闽江河口湿地植物(2.86 mg/g)>旱作植物(1.33 mg/g)[17]>亚热带森林(0.56 mg/g)[13]>草地(0.54 mg/g)[30]。对比不同区域湿地植物的平均PhytOC含量发现:嘉兴水稻(6.07 mg/g)>闽江河口湿地植物(2.86 mg/g)>白洋淀芦苇(2.49 mg/g)>杭州西溪湿地芦苇(1.5 mg/g)[31]。由此可见,闽江河口湿地植物植硅体固碳能力尚处于较高水平。湿地植物独特的“通气组织”能够吸收较多的氧气,同时也产生较多的CO2和CH4[32],且闽江河口湿地地处亚热带,光照时间充足,有利于植物进行光合作用,增加植物体内的碳含量,促使植硅体封存的碳含量增加;另外,温度也会影响植物植硅体的形态组合[33],进而影响植硅体封存碳的能力。
本研究中闽江河口湿地典型植物群落PhytOC储量整体表现为芦苇(2623.16 mg/m2)>短叶茳芏(1028.41 mg/m2)>互花米草(854.02 mg/m2),这3种植物平均的碳储量分别为986 g/m2、701 g/m2和1208 g/m2[20],PhytOC储量分别占植物碳储量的0.27 %、0.15 %和0.07 %,这部分通过植硅体封存的碳将会长久的被保存下来,虽然量很低,但经过千万年的累积,以及庞大的湿地植物生物量,湿地植物植硅体封存的碳将成为巨大的碳库。然而,植物群落在相互扩展时又会降低植物植硅体的固碳能力,芦苇与短叶茳芏扩展形成的交错带芦苇下降幅度45.75 %,短叶茳芏(PA-CM′)下降36.79 %,而短叶茳芏与互花米草形成的交错带短叶茳芏(CM′-SA)下降幅度56.29 %,互花米草下降26.15 %。因此,如何促进植物的植硅体固碳效率是当前急需解决的问题,这样可以为减少湿地排放温室气体做出巨大的贡献。据此,也可以看出,互花米草入侵对于该区域的植硅体固碳产生一定的影响。
3.2 水文条件及有效硅对植物PhytOC含量的影响土壤有效硅是植物硅素的主要来源,其含量直接影响植物硅的含量[34],植物植硅体的含量与土壤中可利用硅的含量之间具有显著的相关性[28]。高会等[35]研究发现闽江河口湿地不同植物群落土壤有效硅的含量呈现由陆向海逐渐升高的特征,与本研究中植物群落的PhytOC含量水平变化趋势大致相反,本研究中植物PhytOC含量依次表现为芦苇纯群落(4.14 mg/g)>交错带芦苇(3.67 mg/g)>与芦苇交错的短叶茳芏(3.08 mg/g)>互花米草纯群落(2.70 mg/g)>与互花米草交错的短叶茳芏(1.96 mg/g)>交错带互花米草(1.86 mg/g)>短叶茳芏纯群落(1.75 mg/g),整体由陆向海方向逐渐降低。闽江河口湿地潮汐属于规则半日潮,离海越近湿地土壤淹水越深、越久,土壤含水量越高,影响植物的蒸腾作用,从而影响植物对硅的吸收与累积[36~37]。高卓等[38]对芦苇的研究发现,环境较干旱时,芦苇产生抗逆性,植株对硅的需求量增大,因而植株从土壤中主动吸收硅元素;土壤中有效硅浓度较高时,植株对硅的需求量小,芦苇采取被动吸收硅的方式,从而植株中硅的含量较低。另外,闽江河口湿地不同植物群落土壤的生物硅含量由陆向海逐渐降低[39],且与本研究中植物PhytOC含量呈极显著正相关(R2=0.481,P < 0.01)。
3.3 植物空间扩展对植被生态特征及植物PhytOC分布特征的影响研究表明,植物对硅的富集能力会影响植物植硅体的含量,进而影响PhytOC含量[14, 17, 26],且湿地植物间的相互扩展也会对植被生态特征和养分吸收利用状况产生重要影响[23, 40]。本研究中,芦苇、短叶茳芏、互花米草这3种植物在交错带较各自纯群落而言,根冠比均增加,根系的PhytOC储量分配比均上升,这可能是因为在交错带中,植物之间的空间扩展竞争从地上转移至地下,根系竞争能够提高根系活力及对营养元素的吸收与累积能力[41],因此植物根系对硅的吸收与累积增强,根系生物量增多,导致根系PhytOC储量分配比上升。
短叶茳芏分别与芦苇、互花米草竞争过程中所表现出来的特征明显不同(P=0.02)。短叶茳芏在与芦苇的相互扩展中,各器官PhytOC含量在交错带均高于纯群落,芦苇则反之,这可能是二者在扩展过程中对于养分的吸收与分配所采取的策略不同,植被形态特征也发生相应的改变。芦苇在交错带的密度明显高于纯群落,但是株高显著下降,茎和鞘的PhytOC储量分配比也同时下降,可能是芦苇具有明显的“光合午休”现象,而短叶茳芏作为C4植物,比C3植物芦苇具有更高的光合速率[42~44],对碳的吸收和利用更强,因此植株的生长也强于芦苇。另外,短叶茳芏茎表皮上有大量的气孔分布其中,且呈绿色取代叶行使光合作用的功能[45],也有利于茎的生长。另一方面,硅有助于植物抵抗外界的生物和非生物压力,提高植物抗倒伏能力与抗逆性,植物对硅的有效利用也会影响植物动态环境中的竞争性[46~48]。芦苇与短叶茳芏在相互扩展过程中,二者均是将硅素同时分配于繁殖器官和同化器官,尽管芦苇吸收累积硅素的能力下降,但是通过增加密度提高空间占据能力,而短叶茳芏则通过提高吸收硅素能力显著促进植株的高度(P=0.023)来对抗芦苇的扩展。
相比较与芦苇的竞争,短叶茳芏在与互花米草的竞争中不具备优势,交错带短叶茳芏根、茎PhytOC含量较纯群落带均下降,尽管短叶茳芏更多地将硅素分配于地下根系,使得茎的硅素分配比例下降,但是可能因为相比较短叶茳芏根的养分利用性,互花米草根内稳性的调节能力使其能够在多变的环境中保持较好的生长[49],互花米草同样将硅素更多地分配于繁殖器官,使其根系分配比显著提高,利用根状茎或营养片段扩散来扩带种群[50],在空间扩展过程中具备更强的竞争力和适应力。另外,相比较与芦苇扩展形成的交错带中的短叶茳芏更靠近海,受水文影响更大,维管组织相对不发达,气孔退化也更严重[51],从而影响到植株对碳的吸收累积,且互花米草由于枝叶较多,株高较短叶茳芏高,对短叶茳芏具有遮阴作用,影响短叶茳芏茎光合作用及对碳的吸收和利用,使得短叶茳芏的生物量下降幅度大,株高增幅不明显,且茎的PhytOC含量和储量分配比也下降,而互花米草则相反。
综上,闽江河口湿地植物PhytOC的分布受水文条件、不同植物对碳与硅的累积与分配差异的影响,同时交错带植物之间相互扩展竞争时采取不同策略对植物PhytOC的分布也有一定影响。
4 结论本文选取闽江河口鳝鱼滩湿地芦苇群落、短叶茳芏群落、互花米草群落及交错带为研究对象,研究这3种植物植硅体碳含量和储量的空间变化特征和影响因素,探讨PhytOC含量在纯群落和交错带的差异,结果如下:
(1) 水文条件影响土壤有效硅分布,进而影响植物PhytOC含量的分布,闽江河口湿地植物PhytOC含量整体呈现出由陆向海逐渐降低的趋势,依次表现为:芦苇纯群落(4.14 mg/g)>交错带芦苇(3.67 mg/g)>与芦苇交错的短叶茳芏(3.08 mg/g)>互花米草纯群落(2.70 mg/g)>与互花米草交错的短叶茳芏(1.96 mg/g)>交错带互花米草(1.86 mg/g)>短叶茳芏纯群落(1.75 mg/g)。
(2) 闽江河口湿地植物PhytOC储量整体表现为:芦苇(2623.16 mg/m2)>短叶茳芏(1028.41 mg/m2)>互花米草(854.02 mg/m2),这3种植物通过植硅体封存的碳储量分别占植物碳储量的0.27 %、0.15 %和0.07 %,这部分碳可以被长久储存下来。
(3) 植物的空间扩展导致PhytOC储量下降。芦苇与短叶茳芏扩展形成的交错带中芦苇下降幅度为45.75 %,短叶茳芏(PA-CM′)下降36.79 %,而短叶茳芏与互花米草形成的交错带中短叶茳芏(CM′-SA)下降幅度为56.29 %,互花米草下降26.15 %,可见互花米草入侵对于该区域的植硅体固碳产生较大的影响。
致谢: 感谢中国科学院地质与地球物理研究所吕厚远教授、博士温昌辉,福建师范大学左昕昕副研究员在实验方法上给予的帮助和指导。
| [1] |
Falkowski P, Scholes R J, Boyle E, et al. The global carbon cycle:A test of our knowledge of earth as a system[J]. Science, 2000, 290(5490): 291-296. DOI:10.1126/science.290.5490.291 |
| [2] |
Smith P, Fang C. Carbon cycle:A warm response by soils[J]. Nature, 2010, 464(7288): 499-500. |
| [3] |
Mitsch W J, Nahlik A M, Vlo M, et al. Wetlands, carbon, and climate change[J]. Landscape Ecology, 2013, 28(4): 583-597. DOI:10.1007/s10980-012-9758-8 |
| [4] |
Lelieveld J, Crutzen P J, Dentener F J. Changing concentration, lifetime and climate forcing of atmospheric methane[J]. Tellus Series B—Chemical & Physical Meteorology, 1998, 50(2): 128-150. |
| [5] |
Parr J F, Sullivan L A. Soil carbon sequestration in phytoliths[J]. Soil Biology & Biochemistry, 2005, 37(1): 117-124. |
| [6] |
Piperno D R. Phytoliths:A Comprehensive Guide for Archmeologists and Paleoecologists[M]. Washington D.C.: AltaMira Press, 2006: 117-124.
|
| [7] |
Wilding L P, Brown R E, Holowaychuk N. Accessibility and properties of occluded carbon in biogenetic opal[J]. Soil Science, 1967, 103(1): 56-61. DOI:10.1097/00010694-196701000-00009 |
| [8] |
Strömberg C A E. Evolution of grasses and grassland ecosystems[J]. Annual Review of Earth & Planetary Sciences, 2011, 39(39): 517-544. |
| [9] |
Parr J, Sullivan L, Quirk R. Sugarcane phytoliths:Encapsulation and sequestration of a long-lived carbon fraction[J]. Sugar Tech, 2009, 11(1): 17-21. DOI:10.1007/s12355-009-0003-y |
| [10] |
李自民, 宋照亮, 姜培坤. 湿地植物植硅体的生物地球化学碳汇:以西溪湿地为例[J]. 科学通报, 2013, 58(17): 1682-1682. Li Zimin, Song Zhaoliang, Jiang Peikun. Biogeochemical sequestration of carbon within phytoliths of wetland plants:A case study of Xixi wetland, China[J]. Chinese Science Bulletin, 2013, 58(20): 2480-2487. |
| [11] |
王丹, 王奥博, 龙高飞, 等. 湿地生态系统中植硅体与植硅体碳的研究进展[J]. 生态学杂志, 2017, 36(12): 3602-3609. Wang Dan, Wang Aobo, Long Gaofei, et al. Research advances of phytolith and phytolith-occluded-carbon in wetland ecosystems[J]. Chinese Journal of Ecology, 2017, 36(12): 3602-3609. |
| [12] |
郭凤山, 宋照亮, Sullivan L, 等. 岩粉施加对水稻生态系统植硅体碳的增汇作用[J]. 科学通报, 2015, 60(10): 963-963. Guo Fengshan, Song Zhaoliang, Sullivan L, et al. Enhancing phytolith carbon sequestration in rice ecosystems through basalt powder amendment[J]. Chinese Science Bulletin, 2015, 60(6): 591-597. |
| [13] |
应雨骐, 项婷婷, 李永夫, 等. 中国亚热带重要树种植硅体碳封存潜力估测[J]. 自然资源学报, 2015, 30(1): 133-140. Ying Yuqi, Xiang Tingting, Li Yongfu, et al. Estimation of sequestration potential via phytolith carbon by important forest species in subtropical China[J]. Journal of Natural Resources, 2015, 30(1): 133-140. |
| [14] |
Parr J F, Sullivan L, Chen B, et al. Carbon bio-sequestration within the phytoliths of economic bamboo species[J]. Global Change Biology, 2010, 16(10): 2661-2667. DOI:10.1111/gcb.2010.16.issue-10 |
| [15] |
Song Z L, Liu H Y, Si Y, et al. The production of phytoliths in China's grasslands:Implications to the biogeochemical sequestration of atmospheric CO2[J]. Global Change Biology, 2012, 18(12): 3647-3653. DOI:10.1111/gcb.12017 |
| [16] |
Qi L M, Li F Y, Huang Z T, et al. Phytolith-occluded organic carbon as a mechanism for long-term carbon sequestration in a typical steppe:The predominant role of belowground productivity[J]. Science of the Total Environment, 2017, 577: 413-417. DOI:10.1016/j.scitotenv.2016.10.206 |
| [17] |
左昕昕, 吕厚远. 我国旱作农业黍、粟植硅体碳封存潜力估算[J]. 科学通报, 2011, 56(34): 2881-2887. Zuo Xinxin, Lü Houyuan. Carbon sequestration within millet phytoliths from dry-farming of crops in China[J]. Chinese Science Bulletin, 2011, 56(32): 3451-3456. |
| [18] |
Song Z L, Wang H L, Strong P J, et al. Phytolith carbon sequestration in China's croplands[J]. European Journal of Agronomy, 2014, 53: 10-15. DOI:10.1016/j.eja.2013.11.004 |
| [19] |
Simas T, Nunes J P, Ferreira J G. Effects of global climate change on coastal salt marshes[J]. Ecological Modelling, 2001, 139(1): 1-15. |
| [20] |
黄炜娟.闽江河口湿地碳储量的研究[D].福州: 福建农林大学硕士学位论文, 2008: 20-39. Huang Weijuan. Study on Carbon Storage in Minjiang River Estuary[D]. Fuzhou: The Master's Dissertation of Fujian Agriculture and Forestry University, 2008: 20-39. http://cdmd.cnki.com.cn/Article/CDMD-10389-2008141788.htm |
| [21] |
仝川, 曾从盛, 王维奇, 等. 闽江河口芦苇潮汐湿地甲烷通量及主要影响因子[J]. 环境科学学报, 2009, 29(1): 207-216. Tong Chuan, Zeng Congsheng, Wang Weiqi, et al. Main factors influencing CH4 flux from a Phragmites australis wetland in the Min River estuary[J]. Acta Scientiae Circumstantiae, 2009, 29(1): 207-216. DOI:10.3321/j.issn:0253-2468.2009.01.032 |
| [22] |
曾从盛, 王维奇, 张林海, 等. 闽江河口短叶茳芏潮汐湿地甲烷排放通量[J]. 应用生态学报, 2010, 21(2): 500-504. Zeng Congsheng, Wang Weiqi, Zhang Linhai, et al. Methane fluxes of Cyperus malaccensis tidal wetland in Minjiang River estuary[J]. Chinese Journal of Applied Ecology, 2010, 21(2): 500-504. |
| [23] |
何涛, 孙志高, 李家兵, 等. 闽江河口芦苇与短叶茳芏空间扩展植物-土壤系统硫含量变化特征[J]. 生态学报, 2018, 38(5): 1607-1618. He Tao, Sun Zhigao, Li Jiabing, et al. Variations in total sulfur content in plant-soil systems of Phragmites australis and Cyperus malaccensis in the process of their spatial expansion in the Min River estuary[J]. Acta Ecologica Sinica, 2018, 38(5): 1607-1618. |
| [24] |
Zhang W L, Zeng C S, Tong C, et al. Analysis of the expanding process of the Spartina alterniflora salt marsh in Shanyutan wetland, Minjiang River estuary by remote sensing[J]. Procedia Environmental Sciences, 2011, 10(1): 2472-2477. |
| [25] |
杨雅杰. 用镍坩埚碱溶消化测定水稻植株硅的方法[J]. 生物技术, 1995, 5(3): 42-44. Yang Yajie. Determination of silicon in rice plants by alkali dissolution with Nickel Crucible[J]. Biotechnology, 1995, 5(3): 42-44. |
| [26] |
Song Z L, Liu H Y, Li B L, et al. The production of phytolith-occluded carbon in China's forests:Implications to biogeochemical carbon sequestration[J]. Global Change Biology, 2013, 19(9): 2907-2915. DOI:10.1111/gcb.2013.19.issue-9 |
| [27] |
王永吉, 吕厚远. 植物硅酸体的研究及应用简介[J]. 黄渤海海洋, 1989, 7(2): 66-68. Wang Yongji, Lü Houyuan. An introduction of study on plant opal and its uses[J]. Journal of Oceanography of Huanghai & Bohai Seas, 1989, 7(2): 66-68. |
| [28] |
杨杰, 吴家森, 姜培坤, 等. 苦竹林植硅体碳与硅的研究[J]. 自然资源学报, 2016, 31(2): 299-309. Yang Jie, Wu Jiasen, Jiang Peikun, et al. Study on phytolith-occluded organic carbon and silicon in a Pleioblastus amarus forest[J]. Journal of Natural Resources, 2016, 31(2): 299-309. |
| [29] |
杨杰, 项婷婷, 姜培坤, 等. 绿竹生态系统植硅体碳积累与分布特征[J]. 浙江农林大学学报, 2016, 33(2): 225-231. Yang Jie, Xiang Tingting, Jiang Peikun, et al. Phytolith-occluded organic carbon accumulation and distribution in a Dendrocalamopsis oldhami bamboo stand ecosystem[J]. Journal of Zhejiang A & F University, 2016, 33(2): 225-231. |
| [30] |
汝宁.温带灌丛和沙化草地生态系统硅分布与植硅体碳汇研究[D].杭州: 浙江农林大学硕士学位论文, 2015: 27-32. Ru Ning. Research on Silicon Distribution and Phytolith Carbon Sequestration in Temperate Shrubland and Desertification of Grassland[D]. Hangzhou: The Master's Dissertation of Zhejiang A & F University, 2015: 27-32. |
| [31] |
李自民.典型湿地生态系统中植硅体碳汇潜力研究[D].杭州: 浙江农林大学硕士学位论文, 2013: 11-37. Li Zimin. Research on the Potential of Phytolith Sequestration Carbon from Atmosphere in Soil-Plant Ecosystem of Typical Wetland[D]. Hangzhou: The Master's Dissertation of Zhejiang A & F University, 2013: 11-37. |
| [32] |
孟伟庆, 吴绽蕾, 王中良. 湿地生态系统碳汇与碳源过程的控制因子和临界条件[J]. 生态环境学报, 2011, 20(z2): 1359-1366. Meng Weiqing, Wu Zhanlei, Wang Zhongliang. Control factors and critical conditions between carbon sinking and sourcing of wetland ecosystem[J]. Ecology and Environmental Sciences, 2011, 20(z2): 1359-1366. |
| [33] |
刘洪妍, 介冬梅, 刘利丹, 等. 不同增温方式下芦苇植硅体数量变化特征的对比分析[J]. 第四纪研究, 2015, 35(4): 977-987. Liu Hongyan, Jie Dongmei, Liu Lidan, et al. The comparative analysis of the variation characteristics of phytoliths in under different warming treatments[J]. Quaternary Sciences, 2015, 35(4): 977-987. |
| [34] |
邢雪荣, 张蕾. 植物的硅素营养研究综述[J]. 植物学报, 1998, 15(2): 33-40. Xing Xuerong, Zhang Lei. Review of the studies on silicon nutrition of plants[J]. Chinese Bulletin of Botany, 1998, 15(2): 33-40. DOI:10.3969/j.issn.1674-3466.1998.02.005 |
| [35] |
高会, 翟水晶, 孙志高, 等. 互花米草入侵影响下闽江河口湿地土壤有效硅的时空变化特征[J]. 生态学报, 2018, 38(17): 1-7. Gao Hui, Zhai Shuijing, Sun Zhigao, et al. Spatial and temporal variations of available silica cotent in marsh soils under the Spartina alterniflora invasion in the Min River estuary[J]. Acta Ecologica Sinica, 2018, 38(17): 1-7. |
| [36] |
Struyf E, Damme S V, Gribsholt B, et al. Biogenic silica in tidal freshwater marsh sediments and vegetation(Schelde estuary, Belgium)[J]. Marine Ecology Progress, 2005, 303(1): 51-60. |
| [37] |
Querné J, Ragueneau O, Poupart N. In situ biogenic silica variations in the invasive salt marsh plant, Spartina alterniflora: A possible link with environmental stress[J]. Plant & Soil, 2012, 352(1-2): 157-171. |
| [38] |
高卓, 介冬梅, 刘利丹, 等. 东北地区土壤有效硅的时空分异及其对芦苇植硅体形成的影响[J]. 第四纪研究, 2015, 35(4): 967-976. Gao Zhuo, Jie Dongmei, Liu Lidan, et al. Temporal and spatial variation of available soil silica and its influence on the formation of phytoliths in Phragmites communis in Northeast China[J]. Quaternary Sciences, 2015, 35(4): 967-976. |
| [39] |
高会, 李家兵, 何涛, 等. 闽江河口典型植被群落带及交错带植物-土壤体系中硅素的分布特征[J]. 水土保持学报, 2017, 31(1): 279-285. Gao Hui, Li Jiabing, He Tao, et al. Silica distribution characteristics in plant-soil systems of typical vegetation communities and ecotones in Min River estuary wetland[J]. Journal of Soil and Water Conservation, 2017, 31(1): 279-285. |
| [40] |
Ewanchuk P J, Bertness M D. Structure and organization of a northern New England salt marsh plant community[J]. Journal of Ecology, 2004, 92(1): 72-85. DOI:10.1111/jec.2004.92.issue-1 |
| [41] |
Hou L J, Liu M, Yang Y, et al. Biogenic silica in intertidal marsh plants and associated sediments of the Yangtze Estuary[J]. Journal of Environmental Sciences, 2010, 22(3): 374-380. DOI:10.1016/S1001-0742(09)60118-2 |
| [42] |
赵广琦, 张利权, 梁霞. 芦苇与入侵植物互花米草的光合特性比较[J]. 生态学报, 2005, 25(7): 1604-1611. Zhao Guangqi, Zhang Liquan, Liang Xia. A comparison of photosynthetic characteristics between an invasive plant Spartina alterniflora and an indigenous plant Phragmites australis[J]. Acta Ecologica Sinica, 2005, 25(7): 1604-1611. DOI:10.3321/j.issn:1000-0933.2005.07.011 |
| [43] |
伍欢.大莎草的光合模式鉴定及C3/C4差异表达基因的功能研究[D].武汉: 华中农业大学硕士学位论文, 2014: 1-25. Wu Huan. Photosynthetic Characteristic Identification of Eleocharis baldwinii & the Functional Study of C3/C4 Differentially Expressed Genes[D]. Wuhan: The Master's Dissertation of Huazhong Agricultural University, 2014: 1-25. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2566234 |
| [44] |
Wang W Q, Sardans J, Wang C, et al. Ecological stoichiometry of C, N, and P of invasive phragmites australis and native Cyperus malaccensis species in the Minjiang River tidal estuarine wetlands of China[J]. Plant Ecology, 2015, 216(6): 1-14. |
| [45] |
黄敏参.咸草植物形态解剖及生理生态特性初步探讨[D].福州: 福建师范大学硕士学位论文, 2008: 13~21 Huang Mincan. Primary Study on the Morphological Anatomy and Eco-physiological Characteristics of Cyperus malaccensis var. brevifolius [D]. Fuzhou: The Master's Dissertation of Fujian Normal University, 2008: 13-21. |
| [46] |
Schoelynck J, Bal K, Backx H, et al. Silica uptake in aquatic and wetland macrophytes:A strategic choice between silica, lignin and cellulose?[J]. New Phytologist, 2010, 186(2): 385-391. DOI:10.1111/j.1469-8137.2009.03176.x |
| [47] |
Epstein E. Chapter 1 Silicon in plants:Facts vs. concepts[J]. Studies in Plant Science, 2001, 8(1): 1-15. |
| [48] |
Struyf E, Conley D J. Silica:An essential nutrient in wetland biogeochemistry[J]. Frontiers in Ecology & the Environment, 2009, 7(2): 88-94. |
| [49] |
蒋利玲, 曾从盛, 邵钧炯, 等. 闽江河口入侵种互花米草和本地种短叶茳芏的养分动态及植物化学计量内稳性特征[J]. 植物生态学报, 2017, 41(4): 450-460. Jiang Liling, Zeng Congsheng, Shao Junjiong, et al. Plant nutrient dynamics and stoichiometric homeostasis of invasive species Spartina alterniflora and native Cyperus malaccensis var. brevifolius in the Minjiang River estuarine wetlands[J]. Chinese Journal of Plant Ecology, 2017, 41(4): 450-460. |
| [50] |
Sun S M. Monitoring of smooth cordgrass invasion by remote sensing in Sandu Bay, Fujian[J]. Journal of Oceanography in Taiwan Strait, 2005, 24(2): 223-228. |
| [51] |
Deschamp P A, Cooke T J. Leaf dimorphism in aquatic angiosperms: Significance of turgor pressure and cell expansion[J]. Science, 1983, 219(4584): 505-507. DOI:10.1126/science.219.4584.505 |
2 Key Laboratory of Humid Subtropical Eco-geographical Process, Ministry of Education, Fujian Normal University, Fuzhou 350007, Fujian;
3 Institute of Geography, Fujian Normal University, Fuzhou 350007, Fujian)
Abstract
Wetland is regarded as not only "carbon sink" but also "carbon source". Recent studies have found that carbon can be stably and permanently encapsulated in phytoliths, and the ability of phytoliths in different plants to retain carbon is significantly different. In Shanyutan wetland(26°00'36"~26°03'42"N, 119°34'12"~119°40'40"E) of the Min River Estuary, Phragmites australis community, Cyperus malaccensis community and Spartina alternifloras community continually expanded as belts from the bank to the sea. The spatial variation characteristics and influencing factors of Phytolith-occluded Carbon(PhytOC) contents and stocks in these communities and their ecotones were investigated. The difference of PhytOC contents between pure communities and ecotones was studied to provide evidence for plants competition and carbon cycling. Results showed that, affected by hydrological conditions, plant growth and spatial expansion, the PhytOC contents in the nearshore area was generally higher than that in the offshore area, and the PhytOC stocks higher in pure communities than that in ecotones. In order of PhytOC contents, it goes:Phragmites australi (4.14 mg/g), the Phragmites australi in Phragmites australi-Cyperus malaccensi ecotone(3.67 mg/g), the Cyperus malaccensi in Phragmites australi-Cyperus malaccensi ecotone(3.08 mg/g), Spartina alterniflora(2.70 mg/g), the Cyperus malaccensi in Cyperus malaccensi-Spartina alterniflora (1.96 mg/g), the Spartina alterniflora in Cyperus malaccensi-Spartina alterniflora (1.86 mg/g) and Cyperus malaccensi (1.75 mg/g). PhytOC contents in Cyperus malaccensi and its organs increased when it expanded with Phragmites australi, but decreased when expanded with Spartina alterniflora except for root and stem. Although the allocation ratios of PhytOC stocks in different organs of three marsh plants varied during plant spatial expansion, however, more silicon nutrients were allocated to the roots to improve competitiveness, and the allocation ratios of PhytOC stocks in the roots in the ecotones increased. The carbon stocks occluded by phytoliths of Phragmites australis, Cyperus malaccensis and Spartina alternifloras accounted for 0.27%, 0.15% and 0.07% of plant carbon stocks respectively. But the spatial expansion of plants affects PhytOC stocks. Among them, in the ecotone formed by Cyperus malaccensis and Spartina alternifloras, Cyperus malaccensis decreased most by 56.29%, and Spartina alternifloras decreased least by 26.15%. It can be concluded that plant expansion in the ecotone had certain effects on PhytOC contents, stocks and allocation ratio of different organs. The Cyperus malaccensis adopts different PhytOC allocation mechanism when competing with Phragmites australis and Spartina alternifloras. 2019, Vol.39
2019, Vol.39

