自工业革命以来,人类社会的快速发展导致了大气二氧化碳(CO2)浓度的不断攀升,引发了全球变暖等一系列环境问题,因此越来越多的研究致力于寻求长期稳定的碳封存机制[1~2]。硅(Si)作为地壳中第二大含量的元素,对于保证植物的正常生长发育具有重要作用[3~4]。植硅体(phytolith)是一种沉积在植物组织中的非晶态二氧化硅,是Si在植物组织中的主要存在形式之一[5~6]。植硅体普遍存在于不同类型的植物中,其含量分布范围约为0.5 % ~15.0 %,且在形成过程中可以包裹部分有机物质(0.2 % ~5.8 %),形成植硅体碳(Phytolith-Occluded Carbon,简称PhytOC)[7~9]。植硅体碳汇被认为是一种有效的长期稳定的大气CO2封存机制。据估算,全球陆地生态群落植物植硅体每年的固碳量约为156.70±91.60 Tg CO2[10]。
草地生态系统占全球陆地总面积的20 %以上,是陆地生态系统碳汇中不可或缺的组成部分[11~12]。最近的研究发现,草地生态系统在全球陆地生态系统植硅体碳汇中扮演着重要角色,其植物地上部分产生的植硅体每年可以固定约41.4 Tg CO2,约占全球陆地生态群落的40 % [10, 13]。在我国,草地生态系统约占国土面积的1/ 3[14],但由于草地退化等原因导致地上初级净生产力(ANPP)减弱,其植物地上部分的植硅体固碳速率仅为0.6 Tg CO2/a,占全球草地生态系统的1.45 % [13]。据统计,我国内蒙古境内90 %左右的草地都存在不同程度的退化现象[15~16]。在我国,虽然对于不同类型草原生态系统的Si分布特征和植硅体碳汇潜力有了一定的研究,但缺乏草地退化对植物Si分布和植硅体碳汇的影响方面的认识[17]。
农牧交错带,是指存在于农业区与牧业区之间的一个农牧过渡地带[18~19]。在此过渡带内,草地畜牧业和种植业交错分布,该地区的草地生态系统受到了较为强烈的人类活动的干扰,退化现象明显[20~21]。本研究选取了我国北方农牧交错带为研究对象,调查了30个样地的植被退化情况,并采集了每个样地的植物常见种样品,分析了该区域内植物Si的分布特征,并估算了植物地上部分植硅体碳产生通量。同时,为了研究草地退化对不同功能类型植物的影响,本文选取了羊草和糙隐子草进行对比讨论。本文将为进一步研究草地退化对植物Si分布和植硅体碳汇的影响提供参考依据。
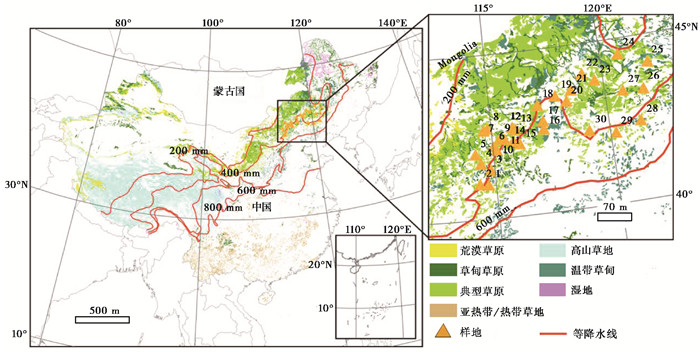
1 材料和方法 1.1 研究区域概况如图 1所示,样地所在的研究区域位于我国北方农牧交错带东北部分,横跨河北省北部、内蒙古自治区的南部和东部(41°3′~44°31′N,114° 15′~122°2′E),海拔为185~1554 m。样地位于温带的半湿润半干旱区,年均温度(MAT)为2.1~8.3 ℃,年均降水(MAP)为311.9~421.3 mm。植被调查结果发现,该研究区域内植被类型多样,常见的种为羊草(Leymus chinensis)、糙隐子草(Cleistogenes squarrosa)、毛沙芦草(Agropyron mongolicum)和针茅(Stipa capillata)等。其中,羊草和糙隐子草在此研究区域分布最为广泛,分别出现在了16个和23个样地(表 1)。本研究区域内的草原类型主要为典型草原,同时夹杂少数的草甸草原[14]。根据FAO(Food and Agriculture Organisation)土壤分类系统,土壤类型以栗钙土和风沙土为主。
|
图 1 研究区域草地类型和样地的分布图(修改自Song等[13~14]) Fig. 1 Grassland types of China and sampling sites(modified from Song, et al. [13~14]) |
| 表 1 不同退化程度样地盖度、地上净初级生产力和植物样品的Si含量 Table 1 Coverage, ANPP and plant Si content of grasslands with different degradation degrees |
植被调查和样品采集于2017年7月开展。通过分析地形气候-土壤-植被耦合系统在空间上的一致性,对整个研究区域先进行综合的相似性的分区,使得有限的样本量尽量覆盖各类型的区域,提高样本的整体代表性。在此基础上,我们在本研究区域内选取了30个样地。每个样地随机设置3个2 m×2 m的样方,对每个样方的植被总盖度以及每个物种的多度、高度和盖度进行系统的调查,并收集此样方内1 m×1 m小样方中所有植物的地上部分,用于计算该样地的地上生物量(Biomass of aboveground vegetation)。同时,单独收集每个样地的2~4种常见草种的地上部分,每种植物采集约300 g。
1.3 实验室分析 1.3.1 植物样品的预处理用自来水将植物洗净,并用超纯水冲洗3次以上。将样品置于75 ℃的烘箱中,烘干至恒定质量。其中用1 m×1 m样方内的混合样品计算该样地的地上生物量,进而估算地上净初级生产力(ANPP);将不同种类的植物样品磨细,进行Si含量分析。
1.3.2 植物Si含量的测定取0.7500 g左右的植物样品,在950 ℃下,用偏硼酸锂将其熔融,将熔融物溶解在4 %的稀硝酸溶液中并定容,用钼蓝比色法分析溶液的Si浓度[22]。
1.4 数据计算 1.4.1 草地退化程度的划分结合已有的研究结果和此研究区的特点,本文选取植被总盖度(Coverage)和地上净初级生产力作为植被退化的指标[23],植被总盖度的降低和地上净初级生产力的减少代表草地退化程度的加深。采用K-均值聚类分析的方法将30个样点划分为3个退化梯度[24]:轻度退化(11个)、中度退化(11个)和重度退化(8个)(表 1)。其中植被总盖度分别为63±1.2 %、50±3.0 %和42±2.0 %;地上净初级生产力分别为0.86±0.09 g/(m2·a)、0.59±0.04 g/(m2· a)和0.31±0.05 g/(m2·a),均随草地退化的加重而显著减少(表 1)。由于草地退化划分标准并不统一[25],因此本文中的退化程度仅为一个相对概念,并不代表绝对的轻度退化、中度退化或重度退化的草地。
1.4.2 植硅体含量的估算植硅体主要由SiO2(约90 %)构成,且植物中约90 %的SiO2以植硅体的形式存在,因此,植物中植硅体的含量可以通过硅含量的数据来估算[13]。对于草本植物,其植硅体含量可由“植硅体-硅”转换方程来估算[13, 22]:

|
(1) |
公式(1)中植硅体含量和硅含量分别代表植物中植硅体含量(g/kg,干重)和硅含量(g/kg,干重)。
1.5 数据统计使用Excel 2010和SPSS 18.0软件进行数据分析。对于处于相同退化程度的样品,其Si含量和产生通量数据分别基于所包含样地的平均值进行计算。采用单因素方差分析和最小显著差异检验来比较不同退化程度间Si分布的差异性(P < 0.05)。使用Origin 9.5软件将分析结果制作成图。
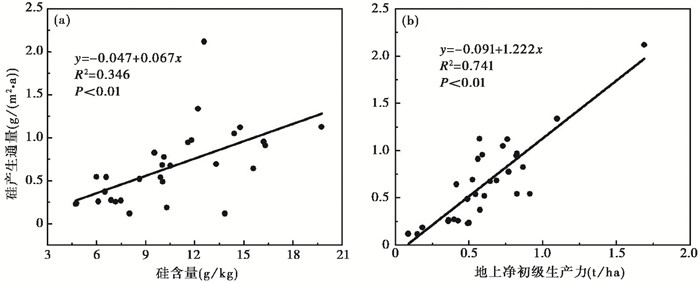
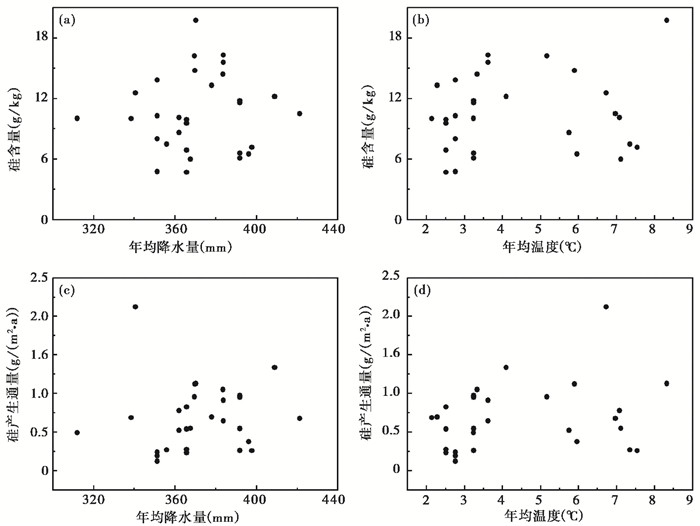
2 结果 2.1 样地植物总体Si分布特征本研究区域中30个样地植被Si含量的变化范围为4.71~19.74 g/kg,平均值为10.51±0.61 g/kg(图 2)。虽然植物的Si产生通量等于植物Si含量和植物地上净初级生产力的乘积,但通过比较R2值可知,Si产生通量主要是由植物的地上净初级生产力决定的(图 2)。样地植物总体Si含量和Si产生通量与气候因素(年均降水和年均温)之间无明显的相关关系(图 3)。
|
图 2 30个样地植被Si产生通量与Si含量(a)和地上净初级生产力(b)之间的关系 Fig. 2 Relationships between production fluxes of Si and Si content (a) and ANPP (b) for the vegetation of the 30 sites |
|
图 3 样地Si含量(a和b)和产生通量(c和d)与年均降水和年均温度之间的关系 年均温和年均降水参考于中国气象数据网中1981~2010年的均值 Fig. 3 Relationships between content(a and b)and production fluxes of Si(c and d)and climate factors. Mean annual temperature and mean annual precipitation are the average values during 1981 to 2010, obtained from the China Meteorological Data Service Center |
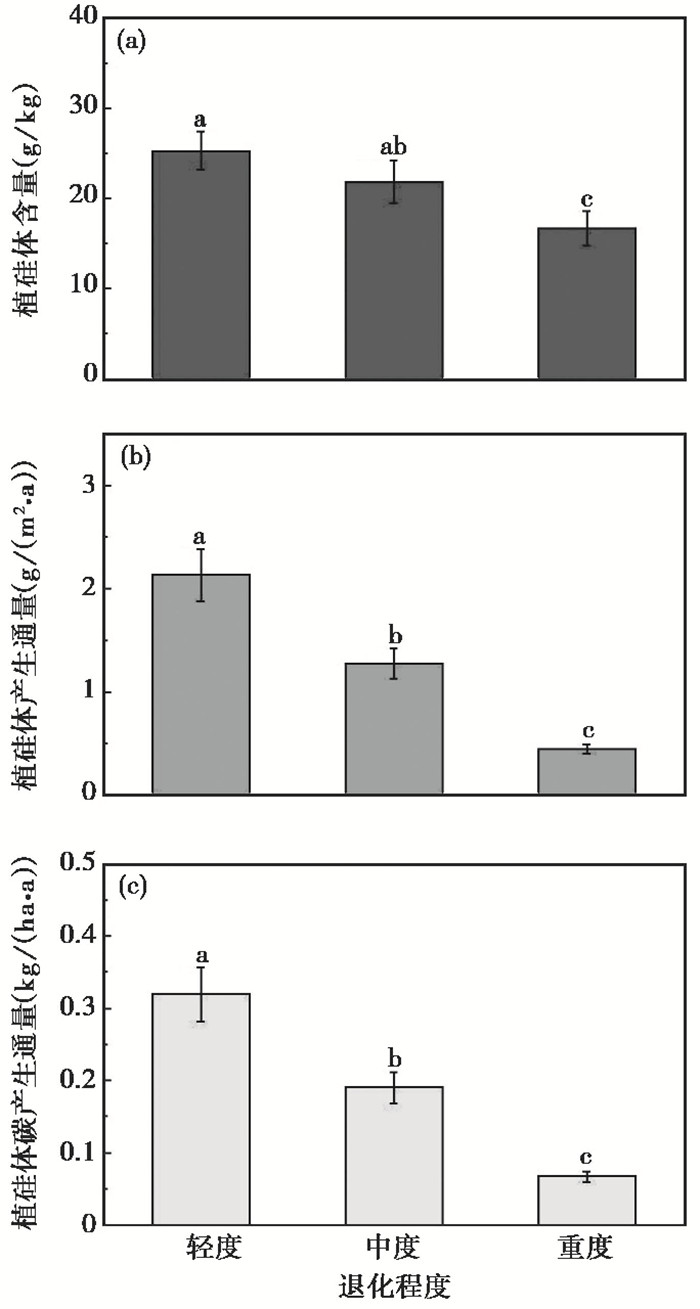
轻度退化样地Si含量平均值为12.25±1.02 g/kg,显著高于重度退化的8.06±0.93 g/kg(p < 0.05),但与中度退化(10.56±1.15 g/kg)样地间无显著性差异(图 4c)。样地植物总体的Si产生通量的分布范围为0.12~2.12 g/(m2·a),平均值为0.66±0.08 g/(m2·a)(图 2)。不同退化程度样地的Si产生通量的平均值分别为1.03±0.12 g/(m2·a)(轻度)、0.61±0.07 g/(m2·a)(中度)和0.22±0.02 g/(m2·a)(重度),呈递减趋势(P < 0.05)(图 4f)。

|
图 4 不同退化程度草地植物的硅含量和硅产生通量 (a)和(d)为糙隐子草;(b)和(e)为羊草;(c)和(f)为样地植物总体均值 Fig. 4 Si content and Si production fluxes of grasslands with different degradation degrees. (a)and (d) are Cleistogenes squarrosa; (b)and (e) are Leymus chinensis; (c)and (f) are average values of all the plants |
糙隐子草中Si含量的变化范围为6.10~20.71 g/kg,平均含量为12.83±0.81 g/kg(表 1)。轻度退化样地中糙隐子草Si含量平均值13.87±1.23 g/kg,大于中度的13.11±1.25 g/kg和重度的10.58±1.51 g/kg,但不同退化程度之间无显著性差异(表 1和图 4a)。不同样地中糙隐子草的Si产生通量平均值为0.11±0.02 g/(m2·a)(图 4d),且轻度退化样地中糙隐子草Si产生通量的平均值为0.20±0.03 g/(m2·a),明显高于中度的0.08±0.02 g/(m2·a)和重度的0.05±0.01 g/(m2·a)(P < 0.05)(图 4d)。
羊草中Si含量的变化范围为5.77~23.93 g/kg,平均含量为12.39±1.24 g/kg(表 1)。不同退化程度中羊草的Si含量平均值分别为12.37±1.66 g/kg(轻度)、13.36±2.26 g/kg(中度)和10.95±2.42 g/kg(重度),不同程度之间无显著性差异(图 4b)。不同样地中羊草的Si产生通量平均值为0.08±0.01 g/(m2·a)(表 1和图 4e),且轻度退化样地中羊草Si产生通量的平均值为0.10±0.02 g/(m2· a),显著高于重度的0.05±0.01 g/(m2·a)(P < 0.05),但中度退化样地的通量均值与其他样地之间的差异不显著(图 4e)。
3 讨论 3.1 草地退化对植物Si分布特征的影响陆地生态系统中,草地生态系统是一个巨大的Si库,这主要是由两方面原因造成的:一是草地生态系统的净生产力较高(占全球陆地生态系统的20 %以上),二是草本植物含有较高的硅含量[13, 26~27]。然而,并不是所有草地植物都富集Si,从系统发生学的角度看,草地中的禾本科和莎草科属于喜硅植物,平均含有10~30 g/kg的Si,而豆科植物的Si含量仅约为3 g/kg,属于厌硅植物[3, 28~29]。在此研究区域内,禾本科和莎草科植物的平均Si含量分别为11.53±0.61 g/kg(n=59)和9.51±1.23 g/kg(n=5),而藜科(猪毛菜,Salsola collina)平均含Si量为1.78±0.36 g/kg(n=6),与已有的研究结果相近[22](表 1)。随着退化程度的增加,样地植物Si含量显著下降(图 4c),这可能是作为建群种和喜硅的禾本科植物(如羊草和针茅)被藜科和亚竹科(如猪毛菜和沙竹)逐渐替代的结果[25]。此研究结果显示,草地退化可以通过影响种群结构而改变草地生态系统植物整体的Si含量状况。草地退化的另一作用是使地上净初级生产力降低(表 1),这导致了草地Si产生通量随着退化程度的加深而快速减小(图 4f)。总体来说,草地退化会导致种群结构的变化和地上净初级生产力的下降,从而影响草地生态系统地上植物的Si分布特征。
3.2 草地退化对不同功能类型植物Si分布的影响在生态学中,为了研究环境变化对某种功能类型植物的影响,通常可以选取其中的一种或几种常见物种,用来代表该功能类型植物[30]。本研究中,作为分布最为广泛的两种植物,羊草是一种典型的C3植物,是我国温带草原地带性植物的优势种和主要的建群种,可以组成大面积的草原;而糙隐子草(C4植物)是羊草草原或针茅草原群落中组成下层的小禾草层片[31]。
本研究中,虽然两种植物Si含量的平均值相近,但羊草Si含量的分布范围(5.77~23.93 g/kg)大于糙隐子草(6.10~20.71 g/kg),且随着退化程度的增加,羊草Si含量呈现为先上升后下降的倒“V”型,而糙隐子草Si含量呈下降趋势(表 1和图 4),两种植物Si含量表现的不同可能是由于建群种和伴生种植物的特征不同造成的。羊草为典型的建群种,可以使用多种营养利用策略,调整营养元素的需求,以适应外界环境中营养物质的变化[32]。已有研究发现,当外界环境中的N和P等营养充足时,羊草将多余的营养元素储存在根部,当营养元素匮乏时,羊草可以利用根中储存的营养元素,以维持个体地上部分的营养平衡[24, 33]。Ma和Yamaji[34]发现植物中存在两种负责Si运输的蛋白,Low Silicon 1(Lsi1)和2(Lsi2),证明植物主动从土壤中吸收Si的机制。在植物体内,Si主要依靠蒸腾作用运输到各个组织,大部分的Si储存于植物的地上部分[6]。本研究中羊草中Si含量的变化可能是主动调控Si吸收的结果。
糙隐子草Si产生通量(0.11±0.02g/(m2·a))高于羊草(0.08±0.01 g/(m2 ·a)),且轻度退化样地糙隐子草的Si产生通量大于羊草(图 4)。由Si产生通量主要取决于植物的地上净初级生产力可知,造成这种现象的直接原因是糙隐子草的地上净初级生产力高于羊草。而两者生产力的差别,可能反映了两种植物光合作用类型的差异。糙隐子草是一种典型的C4植物,有研究表明,我国温带草原C4植物种数由东向西随干旱化程度加重呈增加趋势,特别是在放牧干扰下,C4植物生物量占群落总生物量比率明显增大[35~36]。同时,在放牧退化演替的草地中,糙隐子草种群存在明显的“超补偿性生长”效应,可成为优势度最大的物种[30]。但当草地退化加剧时,糙隐子草的地上净初级生产力急剧下降,而羊草降幅不明显(图 2和4),因此糙隐子草的Si产生通量明显降低(P < 0.05),而羊草的Si产生通量变化不显著。随着草地的进一步退化,糙隐子草和羊草的地上净初级生产力随之减少,造成Si产生通量的降低(图 4)。
因此,对于羊草和糙隐子草,草地退化主要以降低植物的地上净初级生产力和影响其Si含量的方式影响Si的分布,且因植物功能类型不同而效果不同。此外,结果显示寸草苔(莎草科)Si含量随草地退化程度的增强而增加,与禾本科的几类植物的变化趋势相反,这可能与该植物本身的生理特性有关。寸草苔具有耐寒、耐旱和耐践踏等特点[37],当草地退化加剧时,该植物可以成为优势种,这与本文的植被调查结果相近(表 1)。且禾本科和莎草科植物均为富硅植物[3~4],因此对于Si的吸收可能存在一定的竞争关系。因此,在退化不明显的草地中,其Si含量较低。当退化加重时,其Si含量反而增加。
3.3 草地退化对植硅体碳汇的影响草地生态系统在全球陆地生态群落植硅体碳汇中占有重要地位,Song等[13]研究表明,由于植物中Si含量与植硅体含量密切相关,草本植物的植硅体含量可以根据Si含量进行估计,由此估算了我国5种不同类型草原植物地上的植硅体含量分别为27.8 g/kg(荒漠草原)、34.8 g/kg(典型草原)、41.2 g/kg(草甸草原)、31.4 g/kg(高寒草原)和27.4 g/kg(高寒草甸)。对比本研究,不同退化程度草地植物地上部分的植硅体含量分别为25.33±2.11 g/kg(轻度)、21.85±2.37 g/kg(中度)和16.68±1.93 g/kg(重度),相对低于Song等[13]的结果,可能的原因包括两方面,一是草地退化造成土壤中营养元素的降低[38~39],从而影响植物植硅体含量;二是由于植被物种分布的空间异质性造成的。
根据Song等[13]提出的空间尺度上估算草地生态系统地上部分植硅体碳产生通量的方法,假定草本植物中植硅体碳含量中值为1.5 %,我们初步估计了不同退化程度草地植物地上部分植硅体碳产生通量分别为0.320±0.038 kg/(ha·a)(轻度)、0.190±0.021 kg/(ha·a)(中度)和0.068±0.006 kg/(ha·a)(重度),随着退化程度的加剧而显著性减小(P < 0.05)(图 5)。Ru等[25]系统测定了不同沙化程度草地植物地上部分的植硅体碳含量和植硅体碳产生通量,其植硅体碳产生通量变化范围为0.06~0.48 kg/(ha·a),与本研究区域内的估算结果相近。由此可见,由于草地退化,本区域内草地生态系统植物地上部分植硅体碳产生通量呈现不同程度的减少,当退化严重时,固碳速率将下降5倍以上。然而,应该注意的是,本文对于退化草地植硅体碳汇的研究为粗略评估,未来仍需开展深入的实测研究。同时,由于气候条件和植被特征的差异,我国包含7种不同类型的草原生态系统,不同类型草原的植物群落结构差异较大[13],因此草地退化对其植硅体固碳速率的影响可能效果不同,未来可以开展此方面的研究。Qi等[40]研究了典型草原中植物地下部分对植硅体碳汇的贡献,发现植物地下部分植硅体碳含量明显高于地上部分,且植硅体碳产生通量为地上部分的25~51倍。因此未来可以研究草地退化对地下部分植硅体固碳能力的影响。
|
图 5 不同退化程度草地植硅体含量(a)以及植硅体(b)和植硅体碳产生通量(c) Fig. 5 Phytolith content (a) and production fluxes of phytolith(b) and PhytOC (c) of grasslands with different degradation degrees |
草地退化不仅降低植物群落固碳速率,同时进一步对土壤碳库产生影响。Pan等[41]定量分析了不同退化程度草地土壤剖面(0~50 cm)有机碳和植硅体碳的分布特征。其中,不同退化程度草地土壤有机碳含量分别为6.06±1.33 g/kg(未退化)、3.41±0.57 g/kg(轻度)、5.43±1.78 g/kg(中度)和2.41±0.45 g/kg(重度),其储量分别为40.15±1.98 t/ha(未退化)、24.08±1.13 t/ha(轻度)、33.52±1.73 t/ha(中度)和16.81±0.17 t/ha(重度),随退化程度的加深而呈现明显降低的趋势;不同退化程度草地土壤植硅体储量分别为12.97±2.15 t/ha、15.90±0.65 t/ha、14.35±0.79 t/ha和13.22±1.07 t/ha,植硅体碳储量分别为0.11±0.02 t/ha、0.16±0.02 t/ha、0.12±0.01 t/ha和0.07±0.01 t/ha。以上这些结果表明草地退化能够显著影响土壤植硅体和植硅体碳储量。
3.4 对草地管理的启示在我国,因草地退化等原因而导致的地上净初级生产力低下是限制植硅体固碳潜力的主要因素之一[13, 25]。研究表明,适当的人为调控措施,例如施加相应的肥料[42]和避免过度放牧[43~44],可以显著提高草地生态系统的生产力。Zhao等[45]研究发现,适量的氮肥施加可以有效提高退化草地的生物量以及草本植物中的植硅体和植硅体碳的含量。有研究表明,适度放牧(避免过度放牧)不仅可以有效提高草地的生物量,而且可以增加禾本科在植物群落中的比例[46~47],从而影响植物Si的分布。本文认为这些措施实施的同时可以改变草地生态系统的Si分布特征以及提高植物植硅体的固碳速率。
4 结论和展望本研究以我国北方农牧交错带内退化草地为研究对象,调查了草地退化对植物地上部分Si分布特征的影响,并初步估算了草地退化对植物地上部分植硅体固碳能力的影响。研究发现,随着草地退化程度的加剧,糙隐子草地上部分Si含量呈下降趋势,分别为13.87±1.23 g/kg(轻度)、13.11±1.25 g/kg(中度)和10.58±1.51 g/kg(重度)。而羊草表现为先上升后下降的倒“V”型趋势,分别为12.37±1.66 g/kg(轻度)、13.36±2.26 g/kg(中度)和10.95±2.42 g/kg(重度)。这些结果表明,由于植物的功能类型不同,不同种类植物Si分布特征对草地退化的响应方式不同。同时,不同退化程度样地植物地上部分Si含量和产生通量总体呈现下降趋势。植硅体碳产生通量显著降低(P < 0.05),分别为0.320±0.038 kg/(ha·a)(轻度)、0.190±0.021 kg/(ha·a)(中度)和0.068±0.006kg/(ha·a)(重度)。草地退化可以通过改变种群结构和降低地上生物量的方式影响植物地上部分Si的分布和植硅体的固碳能力。未来可以从以下4个方面深化此研究:
(1) 实际测量不同退化程度草地植物植硅体和植硅体碳含量;
(2) 研究草地退化对植物地下部分Si分布特征和植硅体固碳潜力的影响;
(3) 针对不同类型的草原,开展草地退化对植物Si分布和植硅体固碳的影响的研究;
(4) 研究草地恢复工程对草地生态系统Si分布和植硅体碳汇的影响。
致谢: 在此特别感谢北京大学刘鸿雁教授对野外植被调查和样品采集的指导;感谢审稿专家和编辑部杨美芳老师建设性的修改意见。
| [1] |
Mitchell J F B, Johns T C, Gregory J M, et al. Climate response to increasing levels of greenhouse gases and sulphate aerosols[J]. Nature, 1995, 376(6540): 501-504. DOI:10.1038/376501a0 |
| [2] |
Falkowski P, Scholes R J, Boyle E, et al. The global carbon cycle:A test of our knowledge of earth as a system[J]. Science, 2000, 290(5490): 291-296. DOI:10.1126/science.290.5490.291 |
| [3] |
Epstein E. The anomaly of silicon in plant biology[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(1): 11-17. DOI:10.1073/pnas.91.1.11 |
| [4] |
Epstein E. Silicon[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50(50): 641-664. |
| [5] |
Zuo X, Lu H, Jiang L, et al. Dating rice remains through phytolith carbon-14 study reveals domestication at the beginning of the Holocene[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(25): 6486. DOI:10.1073/pnas.1704304114 |
| [6] |
Song Z, Mcgrouther K, Wang H. Occurrence, turnover and carbon sequestration potential of phytoliths in terrestrial ecosystems[J]. Earth-Science Reviews, 2016, 158: 19-30. DOI:10.1016/j.earscirev.2016.04.007 |
| [7] |
Parr J F, Sullivan L A. Soil carbon sequestration in phytoliths[J]. Soil Biology and Biochemistry, 2005, 37: 117-124. DOI:10.1016/j.soilbio.2004.06.013 |
| [8] |
张健平, 吕厚远, 吴乃琴, 等. 关中盆地6000-2100 cal.a B.P.期间黍、粟农业的植硅体证据[J]. 第四纪研究, 2010, 30(2): 287-297. Zhang Jianping, Lü Houyuan, Wu Naiqin, et al. Phytolith evidence of millet agriculture during about 6000-2100 a B.P. in the Guanzhong Basin, China[J]. Quaternary Sciences, 2010, 30(2): 287-297. |
| [9] |
刘洪妍, 介冬梅, 刘利丹, 等. 长白山区典型禾本科植物植硅体形状系数[J]. 第四纪研究, 2013, 33(6): 1234-1244. Liu Hongyan, Jie Dongmei, Liu Lidan, et al. The shape factors of phytolith in selected plants from Changbai Mountains and their implications[J]. Quaternary Sciences, 2013, 33(6): 1234-1244. DOI:10.3969/j.issn.1001-7410.2013.06.19 |
| [10] |
Song Z, Liu H, Cae S, et al. Phytolith carbon sequestration in global terrestrial biomes[J]. Science of the Total Environment, 2017, 603-604: 502-509. DOI:10.1016/j.scitotenv.2017.06.107 |
| [11] |
Scurlock J M O, Hall D O. The global carbon sink:A grassland perspective[J]. Global Change Biology, 1998, 4(2): 229-233. |
| [12] |
Piao S, Fang J, Zhou L, et al. Changes in biomass carbon stocks in China's grasslands between 1982 and 1999[J]. Global Biogeochemical Cycles, 2007, 21(2): GB2002, 1-10. |
| [13] |
Song Z, Liu H, Si Y, et al. The production of phytoliths in China's grasslands:Implications to the biogeochemical sequestration of atmospheric CO2[J]. Global Change Biology, 2012, 18(12): 3647-3653. DOI:10.1111/gcb.12017 |
| [14] |
侯学煜. 中国植被地理及优势植物化学成分[M]. 北京: 科学出版社, 1982: 188-243. Hou Xueyu. Vegetation Geography of China and Chemical Composition of Its Dominant Plants[M]. Beijing: Science Press, 1982: 188-243. |
| [15] |
赵哈林, 赵雪. 中国北方半干旱地区生态环境的退化及其防治[J]. 干旱区研究, 1993(4): 44-48. Zhao Halin, Zhao Xue. The ecological environment degradation and its control in the semi-drought region of Northern China[J]. Arid Zone Research, 1993(4): 44-48. |
| [16] |
Wu J, Jiang G, Han X. Restoration and management of the Inner Mongolia grassland require a sustainable strategy[J]. Ambio, 2006, 35(5): 269-270. DOI:10.1579/06-S-158.1 |
| [17] |
Pan W, Song Z, Liu H, et al. Impact of grassland degradation on soil phytolith carbon sequestration in Inner Mongolian steppe of China[J]. Geoderma, 2017, 308: 86-92. DOI:10.1016/j.geoderma.2017.08.037 |
| [18] |
朱震达, 刘恕. 中国北方农牧交错沙漠化地区农业发展战略问题的研究[J]. 中国沙漠, 1982, 2(4): 1-5. Zhu Zhenda, Liu Shu. A study on strategy of the development of agriculture of desertified lands in the interlacing pastoral-agricultural in North China[J]. Journal of Desert Research, 1982, 2(4): 1-5. |
| [19] |
赵哈林, 赵学勇, 张铜会, 等. 北方农牧交错带的地理界定及其生态问题[J]. 地球科学进展, 2002, 17(5): 739-747. Zhao Halin, Zhao Xueyong, Zhang Tonghui, et al. Boundary line on agro-pasture zigzag zone in North China and its problems on eco-environment[J]. Advance in Earth Sciences, 2002, 17(5): 739-747. DOI:10.3321/j.issn:1001-8166.2002.05.017 |
| [20] |
程序. 农牧交错带研究中的现代生态学前沿问题[J]. 资源科学, 1999, 21(5): 1-8. Cheng Xu. Frontier issue of modern ecology in the study of ecotone between agriculture and animal husbandry[J]. Resource Science, 1999, 21(5): 1-8. DOI:10.3321/j.issn:1007-7588.1999.05.001 |
| [21] |
张殿发, 李凤全. 我国北方农牧交错带脆弱生态地质环境形成机制探讨[J]. 生态与农村环境学报, 2000, 16(4): 58-60. Zhang Dianfa, Li fengquan. Mechanism of formation of fragile eco-geo-environment of agro-pastoral zigzag zone in Northern China[J]. Journal of Ecology and Rural Environment, 2000, 16(4): 58-60. DOI:10.3969/j.issn.1673-4831.2000.04.014 |
| [22] |
Ji Z, Yang X, Song Z, et al. Silicon distribution in meadow steppe and typical steppe of Northern China and its implications for phytolith carbon sequestration[J]. Grass & Forage Science, 2017, 73(2): 482-492. |
| [23] |
Yang X, Zhang K, Jia B, et al. Desertification assessment in China:An overview[J]. Journal of Arid Environments, 2005, 63(2): 517-531. DOI:10.1016/j.jaridenv.2005.03.032 |
| [24] |
Li Y, Li Q, Guo D, et al. Ecological stoichiometry homeostasis of Leymus chinensis in degraded grassland in western Jilin Province, NE China[J]. Ecological Engineering, 2016, 90: 387-391. DOI:10.1016/j.ecoleng.2016.01.079 |
| [25] |
Ru N, Yang X, Song Z, et al. Phytoliths and phytolith carbon occlusion in aboveground vegetation of sandy grasslands in eastern Inner Mongolia, China[J]. Science of the Total Environment, 2018, 625: 1283-1289. DOI:10.1016/j.scitotenv.2018.01.055 |
| [26] |
Blecker S W, Mcculley R L, Chadwick O A, et al. Biologic cycling of silica across a grassland bioclimosequence[J]. Global Biogeochemical Cycles, 2006, 20(3): GB3023, 1-11. |
| [27] |
Carnelli A L, Madella M, Theurillat J P. Biogenic silica production in selected alpine plant species and plant communities[J]. Annals of Botany, 2001, 87(4): 425-434. DOI:10.1006/anbo.2000.1355 |
| [28] |
Conley D J. Terrestrial ecosystems and the global biogeochemical silica cycle[J]. Global Biogeochemical Cycles, 2002, 16(4): 1-8. |
| [29] |
Schaller J, Hodson M J, Struyf E. Is relative Si/Ca availability crucial to the performance of grassland ecosystems?[J]. Ecosphere, 2017, 8(3): 1-11. |
| [30] |
汪诗平, 王艳芬, 陈佐忠. 气候变化和放牧活动对糙隐子草种群的影响[J]. 植物生态学报, 2003, 27(3): 337-343. Wang Shiping, Wang Yanfen, Chen Zuozhong. Effect of climate change and grazing on populations of Cleistogenes squarrosa in Inner Mongolia steppe[J]. Acta Phytoecologica Sinica, 2003, 27(3): 337-343. DOI:10.3321/j.issn:1005-264X.2003.03.008 |
| [31] |
中国科学院中国植物志委员会. 中国植物志[M]. 北京: 科学出版社, 1987: 19-20. Committee of Flora of China, Chinese Academy of Sciences. Flora of China[M]. Beijing: Science Press, 1987: 19-20. |
| [32] |
黄菊莹, 袁志友, 李凌浩. 羊草绿叶氮、磷浓度和比叶面积沿氮、磷和水分梯度的变化[J]. 植物生态学报, 2009, 33(3): 442-448. Huang Juying, Yuan Zhiyou, Li Linghao. Changes in[J]. Chinese Journal of Plant Ecology, 2009, 33(3): 442-448. DOI:10.3773/j.issn.1005-264x.2009.03.003 |
| [33] |
Yu Q, Elser J J, He N, et al. Stoichiometric homeostasis of vascular plants in the Inner Mongolia grassland[J]. Oecologia, 2011, 166(1): 1-10. DOI:10.1007/s00442-010-1902-z |
| [34] |
Ma J F, Yamaji N. A cooperative system of silicon transport in plants[J]. Trends in Plant Science, 2015, 20(7): 435. DOI:10.1016/j.tplants.2015.04.007 |
| [35] |
殷立娟, 王萍. 中国东北草原植物中的C3和C4光合作用途径[J]. 生态学报, 1997, 17(2): 113-123. Yin Lijuan, Wang Ping. Distribution of C3 and C4 photosynthetic pathways of plants on the steppe of Northeastern China[J]. Acta Ecologica Sinica, 1997, 17(2): 113-123. |
| [36] |
唐海萍, 刘书润, 张新时. 内蒙古地区的C4植物及其生态地理特性的研究[J]. 植物学报(英文版), 1999, 41(4): 420-424. Tang Haiping, Liu Shurun, Zhang Xinshi. The C4 plants in Inner Mongolia and their eco-geographical characteristics[J]. Acta Botanica Sinica, 1999, 41(4): 420-424. DOI:10.3321/j.issn:1672-9072.1999.04.016 |
| [37] |
萧运峰, 陈茂庆. 野生草坪植物——寸草苔的研究[J]. 生物学杂志, 1996(4): 15-17. Xiao Yunfeng, Chen Maoqing. Plants of wild grasslands:A study of Carex duriuscula[J]. Journal of Biology, 1996(4): 15-17. |
| [38] |
Zhou R L, Li Y Q, Zhao H L, et al. Desertification effects on C and N content of sandy soils under grassland in Horqin, Northern China[J]. Geoderma, 2008, 145(3): 370-375. |
| [39] |
Feng Q, Endo K N, Cheng G. Soil carbon in desertified land in relation to site characteristics[J]. Geoderma, 2002, 106(1): 21-43. |
| [40] |
Qi L, Li F Y, Huang Z, et al. Phytolith-occluded organic carbon as a mechanism for long-term carbon sequestration in a typical steppe:The predominant role of belowground productivity[J]. Science of the Total Environment, 2016, 577: 413-417. |
| [41] |
Pan W, Song Z, Liu H, et al. Impact of grassland degradation on soil phytolith carbon sequestration in Inner Mongolian steppe of China[J]. Geoderma, 2017, 308: 86-92. DOI:10.1016/j.geoderma.2017.08.037 |
| [42] |
Gough L, Osenberg C W, Gross K L, et al. Fertilization effects on species density and primary productivity in herbaceous plant communities[J]. Oikos, 2000, 89(3): 428-439. DOI:10.1034/j.1600-0706.2000.890302.x |
| [43] |
Su Y Z, Li Y L, Cui J Y, et al. Influences of continuous grazing and livestock exclusion on soil properties in a degraded sandy grassland, Inner Mongolia, Northern China[J]. Catena, 2005, 59(3): 267-278. DOI:10.1016/j.catena.2004.09.001 |
| [44] |
王静, 郭铌, 蔡迪花, 等. 玛曲县草地退牧还草工程效果评价[J]. 生态学报, 2009, 29(3): 1276-1284. Wang Jing, Guo Ni, Cai Dihua, et al. The effect evaluation of the program of restoring grazing to grasslands in Maqu County[J]. Acta Ecologica Sinica, 2009, 29(3): 1276-1284. DOI:10.3321/j.issn:1000-0933.2009.03.023 |
| [45] |
Zhao Y, Song Z, Xu X, et al. Nitrogen application increases phytolith carbon sequestration in degraded grasslands of North China[J]. Ecological Research, 2016, 31(1): 117-123. DOI:10.1007/s11284-015-1320-0 |
| [46] |
刘颖, 王德利, 王旭, 等. 放牧强度对羊草草地植被特征的影响[J]. 草业学报, 2002, 11(2): 22-28. Liu Ying, Wang Deli, Wang Xu, et al. The effect of grazing intensity on vegetation characteristics in Leymus chinensis grassland[J]. Acta Prataculturae Sinica, 2002, 11(2): 22-28. DOI:10.3321/j.issn:1004-5759.2002.02.004 |
| [47] |
肖金玉, 蒲小鹏, 徐长林. 禁牧对退化草地恢复的作用[J]. 草业科学, 2015, 32(1): 138-145. Xiao Jinyu, Pu Xiaopeng, Xu Changlin. Effects of grazing prohibition on restoration of degraded grassland[J]. Pratacultural Science, 2015, 32(1): 138-145. |
Abstract
In grasslands, silicon(Si) not only plays an irreplaceable role during the plant growth, but also contributes significantly to the terrestrial ecosystem carbon sink in the form of phytolith-occluded carbon(PhytOC). In the past decades, grassland degradation due to the human disturbances has got much attention. In this study, we chose 30 sampling sites with different degrees of degradation in agro-pastoral ecotone of Northern China(41°3'~44°31'N, 114° 15'~122°2'E). Based on the coverage and above-ground biomass of vegetation, these sampling sites were classified into three different degraded degrees:lightly degraded grasslands(LDG), moderately degraded grasslands(MDG) and seriously degraded grasslands(SDG). Then we analyzed the Si content and distribution in the above-ground parts of 71 plants(eight typical species), and estimated the PhytOC production fluxes of degraded grasslands. The Si content of Cleistogenes squarrosa shows a decreasing trend with the degradation degree of the grasslands, while that of the Leymus chinensis shows an inverted "V" type that rises first and then falls. The Si content of plant above-ground parts in grasslands of different degradation degrees are 12.25±1.02 g/kg(lightly degraded), 10.56±1.15 g/kg(moderately degraded) and 8.06±0.93 g/kg(seriously degraded), and the production fluxes of PhytOC significantly decrease in the order of degradation degrees, being 0.320±0.038 kg/(ha·a), 0.190±0.021 kg/(ha·a) and 0.068±0.006 kg/(ha·a), respectively(P < 0.05). This article suggests that the impacts of grassland degradation on Si content and production flux of diverse plant species are different, which may be caused by the different functional types of plants. Grassland degradation can change the plant population structure and above-ground net primary productivity(ANPP) of grasslands, and then affect the distribution of Si in above-ground vegetation and the potential of phytolith carbon sequestration. As the degradation continually develops, the above-ground PhytOC production retes of grasslands in this study region can decline by more than 5 times. 2019, Vol.39
2019, Vol.39

