2 青岛海洋科学与技术国家实验室, 海洋地质过程与环境功能实验室, 山东 青岛 266237;
3 国家海洋局第一海洋研究所, 海洋沉积与环境地质国家海洋局重点实验室, 山东 青岛 266061)
陆源物质通过河流向海洋的输送及其对近海环境的影响已成为全球环境变化研究的重要领域[1~2]。河流物质输送以及河流-流域复合生态系统生态环境变化直接关系到河口、近岸海洋环境演变过程,是陆海相互作用研究的重要领域[3]。河流颗粒物主要来源于所在流域被侵蚀的土壤和岩石风化产物,其组成和性质在很大程度上反映了流域的岩石-气候-生物的组合特点[4],同时也是河口、近海物质的重要来源之一[5~6]。
河流水体颗粒物中的生物硅,尤其是植物硅酸体(植物硅酸体是高等植物细胞中发育的硅质颗粒,其不包括海绵类、硅藻类、放射虫类及类似物种中的硅[7~8],简称植硅体,其英文名为Phytolith),是由陆地向海洋输送生物硅的重要载体,是硅元素陆海循环的重要环节[9]。近年来,植硅体在陆地生态系统中的作用和对海洋硅循环的重要影响已日益引起更多的关注[9~12],也逐渐成为硅循环研究中的全新领域,特别是在当今河流的筑坝调蓄和流域的富营养化大大降低了溶解硅向海洋输送的情况下。
不同于微体古生物和古环境学家眼中的植硅体,水文水化学家视野中河流输送的植硅体具有一定的化学活性,是参与地球化学循环过程的重要载体;与植硅体相关的水文生物地球化学研究领域包括以下3个方面:1)流域高等植物生长,植硅体在土壤中的累积、转化和埋藏等,地表过程致使土壤中的植硅体进入河流;2)由梯级水利工程产生的水流减缓、水龄延长以及水量锐减等水文水动力变化导致的河流物质输送时空分布变化及物质滞留;3)植硅体进入河口、近海,影响海洋硅的生物地球化学过程。实际上,对于河流植硅体参与水体硅循环的认识过程也是生物硅概念更新的过程,是对陆-海相互作用认识的深化,并可能深化对全球硅循环的认识。因此,了解河口硅循环的主要过程、控制机制和影响因素对于更好地认识区域硅的源汇格局与特征以及评价人类活动的影响具有重要意义。为此,本文综述了植硅体参与硅循环的主要研究进展,并选择我国典型流域——长江流域与黄河流域为案例,深入系统地研究自然与人类活动影响背景下河流植硅体入海通量及其变化的规律,以期为流域-海洋系统硅循环提供新的科学依据。
1 研究材料与方法生物硅是由生物生理作用所形成具有不定型结构的活性硅。相比于成岩硅,水体中生物硅无疑是硅循环中关键的一环[13],也是记录水体环境状况的重要指标[8, 14~16],并在碳循环中扮演着重要的角色[17]。就来源而言,水体生物硅有4类主要的来源(图 1)。在海洋中生物硅分别由硅藻、放射虫和海绵骨针等硅质颗粒所构成[18],并以硅藻为主(90 % [19]);在河流中,水体生物硅主要是由高等植物所产生的植硅体和淡水硅藻所构成。由于陆地和海洋两大生态系统所产生的生物硅库都非常的巨大,总量均在5.6×109 t(以硅(Si)计)左右[13],其必然成为地表和水体硅循环中最主要的参与者。正是由于流域地表生物过程的巨大贡献,河流所携带的生物硅成为河流与近海活性硅的重要组成部分[9, 12, 20~21],其在海洋硅循环和生态环境变化中的重要影响已日益引起研究者更多的关注[12, 16],并逐渐成为硅循环和碳循环研究中的全新领域。
当前,人们已开展了一定数量的河流-近海硅循环的研究,但对水体硅循环的认识仍有不足。准确量化生物硅在硅循环中的地位,我们有必要对生物硅性质和组成及其生态效应等的研究进展进行系统的总结,这对于今后深入开展多学科交叉的水体硅循环研究十分的必要。本文所讨论的问题与数据来自国内外已发表的相关研究,未涉及到微生物相关的生物硅循环研究,这主要是缺乏相关的研究。
2 河流植硅体输送与硅循环:从假设到验证陆源生源要素(硅、氮与磷)入海在全球近岸海洋初级生产力中起着关键的作用,同时其对稳定大气CO2浓度变化的贡献不可忽视[24~26]。硅是地球表面含量仅次于氧的大量元素,作为重要的生源要素在许多生物地球化学过程中起着非常重要的作用[27~28]。就全球硅循环而言,输入世界大洋中的硅大部分来自于河流的输送[29~30],而目前关于河流水体中硅的研究主要集中在溶解硅的浓度和通量及区域性差异等方面,因为这些方面与海洋生态系统的变化密切相关[2, 11, 30]。但对于河流颗粒物中生物硅(包括水体生长的硅藻、放射虫和海绵骨针以及流域植被产生的植硅体等[31~32])的含量、输运与转化规律等研究则较少,特别是植硅体的含量、输运与转化及其对河流硅输送通量的贡献方面,目前还了解很少。河流输送的生物硅占其向海洋输送的生物硅和溶解硅总量的16 % [20],因而河流中的生物硅在全球硅循环中与溶解硅相同也扮演着十分重要的角色,是河流向海洋输送硅的重要载体,值得进一步关注。
传统认为硅的循环主要受岩石风化、矿物溶解和水体沉积的影响。实际上,高等植物产生的植硅体,作为河流硅来源的重要方面,在全球硅的生物地球化学循环中起着重要作用。在陆地生态系统中,除硅藻类浮游植物消耗水体中溶解硅以外,某些大型植物的生长也需要硅。高等植物每年可将(1.7~5.6)×109 t(以硅(Si)计)的溶解硅转化为植硅体[9~10],其接近于海洋水体中溶解硅的总量[10, 30]。最为重要的一点,植硅体等形式的生物硅为不定形硅,其中一部分较易溶出并再次进入硅的循环过程[33~34];高等植物固定的植硅体可通过降解再循环以及地表迁移等过程进入水体[11],成为河流水体溶解硅的重要来源,如在美国夏威夷州河流中,68 % ~90 %的溶解硅是由植硅体转化而来的[11]。因此,除岩石风化作用贡献以外,河流输送的溶解硅中还有相当一部分来源于高等植物产生的植硅体再循环过程所释放[9~10]。此外,植硅体也可通过地表径流等形式进入河流等地表水体成为生物硅的重要来源,并最终汇入到海洋,影响海洋硅循环过程及全球变化[35~36]。中国东海沉积物中曾发现植硅体的存在[37],这可能与江河的输送有关。又如,在三峡水库入库的涪陵江段及长江中下游水体中观测到较高含量的生物硅(约0.4 mg/L,以硅(Si)计),其与硅藻生物量相关性不高,这部分生物硅可能主要是由植硅体所组成[38],而鄱阳湖沉积物中丰富的植硅体含量[39]也从一个侧面说明了长江河流颗粒物中存在较为可观的植硅体。此外,对于渤海表层与浅钻孔岩芯分析发现,绝大部分样品中均含有丰富的植硅体[8],一个可行的假设是:渤海沿岸河流对海洋沉积物中植硅体的含量贡献较大。上述假设正在被证实,如在非洲喀麦隆的尼永河(Nyong River)输送的生物硅中有84 % ~94 %是由植硅体组成的,硅藻仅占0~3 % [32]。同样,在中国的黄河和长江以及注入非洲马拉维湖(Lake Malawi)的众多河流里,水体中植硅体也占绝对优势[12, 40~41]。因此,植硅体是河流水体中最能代表“生物硅”的硅质颗粒。尽管部分研究者已经发现在河流输送的泥沙颗粒中存在大量的植硅体,但是这部分硅还未被完全纳入到地表水体硅生物地球化学循环中来研究[31, 42]。同时,植硅体在陆地生态系统中累积以及转化作用极大地影响着河流等水体硅的输出通量[11, 43~46]。当然,环境中植硅体的活性与其所处的环境、个体大小及自身形成的时间等因素息息相关,并最终有少部分得以保存下来,成为记录其所处环境状况的指标之一[16, 22]。遗憾的是,这类有关植硅体化学活性、环境行为的研究几乎没人涉及,极大地限制了植硅体参与硅循环的研究。因此,深入了解陆地植硅体的迁移、转化过程对于研究河流、海洋硅循环以及全球环境变化问题至关重要。
3 高混浊河流植硅体输送:长江和黄河为例不可否认,在过去历史上和现今研究中河流携带植硅体在陆海相互作用和区域硅循环中一直没有被给予足够的重视。全球河流每年输送15×109 t的泥沙到河口[47],这些传输到河口的泥沙中包含有一定量的生物硅,其总量约为(3.1±0.6)×107 t(以硅(Si)计)[20],与河流输送的溶解硅通量大致处于同一量级,是河口水体溶解硅的重要来源。在其中,高混浊河流在输送陆源物质入海方面贡献较大[20, 41, 47],是陆海相互作用研究的重要内容。
当研究的问题涉及到流域或者近海尺度上的生物地球化学过程及其生态效应方面时,仅仅是分析河流入海硅通量的变化是不够的。从物质循环角度,植硅体对河流和近海物质循环具有控制作用,它对水体溶解硅的时间和空间分布格局具有一定的影响。例如,在我国的长江口,陆源生物硅都是河口溶解硅的重要来源,且显著提高了近河口区域生物硅的浓度[48]。中国渤海与东海沉积物中都发现有陆地生物硅的存在[8, 23, 37],这与黄河和长江的输送直接相关。可见,无论是长江还是黄河,其颗粒物中生物硅的含量和年输送量都很可观(表 1)[12, 41],其必然是我国河口生物硅和溶解硅存量的重要来源之一,并会对河口和陆架边缘海硅循环及海洋生态系产生深远影响。
| 表 1 长江和黄河硅的输送通量(103 t/a,以硅(Si)计) Table 1 Transport fluxes of silica(103 t/a) from the Changjiang River and the Yellow River |
另外,长江与黄河生物硅在组成上较为一致,均为植硅体、硅藻和放射虫所构成,其中硅藻和植硅体占主要部分[41, 43]。在长江,植硅体构成了43 %的生物硅,硅藻的贡献占55 %,海绵骨针的贡献仅为1.9 % [41];在黄河,植硅体和硅藻贡献了近50 %的生物硅,海绵骨针的贡献微乎其微[43](图 2)。相比于长江(生物硅/活性硅=0.19),黄河河流输送的生物硅占总活性硅的比例较高,约为0.48(生物硅/活性硅)(表 1),且植硅体更多地来源于中游干旱的黄土高原,这与长江流域的情况显著不同,长江向海输送的生物硅主要来源于温暖湿润的中下游流域[41]。
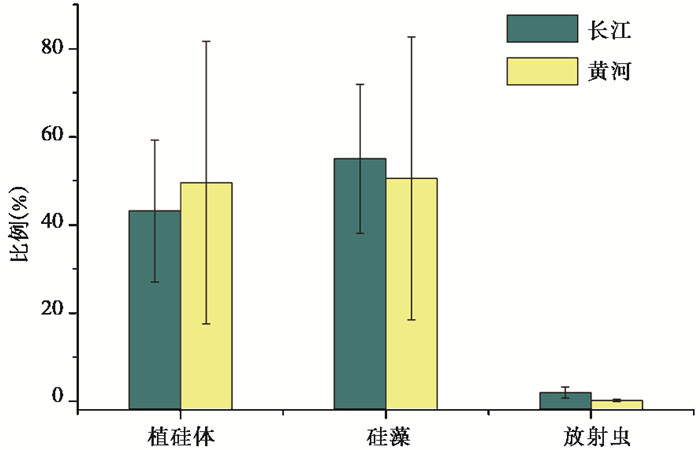
|
图 2 长江和黄河生物硅组成(数据源自文献[41, 43]) Fig. 2 Biogenic silica compositions in the Changjiang River and the Yellow River(data derived from references[41, 43]) |
特别需要指出的是,黄河干流在丰水期(7月)输送的生物硅中有超过90 %的部分为植硅体[12],这与非洲的尼永河[32]和马来西亚的热带河流[21]相一致,表明高的土壤侵蚀速率对河流生物硅组成的影响较大。然而,河流筑坝促使颗粒物在流域内滞留,这会导致河流输送的活性硅通量的减少。水库的截流(颗粒物的沉降)所引起的河流生物硅通量的减少[41],可能是导致河口活性硅构成显著变化的直接原因,这一点往往被研究者忽略。当然,水库效应导致的透明度提高还可能会促进淡水硅藻的初级生产的增加[2, 40],淡水硅藻的勃发形成的滞留效应会造成活性硅构成向更加复杂的方向发展(图 3)。同样遗憾的是,世界范围内水库中生物硅组成的研究及水库蓄水前后的变化还未见报道,极大地限制了水库效应对河流硅循环的影响研究。我们尝试通过河流生物硅与悬浮颗粒物的关系间接评估河流筑坝对生物硅输送的影响,相比之前随着泥沙的减少河流生物硅/活性硅的比例也在发生了显著的变化。以长江为例,河流输送的生物硅/活性硅比值从1980年前的0.47降低到目前的0.19 (2013~2014年)[41]。河流活性硅结构的变化无疑会对河口硅的来源和供给产生深远的影响。
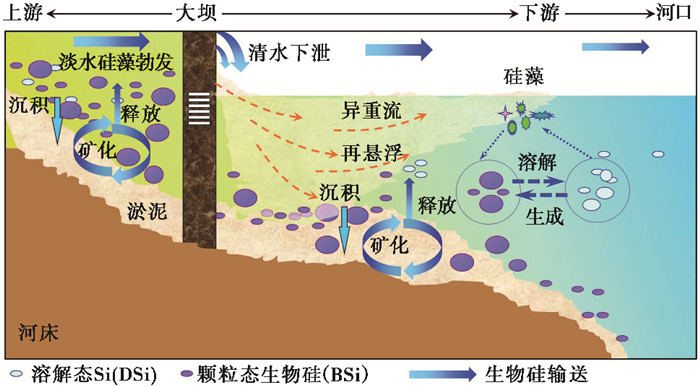
|
图 3 筑坝河流硅输送的示意图 Fig. 3 Influence of damming on the silica transport from river to sea |
河口区的生物硅可分海源和陆源两种类别。“海源”生物硅主要包括河口区自生浮游硅藻产生的硅质颗粒,“陆源”生物硅主要由流域陆地侵蚀产物植硅体和淡水硅藻所构成。从表观上看,河流输入到河口的生物硅在河口输运过程中多呈现为被移出的特征,即表现为生物硅的“汇”的作用,如德国的易北河(Elbe River)河口生物硅的去除率约为88 % [49],长江口生物硅的去除率在60 %以上[49]。实际上,河口这些生物硅连同海洋自生的硅藻等硅质颗粒仅有一小部分(3 %,全球尺度)被“真正”地保存下来[19],这意味着大部分生物硅将在河口过程中被溶解;若以Conley[20]的研究结果计算,全球河流中生物硅占活性硅(生物硅与溶解硅之和)的16 %,其溶解过程将是河口和近海硅收支的重要组成部分,尤其是那些颗粒物含量高、生物硅对溶解硅与生物硅之和贡献比例较大的河口[12~13, 50]。又如在芬兰的万塔河(Vantaa River)河口,陆源硅主导着河口硅循环过程(该区域的生物硅主要是陆地来源的植硅体),且在河口输送过程中有97 %的生物硅被溶解,成为河口溶解硅的重要来源(约占38 % [50])。同样,在我国的长江口[48]、比利时/荷兰的斯海尔德河(Scheldt River)河口[51],生物硅也是河口溶解硅的重要来源。正是由于生物硅的溶解作用对溶解硅的补充,部分河口中表现出溶解硅“源”的特征[52]。在黄河口的初步研究显示,植硅体占生物硅的比例为62 %,海洋浮游藻类的贡献仅占33 % [23],这表明陆源生物硅也是我国河口硅的主要来源,其在河口硅的输送、溶解和保存等区域硅循环中的地位不容忽视,值得进一步关注。
然而,世界主要河口中生物硅的时空分布格局、组成和性质差异较大,不同研究体系中生物硅对溶解硅总量的补充差异显著。一方面,颗粒物在河口区或边缘海的散布过程受到水动力和再悬浮等因素的影响[53];另一方面,生物硅的溶解受到盐度等因素的影响[54~55],但毫无疑问的是河口硅循环过程受到陆源硅的显著影响,特别是那些河流泥沙含量高、水流量大的大河口系统。一般而言,近海生态系统中(以东海为例)生物硅的溶解率约为75 % [56],这个比例在河口和近岸或许会更低一些,如在奥得河(Oder River,中欧,流经捷克、波兰和德国)河口,仅有50 %的自生的生物硅被溶解[52]。然而,必须指出的是入海后盐度和酸碱度的急剧变化将可能导致陆源生物硅的溶解作用大大加强[55],这也是比利时/荷兰的斯海尔德河河口[51]植硅体数量不多的可能原因,即存在陆源生物硅被快速地溶解,而海源生物硅则相对稳定的情况。此外,再悬浮过程也会对河口生物硅的组成产生影响[57]。从目前的数据看,再悬浮主要向水体供应硅藻碎屑,这个比例在10 % ~30 %之间(与硅藻产生总的生物硅相比[48])。在比利时/荷兰的斯海尔德河河口,研究者利用生物硅含量、悬浮物含量和硅藻色素之间的联系建立方程,区分活体硅藻与硅藻碎屑的作用[51]。不过,二者都属于硅藻类生物硅的范畴,仅可能在硅的溶解动力学方面存在差异,因此可在来源方面将他们一起研究。除物理过程外,生物硅还会与水环境中的铝、钾和铁等阳离子和粘土反应形成弱晶格结构的自生硅酸盐矿物[58~59]。但相比于河口生物硅的埋藏/溶解速率以及快的水交换速率和高的物质输送通量而言,生物硅形成自生硅酸盐矿物的时间极为漫长(18~36个月[58]),难以对水体生物硅含量产生实质的影响,其作用是可以忽略的。不过,在众多河口硅的相关研究中,仅有中国的黄河口、长江口、芬兰的万塔河河口和比利时/荷兰的斯海尔德河口考虑了生物硅的来源[23, 48, 50],并证明了陆-海相互作用中陆源生物硅在河口区硅循环中的重要作用。不过,也有研究认为生物硅在河口硅循环中的作用是被高估了;Arndt和Regnier[60]模拟结果显示,在斯海尔德河口仅有不到1 %的硅藻初级生产所需的溶解硅是由再循环产生的;实际上,这很大程度上是由于河流输入的溶解硅的通量显著高于生物硅的再生,同时河口近岸海域生物硅的埋藏作用又普遍高于大洋的结果造成的[13]。生物硅在河口到底扮演多么重要的角色,需要更多的数据支持。
此外,随着社会经济的发展,流域内各种人文活动强烈地冲击着河流原有的生物地球化学过程[61~63],导致河流物质输送的空间格局和时间分配的改变。世界上292个大河系统中的172个受到水坝的影响[64]。诸如筑坝等区域尺度水文变化将导致溶解硅入海通量的减少[2, 63, 65~66],并可能造成沿海浮游生物群落结构发生变化,从而影响海洋以硅藻为基础的生态系统的稳定。河流筑坝形成水库将引起河流水动力学条件的改变,导致颗粒物沉积作用加速[67],从而使颗粒物携带的生物硅在河流中去除。根据最新的统计结果,每年有13 %的河流输送的沉积物因水库修建而滞留于水库内[68],这必然会显著影响河流中包括植硅体在内的生物硅含量、分布及输送规律乃至影响河口、近海硅循环过程(图 3)。
5 结语和展望当前,关于河流和河口硅的研究主要集中在硅的输送通量、分布特征、化学行为、硅限制和硅收支等领域[13, 20, 69~71]。这些研究对溶解硅的关注多一些,对生物硅的研究则很少。近些年来,国外学者陆续开展了大量关于生物硅参与硅循环的研究[13, 71~73],其在海洋硅循环中的重要作用也逐渐被揭示[13]。国内关于生物硅的研究开始于本世纪初[74],相关研究也从最初的分析方法的探索[74~75]向生物硅含量与分布[56]、循环与收支[56, 70]及对碳循环影响[17, 76~77]等方向拓展;最近的研究开始关注于河流与河口硅[23, 48, 78~79]。相比于海洋自生的生物硅(主要是海洋硅藻)而言,陆源生物硅在特定盐度下的溶解速率要远高于前者[55],这使其最有可能成为河口溶解硅不可或缺的重要来源。但是,目前的研究缺少生物硅组成与来源方面的探索,很难定量计算陆源生物硅对海洋硅循环的准确贡献。这主要是因为利用化学提取法获取沉积物和水体颗粒物生物硅的含量[74~75],难以区分其来源及影响因素,更无法知晓不同来源生物硅对河口硅循环的具体贡献。只有综合分析生物硅的含量、组成、来源及入海行为等,才能准确地揭示陆地对海洋硅输送的作用,而这一点对于了解人类活动深刻影响下近海生态环境的变化同样关键。
值得说明的是,生物硅中有很大部分具有化学活性;陆源生物硅除向水体供应溶解硅、参与河口生物地球化学过程外,还在沉积物中记录着河流与河口生态环境的变化,特别是在评估筑坝过程对河流硅输送的影响等方面具有应用潜力[41]。由于筑坝会显著减少河流输送的泥沙,导致来自于水坝上游的陆源植硅体来源的生物硅负荷的减少[41],这必然在河口生物硅的组成上有所反映。尽管类似的研究在河口并不多见,但相关工作在淡水湖泊和南大洋均有许多有趣的发现[14~16],如生物硅组成的变化在不同程度上调节着碳循环的过程。一个有趣且可能的推断是,河口一方面受到筑坝的影响,陆源生物硅的负荷持续减少,这相应的减少了陆源硅向河口的输送通量[70],并改变了陆源生物硅在河口的组合特征;另一方面由于筑坝减少的河流泥沙会改善河口的透明度,进而刺激海洋浮游藻的生长[80]。因此,陆源与海源生物硅在沉积物中含量的此消彼长与植硅体组合特征的变化应与河流筑坝过程引起的河流物质输送的变化相呼应,这也为河口硅循环与环境问题研究打开新的视窗,并有望丰富流域筑坝对河流系统物质输送影响的认识。
此外,尽管在河流悬浮颗粒物中发现了植硅体的重要贡献[12, 31~32],但由于植硅体个体大小和化学活性不一,目前尚无法对世界河流的植硅体所贡献的生物硅库进行系统地量化,因此有必要对包括植硅体在内的生物硅进行地球化学的方法学研究,建立用化学提取和重液浮选等多种分析手段相结合的综合的生物硅分析方法,这种研究必将为硅生物地球化学循环提供新的视角。当然,考虑到国际上植硅体参与河流和河口硅循环的研究较少,可供借鉴的资料也很有限,因此我们推断的某些结论可能略显大胆(筑坝对河口植硅体(或生物硅)组成的影响),需要更多的相关河流-河口的记录来验证。
致谢: 感谢审稿专家和编辑部杨美芳老师细致的修改建议;感谢国家海洋局第一海洋研究所刘军博士、刘森、王昊、臧家业研究员和中国海洋大学于志刚教授在文章写作过程中给予的支持。本文在构思等阶段得到了中国科学院地质与地球物理研究所吕厚远研究员和张健平博士的大力相助,在此一并深表谢意!
| [1] |
Raymond P A, Oh N H, Turner R E, et al. Anthropogenically enhanced fluxes of water and carbon from the Mississippi River[J]. Nature, 2008, 451(7177): 449-452. DOI:10.1038/nature06505 |
| [2] |
Humborg C, Ittekkot V, Cociasu A, et al. Effect of Danube River dam on Black Sea biogeochemistry and ecosystem structure[J]. Nature, 1997, 386(6623): 385-388. DOI:10.1038/386385a0 |
| [3] |
Bauer J E, Cai W J, Raymond P A, et al. The changing carbon cycle of the coastal ocean[J]. Nature, 2013, 504(7478): 61-70. DOI:10.1038/nature12857 |
| [4] |
Golterman H L, Sly P G, Thoms R L. Study of the Relationship between Water Quality and Sediment Transport:A Guide for the Collection and Interpretation of Sediment Quality Data[M]. Paris: UNESCO, 1983: 231.
|
| [5] |
马骏强, 岳伟, 刘健辉, 等. 中国东部入海河流沉积物磁性矿物化学特征及物源意义[J]. 第四纪研究, 2017, 37(1): 57-66. Ma Junqiang, Yue Wei, Liu Jianhui, et al. Geochemical properties of magnetic mineral in the Eastern China river sediments and their provenance implications[J]. Quaternary Sciences, 2017, 37(1): 57-66. |
| [6] |
曹文红, 陈静, 马俊强. 大陆东南沿海河流与台湾西部河流磁性矿物特征及判源指标[J]. 第四纪研究, 2016, 36(1): 227-236. Cao Wenhong, Chen Jing, Ma Junqiang. Magnetic minerals as tracers for the mainland coastal rivers and west Taiwan rivers[J]. Quaternary Sciences, 2016, 36(1): 227-236. |
| [7] |
Simpson T L, Volcani B E. Silicon and Siliceous Structures in Biological Systems[M]. New York: Springer-Verlag, 1981: 587.
|
| [8] |
王永吉, 吕厚远. 植物硅酸体研究及应用[M]. 北京: 海洋出版社, 1993: 170-177. Wang Yongji, Lü Houyuan. Phytoliths Study and Its Application[M]. Beijing: China Ocean Press, 1993: 170-177. |
| [9] |
Conley D J. Terrestrial ecosystems and the global biogeochemical silica cycle[J]. Global Biogeochemical Cycles, 2002, 16(4): 68. DOI:10.1029/2002GB001894 |
| [10] |
Conley D J. The biogeochemical silica cycle:Elemental to global scales[J]. Oceanis, 2002, 28: 353-368. |
| [11] |
Derry L A, Kurtz A C, Ziegler K, et al. Biological control of terrestrial silica cycling and export fluxes to watersheds[J]. Nature, 2005, 433(7027): 728-731. DOI:10.1038/nature03299 |
| [12] |
Ran X B, Che H, Zang J Y, et al. Variability in the composition and export of silica in the Huanghe River basin[J]. Science China:Earth Sciences, 2015, 58(11): 2078-2089. DOI:10.1007/s11430-015-5064-z |
| [13] |
Tréguer P J, De La Rocha C L. The world ocean silica cycle[J]. Annual Reviews of Marine Science, 2013, 5(5): 477-501. DOI:10.1146/annurev-marine-121211-172346 |
| [14] |
Jacot Des Combes H, Esper O, De la Rocha C L, et al. Diatom δ13C, δ15N, and C/N since the Last Glacial Maximum in the Southern Ocean:Potential impact of species composition[J]. Paleoceanography, 2008, 23(4): PA4209. DOI:10.1029/2008PA001589 |
| [15] |
Barker P A, Hurrell E R, Leng M J, et al. Carbon cycling within an East African lake revealed by the carbon isotope composition of diatom silica:A 25-ka record from Lake Challa, Mt. Kilimanjaro[J]. Quaternary Science Reviews, 2013, 66(436): 55-63. DOI:10.1016/j.quascirev.2012.07.016 |
| [16] |
Tallberg P, Opfergelt S, Cornelis J T, et al. High concentrations of amorphous, biogenic Si(BSi)in the sediment of a small high-latitude lake:Implications for biogeochemical Si cycling and for the use of BSi as a paleoproxy[J]. Aquatic Sciences, 2015, 77(2): 293-305. DOI:10.1007/s00027-014-0387-y |
| [17] |
Song Z, Mcgrouther K, Wang H. Occurrence, turnover and carbon sequestration potential of phytoliths in terrestrial ecosystems[J]. Earth-Science Reviews, 2016, 158: 19-30. DOI:10.1016/j.earscirev.2016.04.007 |
| [18] |
Demaster D J. The supply and accumulation of silica in the marine environment[J]. Geochimica et Cosmochimica Acta, 1981, 45(10): 1715-1732. DOI:10.1016/0016-7037(81)90006-5 |
| [19] |
Nelson D M, Trégure P, Brzezinski M A, et al. Production and dissolution of biogenic silica in the ocean:Revised global estimates, comparison with regional data and relationship to biogenic sedimentation[J]. Global Biogeochemical Cycle, 1995, 9(3): 359-372. DOI:10.1029/95GB01070 |
| [20] |
Conley D J. Riverine contribution of biogenic silica to the oceanic silica budget[J]. Limnology and Oceanography, 1997, 42(4): 774-777. DOI:10.4319/lo.1997.42.4.0774 |
| [21] |
Zang J Y, Liu S, Liu Y G, et al. Contribution of phytoliths to total biogenic silica volumes in the tropical rivers of Malaysia and associated implications for the marine biogeochemical cycle[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(5): 1076-1084. DOI:10.1007/s0034 |
| [22] |
Conley D J, Schelske C L. Biogenic silica[M]//Smol J P, Birks H J B, Last W M, et al. Tracking Environmental Change Using Lake Sediments: Terrestrial, Algal, and Siliceous Indicators. Dordrecht: Kluwer Academic Press, 2002: 281-293.
|
| [23] |
冉祥滨, 车宏, 孙涛, 等. 渤海颗粒有机碳与生物硅的分布及来源[J]. 海洋学报, 2014, 36(10): 27-39. Ran Xiangbin, Che Hong, Sun Tao, et al. Distributions and sources of particle organic carbon and biogenic silica in the Bohai Sea[J]. Acta Oceanologica Sinica, 2014, 36(10): 12-24. DOI:10.3969/j.issn.02534193.2014.10.002 |
| [24] |
Volk T. Feedbacks between weathering and atmospheric CO2 over the last 100 million years[J]. American Journal of Science, 1987, 287(8): 763-779. DOI:10.2475/ajs.287.8.763 |
| [25] |
Berner R A. The rise of plants and their effect on weathering and atmospheric CO2[J]. Science, 1997, 276(5312): 506-511. DOI:10.1126/science.276.5312.544 |
| [26] |
Conley D J, Carey J C. Biogeochemistry:Silica cycling over geologic time[J]. Nature Geoscience, 2015, 8(6): 431-432. DOI:10.1038/ngeo2454 |
| [27] |
Carey J C, Fulweiler R W. The terrestrial silica pump[J]. PloS ONE, 2012, 7(12): e52932. DOI:10.1371/journal.pone.0052932 |
| [28] |
Smetacek V. Diatoms and the ocean carbon cycle[J]. Protist, 1999, 150(1): 25-32. DOI:10.1016/S1434-4610(99)70006-4 |
| [29] |
Bluth G J S, Kump L R. Lithologic and climatologic controls of river chemistry[J]. Geochimica et Cosmochimica Acta, 1994, 58(10): 2341-2359. DOI:10.1016/0016-7037(94)90015-9 |
| [30] |
Tréguer P, Nelson D M, Van Bennekom A J, et al. The silica balance in the world ocean:A reestimate[J]. Science, 1995, 268(5209): 375-379. DOI:10.1126/science.268.5209.375 |
| [31] |
Olivié-Lauquet G, Allard T, Bertaux J, et al. Crystal chemistry of suspended matter in a tropical hydrosystem, Nyong Basin(Cameroon, Africa)[J]. Chemical Geology, 2000, 170(1-4): 113-131. DOI:10.1016/S0009-2541(99)00244-2 |
| [32] |
Cary L, Alexandre A, Meunier J D, et al. Contribution of phytoliths to the suspended load of biogenic silica in the Nyong Basin rivers(Cameroon)[J]. Biogeochemistry, 2005, 74(1): 101-114. DOI:10.1007/s10533-004-2945-1 |
| [33] |
Alexandre A, Meunier J D, Colin F, et al. Plant impact on the biogeochemical cycle of silicon and related weathering processes[J]. Geochimica et Cosmochimica Acta, 1997, 61(3): 677-682. DOI:10.1016/S0016-7037(97)00001-X |
| [34] |
Struyf E, Dausse A, Van Damme S, et al. Tidal marshes and biogenic silica recycling at the land-sea interface[J]. Limnology and Oceanography, 2006, 51(2): 838-846. DOI:10.4319/10.2006.51.2.0838 |
| [35] |
Meunier J D, Guntzer F, Kirman S, et al. Terrestrial plant-Si and environmental changes[J]. Mineralogical Magazine, 2008, 72(1): 263-267. DOI:10.1180/minmag.2008.072.1.263 |
| [36] |
Saccone L, Conley D J, Likens G E, et al. Factors that control the range and variability of amorphous silica in soils in the Hubbard Brook Experimental Forest[J]. Soil Science Society Journal of America, 2008, 72(6): 1637-1644. DOI:10.2136/sssaj2007.0117 |
| [37] |
Lü H, Saito Y, Liu B, et al. Rice domestication and climatic change:Phytolith evidence from East China[J]. Boreas, 2002, 31(4): 378-385. DOI:10.1111/j.1502-3885.2002.tb01081.x |
| [38] |
Ran X B, Yu Z G, Chen H T, et al. Silicon transport of Changjiang River:Would the Three Gorges Reservoir be a filter?[J]. Environmental Earth Sciences, 2013, 70. DOI:10.1007/s12665-013-2275-5 |
| [39] |
Zhao Z, Piperno D R. Late Pleistocene/Holocene environments in the middle Yangtze River Valley, China and rice(Oryza sativa L.)domestication:The phytolith evidence[J]. Geoarchaeology, 1999, 15(2): 203-222. DOI:10.1002/(SICI)1520-6548(200002)15:2<203:AID-GEA5>3.0.CO;2-J |
| [40] |
Bootsma H A, Hecky R E, Johnson T C, et al. Inputs, outputs, and internal cycling of silica in a large, tropical lake[J]. Journal of Great Lakes Research, 2003, 29(Suppl.2): 121-138. DOI:10.1016/S0380-1330(03)70543-7 |
| [41] |
Ran X, Liu S, Liu J, et al. Composition and variability in the export of biogenic silica in the Changjiang River and the effect of Three Gorges Reservoir[J]. Science of the Total Environment, 2016, 571: 1191-1199. DOI:10.1016/j.scitotenv.2016.07.125 |
| [42] |
Street-Perrott F A, Barker P A. Biogenic silica:A neglected component of the coupled global continental biogeochemical cycles of carbon and silicon[J]. Earth Surface Processes and Landforms, 2008, 33(9): 1436-1457. DOI:10.1002/esp.1712 |
| [43] |
Ran X B, Liu J, Zang J Y, et al. Export and dissolution of biogenic silica in the Yellow River(Huanghe)and implications for the estuarine ecosystem[J]. Marine Chemistry, 2018, 200: 14-21. DOI:10.1016/j.marchem.2018.02.001 |
| [44] |
Farmer V C, Delbos E, Miller J D. The role of phytolith formation and dissolution in controlling concentrations of silica in soil solutions and streams[J]. Geoderma, 2005, 127(1-2): 71-79. DOI:10.1016/j.geoderma.2004.11.014 |
| [45] |
Gérarda F, Mayerb K U, Hodsonc M J, et al. Modelling the biogeochemical cycle of silicon in soils:Application to a temperate forest ecosystem[J]. Geochimica et Cosmochimica Acta, 2008, 72(3): 741-758. DOI:10.1016/j.gca.2007.11.010 |
| [46] |
Cornelis J T, Ranger J, Iserentant A, et al. Tree species impact the terrestrial cycle of silicon through various uptakes[J]. Biogeochemistry, 2009, 97(2-3): 231-245. DOI:10.1007/s10533-009-9369-x |
| [47] |
Milliman J D. Flux and fate of fluvial sediments and water in coastal seas[M]//Mantoura R, Martin J M, Wollast R, et al. Ocean Margin Processes in Global Change. New York: Wiley, 1991: 69-90.
|
| [48] |
Ran X B, Liu J, Zhao C Y, et al. The biogenic silica composition, behavior and budget in the Changjiang River estuary[J]. Acta Oceanologica Sinica, 2018, 37(1): 60-72. DOI:10.1007/s13131-018-1159-7 |
| [49] |
Amann T, Weiss A, Hartmann J. Silica fluxes in the inner Elbe Estuary, Germany[J]. Biogeochemistry, 2014, 118(1-3): 389-412. DOI:10.1007/s10533-013-9940-3 |
| [50] |
Lehtimäki M, Tallberg P, Siipola V. Seasonal dynamics of amorphous silica in Vantaa River Estuary[J]. Silicon, 2013, 5(1): 35-51. DOI:10.1007/s12633-012-9126-y |
| [51] |
Carbonnel V, Vanderborght J-P, Lionard M, et al. Diatoms, silicic acid and biogenic silica dynamics along the salinity gradient of the Scheldt estuary(Belgium/The Netherlands)[J]. Biogeochemistry, 2013, 113(1-3): 657-682. DOI:10.1007/s10533-012-9796-y |
| [52] |
Pastuszak M, Conley D J, Humborg C, et al. Silicon dynamics in the Oder estuary, Baltic Sea[J]. Journal of Marine Systems, 2008, 73(3/4): 250-262. DOI:10.1016/j.jmarsys.2007.10.013 |
| [53] |
Bianchi T S, Galler J J, Allison M A. Hydrodynamic sorting and transport of terrestrially derived organic carbon in sediments of the Mississippi and Atchafalaya Rivers[J]. Estuarine, Coastal and Shelf Science, 2007, 73(1-2): 211-222. DOI:10.1016/j.ecss.2007.01.004 |
| [54] |
Bidle K D, Azam F. Accelerated dissolution of diatom silica by marine bacterial assemblages[J]. Nature, 1999, 397(6719): 508-512. DOI:10.1038/17351 |
| [55] |
Loucaides S, Cappellen P V, Behrends T. Dissolution of biogenic silica from land to ocean:Role of salinity and pH[J]. Limnology and Oceanography, 2008, 53(4): 1614-1621. DOI:10.4319/lo.2008.53.4.1614 |
| [56] |
Liu S M, Zhang J, Li R X. Ecological significance of biogenic silica in the East China Sea[J]. Marine Ecology Progress Series, 2005, 290: 15-26. DOI:10.3354/meps290015 |
| [57] |
Katz T, Yahel G, Tunnicliffe V, et al. The silica cycle in a Northeast Pacific fjord; the role of biological resuspension[J]. Progress in Oceanography, 2016, 147: 10-21. DOI:10.1016/j.pocean.2016.07.004 |
| [58] |
Michalopoulos P, Aller R C, Reeder R J. Conversion of diatoms to clays during early diagenesis in tropical continental shelf muds[J]. Geology, 2000, 28(12): 1095-1098. DOI:10.1130/0091-7613(2000)28<1095:CODTCD>2.0.CO;2 |
| [59] |
Michalopoulos P, Aller R C. Early diagenesis of biogenic silica in the Amazon delta:Alteration, authigenic clay formation, and storage[J]. Geochimica et Cosmochimica Acta, 2004, 68(5): 1061-1085. DOI:10.1016/j.gca.2003.07.018 |
| [60] |
Arndt S, Regnier P. A model for the benthic-pelagic coupling of silica in estuarine ecosystems:Sensitivity analysis and system scale simulation[J]. Biogeosciences, 2007, 4(2): 331-352. DOI:10.5194/bg-4-331-2007 |
| [61] |
Caraco N F, Cole J J. Human impact on nitrate export:An analysis using major world rivers[J]. Ambio, 1999, 28(2): 167-170. |
| [62] |
Vörösmarty C J. The storage and aging of continental runoff in large reservoir systems of the world[J]. Ambio, 1997, 26(4): 210-219. |
| [63] |
Dürr H H, Meybeck M, Hartmann J, et al. Global spatial distribution of natural riverine silica inputs to the coastal zone[J]. Biogeosciences, 2011, 8(3): 597-620. DOI:10.5194/bg-8-597-2011 |
| [64] |
Nilsson C, Reidy C A, Dynesius M, et al. Fragmentation and flow regulation of the world's large river systems[J]. Science, 2005, 308(5720): 405-408. DOI:10.1126/science.1107887 |
| [65] |
Milliman J D, Quraishee G S, Beg M N A. Sediment discharge from the Indus river to the ocean: Past, present and future[M]//Haq Bu, Milliman J D. Marine Geology and Oceanography of the Arabian Sea. New York: Van Nostrand Reinhold, 1984: 65-70.
|
| [66] |
Halim Y. The impact of human alterations of the hydrological cycle on ocean margins[M]//Mantoura R F C, Martin J M, Wollast R, et al. Ocean Margin Processes in Global Change. Chichester(UK): John Wiley & Sons, 1991: 301-327.
|
| [67] |
Dynesius M, Nilsson C. Fragmentation and flow regulation of river systems in the northern Third of the World[J]. Science, 1994, 266(5186): 753-762. DOI:10.1126/science.266.5186.753 |
| [68] |
Beusen A H W, Dekkers A L M, Bouwman A F, et al. Estimation of global river transport of sediments and associated particulate C, N, and P[J]. Global Biogeochemical Cycles, 2005, 19: GB4S05. DOI:10.1029/2005GB002453 |
| [69] |
Dai Z, Du J, Zhang X, et al. Variation of riverine material loads and environmental consequences on the Changjiang(Yangtze)Estuary in recent decades(1955-2008)[J]. Environmental Science and Technology, 2011, 45(1): 223-227. DOI:10.1021/es103026a |
| [70] |
Liu J, Zang J Y, Bouwman L, et al. Distribution and budget of dissolved and biogenic silica in the Bohai Sea and Yellow Sea[J]. Biogeochemistry, 2016, 130(1-2): 85-101. DOI:10.1007/s10533-016-0244-2 |
| [71] |
Maavara T, Dürr H H, Van Cappellen P. Worldwide retention of nutrient silicon by river damming:From sparse data set to global estimate[J]. Global Biogeochemical Cycles, 2014, 28: 842-855. DOI:10.1002/2014GB004875 |
| [72] |
Pichevin L E, Ganeshram R S, Geibert W, et al. Silica burial enhanced by iron limitation in oceanic upwelling margins[J]. Nature Geoscience, 2014, 7: 541-546. DOI:10.1038/NGEO2181 |
| [73] |
Panizzo V N, Swann G E A, Mackay A W, et al. Constraining modern-day silicon cycling in Lake Baikal[J]. Global Biogeochemical Cycles, 2017, 31(3): 556-574. |
| [74] |
Liu S M, Ye X W, Zhang J, et al. Problems with biogenic silica measurement in marginal seas[J]. Marine Geology, 2002, 192(4): 383-392. DOI:10.1016/S0025-3227(02)00531-5 |
| [75] |
陈洪涛, 张欣泉, 米铁柱, 等. 悬浮颗粒物中生物硅测定方法的改进与应用[J]. 海洋学报, 2007, 29(4): 156-160. Chen Hongtao, Zhang Xinquan, Mi Tiezhu, et al. Improvement and application of method for the measurement of biogenic silica in suspended matter[J]. Acta Oceanologica Sinica, 2007, 29(4): 156-160. DOI:10.3321/j.issn:0253-4193.2007.04.019 |
| [76] |
Zuo X X, Lu H Y, Gu Z Y. Distribution of soil phytolith-occluded carbon in the Chinese Loess Plateau and its implications for silica-carbon cycles[J]. Plant Soil, 2013, 374(1-2): 223-232. DOI:10.1007/s11104-013-1850-6 |
| [77] |
Qi L, Li F Y, Huang Z, et al. Phytolith-occluded organic carbon as a mechanism for long-term carbon sequestration in a typical steppe:The predominant role of belowground productivity[J]. Science of the Total Environment, 2017, 577: 413-417. DOI:10.1016/j.scitotenv.2016.10.206 |
| [78] |
Hou L J, Liu M, Yang Y, et al. Biogenic silica in intertidal marsh plants and associated sediments of the Yangtze estuary[J]. Journal of Environmental Sciences, 2010, 22(3): 374-380. DOI:10.1016/S1001-0742(09)60118-2 |
| [79] |
李延伟, 刘素美, 朱卓毅, 等. 万泉河口悬浮颗粒态磷和硅的分布特征及收支估算[J]. 海洋学报, 2011, 33(6): 180-188. Li Yanwei, Liu Sumei, Zhu Zhuoyi, et al. Distribution and budget of particulate phosphorus and silica in Wangquanhe River estuary[J]. Acta Oceanologica Sinica, 2011, 33(6): 180-188. |
| [80] |
Wang B D, Xin M, Sun X, et al. Does reduced sediment load contribute to increased outbreaks of harmful algal blooms off the Changjiang Estuary?[J]. Acta Oceanologica Sinica, 2016, 35(8): 16-21. DOI:10.1007/s13131-016-0846-5 |
2 Laboratory for Marine Geology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, Shandong;
3 Key Laboratory of Marine Sedimentology and Environment Geology, First Institute of Oceanography, State Oceanic Administration, Qingdao 266061, Shandong)
Abstract
The phytoliths produced by higher plant is an important tool in the study of paleoclimate and paleoenvironment, which can be employed to reconstruct the terrestrial vegetation changes in the past. There is an increase in studies of phytolith records for reconstructing pre-Quaternary vegetation changes that links to the climate change and carbon cycling. It has therefore been becoming a hot topic worldwide. In fact, the phytoliths in soils, rivers, and coastal areas are also a kind of reactive silica that deeply participates in the global silica cycle, balancing the CO2 concentrations and controlling the carbon sequestration. Accumulations of phytoliths in the soil are a major reactive silica pool in land, and also a source of riverine biogenic silica. Basin processes could transport part of phytolith from the soil to river, which always was neglected by the previous studies of silica cycling. The transport of phytolih silica in rivers plays an essential role in the local and global biogeochemical cycle processes, and results in long-term ecosystem effect in the ocean margin. Based on the available studies, the river-borne biogenic silica is normally composed by the one from autogenic source produced by the diatom and external source yielded by phytoliths from land soils. As a case study about the Changjiang River and the Huanghe River, the phytoliths could contribute approximately 50% of loading to that of the bulk biogenic silica, which should be included in the silica budget in the river. Damming in the Changjiang and the Huanghe Rivers results in a decline in the loading of riverine biogenic silica, and may thus alter the composition of biogenic silica in the estuary. Therefore, there is a need to bring the phytoliths into the silica cycling research in the river. However, specific pathways and mechanisms governing the abundance, transport and fluxes of biogenic silica from different sources remain poorly understood in the river system. The study of biogenic silica from different sources, the chemical behavior of phytoliths in the river and estuary and the contribution of phytoliths to local silica cycling would have important significance in exploring the silica cycling in river-estuary systems, especially for the huge river in the world. And, the variation of phytoliths in sediments in the coastal zone could provide useful information in assessing damming effect. These works would be needed for better understanding of global scale biogeochemical cycles of silicon and other elements as well as the changing estuary environment. 2019, Vol.39
2019, Vol.39

