2 中国地质大学(武汉)生物地质与环境地质国家重点实验室, 湖北 武汉 430074)
由微生物膜脂合成的甘油二烷基甘油四醚脂类化合物(Glycerol Dialkyl Glycerol Tetraethers,简称GDGTs),对环境参数特别是温度以及pH值等响应敏感。基于此构建的一系列环境替代指标,是定量重建古环境的重要工具,逐渐成为近年来第四纪研究的热点之一[1~3]。除了对环境参数响应敏感之外,GDGTs的另一个优势则是其分布的广泛性,不仅分布在海洋[4]、湖泊[5]、泥炭[6~7]以及土壤[8~9]等常见生境中,在热泉[10]、盐湖[11]等极端环境中也能检测到此类化合物。GDGTs的广泛分布是开展此类化合物现代过程以及古环境重建研究的重要前提,相较之下,其他类型生物标志化合物在某些沉积载体中的缺失可能在一定程度上限制其研究工作的广泛开展。
作为微生物膜脂核心类脂(core lipids)的GDGTs通常与头基(head groups)一起组成完整极性脂(intact polar lipids)。然而,头基通常在细胞死亡后快速水解,核心类脂则相对稳定且易保留,本文主要讨论在沉积载体中相对稳定保存的核心类脂GDGTs化合物。GDGTs主要由两条烷基链与甘油分子以醚键形式键合形成,依据碳链结构以及生物来源的差异分为两种类型,一类是由古菌合成的类异戊二烯GDGTs(isoprenoid GDGTs,简称isoGDGTs),其碳链分别携带不同个数的五元环或者六元环[4],其中被认为由奇古菌合成的特征标志物——泉古菌醇(crenarchaeol),则同时携带五元环以及六元环[6];另一类则是来源于细菌的支链GDGTs(branched GDGTs,简称brGDGTs),其碳链为烷基链结构,携带不同个数的甲基以及五元环[12]。
近几年来,借助高效液相色谱(High Performance Liquid Chromatography,简称HPLC)/大气压化学电离(Atmospheric Pressure Chemical Ionization,简称APCI)/四级杆飞行时间质谱(quadrupole time-of-flight Mass Spectrometry,简称qTOF MS)联用技术,一些在碳链结构上,有别于传统GDGTs碳链结构的化合物也逐渐被检测出来[13]。其中一类被称为羟基甘油二烷基甘油四醚(Hydroxylated GDGTs,简称OH-GDGTs)的化合物被引起广泛关注,研究结果显示此类化合物广泛分布于全球不同海域[14~16],且受温度的控制,与海水表层温度(Sea Surface Temperature,简称SST)之间有着较好的线性关系[16~19],成为一类较好的温度指标。基于此,本文主要介绍此类化合物的结构、生物来源,并阐述此类化合物在不同类型沉积载体包括海洋以及湖泊中的研究进展,为进一步挖掘此类化合物所携带的生物和环境信息提供依据。
1 OH-GDGTs结构及其来源与分布羟基甘油二烷基甘油四醚化合物,顾名思义,较传统isoGDGTs在双植烷结构上携带羟基结构(图 1)。借助二维核磁共振技术以及质谱方法,推测羟基可能位于双植烷碳链sn-3的C-3位置上[15]。根据碳链上五元环的数量,OH-GDGTs化合物可以分为OH-GDGT-0、OH-GDGT-1以及OH-GDGT-2,即分别携带0个、1个以及2个五元环(图 1)。其中不含环的OH-GDGT-0,又根据其碳链上所携带的羟基个数,分为OH-GDGT-0和2OH-GDGT-0,即分别携带1个和2个羟基(图 1)。OH-GDGTs化合物具有相对较高的稳定性,有研究显示仅30 %的OH-GDGTs会在酸解过程中损失,其稳定性远高于携带羟基的二醚化合物(hydroxylated diethers),据推测这可能与GDGTs作为四醚化合物具有相对闭合的化学结构有关,在一定程度上起到保护羟基的作用[16]。
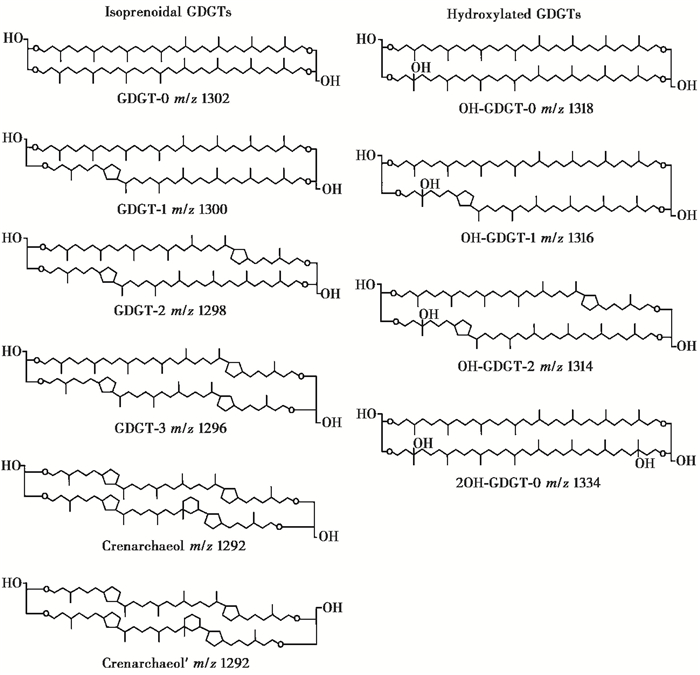
|
图 1 古菌合成的类异戊二烯结构isoGDGTs与羟基结构OH-GDGTs的化学结构 Fig. 1 Chemicalstructures of isoprenoidal GDGTs and hydroxylated isoprenoidal GDGTs |
OH-GDGTs因为在碳链结构上较传统GDGTs多携带1个或2个羟基结构,导致其具有相对较高的极性,因此在正相液相条件下,OH-GDGTs会较传统GDGTs后馏出[13]。经过大气压化学电离作用,OH-GDGT-0和2OH-GDGT-0会分别脱水(H2O)生成[M+H-18]+以及[M+H-36]+,据此通过提取质子化离子[M+H]+的质荷比(m/z)1334、1318、1316和1314可以分别获取2OH-GDGT-0、OH-GDGT-0、OH-GDGT-1以及OH-GDGT-2;此外也可以通过提取去水离子[M+H-18]+的质荷比(m/z)1300、1298、1298和1296分别获取OH-GDGT-0、OH-GDGT-1、2OH-GDGT-0和OH-GDGT-2,这与不含羟基的GDGT-1、GDGT- 2、GDGT- 3质荷比一致。需要指出的是,在OH-GDGTs类化合物的化学结构还未被鉴定之前,有学者基于其化学结构特征,比传统GDGTs结构多18Da,而将其推断为H341-GDGT[14]或者2Gly-GDGT+18[20]。然而就羟基具体位置的分析仍需下一步深入研究工作的支持,因为现有的分析手段仅能确定羟基位于双植烷碳链的C-3位置上,然而究竟位于哪一侧碳链还不得而知,这就意味着上述几类化合物均可有相对应的异构体(isomer)出现[15]。
与不含羟基的isoGDGTs类似,OH-GDGTs的生物来源也非常丰富,目前已知纯培养菌株有奇古菌Nitrosopumilus maritimus[14~15, 21]、产甲烷古菌Methanothermococcus thermolithotrophicus[15]。此外,隶属于奇古菌Thaumarchaeota I.1a的Nitrosopumilusmaritimus NAO 2、NAOA 6、N.adriaticus、N.piranensis以及隶属于SAGMCG-1的Nitrosotalea devanaterra也被检测出可以合成此类化合物,而Thaumarchaeota I.1b则无法合成此类化合物,基于此,OH-GDGTs被认为是Thaumarchaeota I.1a有效区别于Thaumarchaeota I.1b的生物标志化合物[22~23]。
OH-GDGTs也广泛分布在地质环境样品中,包括海洋水柱[24~25]、海洋深处甲烷富集区域[20]、不同海域不同类型海洋沉积物[17~19, 26~32]、河口沉积物[33~34]以及湖泊表层沉积物[16]与湖泊沉积柱岩芯[35~36](图 2)。而究竟OH-GDGTs与具有相似结构的isoGDGTs在来源问题上是否一致仍然是值得商榷的问题。对比不同海域海洋沉积物中两类化合物的分布发现,两者之间并不存在显著相关,据此推测两类化合物的生物来源存在差异,或者两者对环境胁迫的响应机制存在差异[15]。然而,来自北海海域的研究结果则表明,海洋沉积物中OH-GDGTs与isoGDGTs之间的变化模式类似,据此作者认为两类化合物来自相同的古菌生物群落[18]。此外,波罗的海的研究结果也显示,海洋表层沉积物中isoGDGTs与OH-GDGTs的分布具有较高的正相关(r≥0.9),并推测两者可能具有同一种生物来源[26]。来自碳同位素的证据显示[28, 37~38],OH-GDGTs与isoGDGTs所利用的碳源类似,因为两者裂解产物—双植烷的碳同位素组成类似,但是不同地区的样品,碳同位素组成显著差异,例如地中海高盐地区海洋沉积柱岩芯的碳同位素组成在- 23.3 ‰ ~- 17.7 ‰ [37];而在南极富含有机质的海洋岩芯样品中,来源于OH-GDGTs的裂解产物——双植烷的碳同位素组成为- 24 ‰ ~- 21 ‰ [28],不过均与浮游奇古菌的碳同位素组成类似,证实OH-GDGTs的生物来源为浮游奇古菌[38]。
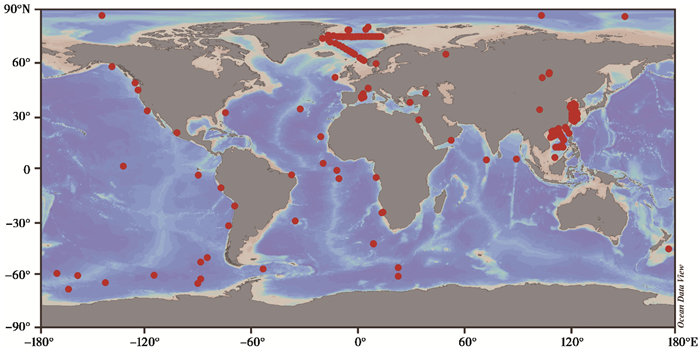
|
图 2 全球已开展OH-GDGTs研究的海洋和湖泊点分布示意图 Fig. 2 Samplingsites of the occurrence of OH-GDGTs from global marine and lacustrine environments |
Liu等[15]于2012年首先开展不同海域海洋表层沉积物样品中OH-GDGTs的分布研究,报道称这些温带和热带海域沉积物样品中检测的OH-GDGTs相对含量约占总isoGDGTs的1 % ~8 % (OH-GDGT %),见公式(1)。
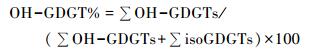
|
(1) |
随后在全球海域开展的研究表明,不同海域水柱、表层沉积物以及沉积柱芯中均可以检测到相当含量的OH-GDGTs,并具有明显的“纬度效应”分布特征,即OH-GDGTs在赤道地区的含量最低,相对含量占isoGDGTs的1 % ~8 %,而在高纬度地区,相对含量逐渐增加,可以达到20.5 %,其中在温度低于0 ℃的海域,OH-GDGTs的相对含量可以达到20 %,表明此类化合物的细胞膜脂结构能够较好适应低温寒冷环境[16]。在挪威、格陵兰岛以及冰岛等北欧海域开展的研究结果也显示,OH-GDGTs在低温冷水海域中的相对含量都较高,特别是在有冰覆盖的区域,OH-GDGT %在海水样品中的相对含量占到19.8 %,而在表层沉积物中约占到16 % [18]。OH-GDGTs在中国沿海海域表层沉积物中所占比例为1.8 % ~12.8 % [17],此外利用不同前处理方法获取中国南海表层沉积物中的OH-GDGT %相对较低,介于0.75 % ~2.70 %之间[19]。
值得注意的是,单个OH-GDGTs化合物的分布模式在不同海域也存在差异。Liu等[15]发现海洋表层沉积物样品中不含环的OH-GDGT-0含量最高,而携带两个羟基的2OH-GDGT-0含量相对较低,纯培养菌株M.thermolithotrophicus则无法合成2OH-GDGT-0,或者含量太低无法检测[15]。在波罗的海沉积物中,OH-GDGT-0含量最高,其次分别是2OH-GDGT-0和OH-GDGT-1,携带两个五元环的OH-GDGT-2含量最低[26];同样是来自波罗的海的研究结果显示,除OH-GDGT-0仍然是含量最高的化合物以外,OH-GDGT-1以及OH-GDGT-2的含量其次[39]。对中国边缘海域的研究结果则表明,OH-GDGTs的分布模式存在空间差异,OH-GDGT-0的相对含量随着纬度增加,而OH-GDGT-2的含量则降低,其中OH-GDGT-0的含量在黄海北部最高,在有冷水团的海域,其相对含量可达到75 %以上,而OH-GDGT-2则在中国南海以及东海南部区域样品中占据主导,其相对含量高于52 % [17];中国南海表层沉积物中OH-GDGTs的分布模式也具有多样性,不同样品中所占优势的OH-GDGTs也不尽相同,部分样品以OH-GDGT-0为主,部分样品则以OH-GDGT-2为主[19]。上述各种研究显示,不同海域OH-GDGTs的分布模式存在差异,造成这一现象的原因可能是不同环境中合成OH-GDGTs的生物来源差异导致,或是不同环境条件下环境因子影响不同类型OH-GDGTs化合物所致。
影响OH-GDGTs化合物在海洋环境中分布的因素很多,其中在北欧海域的研究结果表明,海水中磷酸盐以及硅酸盐的浓度并不影响OH-GDGTs的相对含量,但是硝酸盐的浓度却与OH-GDGTs的相对含量显著相关,即在硝酸盐浓度较低的海域,OH-GDGT %较高[18]。有研究指出,盐度会影响OH-GDGTs分布,即在高盐度条件下合成高含量的OH-GDGTs[23],这在海洋沉积物中得到验证,即具有盐度差异的海洋沉积物合成的OH-GDGTs分布模式有别[39]。
2.2 OH-GDGTs与海水温度的定量关系Huguet等[16]首次评估全球不同区域海洋和湖泊沉积物中OH-GDGTs的分布与温度之间的关系,调查结果显示OH-GDGTs在低纬高温海域含量偏低,但在高纬低温水域含量逐渐升高,并进一步揭示海洋表层沉积物中OH-GDGTs的相对含量与温度之间有着显著的负相关关系。其中,基于OH-GDGTs与isoGDGTs化合物如GDGT - 1、GDGT- 2、GDGT- 3以及crenarchaeol的比例关系逐步建立与海水温度之间的线性关系,虽然由于某些样品中OH-GDGTs含量较低影响统计结果,以及水体盐碱度差异等原因造成结果部分离散,但OH-GDGTs的分布与海水温度之间的关系显著,温度仍然是影响OH-GDGTs分布的主导因素之一[16]。据此,该研究还进一步构建基于OH-GDGTs的温度指标,显示与温度之间存在显著相关,并认为低温海域的OH-GDGTs相关指标能够有效指示温度[16]。
Fietz等[18]在对北欧海域(包括巴伦支海、挪威海域、格陵兰以及冰岛海域)的研究发现,水柱以及沉积物样品中均检测出OH-GDGTs,并且较高的OH-GDGT %通常出现在有极地水团以及岸冰贡献的区域,因此推测OH-GDGT %可能与水团贡献有关,而不是仅仅指示海水表层温度,其中有无冰层以及极地水团的覆盖是影响OH-GDGT-0以及OH-GDGT-1相对含量的主导因素。然而值得注意的是,在此海域,基于isoGDGTs构建的TEX86(TetraEther indeX of 86 carbon atoms,即含有86个碳原子的四醚指标)以及TEX86L(适用于低温海域的改良TEX86指标)并不能很好地反映海水表层温度,且这两个指标中所涉及的isoGDGTs化合物与海水表层温度之间均无显著相关,因此在这些北极低温海域,如何正确使用TEX86以及TEX86L指标还需慎重[18]。相反在该地区,OH-GDGTs及其指标则为温度的重建提供途径,研究发现,表层水体以及沉积物中OH-GDGT-0的分布与海水表层温度呈显著正相关(p=0.04),因此相较之下,该海域的OH-GDGTs较isoGDGTs更容易与海水表层温度之间建立相关性研究的分析[18]。基于OH-GDGT的指标如OH-GDGT-0/OH-GDGT-1以及OH-GDGT-0/crenarchaeol与另一类生物标志化合物长链烯酮% C37:4以及U37K(长链烯酮不饱和度)的相关指标具有类似的分布,虽然OH-GDGT %与U37K恢复的海水表层温度之间的相关性并不显著,造成这一现象的原因可能是由于OH-GDGTs的分布还受其他环境因素的影响,因此,北欧海域OH-GDGTs分布结果显示,OH-GDGTs在低温极地海域具有恢复温度的潜力[18]。
随后,Kaiser和Arz[26]在对波罗的海的研究中发现,该海域表层沉积物中OH-GDGTs的分布与海水温度之间有着较好的线性关系,其中OH-GDGT %以及OH-GDGT-0/crenarchaeol与海水表层温度(r2=0.7,r2=0.7)以及海水底层温度(Tbottom)(r2=0.5,r2=0.6)之间均存在较好的负相关关系。值得注意的是,这与前人在北欧海域的研究结果类似,即两个指标均与海水表层温度之间存在负相关关系(r2=0.6,r2=0.6)[18]。然而对比这两个海域各自所建立的回归方程分析发现[18, 26],两者之间的斜率类似,但是截距差异较大,故根据这两个校正公式重建的温度也会有较大的差异。两个校正公式具有类似斜率的主要原因可能在于OH-GDGTs对温度的响应类似,但因为不同海域可能存在季节性、OH-GDGTs生长层位以及生物来源等的差异从而导致这两个回归方程具有不同的截距。
对我国边缘海域(包括黄海、东海以及南海北部)OH-GDGTs分布特征调查显示温度是控制OH-GDGTs分布的主要因素,其中OH-GDGT-2的相对含量与海水表层温度之间存在显著的正相关关系,而OH-GDGT-0的相对含量以及OH-GDGT %与海水表层温度之间有着明显的负相关,OH-GDGT-1与海水表层温度之间并无相关性,并认为较高的温度会增加OH-GDGTs的环化程度[17],这与isoGDGTs为响应温度升高而增加自身环化程度的机制一致[40]。此外,研究结果还发现在该区域,OH-GDGTs的环化指数(Ring Index,简称RI-OH)、OH-GDGT-2 %、OH-GDGT-0 %均与海水表层年均温之间存在显著的相关性,R方达到0.8以上,即基于OH-GDGTs构建的指标在热带以及亚热带海域也可被用来重建海水表层温度[17]。其中,值得注意的是,在此海域RI-OH指标能够更有效响应夏季以及秋季海水表层温度,特别是在东海海域,RI-OH以及TEX86H(适用于高温海域的改良TEX86指标)均有效响应夏季海水表层温度[41]。鉴于中国边缘海域,RI-OH指标与海水表层温度之间显著的相关性,结合前人已发表的全球不同海域样品中的RI-OH指标[16, 18],并将之优化为RI-OH′指标,即在原公式中将含量相对较高的OH-GDGT-0列入计算如下:
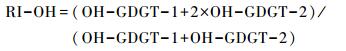
|
(2) |
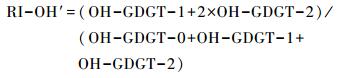
|
(3) |
研究发现,RI-OH′指标在极地样品中较高,并且与海水表层温度显著相关,且残差更低,虽然在中国边缘海区域不如RI-OH指标优越,据此推测RI-OH′指标更适用于极地较冷海域,而RI-OH指标则适用于温度较高的海域[17]。
最近对中国南海表层沉积物的研究显示,OH-GDGT-0 %、OH-GDGT-2 %以及RI-OH指标与海水表层温度之间的相关性要好于TEX86H指标,其中OH-GDGT-2 %与海水表层温度之间有着非常显著的相关性,且没有明显的季节性效应,使OH-GDGT-2 %成为恢复南海海水表层温度的有效替代指标[19]。然而需要注意的是,当年均海水表层温度低于25 ℃时,OH-GDGT-2 %与温度之间呈正相关的关系,而当海水表层温度高于25 ℃时,两者之间呈现明显的负相关,而OH-GDGT-0 %与温度之间的关系则呈现相反的趋势,OH-GDGT-1 %则在不同的温度区间内对温度响应不同,表明OH-GDGTs化合物对温度的响应非常复杂;但综合来看,当海水表层温度高于25 ℃时,烯酮指标的使用即将达到上限温度时,OH-GDGT-2 %可以有效重建热带海域的温度[19]。
虽然上述研究均显示,不同海域表层沉积物中OH-GDGTs化合物及其相关指标与温度之间存在较好的关系,较好地响应海水表层温度的变化,特别是在TEX86以及U37K不能较好使用的情况下,OH-GDGTs是一类重建海水表层温度的有效指标[18]。此外,通过分子动力模拟实验[42]以及高纬度海域分布着高含量的OH-GDGTs[16],推测海洋浮游奇古菌可能在高温条件下提高细胞膜脂的流动性,然而实验室条件下,并没有发现温度影响OH-GDGTs的含量[22],究竟OH-GDGTs与温度之间的关系如何,及其响应机理如何仍需进一步研究工作来佐证。
2.3 OH-GDGTs在海洋古环境重建中的应用相较于TEX86及其相关指标在海洋环境被广泛应用于温度的定量重建研究[1],OH-GDGTs及其相关指标的古环境定量重建研究则略显不足,主要原因之一在于此类化合物的鉴定和发现均晚于isoGDGTs。借助对北欧海域OH-GDGTs的分布而建立的OH-GDGT-0/OH-GDGT-1以及OH-GDGT-0/crenarchaeol指标,能够有效恢复Spitsbergen大陆边缘地区沉积柱芯2000年来温度的变化,并且与其他温度替代指标长链烯酮%C37:4以及U37K的变化趋势一致,发现当海水表层温度下降的时候,该地区低盐度的海水,极地冷水团的贡献增加[18]。然而需要注意的是,OH-GDGT %与U37K恢复的海水表层温度之间的相关性并不显著,可能是由于其他环境因素影响OH-GDGTs的分布而造成的[18]。随后,Knies等[31]借助基于Fietz等[18]建立的OH-GDGTs与SST之间的校正公式,从而有效恢复大西洋-北极通道地区上新世的温度,研究指出该地区在早上新世期间相对较暖(约7~10 ℃),据此推测该海域应该是受到相对较暖的大西洋海水的供给,而非相对较冷的极地海水[31];Fietz等[43]借助OH-GDGTs及其指标有效恢复亚南极大西洋海域过去50万年来冰期-间冰期温度的变化,其结果与有孔虫以及烯酮所恢复的海水表层温度一致,而基于TEX86恢复的温度则不太吻合。值得注意的是,此研究新构建的OH-GDGT指标,OHC(适用于相对低温海域的OH-GDGT指标)以及OHL(适用于相对高温海域的OH-GDGT指标)指标则能准确恢复温度变化趋势,其中前者去掉相对指示低温端元的OH-GDGT-0,后者则是引入对数函数[43];同样借助OH-GDGTs及其指标,Warden[39]有效恢复波罗的海地区过去七千多年来海水表层温度的变化,研究结果与前人一致,然而因为外源GDGTs的贡献以及盐度的作用,可能会影响部分OH-GDGT指标的准确使用,在古环境重建应用中需注意。
3 OH-GDGTs在陆生环境的研究进展与在全球不同海域广泛开展的OH-GDGTs研究相比,陆生环境OH-GDGTs的研究还略显不足。其中Huguet等[16]对不同地区湖泊的调查研究发现,这些湖泊沉积物捕集器、表层沉积物以及湖泊沉积物岩芯中大多能检测到OH-GDGTs化合物,但在一个碱性湖泊中未能检测到此类化合物,虽然在这个碱性湖泊中,isoGDGTs的含量也很低[44]。此外,在对中国珠江表层沉积物以及珠江口表层沉积物的研究中均发现OH-GDGTs化合物的分布[34]。来自韩国汉江的证据显示,河堤表层沉积物、河流悬浮颗粒有机质、湖泊表层沉积物以及河流周边土壤中均检测到OH-GDGTs化合物的分布,虽然部分样品中OH-GDGTs的含量较低,低于检测限,值得注意的是,这也是首次在土壤样品中检测到OH-GDGTs化合物[45]。最近,在位于青藏高原东北部的青海湖钻孔中,也发现OH-GDGTs化合物的分布,其中OH-GDGTs的含量与奇古菌的特征标志物crenarchaeol的含量以及奇古菌的功能基因amoA丰度一致,据此作者推测OH-GDGTs主要来源于湖泊自生奇古菌1.1a类群的贡献,并且有效响应湖水深度的变化,指示古湖岸线的变化趋势[35];此外,在云南高原深水湖泊泸沽湖的水柱以及表层沉积物中均检测到OH-GDGTs的分布,研究表明此类化合物的分布存在显著的季节变化规律(未发表数据)。这些研究均表明OH-GDGTs也广泛分布在陆地环境,包括湖泊、河流等,其中值得注意的是,并不是所有湖泊均能检测到此类化合物,而且就目前研究结果来看,湖泊环境中的OH-GDGTs与湖水温度之间并不如海洋环境显著[35, 45],区别于海洋环境中OH-GDGTs及其指标能较好响应海水表层温度,究竟影响湖泊环境OH-GDGTs分布的主控环境因子如何以及此类化合物的具体生物来源是什么,均需要进一步深入研究。
4 小结和展望近几年来,随着液相质谱分析手段的进一步提高,一些有别于传统GDGTs的化合物也逐渐被鉴定出来,这些化合物所携带的生物与环境信息也被逐步挖掘。其中一类叫着OH-GDGTs的化合物,在碳链结构上较传统GDGTs多携带不同个数的羟基,其在海洋环境的分布受海水表层温度的影响,即在温度相对较高的赤道海域,OH-GDGTs的含量相对较低,而在温度相对较低的高纬度海域,此类化合物的含量逐渐增加,相对含量可以达到20 %,表明此类化合物的细胞膜脂结构能够较好地适应低温寒冷环境。基于此而构建的OH-GDGTs指标被应用于海洋古环境重建研究,有效恢复海水表层温度,特别是在TEX86以及U37K使用受限的区域。此外,OH-GDGTs指标的另一个优势则是,土壤环境可能无法普遍合成OH-GDGTs化合物,据此可以认定海洋环境中此类化合物的陆源输入贡献为零,而TEX86指标则因为陆源输入的影响,所恢复的温度可能与实测值之间出现偏差。
陆地环境OH-GDGTs化合物的研究还略显不足,目前仅在一两个湖泊开展相关研究,且此类化合物的来源分析以及与环境参数如温度之间的关系还不甚清楚,因此仍需要许多相关研究工作的支持。在湖泊现代过程研究方面,可以通过系统采集湖泊周边土壤、悬浮颗粒有机质、设置沉积物捕集器、湖泊表层沉积物以及湖泊沉积柱芯等,为深入解析此类化合物的来源问题提供证据,并可以借助器测资料,尝试构建温度与沉积柱芯OH-GDGTs的关系。此外,通过分析有温度梯度湖泊中OH-GDGTs的分布特征,进一步尝试构建湖泊环境温度与OH-GDGTs的校正公式。
综上,OH-GDGTs在海洋环境的研究已经取得一系列成果,特别是当其他指标使用受限的情况下,OH-GDGTs指标能够有效恢复海水表层温度。然而相较之下,OH-GDGTs在湖泊环境的研究还相对匮乏,此类化合物的来源分析,以及他们的分布主要受控于哪些因素等问题均需要进一步研究工作的支持。
致谢: 感谢中国地质大学(武汉)生物地质与环境地质国家重点实验室谢树成教授对本文提出的宝贵建议以及同济大学陈雨霏博士提供的数据信息。
| [1] |
Schouten S, Hopmans E C, Sinninghe Damsté J S. The organic geochemistry of glycerol dialkyl glycerol tetraether lipids:A review[J]. Organic Geochemistry, 2013, 54: 19-61. DOI:10.1016/j.orggeochem.2012.09.006 |
| [2] |
Pearson A, Ingalls A E. Assessing the use of archaeal lipids as marine environmental proxies[J]. Annual Review of Earth and Planetary Sciences, 2013, 41: 359-384. DOI:10.1146/annurev-earth-050212-123947 |
| [3] |
Castañeda I S, Schouten S. A review of molecular organic proxies for examining modern and ancient lacustrine environments[J]. Quaternary Science Reviews, 2011, 30(21): 2851-2891. |
| [4] |
Schouten S, Hopmans E C, Pancost R D, et al. Widespread occurrence of structurally diverse tetraether membrane lipids:Evidence for the ubiquitous presence of low-temperature relatives of hyperthermophiles[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(26): 14421-14426. DOI:10.1073/pnas.97.26.14421 |
| [5] |
Powers L A, Werne J P, Johnson T C, et al. Crenarchaeotal membrane lipids in lake sediments:A new paleotemperature proxy for continental paleoclimate reconstruction?[J]. Geology, 2004, 32(7): 613-616. DOI:10.1130/G20434.1 |
| [6] |
Sinninghe Damsté J S, Schouten S, Hopmans E C, et al. Crenarchaeol:The characteristic core glycerol dibiphytanyl glycerol tetraether membrane lipid of cosmopolitan pelagic crenarchaeota[J]. Journal of Lipid Research, 2002, 43(10): 1641-1651. DOI:10.1194/jlr.M200148-JLR200 |
| [7] |
李奇缘, 刘潇敏, 王章章, 等. 青藏高原东部现代泥炭GDGTs分布特征及环境意义[J]. 第四纪研究, 2016, 36(2): 388-395. Li Qiyuan, Liu Xiaomin, Wang Zhangzhang, et al. Distributions and environmental significance of GDGTs in modern peat samples from eastern Tibetan Plateau[J]. Quaternary Sciences, 2016, 36(2): 388-395. |
| [8] |
Weijers J W, Schouten S, Spaargaren O C, et al. Occurrence and distribution of tetraether membrane lipids in soils:Implications for the use of the TEX86 proxy and the BIT index[J]. Organic Geochemistry, 2006, 37(12): 1680-1693. DOI:10.1016/j.orggeochem.2006.07.018 |
| [9] |
李秀美, 朱二雷, 王明达, 等. 喜马拉雅山南坡海拔梯度表土GDGTs分布特征及其指示意义[J]. 第四纪研究, 2017, 37(6): 1226-1237. Li Xiumei, Zhu Erlei, Wang Mingda, et al. Distributions of glycerol dialkyl glycerol tetraether lips along an altitudinal transect on the southern slope of Mt. Himalaya and their indicating significanc[J]. Quaternary Sciences, 2017, 37(6): 1226-1237. |
| [10] |
Pearson A, Huang Z, Ingalls A E, et al. Nonmarine crenarchaeol in Nevada Hot Springs[J]. Applied and Environmental Microbiology, 2004, 70(9): 5229-5237. DOI:10.1128/AEM.70.9.5229-5237.2004 |
| [11] |
Li J, Pancost R D, Naafs B D, et al. Distribution of glycerol dialkyl glycerol tetraether(GDGT)lipids in a hypersaline lake system[J]. Organic Geochemistry, 2016, 99: 113-124. DOI:10.1016/j.orggeochem.2016.06.007 |
| [12] |
Weijers J W, Schouten S, Hopmans E C, et al. Membrane lipids of mesophilic anaerobic bacteria thriving in peats have typical archaeal traits[J]. Environmental Microbiology, 2006, 8(4): 648-657. DOI:10.1111/emi.2006.8.issue-4 |
| [13] |
Liu X, Summons R E, Hinrichs K. Extending the known range of glycerol ether lipids in the environment:Structural assignments based on tandem mass spectral fragmentation patterns[J]. Rapid Communications in Mass Spectrometry, 2012, 26(19): 2295-2302. DOI:10.1002/rcm.6355 |
| [14] |
Lipp J S, Hinrichs K. Structural diversity and fate of intact polar lipids in marine sediments[J]. Geochimica et Cosmochimica Acta, 2009, 73(22): 6816-6833. DOI:10.1016/j.gca.2009.08.003 |
| [15] |
Liu X, Lipp J S, Simpson J H, et al. Mono-and dihydroxyl glycerol dibiphytanyl glycerol tetraethers in marine sediments:Identification of both core and intact polar lipid forms[J]. Geochimica et Cosmochimica Acta, 2012, 89: 102-115. DOI:10.1016/j.gca.2012.04.053 |
| [16] |
Huguet C, Fietz S, Rosell-Mele A. Global distribution patterns of hydroxy glycerol dialkyl glycerol tetraethers[J]. Organic Geochemistry, 2013, 57: 107-118. DOI:10.1016/j.orggeochem.2013.01.010 |
| [17] |
Lü X, Liu X, Elling F J, et al. Hydroxylated isoprenoid GDGTs in Chinese coastal seas and their potential as a paleotemperature proxy for mid-to-low latitude marginal seas[J]. Organic Geochemistry, 2015, 89: 31-43. |
| [18] |
Fietz S, Huguet C, Rueda G, et al. Hydroxylated isoprenoidal GDGTs in the Nordic Seas[J]. Marine Chemistry, 2013, 152: 1-10. DOI:10.1016/j.marchem.2013.02.007 |
| [19] |
Yang Y, Gao C, Dang X, et al. Assessing hydroxylated isoprenoid GDGTs as a paleothermometer for the tropical South China Sea[J]. Organic Geochemistry, 2018, 115: 156-165. DOI:10.1016/j.orggeochem.2017.10.014 |
| [20] |
Rossel P E, Elvert M, Ramette A, et al. Factors controlling the distribution of anaerobic methanotrophic communities in marine environments:Evidence from intact polar membrane lipids[J]. Geochimica et Cosmochimica Acta, 2011, 75(1): 164-184. DOI:10.1016/j.gca.2010.09.031 |
| [21] |
Elling F J, Könneke M, Lipp J S, et al. Effects of growth phase on the membrane lipid composition of the thaumarchaeon Nitrosopumilus maritimus and their implications for archaeal lipid distributions in the marine environment[J]. Geochimica et Cosmochimica Acta, 2014, 141: 579-597. DOI:10.1016/j.gca.2014.07.005 |
| [22] |
Elling F J, Könneke M, Mußmann M, et al. Influence of temperature, pH, and salinity on membrane lipid composition and TEX86 of marine planktonic thaumarchaeal isolates[J]. Geochimica et Cosmochimica Acta, 2015, 171: 238-255. DOI:10.1016/j.gca.2015.09.004 |
| [23] |
Elling F J, Könneke M, Nicol G W, et al. Chemotaxonomic characterisation of the thaumarchaeal lipidome[J]. Environmental Microbiology, 2017, 19(7): 2681-2700. DOI:10.1111/emi.2017.19.issue-7 |
| [24] |
Schubotz F, Wakeham S G, Lipp J S, et al. Detection of microbial biomass by intact polar membrane lipid analysis in the water column and surface sediments of the Black Sea[J]. Environmental Microbiology, 2009, 11(10): 2720-2734. DOI:10.1111/emi.2009.11.issue-10 |
| [25] |
Xie S, Liu X, Schubotz F, et al. Distribution of glycerol ether lipids in the oxygen minimum zone of the Eastern Tropical North Pacific Ocean[J]. Organic Geochemistry, 2014, 71: 60-71. DOI:10.1016/j.orggeochem.2014.04.006 |
| [26] |
Kaiser J, Arz H W. Sources of sedimentary biomarkers and proxies with potential paleoenvironmental significance for the Baltic Sea[J]. Continental Shelf Research, 2016, 122(Suppl. C): 102-119. |
| [27] |
Zhuang G, Elling F J, Nigro L M, et al. Multiple evidence for methylotrophic methanogenesis as the dominant methanogenic pathway in hypersaline sediments from the Orca Basin, Gulf of Mexico[J]. Geochimica et Cosmochimica Acta, 2016, 187: 1-20. DOI:10.1016/j.gca.2016.05.005 |
| [28] |
Carr S A, Schubotz F, Dunbar R B, et al. Acetoclastic Methanosaeta are dominant methanogens in organic-rich Antarctic marine sediments[J]. Isme Journal, 2017, 12(2): 330-342. |
| [29] |
Braun S, Morono Y, Becker K W, et al. Cellular content of biomolecules in sub-seafloor microbial communities[J]. Geochimica et Cosmochimica Acta, 2016, 188: 330-351. DOI:10.1016/j.gca.2016.06.019 |
| [30] |
Evans T W, Wörmer L, Lever M A, et al. Size and composition of subseafloor microbial community in the Benguela upwelling area examined from intact membrane lipid and DNA analysis[J]. Organic Geochemistry, 2017, 111: 86-100. DOI:10.1016/j.orggeochem.2017.06.008 |
| [31] |
Knies J, Cabedo-Sanz P, Belt S T, et al. The emergence of modern sea ice cover in the Arctic Ocean[J]. Nature Communications, 2014, 5: 5608. DOI:10.1038/ncomms6608 |
| [32] |
Zhu C, Lipp J S, Wörmer L, et al. Comprehensive glycerol ether lipid fingerprints through a novel reversed phase liquid chromatography-mass spectrometry protocol[J]. Organic Geochemistry, 2013, 65: 53-62. DOI:10.1016/j.orggeochem.2013.09.012 |
| [33] |
Meador T B, Bowles M, Lazar C S, et al. The archaeal lipidome in estuarine sediment dominated by members of the miscellaneous crenarchaeotal group[J]. Environmental Microbiology, 2015, 17(7): 2441-2458. DOI:10.1111/1462-2920.12716 |
| [34] |
Chen Y, Zhang C, Jia C, et al. Tracking the signals of living archaea:A multiple reaction monitoring(MRM)method for detection of trace amounts of intact polar lipids from the natural environment[J]. Organic Geochemistry, 2016, 97: 1-4. DOI:10.1016/j.orggeochem.2016.04.006 |
| [35] |
王欢业, 刘卫国, 张传伦, 等. 青海湖钻孔沉积物中的羟基甘油二烷基甘油四醚类化合物及其环境意义[J]. 第四纪研究, 2017, 37(5): 1151-1160. Wang Huanye, Liu Weiguo, Zhang Chuanlun, et al. Hydroxylated glycerol dialkyl glycerol tetraethers in Lake Qinghai sediments and their paleoclimate implications[J]. Quaternary Sciences, 2017, 37(5): 1151-1160. |
| [36] |
Kaiser J, Ön B, Arz H W, et al. Sedimentary lipid biomarkers in the magnesium rich and highly alkaline Lake Salda(south-western Anatolia)[J]. Journal of Limnology, 2016, 75(3): 581-596. |
| [37] |
Becker K W. Biogeochemical Significance and Biomarker Potential of Novel Glycerolipids and Respiratory Quinones in the Marine Environment[D]. Bremen: The Doctoral Dissertation of Univeristy of Bremen, 2015: 1-287.
|
| [38] |
Pearson A, Hurley S J, Walter S R, et al. Stable carbon isotope ratios of intact GDGTs indicate heterogeneous sources to marine sediments[J]. Geochimica et Cosmochimica Acta, 2016, 181: 18-35. DOI:10.1016/j.gca.2016.02.034 |
| [39] |
Warden L A. Paleoenvironmental Reconstructions in the Baltic Sea and Iberian Margin: Assessment of GDGTs and Long-chain Alkenones in Holocene Sedimentary Records[D]. Utrecht: The Doctoral Dissertation of Univeristy of Utrecht, 2017: 1-249.
|
| [40] |
Schouten S, Hopmans E C, Schefuß E, et al. Distributional variations in marine crenarchaeotal membrane lipids:A new tool for reconstructing ancient sea water temperatures?[J]. Earth and Planetary Science Letters, 2002, 204(1-2): 265-274. DOI:10.1016/S0012-821X(02)00979-2 |
| [41] |
Lü X, Yang H, Song J, et al. Sources and distribution of isoprenoid glycerol dialkyl glycerol tetraethers (GDGTs) in sediments from the east coastal sea of China:Application of GDGT-based paleothermometry to a shallow marginal sea[J]. Organic Geochemistry, 2014, 75: 24-35. DOI:10.1016/j.orggeochem.2014.06.007 |
| [42] |
Huguet C, Fietz S, Rosell-Melé A, et al. Molecular dynamics simulation study of the effect of glycerol dialkyl glycerol tetraether hydroxylation on membrane thermostability[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes, 2017, 1859(5): 966-974. DOI:10.1016/j.bbamem.2017.02.009 |
| [43] |
Fietz S, Ho S L, Huguet C, et al. Appraising GDGT-based seawater temperature indices in the Southern Ocean[J]. Organic Geochemistry, 2016, 102: 93-105. DOI:10.1016/j.orggeochem.2016.10.003 |
| [44] |
Huguet C, Fietz S, Stockhecke M, et al. Biomarker seasonality study in Lake Van, Turkey[J]. Organic Geochemistry, 2011, 42(11): 1289-1298. DOI:10.1016/j.orggeochem.2011.09.007 |
| [45] |
Kang S, Shin K, Kim J. Occurrence and distribution of hydroxylated isoprenoid glycerol dialkyl glycerol tetraethers(OH-GDGTs)in the Han River system, South Korea[J]. Acta Geochimica, 2017, 36(3): 367-369. DOI:10.1007/s11631-017-0165-3 |
2 State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences(Wuhan), Wuhan 430074, Hubei)
Abstract
Hydroxylated GDGTs (OH-GDGTs) are a suite of GDGTs with up to two OH groups in one of their alkyl chains and are widespread in global marine sediments. The biological sources of OH-GDGTs are likely planktonic Thaumarchaeota, especially the cultivated representatives of Group 1.1a in marine environments. The OH-GDGTs were also found in an extremophile Euryarchaeota culture (Methanothermococcus thermolithotrophicus). Previous investigations based on global marine environments indicated that the relative abundance of OH-GDGTs in marine sediments increased with the increasing latitude and showed a significant correlation with sea surface temperature (SST), and the relative number of cyclopentane rings in OH-GDGTs increased with increasing SST in subpolar and polar regions. The occurrence of OH-GDGTs in ancient downcore sediments suggests potential for these compounds for paleoenviromental applications, by using an extended compilation from a global core top OH-GDGTs data set, the OH-GDGTs based proxies could be used as potential indicators of paleo sea surface temperature, especially when the application of other biomarkers is limited.Although many studies have focused on OH-GDGTs in marine settings, only a few have examined the occurrence of OH-GDGTs in lacustrine environments. Further studies are necessary to explore the distribution pattern of OH-GDGTs in lake settings, the relationship between the distribution pattern of OH-GDGTs and temperature. Also the applicability of marine environments based OH-GDGTs calibrations should be measured in lacustrine environments.In this paper, we introduce the structures, biological sources and the occurrence of OH-GDGTs in marine and lacustrine environments to further explore the biological and environmental implications of OH-GDGTs in environment samples. 2018, Vol.38
2018, Vol.38
