2 中国科学院大学, 北京 100049;
3 中国科学院青藏高原地球科学卓越创新中心, 北京 100101)
碳酸盐矿物在干旱-半干旱气候下的湖泊、河流和风成沉积物中广泛存在,其矿物、元素与同位素组成保存了重要的古气候、古环境信息[1~8]。近年来,一系列基于干旱区沉积物碳酸盐化学成分的定量研究被成功应用于古环境重建,例如自生碳酸盐成分演化的瑞利分馏模型[8~10]以及粉尘碳酸盐影响河流水化学的混入模型等[11]。定量模型的建立需要精确分析碳酸盐的化学组成,因此识别沉积物中非碳酸盐组分在碳酸盐提取中的影响变得十分重要。沉积物中的金属元素可能赋存于多个相态之中,包括水溶态、交换态(吸附在矿物表面的离子与粘土层间交换性离子)、碳酸盐态、铁锰氧化物结合态、有机质结合态和硅酸盐态[12]。准确、高效、选择性地提取碳酸盐矿物是精确测定碳酸盐化学组成的前提,其关键是选择合适的溶解试剂实现碳酸盐与样品中其它相态的有效化学分离。
对碳酸盐成分提取的探索早在半个多世纪前就已经开始。早先Ray等[13]提出采用稀醋酸进行全岩样品碳酸盐提取可以有效避免对粘土矿物的溶解;相反,盐酸提取会对粘土矿物产生明显破坏。在加热条件下,盐酸对粘土矿物的显著溶解在一系列研究中被报道[2, 14~18]。然而,越来越多的研究指出醋酸也会溶解非碳酸盐组分。如Hodgson[19]的研究表明,2.5%醋酸可以溶出粘土矿物(如蒙脱石)表面吸附的交换态钴;Chester和Hughes[20]认为25%醋酸可对Fe-Mn氧化物产生一定溶解,在20℃条件下反应12小时后铁锰结核样品损失了5.6%的质量的Fe2O3。Yokoo等[21]基于醋酸提取组分中显著含量的Al、K、Ba、Li等元素,推测醋酸可能溶解了微量粘土矿物。更多直接的证据来自对Sr同位素的研究:Bailey等[22]和Liu等[23]对碳酸盐岩石(灰岩和白云岩)的连续提取发现交换态Sr具有高于全岩的87 Sr/86 Sr组成;此后Montañez等[24]实验证明经过醋酸铵等交换性试剂处理后,碳酸盐岩石醋酸提取组分中的Rb、Sr以及87 Sr/86 Sr明显降低,表明对全岩样品直接进行醋酸提取可能会溶解交换态Sr;Liu等[23]对碳酸盐岩石连续增加醋酸浓度的提取实验发现在最后两步较高浓度醋酸的提取结果中,87 Sr/86 Sr比值出现升高,表明可能有微量硅酸盐矿物发生了溶解。
Sr作为微量元素,以类质同象方式赋存于常见的碳酸盐矿物(如方解石、白云石和文石)晶格之中。上述对醋酸提取碳酸盐组分Sr的研究并不能充分说明其它元素是否也同样程度地受到来自非碳酸盐组分的影响,例如Mg在碳酸盐中同样广泛存在,甚至能够作为主量元素形成独立碳酸盐矿物(如:白云石、菱镁矿等),且携带重要的古环境信息[25~26]。但到目前为止,非碳酸盐来源Mg对醋酸提取组分的贡献还尚不清楚,有必要进行深入探讨。本研究以西宁盆地晚中新世莫家庄剖面的河流相沉积物[27]为材料,通过多种实验方法,揭示了稀醋酸对非碳酸盐来源Mg的溶解。该研究将有助于查明沉积物醋酸溶解Mg的多种来源,为合理应用醋酸提取方法进行碳酸盐化学组成的精确定量分析提供约束,同时也是进一步开展沉积物全岩碳酸盐Mg同位素研究的基础。
1 材料与方法 1.1 实验材料莫家庄剖面(MJZ)坐落于西宁盆地东北部(36°41′07″N,102°04′15″E),总厚度为336 m,精细的古地磁定年并结合化石与地层对比揭示该剖面为中中新世-上新世咸水河组和临夏组陆相碎屑岩地层,年龄跨度为12.8 Ma到4.8 Ma[27]。莫家庄剖面岩性自下而上由细变粗,从泥岩和粉砂岩变为粗砂岩和砾岩,表现为一个巨大的沉积旋回,指示了盆地周围山地后期约8 Ma开始的隆升[27]。
对该剖面不同层位多个沉积物的全岩XRD扫描表明沉积物主要含石英、长石、云母、伊利石、绿泥石和方解石,白云石低于检出限(未发表数据),因此该剖面沉积物碳酸盐矿物溶解提供的Mg较为有限,便于开展醋酸对非碳酸盐来源Mg提取的研究。此外,剖面不同层位沉积物碳酸盐含量差异明显,可为对比不同碳酸盐含量样品在连续醋酸提取过程中Mg溶解的行为提供有益的约束。研究选取的样品来自莫家庄剖面5个不同层位,均是泥岩或粉砂岩样品,按照碳酸盐含量由高到低分别命名为ES-1、ES-2、ES-3、ES-4和ES-5(表 1)。样品采回后在40℃下烘干,然后用研钵制成200目以上的粉末样品,以备后续分析测试。
| 表 1 实验样品岩性及无机碳含量 Table 1 Lithological characteristics and inorganic carbon contents of the measured samples |
沉积物的实测无机碳含量来自于样品中的无机碳酸盐,可以用来验证醋酸溶解的沉积物Ca和Mg是否完全来自碳酸盐,因为理论上碳酸根的摩尔数应与碳酸盐阳离子Ca和Mg的摩尔数之和一致。本研究采用碳分析仪(岛津SHIMADZU TOC-L)测试样品无机碳含量,溶解用酸为50%磷酸,使用非分散红外检测器(NDIR)测定CO2释放量以计算无机碳含量。5个样品的无机碳含量测试结果见表 1。
为了探明醋酸提取液中非碳酸盐组分的来源,本研究设计了一组多相态连续提取实验(图 1)。多相态连续提取采用不同的选择性溶解试剂对沉积物进行矿物相态的化学分离,以测定单一或多个化学元素在不同赋存态中的含量,这种方法已被广泛应用于土壤污染、古气候及化学风化研究中[12, 21, 28~31]。本研究分离并测试了样品的交换态、多步醋酸提取组分和热盐酸提取组分,其中多步醋酸提取用于探究在碳酸盐溶尽的情况下醋酸对非碳酸盐组分的溶解。
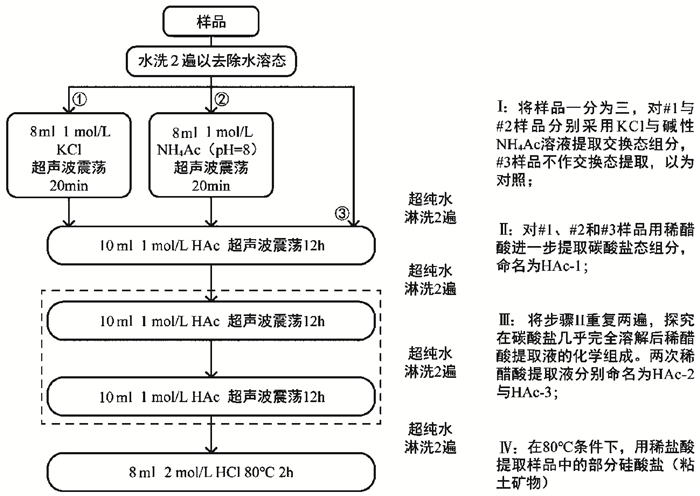
|
图 1 连续提取实验流程 Fig. 1 Experimental procedures of sequential extraction |
首先,在15 ml聚乙烯离心管中准确称取200 mg粉末样品,每个样品称取3份相同的平行样品,分别记为#1、#2和#3,共得到15个样品。在所有平行样品中加入约10 ml超纯水,振荡混合后离心(4000 rpm,20 min),移除上清液。该过程重复2遍,以清洗样品中的水溶盐组分。连续提取步骤如下(图 1):
步骤Ⅰ为交换态Mg、Ca提取。在各样品的平行样#1与#2中分别加入8 ml浓度为1 mol/L的氯化钾溶液与醋酸铵溶液(加入一定量氨水,使溶液呈碱性,pH=8)作为交换性试剂,室温下在超声波清洗仪中反应20 min。平行样#3不作交换态提取,为空白对照,用于比较不同试剂的提取效果,计算交换态贡献。氯化钾[32]和醋酸铵[33~34]均为土壤化学研究中普遍采用的交换性试剂,用于测定土壤交换性阳离子与盐基饱和度;氯化钾也是粘土矿物研究中常用的K饱和试剂[35]。醋酸铵的优点在于不引入其它阳离子,但是中性醋酸铵会对碳酸盐矿物产生少量溶解[22],故需加入缓冲剂(如氨水)使试剂呈碱性[34]。氯化钾不会造成碳酸盐矿物的溶解,但是会引入大量K离子,不过这对本实验的目标元素Ca与Mg不产生影响。
步骤Ⅱ为碳酸盐Mg、Ca提取。Rongemaille等[36]通过实验研究发现,2%与5%醋酸对方解石和白云石都可以达到较高的溶解率,差别在于用2%醋酸溶解白云石时达到平衡所需时间更长;同样,Yang等[37]通过使用浓度逐渐增加的多步连续醋酸提取,发现当醋酸浓度达到5%时,白云石开始有效溶解。因此,为了提取全部碳酸盐矿物,本研究选用10 ml的1 mol/L醋酸(5.62%,v/v),室温下超声波震荡反应12小时。提取的结果记为HAc-1。
步骤Ⅲ为连续稀醋酸提取。醋酸的浓度、用量、反应温度和反应时间与步骤Ⅱ完全一致,一共重复两遍,分别记为HAc-2与HAc-3。
步骤Ⅳ为热盐酸提取。前人研究表明热盐酸可以对沉积物中的绿泥石等粘土矿物产生有效溶解[18, 21, 38]。方法为在上述步骤的不溶物中加入8 ml浓度为2 mol/L的盐酸,在80℃水浴中反应2 h。
每一次提取反应结束后,通过离心(4000 rpm,20 min)分离溶液与不溶物。溶液被取出稀释定容,以备上机测试,不溶物继续进行后续提取。在对离心分离后的不溶物进行下一步提取处理之前,需用超纯水按照前文所述步骤清洗2遍,避免前一次溶解结果对后一次提取的影响。溶液样品采用电感耦合等离子体原子发射光谱仪(ICP-OES)进行元素分析,仪器型号为Leeman Labs Prodigy-H。
以上样品制备与测试分析均在中国科学院青藏高原研究所大陆碰撞与高原隆升重点实验室完成,测得的元素含量为基于全岩烘干重量的质量百分比含量(μg/g),元素比值为摩尔比。重复测试结果表明所有元素含量的相对误差都小于2%,元素比值相对误差小于4%。
2 结果 2.1 无机碳含量与醋酸提取组分的对比如果醋酸提取的元素Ca与Mg都来自碳酸盐,那么Ca、Mg含量折算的CO2释放量应与碳分析仪测得的无机碳含量折算的CO2释放量保持一致。平行样#3的HAc-1是全岩样品的醋酸直接提取结果,其Ca、Mg含量折算的CO2释放量与无机碳含量换算的CO2释放量对比结果如图 2所示(样品ES-5的无机碳含量低于仪器检测限,计算的CO2释放量在对数坐标上以0.001 mmol/g表示)。在无机碳含量相对较低的ES-3、ES-4和ES-5中(表 1),醋酸提取液中Ca、Mg含量换算得到的CO2释放量明显高于无机碳含量计算的CO2释放量;在无机碳含量相对较高的ES-1和ES-2中,两种方法计算的CO2释放量相当,投点落在1 ︰ 1线附近。该结果表明,醋酸对非碳酸盐Ca和(或)Mg具有一定提取能力。非碳酸盐组分对醋酸提取组分中Ca或Mg的贡献可大致使用图 2中投点与1 ︰ 1线之间在垂直方向上的偏移表示,显然这种偏离在无机碳含量很低的样品中尤为明显,表明低碳酸盐含量的样品(以无机碳含量估算,碳酸盐含量 < 1%)更多地受到非碳酸盐组分的影响。在对恒河-布拉马普特拉河流域河流沉积物的研究中[39],也可见到这种在低碳酸盐含量样品中醋酸明显溶解了非碳酸盐矿物组分的现象。该研究中河流沉积物样品经醋酸溶解后的质量损耗与通过气体体积确定的总碳酸盐含量总体相关,但是在低碳酸盐含量样品中(< 2 %)[39],上述质量损耗显著高于碳酸盐含量。

|
图 2 样品无机碳含量和醋酸提取组分Ca、Mg含量通过换算为CO2释放量的对比 Fig. 2 Comparison between the emission amounts of CO2 calculated by inorganic carbon content and Ca and Mg concentrations of acetic acid leachate |
连续提取实验过程中,每一步提取的Ca、Mg、Al、和K含量,以及Mg/Ca与Mg/Al摩尔比值见表 2。其中,平行样品#1由于加入氯化钾试剂导致第一步中K含量极高,但是后续每一步中的K含量都较前一步降低1~2个数量级,这说明实验所采用的超纯水清洗可以有效降低前一步的影响。
| 表 2 连续提取实验分步结果 Table 2 Results of sequential extraction |
图 3为每个样品的#1、#2和#3平行样在连续提取过程中Ca、Mg含量和Mg/Ca、Mg/Al比值的逐步变化情况。由于平行样品#3未经交换态提取,导致在HAc-1中,#3的Ca、Mg含量较#1和#2更高。而且,对于#1与#2,交换态提取的Ca(或Mg)含量与第一次醋酸提取(HAc-1)的Ca(或Mg)含量之和约等于#3的第一次醋酸提取的Ca(或Mg)含量,即若不进行交换态组分预提取,则醋酸可提取绝大部分交换态Ca、Mg,这表明醋酸对交换态Ca、Mg具有很强的提取能力。在后续的HAc-2、HAc-3与热盐酸提取中,3个平行样的元素含量和比值变化十分一致,相互之间无明显差异。在连续醋酸溶解过程中,所有样品呈现出Ca、Mg含量不断降低,但Mg/Ca比值不断升高的特点。在最后一步热盐酸提取中,Mg大量溶出,伴随Mg/Ca比值升至最高。Al含量从HAc-1至HAc-3逐渐减少,但在热盐酸提取时陡然增至约2000~5000 μg/g,其增幅大大超过Mg的变化,导致Mg/Al比值也迅速降低。值得注意的是,所有样品的热盐酸提取组分Mg/Al比值十分接近,所有样品的Mg/Ca比值变化范围集中在0.37~0.59之间。
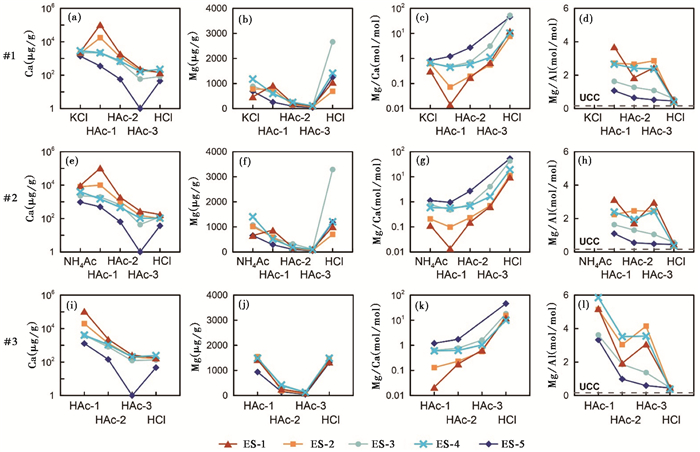
|
图 3 平行样#1、#2与#3的Ca、Mg、Mg/Ca和Mg/Al在连续提取实验中的逐步变化 Fig. 3 Variations in Ca, Mg concentrations and Mg/Ca, Mg/Al ratios during the process of sequential extractions for parallel samples #1, #2 and #3 |
步骤Ⅰ交换态提取结果显示5个样品的KCl提取组分Ca、Mg平均含量分别为2212 μg/g和802 μg/g,醋酸铵提取组分的Ca、Mg平均含量分别为4939 μg/g和960 μg/g,表明样品中存在一定量的交换性Ca与Mg。尽管不同样品之间交换性Ca、Mg含量不同,但是对同一个样品来说,氯化钾与醋酸铵提取的Ca、Mg含量大致相近。两种试剂之间明显的差异主要体现在以下两方面:首先,对高碳酸盐含量的ES-1和ES-2,醋酸铵溶出的Ca显著提高(图 4a);其次,在除ES-5以外的4个样品中,醋酸铵提取了更多Mg(图 4b)。上述现象可能源于醋酸铵溶液对碳酸盐矿物的微量溶解。尽管本实验在醋酸铵溶液中加入了一定量的氨水使试剂呈碱性,但是碳酸盐矿物的微量溶解可能依旧存在。

|
图 4 氯化钾和醋酸铵提取交换态Ca和Mg的结果对比 Fig. 4 Comparison between the exchangeable Ca and Mg extracted by KCl and NH4Ac |
除ES-1和ES-2的醋酸铵交换态提取组分因碳酸盐矿物的微量溶解表现为低Mg/Ca比值,其它样品的氯化钾和醋酸铵交换态组分具有较高的Mg/Ca摩尔比值。各样品的Mg/Ca摩尔比值均在0.3以上,大部分在0.6以上(图 4c),接近甚至超过白云石成分的Mg/Ca摩尔比值[40]。因此,醋酸提取组分中交换态的存在可能会造成对碳酸盐组分Mg/Ca比值的高估,夸大白云石在碳酸盐矿物中的含量。
随着碳酸盐含量降低,5个样品交换态提取后的第一次醋酸提取组分Ca、Mg含量呈现明显降低(图 5a和5b,注意Ca含量以对数坐标表示)。经交换态提取后的醋酸提取组分HAc-1中Ca、Mg含量之和折算的CO2释放量也明显减少(图 2),这说明来自交换态的Ca、Mg元素在醋酸直接提取全岩样品的Ca、Mg元素中占有显著比重。通过交换态提取前后各样品第一次醋酸提取组分Ca、Mg含量的差值可以计算交换态在醋酸溶解组分中的贡献。计算公式为:

|
其中,X为元素Ca或Mg,Xpre为未经交换态提取的醋酸提取组分元素含量(μg/g)(平行样#3),Xpost为经过交换态提取之后的醋酸提取组分元素含量(μg/g)(平行样#1、#2)。计算结果大致呈现出碳酸盐含量越高,交换态Ca、Mg的相对贡献越低的趋势(图 6)。在碳酸盐含量较低的ES-3、ES-4和ES-5样品中,交换态对Ca的贡献超过40%,交换态对Mg的贡献超过50%;在所有样品中,交换态对Mg的贡献都超过30%。显然,交换态对Mg的贡献较Ca更为显著,这也可由Mg/Ca比值在经过交换态提取后出现小幅降低说明(图 3和图 5c)。
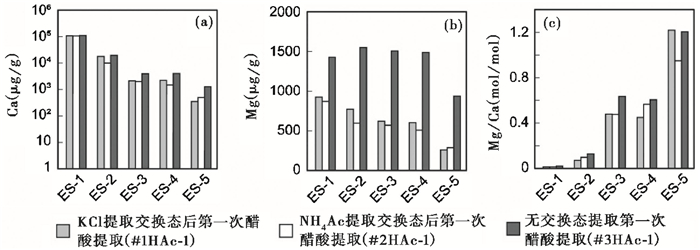
|
图 5 平行样#1、#2与#3的第一次醋酸(HAc-1)提取结果 Fig. 5 The first acetic acid leachate(HAc-1)results for parallel samples #1, #2 and #3 |

|
图 6 交换态对醋酸提取组分Ca和Mg的贡献 Fig. 6 Contributions of exchangeable fractions to the Ca and Mg in acetic acid leachates |
虽然经过交换态提取后,醋酸提取组分Ca、Mg含量折算的CO2释放量出现一定降低,但是在低碳酸盐含量样品中醋酸提取组分Ca、Mg含量计算的CO2释放量依然高于无机碳计算的CO2释放量(图 2),这表明依然存在交换态之外的非碳酸盐Ca、Mg来源。考虑到金属元素的赋存相态,这部分Ca和Mg还可能源于铁锰氧化物结合态、有机质结合态和硅酸盐[12]。因Ca和Mg自身的氧化物和氢氧化物易与碳酸反应,所以它们极少存在于天然沉积物中。对于与有机质和Fe-Mn氧化物有关的金属阳离子,其中可交换部分已被交换性试剂去除。Ca和Mg的元素亲和性决定了它们一般不会与Fe、Mn产生类质同象。所以尽管醋酸可以少量溶解Fe-Mn氧化物[20],但是该组分对Ca和Mg产生贡献的可能性很小。而醋酸对有机质溶解极为有限,与有机质紧密结合的金属阳离子需采用氧化性试剂破坏有机质结构才能大量释放[12]。综上所述,醋酸溶解相中其它的非碳酸盐来源Ca与Mg应主要来自硅酸盐矿物。
连续醋酸提取过程中的Mg/Ca比值及其变化揭示了硅酸盐Mg在醋酸提取过程中的释放。首先,第一次醋酸提取的结果总体呈现碳酸盐含量越低,Mg/Ca比值越高的趋势(图 5c)。高碳酸盐含量的ES-1和ES-2样品HAc-1提取组分主要反映了碳酸盐矿物的溶解,因此其较低的Mg/Ca比值代表了碳酸盐矿物(主要是方解石)的Mg/Ca比值,该值也与Müller等[40]报道的方解石Mg/Ca比值范围接近。这也说明ES-3、ES-4和ES-5这3个低碳酸盐含量样品较高的Mg/Ca比值必然源于方解石之外的矿物,在已知莫家庄剖面沉积物样品几乎不含白云石(未发表数据)的情况下,这种高Mg/Ca比值可能反映了醋酸提取组分中显著含有来自硅酸盐的Mg。其次,三步连续醋酸提取Mg/Ca比值呈现不断升高的现象(图 3)。Ca和Mg的含量随三步连续提取持续下降,当提取至HAc-3时,大部分样品Ca的含量已降至小于300 μg/g左右,这说明所有样品(包括高碳酸盐含量的ES-1和ES-2)中的碳酸盐矿物至HAc-3时已基本溶尽,所以连续醋酸提取过程中Mg/Ca比值的逐渐升高意味着来自硅酸盐组分Mg的相对贡献逐渐上升。在HAc-3中,原本高碳酸盐含量的ES-1和ES-2,3个平行样的平均Mg/Ca比值也已分别达到了0.65和0.61,与HAc-1中低碳酸盐含量样品ES-3和ES-4的Mg/Ca比值接近。这进一步证明低碳酸盐含量样品在醋酸提取组分中较高Mg/Ca比值并非反映碳酸盐矿物本来的成分特征,而是在醋酸过量情况下硅酸盐溶解造成的结果。综上所述,硅酸盐在醋酸溶解过程中可以提供一定的Mg,并且在醋酸提取组分中具有较高的Mg/Ca比值特征。热盐酸对硅酸盐的提取能力强于醋酸[16, 18],但是碳酸盐溶尽后热盐酸提取组分中Ca含量仅为37~245 μg/g,而Mg却高达692~3292 μg/g,这从侧面说明硅酸盐溶解可为醋酸提取组分提供的Ca十分有限,更加佐证了醋酸提取组分中硅酸盐端元具有高的Mg/Ca比值。
所有样品的热盐酸提取组分呈现较为一致的Mg/Al比值(0.36~0.59),低于醋酸提取组分HAc-3的Mg/Al比值(0.49~4.15),但高于平均大陆地壳(Upper Continental Crust,简称UCC)的Mg/Al比值(0.165)[41]。XRD结果显示莫家庄剖面沉积物含有绿泥石,因此热盐酸提取组分中较高且稳定的Mg/Al比值说明绿泥石((Mg,Fe,Al)6(SiAl)4O10)等富Mg的硅酸盐矿物被溶解,这也与前人研究结果相符[16, 18, 21]。热盐酸提取组分中Al的含量为2103~6375 μg/g,表明Al被大量溶出。因此,稳定的Mg/Al比值说明盐酸对这类铝硅酸盐矿物的破坏是较为彻底的。以绿泥石这种层状铝硅酸盐矿物为例,热盐酸既可以溶解层间的水镁石层,也可以破坏晶格的Al-O键,达到硅酸盐的完全溶解。在对黄土样品的3 mol/L热盐酸提取(80℃)实验中,观察到随提取时间逐渐延长Mg/Al比值逐渐降低并趋于稳定的现象[18],同样说明热盐酸可以对特定的含镁硅酸盐产生完全溶解。醋酸提取组分的情况恰恰与此相反,不仅Al的溶出量十分有限,而且Mg/Al比值变化较大:在HAc-3中,Al的含量仅为18.96~112.27 μg/g,而Mg/Al比值的变化范围跨越一个数量级,为0.49~4.15。这意味着Mg的释放速度比Al更快,醋酸对硅酸盐的溶解明显表现为不一致溶解过程。同样以绿泥石为例,这表明在醋酸溶解过程中,晶格的Al-O键并没有显著破坏[2],Mg主要来源由于层间的水镁石层。因此,醋酸提取组分中硅酸盐贡献的元素比值(如Mg/Al比)严重偏离矿物本身的平均元素比值,故而不能简单使用全岩沉积物或者标准物质成分(如上部大陆地壳、标准页岩)、稀酸不溶物甚至矿物的平均组成来校正醋酸提取组分中硅酸盐矿物溶解对Mg贡献。
3.3 醋酸溶解Ca和Mg组分的混合模型综上所述,硅酸盐和交换态都会在醋酸溶解中提供一定数量的Ca和Mg,而且两者相对典型低镁方解石而言具有较高的Mg/Ca比值。在这里尝试通过它们与典型低镁方解石和白云石的混合模型揭示图 2中不同碳酸盐含量醋酸溶解组分Ca和Mg的变化。在(CaCO3+MgCO3)含量-Mg/Ca比值图解上(图 7),对平行样#3的HAc-1醋酸提取组分进行投点,并以无机碳含量极低的样品ES-5代表硅酸盐和交换态端元。混合以基于单位质量ES-5样品与单位质量方解石的不同质量比进行,图 7中的混合比例数字表示混合样品中真实方解石(ES-5与方解石混合)或者白云石(ES-5与白云石混合)的含量。结果发现5个样品主要落在硅酸盐和低镁方解石端元混合线附近(图 7),表明所测样品的Mg/Ca比值与Ca、Mg含量成分特征可能是方解石与硅酸盐和交换态不同比例的混合所造成的。混合线上标注的真实碳酸盐(方解石或者白云石)含量与X轴上基于醋酸提取组分Ca、Mg含量估算的碳酸盐含量在低于2% ~3%存在差异。因此,醋酸提取组分中方解石与硅酸盐和交换态端元的混合模型,以及其中硅酸盐和交换态相对较高的混合比例可以合理地解释本文西宁盆地沉积低碳酸盐样品基于醋酸提取组分Ca、Mg含量估算碳酸盐含量与实际的碳酸盐(方解石)含量并不一致的原因(即图 2中两种方法计算的CO2释放量之间的不一致)。
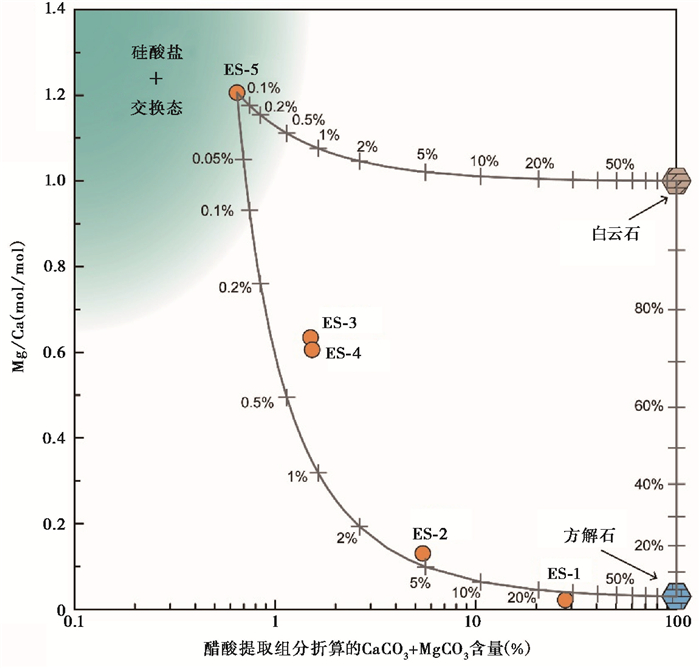
|
图 7 平行样#3的HAc-1醋酸提取组分折算的CaCO3+MgCO3含量与Mg/Ca比值之间的关系,以及硅酸盐+交换态、方解石和白云石端元在醋酸提取组分(CaCO3+MgCO3)含量-Mg/Ca比值图解中的位置示意 灰色曲线为硅酸盐+交换态、方解石和白云石端元之间的二端元混合线;硅酸盐+交换态端元采用无碳酸盐样品ES-5(HAc-1,#3)的醋酸提取组分代表,方解石与白云石分别采用Mg/Ca比值为0.03与1 Fig. 7 The plot of(CaCO3+MgCO3)content versus Mg/Ca molar ratios in HAc -1 acetic acid leachate of parallel samples #3. The gray curves are the binary mixing lines among silicate+exchangeable, calcite and dolomite endmembers. The silicate+exchangeable endmember is represented by the composition of the sample ES-5(HAc-1, #3)with no carbonate. The adopted Mg/Ca ratios for calcite and dolomite are 0.03 and 1, respectively |
稀醋酸广泛应用于对沉积物全岩碳酸盐成分的提取,探究其对非碳酸盐来源Mg的溶解过程对深入理解沉积物全岩醋酸提取组分有重要意义,并且也是进一步进行沉积物各组分Mg同位素研究的基础。本研究选用了5个来自西宁盆地莫家庄剖面的泥岩/粉砂岩样品,采用实验方法探究了稀醋酸对非碳酸盐来源Mg的溶解,获得了如下主要结论:
(1) 将沉积物无机碳含量与1 mol/L醋酸提取组分Ca、Mg含量换算的CO2释放量进行对比,发现醋酸可以显著提取非碳酸盐来源的Ca、Mg;尤其对于无机碳含量较低的3个样品(估算碳酸盐含量约 < 1%),这种醋酸提取组分中的非碳酸盐来源Ca和Mg较为明显。
(2) 交换态组分表现为高的Mg/Ca比值。通过对比经过交换态提取和未经交换态提取的平行样在醋酸提取组分中Mg的含量,发现交换态对醋酸提取组分Mg的贡献超过30%。特别地,在无机碳含量较低的3个样品中,交换态Mg的贡献超过50%。
(3) 硅酸盐是非碳酸盐来源Mg另一个重要来源。连续的1 mol/L醋酸提取表明硅酸盐在醋酸溶解中提供了高Mg/Ca比值的端元。此外,醋酸提取组分中较低的Al含量与较高的Mg/Al比值说明醋酸对硅酸盐晶格的破坏较弱,Mg可能主要来自非晶格位置,如粘土层间。由于醋酸对硅酸盐的提取组分Mg/Al比值显著高于硅酸盐矿物本身,意味着不宜简单使用全岩沉积物或者标准物质成分(如上部大陆地壳、标准页岩)、稀酸不溶物甚至矿物的平均组成来校正硅酸盐矿物溶解的Mg在醋酸提取组分中的贡献。
(4) 莫家庄剖面沉积物样品醋酸提取组分Mg/Ca比值的高低反映了高Mg/Ca比值的交换态与硅酸盐与低Mg/Ca比值的方解石的相对贡献。
致谢 感谢审稿专家和编辑部老师建设性的修改意见,使论文得以完善!
| 1 |
Alonso-Zarza A M, Wright V P. Calcretes. Developments in Sedimentology, 2010, 61: 225-267. DOI:10.1016/S0070-4571(09)06105-6 |
| 2 |
陈秀玲. 黄土高原中部晚新生代碳酸盐反映的气候和源区变化[D]. 兰州: 兰州大学博士学位论文, 2005: 34-46. Chen Xiuling. The Late Cenozoic Climate and Source Area Change Reflected by Carbonate from Central Loess Plateau[D]. Lanzhou: The PhD Thesis of Lanzhou University, 2005: 34-46. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y731579 |
| 3 |
曾蒙秀, 宋友桂. 西风区昭苏黄土剖面中碳酸盐矿物组成及其古环境意义辨识. 第四纪研究, 2013, 33(3): 424-436. Zeng Mengxiu, Song Yougui. Carbonate minerals of Zhaosu loess section in westerly area and their paleoenvironmental significance. Quaternary Sciences, 2013, 33(3): 424-436. |
| 4 |
梁莲姬, 孙有斌, Christiaan J B等. 黄土中的碳酸盐矿物特征与化学风化. 第四纪研究, 2014, 34(3): 345-653. Liang Lianji, Sun Youbin, Christiaan J B et al. Characteristics of carbonate minerals in loess and its implication for chemical weathering. Quaternary Sciences, 2014, 34(3): 345-653. |
| 5 |
Cerling T E. The stable isotopic composition of modern soil carbonate and its relationship to climate. Earth and Planetary Science Letters, 1984, 71(2): 229-240. DOI:10.1016/0012-821X(84)90089-X |
| 6 |
Quade J, Cerling T E, Bowman J R. Development of Asian monsoon revealed by marked ecological shift during the Latest Miocene in northern Pakistan. Nature, 1989, 342(6246): 163-166. DOI:10.1038/342163a0 |
| 7 |
Li G, Chen J, Chen Y. Primary and secondary carbonate in Chinese loess discriminated by trace element composition. Geochimica et Cosmochimica Acta, 2013, 103(2): 26-35. |
| 8 |
Yang Y, Fang X, Galy A et al. Carbonate composition and its impact on fluvial geochemistry in the NE Tibetan Plateau region. Chemical Geology, 2015, 410: 138-148. DOI:10.1016/j.chemgeo.2015.06.009 |
| 9 |
Li T, Li G. Incorporation of trace metals into microcodium as novel proxies for paleo-precipitation. Earth and Planetary Science Letters, 2014, 386(1): 34-40. |
| 10 |
Li T, Liu F, Abels H A et al. Continued obliquity pacing of East Asian summer precipitation after the mid-Pleistocene transition. Earth and Planetary Science Letters, 2017, 457: 181-190. DOI:10.1016/j.epsl.2016.09.045 |
| 11 |
Yang Y, Galy A, Fang X et al. Eolian dust forcing of river chemistry on the northeastern Tibetan Plateau since 8 Ma. Earth and Planetary Science Letters, 2017, 464: 200-210. DOI:10.1016/j.epsl.2017.02.009 |
| 12 |
Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| 13 |
Ray S, Gault H R, Dodd C G. The separation of clay minerals from carbonate rocks. The American Mineralogist, 1957, 42: 681-686. |
| 14 |
Derry L A, Kaufman A J, Jacobsen S B. Sedimentary cycling and environmental change in the Late Proterozoic:Evidence from stable and radiogenic isotopes. Geochimica et Cosmochimica Acta, 1992, 56(3): 1317-1329. DOI:10.1016/0016-7037(92)90064-P |
| 15 |
张志军, 尹观, 张其春. 碳酸盐岩Sr同位素比值的选择性溶解及测定技术. 地质地球化学, 2002, 30(4): 80-84. Zhang Zhijun, Ying Guan, Zhang Qichun. The selective dissolution and determination technique for Sr isotopic ratios in carbonate rocks. Geology-Geochemistry, 2002, 30(4): 80-84. |
| 16 |
汤书婷, 王晓明, 崔建勇等. 全岩样品碳酸盐矿物选择性溶解方法改进及其锶同位素比值测定. 世界核地质科学, 2015, 32(1): 51-56. Tang Shuting, Wang Xiaoming, Cui Jianyong et al. Method improvement of selective dissolution of carbonate minerals in whole rock samples and determination of strontium isotopic ratio. World Nuclear Geoscience, 2015, 32(1): 51-56. |
| 17 |
陈琳莹, 李崇瑛, 陈多福. 碳酸盐岩中碳酸盐矿物稀土元素分析方法进展. 矿物岩石地球化学通报, 2012, 31(2): 177-183. Chen Linying, Li Chongying, Chen Duofu. Progress of analytical methods of rare earth elements of carbonate minerals in carbonate rocks. Bulletin of Mineralogy, Petrology and Geochemistry, 2012, 31(2): 177-183. |
| 18 |
Li G, Ji J, Zhao L et al. Response of silicate weathering to monsoon changes on the Chinese Loess Plateau. Catena, 2008, 72(3): 405-412. DOI:10.1016/j.catena.2007.07.006 |
| 19 |
Hodgson J F. Cobalt reactions with montmorillonite. Soil Science Society of America Journal, 1960, 24(3): 165-168. DOI:10.2136/sssaj1960.03615995002400030013x |
| 20 |
Chester R, Hughes M J. A chemical technique for the separation of ferro-manganese minerals, carbonate minerals and adsorbed trace elements from pelagic sediments. Chemical Geology, 1967, 2(3): 249-262. |
| 21 |
Yokoo Y, Nakano T, Nishikawa M et al. Mineralogical variation of Sr-Nd isotopic and elemental compositions in loess and desert sand from the central Loess Plateau in China as a provenance tracer of wet and dry deposition in the northwestern Pacific. Chemical Geology, 2004, 204(1): 45-62. |
| 22 |
Bailey T R, Mcarthur J M, Prince H et al. Dissolution methods for strontium isotope stratigraphy:Whole rock analysis. Chemical Geology, 2000, 167(3): 313-319. |
| 23 |
Liu C, Wang Z, Raub T D. Geochemical constraints on the origin of Marinoan cap dolostones from Nuccaleena Formation, South Australia. Chemical Geology, 2013, 351(5): 95-104. |
| 24 |
Montañez I P, Banner J L, Osleger D A et al. Integrated Sr isotope variations and sea-level history of Middle to Upper Cambrian platform carbonates:Implications for the evolution of Cambrian seawater 87Sr/86Sr. Geology, 1996, 24(10): 917-920. DOI:10.1130/0091-7613(1996)024<0917:ISIVAS>2.3.CO;2 |
| 25 |
Huang K J, Teng F Z, Shen B et al. Episode of intense chemical weathering during the termination of the 635 Ma Marinoan glaciation. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(52): 14904-14909. DOI:10.1073/pnas.1607712113 |
| 26 |
Riechelmann S, Buhl D, Schrøder-Ritzrau A et al. The magnesium isotope record of cave carbonate archives. Climate of the Past, 2012, 8(3): 1849-1867. |
| 27 |
Yang R S, Fang X M, Meng Q Q et al. Paleomagnetic constraints on the Middle Miocene-Early Pliocene stratigraphy in the Xining Basin, NE Tibetan Plateau, and the geologic implications. Geochemistry, Geophysics, Geosystems, 2017, 18: 3741-3757. DOI:10.1002/2017GC006945 |
| 28 |
Menozzi D, Dosseto A, Kinsley L P J. Assessing the effect of sequential extraction on the uranium-series isotopic composition of a basaltic weathering profile. Chemical Geology, 2016, 446: 126-137. DOI:10.1016/j.chemgeo.2016.05.031 |
| 29 |
金章东, 邹成娟, 李福春等. 湖泊沉积物中元素相态的连续提取分析——以岱海为例. 湖泊科学, 2005, 17(1): 47-53. Jin Zhangdong, Zou Chengjuan, Li Fuchun et al. Elemental distribution in chemical fractions of lake sediments determined by sequential extraction:The case of Lake Daihai(Northern China). Journal of Lake Sciences, 2005, 17(1): 47-53. |
| 30 |
Bayon G, German C R, Boella R M et al. An improved method for extracting marine sediment fractions and its application to Sr and Nd isotopic analysis. Chemical Geology, 2002, 187(3): 179-199. |
| 31 |
Bickle M J, Tipper E, Galy A et al. On discrimination between carbonate and silicate inputs to Himalayan rivers. American Journal of Science, 2015, 315(2): 120-166. DOI:10.2475/02.2015.02 |
| 32 |
Bremner J M, Keeney D R. Determination and isotope-ratio analysis of different forms of nitrogen in soils:3. Exchangeable ammonium, nitrate, and nitrite by extraction-distillation methods 1. Soil Science Society of America Journal, 1966, 30(5): 577-582. DOI:10.2136/sssaj1966.03615995003000050015x |
| 33 |
Miller E K, Blum J D, Friedland A J. Determination of soil exchangeable-cation loss and weathering rates using Sr isotopes. Nature, 1993, 362(6419): 438-441. DOI:10.1038/362438a0 |
| 34 |
Capo R C, Stewart B W, Chadwick O A. Strontium isotopes as tracers of ecosystem processes:Theory and methods. Geoderma, 1998, 82(1): 197-225. |
| 35 |
Neumann R, Costa G E L, Gaspar J C et al. The mineral phase quantification of vermiculite and interstratified clay minerals-containing ores by X-ray diffraction and Rietveld method after K cation exchange. Minerals Engineering, 2011, 24(12): 1323-1334. DOI:10.1016/j.mineng.2011.05.017 |
| 36 |
Rongemaille E, Bayon G, Pierre C et al. Rare earth elements in cold seep carbonates from the Niger delta. Chemical Geology, 2011, 286(3): 196-206. |
| 37 |
Yang Y, Fang X, Koutsodendris A et al. Exploring Quaternary paleolake evolution and climate change in the western Qaidam Basin based on the bulk carbonate geochemistry of lake sediments. Palaeogeography, Palaeoclimatology, Palaeoecology, 2016, 446: 152-161. DOI:10.1016/j.palaeo.2016.01.021 |
| 38 |
Qiu L, Li G. Dissolution of loess-paleosol samples in 3 M HCl at 80℃, and its paleo-climatic implication. Geochimica et Cosmochimica Acta, 2006, 70(18): A512. |
| 39 |
Galy A. Etude Géochimique de L'érosion Actuelle de la Chaîne Himalayenne. Nancy: Thèse de Doctorat of Centre de Recherches Petrographiques et Geochimiques, 1999: 104.
|
| 40 |
Müller G, Irion G, Førstner U. Formation and diagenesis of inorganic Ca-Mg carbonates in the lacustrine environment. Naturwissenschaften, 1972, 59(4): 158-164. DOI:10.1007/BF00637354 |
| 41 |
Rudnick R L, Gao S. Composition of the continental crust[C]//Roberta L R. Treatise on Geochemistry, Volume 4: The Crust(2nd version). Netherland: Elsevier Ltd., 2014: 1-51.
|
2 University of Chinese Academy of Sciences, Beijing 100049;
3 CAS Center for Excellence in Tibetan Plateau Earth Sciences, Beijing 100101)
Abstract
One important precondition for the carbonate composition-based quantitative analyses for paleo-reconstructions is to choose adequate selective leaching reagents for carbonates extractions. The widely adopted diluted acetic acid leaching method is being challenged by contributions from non-carbonate fractions based on multiple clues including strontium isotopes. Such investigations for non-carbonate magnesium in acetic acid leachate, however, are quite limited, hindering the future application of bulk sample carbonate Mg isotope into the studies of weathering and climate change. Herein, we use a series of experimental analyses to investigate the sources of non-carbonate Mg in diluted acetic acid leachate. The materials are from MJZ section (36°41'07″N, 102°04'15″E) in the northeast part of Xining Basin, NW China. This section with 336 m in thickness includes mid-Miocene to Pliocene fluvial sediments, spanning from 12.8 Ma to 4.8 Ma according to detailed paleomagnetism analyses. First, we choose five representative mudstone/siltstone samples, and analyze their inorganic carbon content by carbon analyzer (SHIMADZU TOC-L). The 5 samples are named as ES-1, ES-2, ES-3, ES-4 and ES-5 in sequence (from 116.4 m, 158.8 m, 186.4 m, 89.7 m and 216.7 m of the MJZ section, respectively)according to their carbon content from high to low. And then the carbon contents are compared with the CO2 amount calculated by the Ca and Mg concentrations (ICP-OES, Leeman Labs Prodigy-H)in acetic acid leachate. The results show good correlation among samples with high carbonate contents but poor among those with low carbonate contents, suggesting that there are significant amounts of non-carbonate Mg and Ca leached by acetic acid in the low carbonate samples. Therefore, we design a 4-step sequential extraction to check the sources of these non-carbonate Mg. We first separate each of the 5 samples into 3 parallel samples, one is left as blank and other two are treated with KCl and NH4Ac solutions, respectively, in order to extract the exchangeable fractions and examine the difference between the two exchangeable agents. Next, we use 1 mol/L acetic acid to extract the carbonate fractions. After that, continuous 1 mol/L acetic acid leaching for 2 times are applied in order to check the capability of acetic acid to dissolving non-carbonate fractions when carbonates are exhausted. The final step is 2 mol/L HCl leaching under 80℃. According to the result of exchangeable fraction leaching, the difference in agents leads to little difference in the composition of leachates except that some carbonate may dissolve in NH4Ac. By comparing the first acetic acid leachates with and without exchangeable fraction extractions, the contributions of exchangeable fractions to the Mg in acetic acid leachate are estimated to be more than 30% for all the samples and more than 50% for low carbonate content samples. Another source of non-carbonate Mg might be from silicate, since other fractions such as those bounded to organic matters or Fe-Mn oxides are not likely to provide Mg cations to acetic acid leachate. The silicate fractions provide as an endmember high in Mg/Ca ratios, supported by the generally inverse correlation between Mg/Ca ratios and carbonate content in the first acetic acid leaching step, and the increasing Mg/Ca ratios during continuous acetic acid leaching. The acetic acid leachate has high and relatively stable Mg/Al ratios, suggesting that Mg-rich minerals such as chlorite, which is presented in the XRD diffractogram of bulk sediments (unpublished data), are dissolved in acetic acid. The quite limited Al concentrations as well as high Mg/Al ratios which is higher than the Mg/Al ratios of the heated HCl leachates and UCC mean that acetic acid doesn't destroy the lattice of silicate minerals and the Al-O bonds. So this fraction of Mg is likely to be mainly derived from clays interlayers, such as the brucite layers of chlorites. The low Al and high Mg/Al ratios in acetic acid leachate indicate the incongruent dissolution of silicate minerals by acetic acid, suggesting that using the overall compositions of standard substances, bulk sediments or diluted acid insoluble residues to calibrate the silicate-derived Mg is improper. The mixing between silicate and exchangeable endmember and calcite endmember on the plot of (CaCO3+MgCO3)contents versus Mg/Ca molar ratios explains the variation of Ma/Ca ratios and Ca and Mg concentrations in acetic acid leachate especially among low carbonate content samples. 2018, Vol.38
2018, Vol.38

